Как сделать хлорную кислоту
Добавил пользователь Владимир З. Обновлено: 05.10.2024
HCl при обычной температуре — бесцветный газ с резким запахом, достаточно легко сжижается (Тпл = -114°С, Ткип = -85°С). Безводный НСl и в газообразном, и в жидком состояниях не проводит электрический ток.
HCl хорошо растворяется в воде: при обычной температуре в 1 л воды растворяется ~ 450 л газа (реакция экзотермическая). Насыщенный раствор содержит 36-37 % HCl по массе, имеет резкий, удушающий запах.
Химические свойства хлороводорода
Газообразный HCl
Безводный НСl химически инертен по отношению к металлам, оксидам и гидроксидам металлов, а также ко многим другим веществам. Что означает, что в отсутствие воды хлороводород не проявляет кислотных свойств.
И только при очень сильном нагревании газообразный HCl реагирует с металлами, даже такими малоактивными, как Сu и Аg.
Восстановительные свойства HCl проявляются также в малой степени:
- он может окисляться фтором при обычной температуре:
- при высокой температуре (600°С) в присутствии катализаторов обратимо реагирует с кислородом:
Раствор HCl
Водный раствор HCl является сильной кислотой, т.к. молекулы HCl практически полностью распадаются на ионы:
Плиз, кто занет удобоваримую методу получения безводной хлорной кислоты. Нашёл только экстракцию из 70% НСlO4 олеумом. Но олеум, сами понимаете, достать проблематично.
ПОМОГИТЕ.
Просьба не беспокоиться - она нужна исключительно для науки. Мои вещества не терпят даже следов воды. Надо повторить известную методу, а там используется как раз безв хлорная кислота, там есть даже ссылка как её получать, но, как я уже писал возникают очевидные трудности с олеумом.
К сожалению олеум найти боооольшая проблема. Не знаю почему.
А безводную кислоту готовят в растворе, например хлористого метилена, так что надеюсь не взорвётся. Есть же методы её получения и использования.
Плюнте вы на это дело с хлорной кислотой. Очень это опасная штука. Не думаю, что в метиленовом растворе с ней работать безопасно. Кстати, если для Вас проблема олеум, подумайте, стоит ли связыватся с соединением, взрывающимся, например, от следов смазки на плохих шлифах.
NaClO4 + HCl = HClO4 + NaCl
NaCl труднорастворим в данной системе. Его фильтруем. Полученный раствор перегоняем, получаем азеотроп 72,4%.
Если хотите более конц. HClO4 не обязательно брать олеум. Насыщаем азеотроп жидким Cl2O7, который в своё время получаем термическим разложением другой порции HClO4 (только очень осторожно).
Краткая химическая энциклопедия том 5 - стр.711
азеотроп жидким Cl2O7, который в своё время получаем термическим разложением другой порции HClO4 (только очень осторожно).
Нууу. имея жидкий Cl2O7 можно и неполучать азеотроп, а сразу его с водой в стехиометрическом отношении, или еще лучше сразу его к осушаемому в-ву.
Вообще, по-моему, данный метод опасней чем метод с олеумом, ибо тут приходитса работать с самой кислотой, а при работе с олеумом получают ее неводный раствор, который постабильнее будет.
А нельзя ничем безводную хлорную заменить? Хотя бы каким-нибудь пентоксидом фосфора, натрием. или сита для воды использовать.
Насыщаем азеотроп жидким Cl2O7, который в своё время получаем термическим разложением другой порции HClO4 (только очень осторожно).
Краткая химическая энциклопедия том 5 - стр.711
Господа-теоретики, Вам что, жить надоело, или органов всеразличных избыток? Брауэра, что ли почитати предварительно, или Карякина на худой конец. Вот, кстати, забавная цитатка из Карякина: "при попытке перегонки хлорной кислоты при атмосферном давлении. в приемник отгоняется несколько капель темно-красной жидкости, внезапно взрывающей с громадной силой. "
В книге, увы, ничего не говорится о том, что представляют собой эти капли, равно, как и о том, что стало с экспериментаторами. По поведению действительно похоже на смесь высших оксидов хлора.
В данном случае вопрос не в этом - на форуме сразу закрывают довольно невинные темы, типа "как сделать в домашних условиях магний", но почему-то устраиваются длинные дискуссии о том,как получить безводную хлорную кислоту, вещество в высшей степени опасное и неприятное. Мне кажется, что человек, испытывающий проблемы с простыми реактивами, вряд ли работает в хорошо оснащенном месте, хотя сразу прошу прощения, если это не так. Тогда не совсем понятно, почему он не обратился к большому количеству вполне доступной литературы, живописующей все ужасы работы с безводной HClO4, равно как и различные методы ее получения.
Может все же сменить тему с "как получить" на "чем заменить".
Ведь вроде безводная HClO4 не незаменяемый осушитель. и я вообще раньше не слышал о сушке ею.
Я вот тоже не слышал. Тем более и в 70% кислоте воды почти нет.
Но если автор объяснит поконкретнее зачем она ему нужна и где он собирается с ней работать, то могу дать ссылки на работы по получению 100% хлорной кислоты.
Спасибо всем за активное участие. Могу заверить ещё раз что это чисто научный интерес, и кислота мне необходима именно для получения соединения по моей диссертации. Заменить её ничем нельзя (к сожалению). А купить олеум (как впрочем и другие реактивы могут только юр. лица, мне же, скромному аспиранту ИОХ РАН, достать его проблематично.
Спасибо всем за советы.
Это что в ИОХ такая нищета теперь что нет даже олеума? А вообще стоит подумать что дороже - сомнительная вещь типа степени кхн или жизнь
На химфаке то же есть один перец, Чуранов СС - он в свое время органику с хлорной кислотой смешал, всю жизнь осколки в глазах носит
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH - | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | - | - | Н | Н | Н | |
| F - | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | - | Н | Р | Р |
| Cl - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | - | - | - | Н | - | - | Н | - | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS - | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | - | Н | ? | Н | Н | ? | М | М | - | Н | ? | ? |
| HSO3 - | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | - | Н | Р | Р |
| HSO4 - | Р | Р | Р | Р | Р | Р | Р | Р | - | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | - | Р |
| NO2 - | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | - | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO - | Р | Р | Р | Р | Р | Р | Р | Р | Р | - | Р | Р | - | Р | Р | Р | Р | Р | Р | Р | - | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые (
Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую:
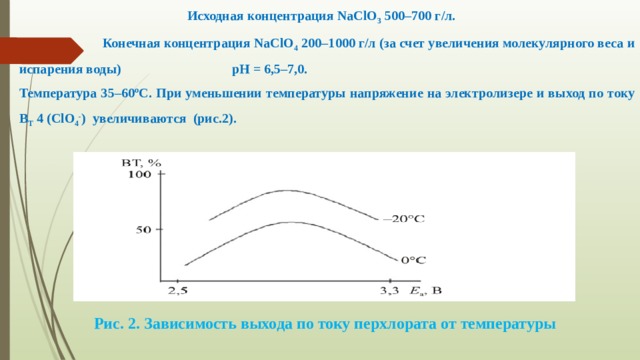
Скопируйте эту ссылку, чтобы разместить результат запроса " " на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки - помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация - такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Хлорная кислота HClO 4 – наиболее сильная и стабильная из всех кислородсодержащих кислот хлора. Используется в аналитической практике, гальваностегии, фотографии; как растворитель органических веществ и катализатор. Соли хлорной кислоты (NaClO 4 , KClO 4 , NH 4 ClO 4 ) используются в пиротехнике, фотографии; как компоненты при изготовлении ракетного топлива. Электрохимическое получение перхлоратов возможно двумя способами: электролизом хлоратов и электролизом NaCl. 1. Электролиз хлоратов (электролит не должен содержать Cl – ). ClO 3 - +H 2 O–2 e→ ClO 4 - +2H + (1) 2H + + 2 e → Н 2 (2) Суммарная реакция: ClO 3 - + H 2 O → ClO 4 - + H 2 (3) В процессе электролиза заметного изменения pH не происходит. Наиболее вероятным механизмом является механизм с участием кислорода, генерируемого на поверхности анода: Mе + H 2 O – e → MеOH + H + (4) MеOH – e → MеO + H + (5) MеO + ClO 3 - → Mе + ClO 4 - (6) Например, для платинового анода: Pt * PtO + ClO 3 - – e → Pt * PtO(ClO 3 ) адс (7) Pt * PtO(ClO 3 ) адс + H 2 O – e → Pt * PtO + ClO 4 - + 2H + (8) Возможно также образование радикалов ·ClO 3 , которые затем превращаются в ионы ClO 4 - . Побочный анодный процесс – выделение кислорода – усиливается при малой концентрации ClO 3 - в растворе. В присутствии Cl – выход потоку ClO 4 - уменьшается, т. к. идет процесс выделения хлора. Ионы Cl – могут образовываться на катоде вследствие восстановления ClO 3 - на катоде, которое предотвращают введением 2–5 г/л K 2 Cr 2 O 7 (нельзя для PbO 2 -анодов). Рис. 1. Зависимость выхода по току от материала анода: 1 – PbO 2 на титановой основе; 2 – Pt; 3 – ПТА Условия электролиза Используются малоизнашиваемые аноды: Pt, ПТА, PbO 2 на титановой основе, которые определяют выход по току и потенциал анода (рис. 1). Исходная концентрация NaClO 3 500–700 г/л. Конечная концентрация NaClO 4 200–1000 г/л (за счет увеличения молекулярного веса и испарения воды) рН = 6,5–7,0. Температура 35–60ºC. При уменьшении температуры напряжение на электролизере и выход по току В Т 4 (ClO 4 - ) увеличиваются (рис.2). Рис. 2. Зависимость выхода по току перхлората от температуры Для платинового анода плотность тока составляет 7 кА/м 2 , катодная плотность тока i к = 1–2 кА/м 2 . Начальный B T (NaClO 4 ) = 95%, в конце электролиза B T (NaClO 4 ) = 40% (конечная концентрация NaClO 3 составляет 50 г/л). Средний B T (NaClO 4 ) = 85%. Cl - → ClO - → ClO 3 - → ClO 4 - Материал катода – Ni, нержавеющая сталь, графит. Получение хлорной кислоты Хлорную кислоту получают химическим и электрохимическими способами. HCl конц на твердый NaClO 4 : NaClO 4 +HCl→HClO 4 + NaCl (9) 2. Электрохимические способы : – анодное окисление Cl 2 в HClO 4 : 1/2Cl 2 + 4H 2 O–7 e → ClO 4 - + 8H + (10) Это многостадийная реакция, последнюю стадию на платиновом аноде можно описать уравнением (8). Условия электролиза: аноды: Pt или ПТА; высокие анодные потенциалы: 2,8–3,0 В; электролит: 40%-ный раствор HClO 4 ; выход по току зависит от температуры: при –20ºС составляет 80–85%; B T (HClO 4 ) зависит от температуры, концентрации HCl, плотности тока. При i a ≈ 4 кА/м 2 B T (HClO 4 ) = 40–50%. Используют аноды с высоким перенапряжением выделения кислорода (Pt, ПТА). Оптимальная концентрация НCl составляет 0,1 моль/л. При увеличении концентрации НCl начинает выделяться Cl 2 , при средних концентрациях образуется HClO 3 . Для обеспечения высокого перенапряжения выделения хлора и кислорода необходима низкая температура (–25ºС). Читайте также:
|