Как сделать пробу на антибиотик
Добавил пользователь Алексей Ф. Обновлено: 04.10.2024
Л.В. Богун, И.Г. Березняков
Харьковская медицинская академия последипломного образования
АЛЛЕРГИЧЕСКИЕ РЕАКЦИИ НА АНТИБИОТИКИ
Удельный вес аллергических реакций (АР) на антибиотики в общей структуре нежелательных лекарственных реакций (НЛР) невелик. Так, кожные АР, которые наиболее распространены при антибиотикотерапии, составляют всего 2,2% среди всех НЛР. Тем не менее АР являются серьезными НЛР, поскольку сопровождаются относительно высокой заболеваемостью и смертностью. Лекарственный препарат инициирует развитие иммунологических НЛР посредством образования гаптенов. Согласно этой теории, небольшие по размерам молекулы лекарства могут становиться иммуногенами (т.е. веществами, способными вызывать специфический иммунный ответ) только после ковалентного связывания с макромолекулами белков. Тип реакции гиперчувствительности зависит от характера иммунного ответа и места образования антигенов. Например, клеточный иммунитет играет ведущую роль в реакциях гиперчувствительности замедленного типа (макулопапулезная сыпь, буллезная экзантема), а IgЕ-опосредованные реакции являются реакциями немедленного типа (крапивница, анафилаксия).
Диагностика АР. Наиболее значимый фактор риска развития АР на антибиотик – наличие АР на антибиотик данного класса в прошлом. Особенно большую роль играет наличие в прошлом АР на пенициллин и цефалоспорины. У больных с АР на пенициллин риск развития АР на любой лекарственный препарат повышен примерно в 3 раза. Наличие атопических заболеваний, таких как аллергический ринит, бронхиальная астма или атопический дерматит, не является независимым фактором риска развития АР на ?-лактамные антибиотики. Однако если анафилактическая реакция развивается, то пациенты с атопическими заболеваниями, особенно с бронхиальной астмой, имеют худший прогноз вследствие более тяжелого течения АР и большей частоты летального исхода. Доказано, что такие сопутствующие патологии, как ВИЧ-инфекция, муковисцидоз, инфекционный мононуклеоз, предопределяют более высокую вероятность развития АР. При подозрении на аллергию к антимикробному препарату следует прежде всего убедиться в ее иммунологическом характере и исключить другие НЛР с неиммунологическими механизмами развития. Важное значение придается также правильной оценке собственно АР – механизма ее развития и тяжести течения. Гипердиагностика АР может привести к снижению эффективности антимикробной терапии, повышению стоимости лечения и формированию резистентности микроорганизмов за счет необоснованной смены антимикробного препарата. У пациентов с АР на антибиотики необходим тщательный сбор анамнеза болезни. Следует точно описать симптомы (крапивница, кожный зуд, ангионевротический отек, нарушения дыхания) и их тяжесть (умеренно выраженные или угрожающие жизни), четко установить время начала развития реакции и ее связь с приемом препарата. При этом необходимо зафиксировать все лекарственные средства, которые больной принимал на момент начала АР, поскольку она может быть вызвана не только антимикробным препаратом. Следует тщательно собрать сведения о переносимости всех антимикробных препаратов в прошлом.
Клинические проявления АР на антибиотики чрезвычайно разнообразны по симптоматике, тяжести течения и тропности к различным органам и системам. Наиболее частыми АР при антибактериальной терапии являются кожные проявления – макулопапулезная сыпь, крапивница и кожный зуд. Эти реакции развиваются, как правило, через несколько дней или недель после начала приема препарата, в течение которых происходит сенсибилизация организма. В случаях повторного контакта с лекарством характерно более быстрое возникновение АР, иногда в течение нескольких часов или даже минут. Значительно реже аллергия на антибиотики проявляется в виде лихорадки, эозинофилии и других симптомов, не связанных с поражением кожных покровов. Например, комбинация амоксициллина с клавулановой кислотой может вызывать печеночный холестаз, а высокие дозы пенициллинов и цефалоспоринов – гемолиз и цитопению вследствие образования специфических для этих препаратов антител. Тяжелые аллергические IgE-опосредованные реакции по типу анафилаксии, к счастью, встречаются редко. Под анафилаксией подразумевают тяжелую системную АР. Единого определения для нее пока не существует, так как она имеет множество проявлений, причем ведущие компоненты выделить трудно. Многие клиницисты пользуются рабочим определением анафилаксии, согласно которому под этим термином понимают наличие хотя бы одного из двух тяжелых симптомов: нарушения дыхания (вследствие отека гортани или астмы) или гипотензии (обморок, коллапс, потеря сознания). Данный подход имеет существенный недостаток, поскольку умеренно выраженные проявления анафилаксии (генерализованная крапивница, ангионевротический отек и ринит) при отсутствии нарушений дыхания и гипотензии выпадают за рамки ее определения, хотя принадлежат к тому же типу реакций гиперчувствительности немедленного типа.
Тактика лечения АР зависит прежде всего от механизма ее развития, т.е. от того, является ли она реакцией замедленного или немедленного типа. Для выявления реакций немедленного типа, т.е., IgE-опосредованных по типу анафилаксии, проводят кожную пробу. Отрицательный результат кожной пробы не означает отсутствие IgE, за исключением кожной пробы с пенициллином, отрицательные результаты которой действительно свидетельствуют о низком риске развития реакций немедленного типа. Причина этого кроется в отсутствии четких данных об иммуногенных структурах большинства лекарственных средств, каковыми также могут быть неидентифицированные метаболиты антибиотиков или продукты их распада. Именно поэтому для подавляющего большинства антибактериальных препаратов в настоящее время не существует диагностических тестов, апробированных in vivo и in vitro, которые позволяли бы выявить все специфические для этих антибиотиков IgE. Кожные пробы обладают высокой диагностической точностью для выявления АР на пенициллин, поскольку клинически значимые антигенные детерминанты пенициллина хорошо изучены. К ним относятся основной антиген пенициллина – пенициллоила полилизин и несколько второстепенных антигенных детерминант. Кожную пробу проводят с пенициллоила полилизином в сочетании с раствором пенициллина G 10 тыс. ЕД в 1 мл или со смесью второстепенных антигенов, из которых чаще всего используют 0,01М раствор бензила пенициллоата, бензила пениллоата и бензил-n-пропиламина. Вначале выполняют кожную скарификационную пробу с нанесением полной тестовой дозы, и если ее результаты отрицательны через 15 мин, то еще одну тестовую дозу вводят внутрикожно. Увеличение диаметра волдыря на 3 мм и более по сравнению с контролем при наличии эритемы свидетельствует о положительной реакции. По результатам кожной пробы пенициллинспецифические IgE выявляются менее чем у 20% больных с АР на пенициллин в анамнезе. Отрицательный результат кожной пробы свидетельствует либо о том, что предшествующие АР не были опосредованы IgE, либо об отсутствии таких антител в настоящее время; в любом случае назначение пенициллина возможно. При этом риск развития реакций гиперчувствительности немедленного типа минимален (менее 4%) и не отличается от такового у лиц без предшествующих АР на пенициллин в анамнезе.
Для подтверждения гиперчувствительности к антибиотику можно применять провокационную пробу, заключающуюся во введении 3-6 постепенно увеличивающихся доз до достижения стандартной дозы препарата. Однако эти пробы небезопасны для пациента, так как могут привести к развитию реакций гиперчувствительности немедленного типа (по данным одного из исследований, частота развития таких реакций при провокационных пробах достигает 17,6%). И хотя эти реакции в подобных случаях обычно протекают сравнительно благоприятно, т.е. менее выражены по длительности и тяжести, однако провокационные пробы могут проводиться только специально обученным медицинским персоналом в отделениях интенсивной терапии, оснащенных оборудованием для сердечно-легочной реанимации.
Десенсибилизация к препарату проводится при необходимости использования антибиотика, вызывающего АР гиперчувствительности немедленного типа. Например, существуют ситуации, когда нельзя избежать назначения ?-лактамов (бактериальный эндокардит, вызванный энтерококками; абсцесс мозга, бактериальный менингит, большинство инфекций, вызванных стафилококками или синегнойной палочкой, включая остеомиелит и сепсис; листериоз, нейросифилис, сифилис у беременных). Суть десенсибилизации заключается в постепенном и медленном (в течение нескольких часов) введении возрастающей дозы антибиотика, пока не будет достигнута его полная терапевтическая доза. Начальные дозы обычно составляют несколько микрограммов препарата, путь введения может быть парентеральный или пероральный, причем последний предпочтительнее, поскольку редко приводит к развитию анафилаксии. Дозу препарата удваивают каждые 15-30 мин, и в большинстве случаев терапевтическая доза антибиотика достигается в течение 4-5 ч.
Осложнения пероральной десенсибилизации включают умеренный зуд, крапивницу во время процедуры и регистрируются у 5-25% пациентов. Важно подчеркнуть, что состояние десенсибилизации проходит через 24-48 ч, поэтому при повторном применении пенициллина необходимо снова выполнять кожную пробу. При необходимости повторного назначения пенициллина десенсибилизацию следует проводить снова. Например, у лиц с муковисцидозом поддерживать состояние десенсибилизации можно с помощью длительного перорального применения пенициллина 2 раза в сутки.
В случаях АР, не связанных с образованием IgЕ, тактика ведения больного зависит от клинических проявлений реакции. Если АР проявляется в виде макулопапулезной сыпи, возможно применение ступенчатой пробной терапии, которая по своей сути сходна с провокационной пробой, отличаясь от последней более высокими начальными дозами (миллиграммы вместо микрограммов) и более длительными интервалами между дозами (от нескольких часов до нескольких дней и даже недель вместо 15-30 мин). В течение всего периода ступенчатой пробной терапии за больным тщательно наблюдают для выявления побочных реакций, которые чаще всего протекают в виде кожных изменений. Решение об отмене антибиотика зависит от тяжести побочной реакции: при появлении волдырей или вовлечении в процесс слизистых оболочек препарат следует отменить, а при развитии более легких реакций, таких как макулопапулезная сыпь, ступенчатую пробную терапию можно продолжить на фоне лечения антигистаминными препаратами и/или глюкокортикостероидами. Метод ступенчатой пробной терапии противопоказан при анамнестических указаниях на тяжелые, опасные для жизни АР, даже если механизм их развития и не связан с образованием IgЕ (лекарственная гемолитическая анемия, синдром Стивенса-Джонсона, токсический эпидермальный некролиз и т.д). Однако прогнозировать эффективность данного метода затруднительно. Кроме того, он представляет потенциальную опасность для пациента. Например, описан случай развития анафилаксии на введение 1 г цефалотина у больного, у которого отсутствовали АР на предшествующие более низкие дозы препарата. Следовательно, как и провокационная проба, ступенчатая пробная терапия должна проводиться в специально оборудованных отделениях интенсивной терапии.
Частные вопросы Аллергия на пенициллин. При подтверждении АР на пенициллин дальнейшее ведение больного возможно по одному из трех вариантов. Первый (наиболее распространенный) заключается в выборе антимикробного препарата другого класса, не принадлежащего к ?-лактамам: макролида, фторхинолона, сульфаниламида, гликопептида. Достоинством данного подхода является отсутствие риска перекрестной аллергии; к недостаткам следует отнести выбор менее эффективного антимикробного средства, повышение стоимости лечения, угрозу развития резистентности микроорганизмов (особенно к ванкомицину). Второй распространенный подход ведения больных с подтвержденной АР на пенициллин заключается в назначении антибиотика из группы цефалоспоринов. Такой подход основан на известном факте, что тяжелые АР на цефалоспорины развиваются достаточно редко. К нему прибегают на практике при наличии совокупности следующих условий: 1) предшествующая АР была легкой степени тяжести и не являлась реакцией немедленного типа; 2) имеются строгие клинические показания к использованию цефалоспоринов; 3) выполнение кожной пробы на пенициллин неосуществимо; 4) имеются лекарственные препараты и оборудование для лечения возможных АР. Наконец, третий подход предусматривает использование кожных проб при обследовании пациента с анамнестическими указаниями на аллергию к пенициллину. По данным статистики, частота отрицательных кожных проб на пенициллин у таких больных высока (80-90%). Таким образом, большинству пациентов назначать цефалоспорины можно. К недостаткам этого метода относятся необходимость наличия специальных наборов для проведения кожных проб и соответственно удорожание лечения. Данный вариант показан пациентам с тяжелыми АР на пенициллин в анамнезе, у которых в конкретной клинической ситуации невозможно заменить цефалоспорины на антибиотики других групп. Аллергия на цефалоспорины. Кожные пробы с пенициллином информативны и для больных с АР на цефалоспорины для решения вопроса о возможности применения пенициллина. При отрицательных результатах пробы применение пенициллина возможно, при положительном – назначают антибиотик другой группы (не-?-лактам) или проводят предварительную десенсибилизацию к пенициллину. При АР на данный цефалоспорин назначение этого антибиотика в дальнейшем противопоказано.. Аллергия на сульфаниламиды. У пациентов с АР на сульфаниламидные антимикробные препараты актуален вопрос о возможности использования других сульфаниламидсодержащих препаратов – диуретиков, целекоксиба, производных сульфонилмочевины (пероральные гипогликемические средства). Однако по сравнению с больными, не имевшими АР в анамнезе, у пациентов с АР на сульфаниламидные антимикробные средства повышен риск развития АР на другие сульфаниламидсодержащие препараты и даже на пенициллин.
Заключение
Больные с АР на антибиотики в анамнезе требуют тщательного обследования для подтверждения иммунного характера НЛР и выявления типа АР. Вопрос о целесообразности дальнейшего назначения антибиотика, вызвавшего АР, зависит от клинической ситуации и возможности применения препарата другого класса. В ряде случаев при невозможности адекватной замены антибиотика препаратами другой группы допускается применение других антибиотиков этого же класса (при нетяжелых АР в анамнезе, низком риске перекрестной аллергии), а при тяжелых АР в прошлом – проведение специфических методов лечения (десенсибилизация, ступенчатая пробная терапия).
Аллергические реакции организма пациента на лекарства встречаются в практике врача любой специальности. Распространенность их, по результатам разных исследователей, варьирует от 5 до 10% и неуклонно растет, что связано с увеличением потребления лекарств н
Аллергические реакции организма пациента на лекарства встречаются в практике врача любой специальности. Распространенность их, по результатам разных исследователей, варьирует от 5 до 10% и неуклонно растет, что связано с увеличением потребления лекарств населением и неблагоприятными экологическими факторами, нарушающими деятельность иммунной системы.
В основе лекарственной аллергии лежит аллергическое воспаление кожи, слизистых и других тканей и органов, обусловленное синтезом в организме факторов иммунной системы, способных взаимодействовать с лекарственными веществами или их метаболитами. Такими факторами могут являться антитела, представляющие собой иммуноглобулины различных классов (А, М, G, но чаще иммуноглобулины класса Е) или Т-лимфоциты. Наличие в организме этих факторов называется сенсибилизацией. Как правило, для формирования сенсибилизации необходимо попадание лекарственного вещества в организм на протяжении не менее 4–5 дней.
Аллергическая реакция развивается, когда лекарство поступает в уже сенсибилизированный организм и вступает во взаимодействие с антителами или сенсибилизированными клетками. Образовавшийся иммунный комплекс вызывает активацию механизмов иммунного ответа с последующим выбросом в кровоток и в межклеточное пространство биологически активных веществ (гистамина, серотонина, брадикинина, лейкотриенов, цитокинов и др.), что приводит к повреждению тканей, формированию аллергического воспаления, проявления которого мы наблюдаем как симптомы аллергических заболеваний.
Наличие периода сенсибилизации, необходимого для формирования антител или сенсибилизированных клеток в организме человека, обусловливает тот факт, что проявления лекарственной аллергии никогда не развиваются при первом приеме препарата. Кроме того, это позволяет без опасений вводить лекарство на протяжении 4–5 дней, если известно, что пациент ранее не принимал данное лекарство или перекрестно-реагирующие вещества.
Проявления лекарственной аллергии
Клинические проявления лекарственной аллергии чрезвычайно многообразны. Симптомы заболевания не зависят от медикамента и вводимой дозы. Любой медикамент может вызвать самые различные аллергические реакции, и одинаковые аллергические симптомы могут быть вызваны разными медикаментами. Случается, что у одного больного одно и то же лекарство вызывает разные аллергические проявления. Так, мы наблюдали женщину, страдавшую пенициллиновой аллергией, проявившейся впервые в виде крапивницы, а во второй раз в виде отека Квинке в области лица, шеи, верхней половины туловища и рук. Вызванные медикаментами аллергические симптомы полностью отличаются от фармакологических эффектов препарата и всегда соответствуют известным проявлениям аллергических заболеваний.
Среди путей введения лекарств наиболее сенсибилизирующим является местный — это единственный путь формирования контактного аллергического дерматита, довольно часто он приводит также к генерализованным высыпаниям и отеку Квинке. Второе место по риску сенсибилизации делят между собой парентеральное (внутривенное, внутримышечное и подкожное) и пероральное введение медикаментов. Крайне редко аллергия формируется при подконъюнктивальном, ретро- или парабульбарном, внутрисуставном назначении лекарства.
В возникновении лекарственной аллергии могут играть роль наследственные факторы. Например, мы наблюдали случаи гиперчувствительности к лидокаину по типу крапивницы и отека Квинке в одной семье у бабушки, мамы и девочки. Также нами наблюдались случаи семейной сульфаниламидной эритемы у женщины и ее внучек-близнецов.
Наиболее актуальными проявлениями лекарственной аллергии являются анафилактический шок, отек Квинке, бронхообструктивный синдром, острая крапивница и полиморфные высыпания, в том числе такие тяжелые эксфолиативные проявления, как синдром Лайелла и синдром Стивенса–Джонсона. Крайне редко встречаются аллергические ринит и конъюнктивит, аллергический миокардит, аллергические поражения желудочно-кишечного тракта (ЖКТ) и гепатобилиарной системы, поражения почек и системы крови.
Диагностика лекарственной аллергии
В подавляющем большинстве случаев лекарственной аллергии удается поставить диагноз, проанализировав анамнестические данные.
Критериями аллергии на лекарство являются:
отсутствие схожести симптомов заболевания с проявлениями других видов побочного действия лекарств (токсического, фармакологического и пр.);
проявления аллергии на предыдущие введения данного лекарства или химически сходных с ним соединений (перекрестно-реагирующих веществ);
Если на основании анамнеза не удалось определить причину аллергии, прибегают последовательно к лабораторному тестированию и затем, при необходимости, к провокационным пробам на самом пациенте. Тестирование проводят в отношении тех медикаментов, аллергия на которые, исходя из анамнеза, представляется вероятной.
Для диагностики лекарственной аллергии применяют лабораторные методы, кожное тестирование и провокационные пробы. Начинать диагностику следует с лабораторных методов, как самых безопасных.
Достоверность современных методов лабораторной диагностики варьирует в пределах 60–85% в зависимости от лекарственного вещества и механизма гиперчувствительности, поэтому исследователи постоянно совершенствуют имеющиеся методики и разрабатывают новые.
Лабораторные методы диагностики
Наиболее актуальными на сегодняшний день являются:
радиоаллергосорбентный метод определения специфических к лекарству иммуноглобулинов классов Е, М и G в сыворотке крови пациентов;
иммуноферментный метод определения специфических к лекарству иммуноглобулинов классов Е, М и G в сыворотке крови пациентов;
Радиоаллергосорбентным и иммуноферментным методами определяют наличие антител к лекарствам в сыворотке крови больного. В России чаще используется иммуноферментный метод, который является рутинным, т. е. обычным для хорошо оснащенной лаборатории. Он безопасен для больного, так как проводится в пробирке, но его применение регламентировано высокой стоимостью реагентов. Этот метод отработан для небольшой группы лекарственных веществ — бета-лактамных антибиотиков, цефалоспоринов, гентамицина, мономицина, лидокаина, ацетилсалициловой кислоты. Для исследования необходимо не менее 1 мл сыворотки крови (ее получают из венозной крови пациента). Исследование, как правило, занимает не менее 18 часов. Информативность его высокая в первые 2–3 месяца после возникновения аллергии и снижается с течением времени.
Тест Шелли и его модификаций, реакция бласттрансформации лейкоцитов, метод хемилюминесценции, а также тест высвобождения ионов калия и сульфидолейкотриенов из лейкоцитов сопряжены со значительными техническими трудностями. Они применяются, в основном, для научных исследований и требуют наличия высококвалифицированного персонала и ряда специальных условий. Эти методики позволяют использовать водорастворимые формы обычных лекарственных препаратов, поэтому отработаны для большого количества медикаментов. Для исследования необходима венозная кровь пациента или ее сыворотка в количестве не менее 5 мл. Результат исследования можно получить через несколько часов, иногда — дней. Диагностику этими методами проводят, как правило, в лабораториях научно-исследовательских институтов.
Флюоресцентный метод аллергической альтерации лейкоцитов также называют тестом аллергической альтерации лейкоцитов (ТААЛ). Он отработан для 92 лекарственных веществ, таких как антибиотики (бета-лактамные, макролиды, аминогликозиды, фторхинолоны, тетрациклины, линкомицин), сульфаниламиды, нестероидные противовоспалительные средства, анестетики, рентгеноконтрастные вещества, витамины и др. Для исследования необходима кровь пациента с антикоагулянтом (ЭДТА, гепарин). Тест занимает около 35 минут. Несомненным преимуществом его является необходимость небольшого количества крови — 100 мкл для тестирования одного лекарства, таким образом, для исследования 10 медикаментов достаточно 1 мл крови.
Тест торможения естественной эмиграции лейкоцитов (ТТЕЭЛ) проводится с растворами лекарственных препаратов с 1980 года. Он разработан академиком А. Д. Адо и его сотрудниками. Тест технически несложен. Поэтому проведение его возможно в любом медицинском учреждении. Метод отработан для диагностики лекарственной аллергии на антибиотики, сульфаниламидные препараты, нестероидные противовоспалительные препараты и местные анестетики, его отличает также низкая себестоимость. Определение чувствительности к одному препарату занимает около 1,5 часов.
Недостатки метода — его невозможность использования у детей до 5–6 лет, у пациентов с воспалением в полости рта, при острых аллергических заболеваниях. Кроме того, в день возможно тестирование только одного препарата. Методика проведения ТТЕЭЛ описана во многих специальных руководствах.
Кожные тесты
Кожное тестирование, являющееся одним из основных методов определения сенсибилизации к бытовым, пыльцевым, эпидермальным и грибковым аллергенам, не получило широкого распространения для диагностики лекарственной аллергии. Применяются скарификационные и прик-тесты (тест уколом), а также аппликационные кожные пробы.
Скарификационные и прик-тесты должны проводиться в специализированном аллергологическом кабинете в условиях реанимационной готовности. Проведение их с нативными препаратами опасно развитием системных аллергических реакций. Поэтому их назначение противопоказано пациентам с тяжелыми аллергическими реакциями в анамнезе (анафилактическом шоке, отеке Квинке в области лица, синдромах Лайелла и Стивенса–Джонсона).
К сожалению, скарификационное и прик-кожное тестирование в отношении лекарств является низкоинформативным диагностическим методом. Это связано с тем, что, во-первых, многие лекарства имеют низкую молекулярную массу и поэтому не способны фиксировать находящиеся в коже антитела, а во-вторых, с тем, что нередко причиной аллергии являются не сами лекарства, а их метаболиты, то есть продукты преобразования лекарственных веществ ферментными системами организма. Поэтому совершенствование диагностики лекарственной аллергии должно идти по пути изучения метаболитов, обладающих наиболее высокой сенсибилизирующей активностью, и получения на их основе реагентов для аллергодиагностики.
Аппликационное исследование с лекарствами является высокоинформативным методом диагностики только одного заболевания — аллергического контактного дерматита. Тестирование проводится следующим образом — на увлажненную физиологическим раствором неповрежденную кожу пациента (межлопаточной области) пластырем приклеивается пластиковая камера размером 1´1 см с лекарственным веществом, разведенным белым вазелином или другой вязкой инертной субстанцией. Открытой частью камера обращена к коже человека. Через 20 минут после начала манипуляции пластырь отклеивают и осматривают область, к которой прилежит лекарство (фиксируют реакцию немедленного типа). Если изменений на коже нет, аппликацию оставляют на 48–72 часа, периодически контролируя состояние места тестирования. При наличии аллергии, в процессе исследования в месте контакта лекарства с кожей больного появляется гиперемия, инфильтрация, папулы или везикулы, сопровождающиеся зудом.
Провокационные пробы
Крайне редко для диагностики лекарственной аллергии используют провокационные тесты на больном. Это необходимо в тех случаях, когда по результатам изучения анамнеза и лабораторных данных не удается установить связь клинических проявлений с приемом лекарства, а назначение этого медикамента в будущем необходимо. Провокационные пробы проводятся только врачом-аллергологом в специализированном аллергологическом кабинете в условиях реанимационной готовности.
Противопоказаниями к постановке провокационных тестов являются:
В настоящее время наиболее часто для диагностики аллергии на таблетированные формы применяется подъязычный тест, а с растворами для инъекций проводится дозированная провокация.
Подъязычная проба. Для подъязычной пробы используется 1/4 таблетки испытуемого лекарства или же 1/4 дозы раствора медикамента можно накапать на кусочек сахара. Больной должен держать, не глотая, таблетку или сахар с препаратом под языком. При положительном результате теста через 5–15 минут у обследуемого появляются симптомы аллергии — зуд во рту, отек губ, крапивница и др.
Дозированная провокация. В основе дозированной провокации лежит последовательное введение пациенту исследуемого медикамента, начиная с очень малых доз и самых поверхностных путей введения (накожного и внутрикожного). После каждого введения лекарства за пациентом наблюдают не менее 20 минут.
При отсутствии симптомов аллергии лекарство применяют подкожно в возрастающих дозах, доводя суммарную дозу до терапевтической. Метод дозированной провокации позволяет безошибочно поставить диагноз. Он отработан для бета-лактамных антибиотиков, местных анестетиков и некоторых других препаратов. Проводить тест необходимо в условиях реанимационной готовности. Протоколы его подробно описаны в специальной литературе.
При выявлении аллергии на лекарство врач должен на лицевой стороне истории болезни или амбулаторной карты пациента красным цветом сделать соответствующую отметку. Назначать причинный препарат больному в дальнейшем нельзя, так как сенсибилизация к лекарству может сохраняться десятки лет, и все это время существует опасность развития на него аллергической реакции.
Лечение лекарственной аллергии
Лечение лекарственной аллергии зависит от тяжести проявлений заболевания. Обязательно исключение медикамента, послужившего причиной аллергии. Если аллерген неизвестен, отменяют все лекарства, на фоне приема которых развилась реакция. Если лекарство принималось внутрь, больному назначают промывание желудка, очистительную клизму и сорбенты (активированный уголь из расчета не менее 1 таб. на 1 кг массы тела в сутки, Энтеросгель по 1–3 ст. л. 2–3 раза в день натощак за 30–60 минут до еды или Фильтрум-СТИ.
При обильных высыпаниях и выраженном зуде назначают антигистаминные препараты в возрастной дозировке (Супрастин, Тавегил, Пипольфен, Фенкарол 2 раза в день, а Кларитин, Зиртек, Кестин, Семпрекс 1 раз в день). При отсутствии эффекта на протяжении 1–2 суток и при усилении симптомов аллергии внутримышечно назначают 60–90 мг преднизолона, что, как правило, приводит к положительной динамике проявлений заболевания. В случае необходимости повторные введения преднизолона назначают через 4–8 часов до исчезновения симптомов. Возможно применение глюкокортикостероидов длительного действия (Дипроспан 0,5–2 мг внутримышечно однократно). Если, несмотря на проводимое лечение, симптомы заболевания сохраняются, переходят к внутривенной инфузии физиологического раствора и внутривенному назначению системных кортикостероидов. Суточная доза препаратов зависит от тяжести состояния и массы тела больного. Пероральные формы глюкокортикостероидов назначаются только при необходимости их длительного приема — в случае синдромов Лайелла и Стивенса–Джонсона.
При выраженной системной аллергической реакции, такой как анафилактический шок, проводят противошоковые мероприятия. После оказания первой помощи необходима госпитализация больного в реанимационное отделение. Наблюдение за ним ведется 8–10 дней. В этот период назначаются глюкокортикостероиды и антигистаминные препараты и контролируются функции печени, почек и сердца.
В госпитализации также нуждаются пациенты с отеком Квинке в области лица и шеи из-за опасности стеноза гортани, пациенты с выраженной некупирующейся бронхиальной обструкцией из-за возможности формирования астматического статуса, больные тяжелыми формами токсикодермий синдромами Лайелла и Стивенса–Джонсона и с лекарственной аллергией, протекающей с поражением внутренних органов (миокардит, гепатит и др.). В стационаре проводится инфузионная терапия, парентеральное введение глюкокортикостероидов и антигистаминных препаратов, симптоматическая терапия.
Особенности ведения пациентов с лекарственной аллергией в анамнезе
Например, пациенту с аллергией на бензилпенициллин противопоказано назначать все бета-лактамные антибиотики (природные или полусинтетические пенициллины, цефалоспорины, монобактамы, карбапенемы и др.). Этому больному, по показаниям, рекомендовано вводить антибиотики остальных фармакологических групп — азалиды (Сумамед, Рулид, Макропен, Вильпрафен и др.), аминогликозиды (гентамицин, мономицин и др.), фторхинолоны (ципрофлоксацин, офлоксацин и др.), тетрациклины, нитрофураны и др. в терапевтических дозах курсом 5–7 дней.
Кроме того, противопоказано назначение комплексных препаратов, содержащих лекарство, послужившее причиной аллергии или перекрестно-реагирующее с ним вещество. Например, при аллергии на сульфаниламиды и Новокаин противопоказано применение местного анестетика Ультракаин Д-С из-за содержания в нем Д-С стабилизатора, являющегося производным парааминобензойной кислоты. При аллергии на ацетилсалициловую кислоту опасно назначение Цитрамона и других препаратов, включающих в состав нестероидные противовоспалительные препараты. В некоторых случаях пациенты, страдающие непереносимостью нестероидных противовоспалительных препаратов, хорошо переносят Ацетаминофен (парацетамол).
Пациентам с лекарственной аллергией в анамнезе назначают медикаменты строго по показаниям. Дозы должны строго соответствовать терапевтическим. Следует избегать полипрагмазии, т. е. одновременного назначения более трех препаратов. Требуется также объяснить пациенту, что принимать разные медикаменты необходимо с интервалом не менее 1,5 часов для снижения риска взаимодействия лекарственных веществ.
При рациональном назначении терапии риск возникновения сенсибилизации к другому медикаменту невысок. По нашим данным, он составляет около 6%, а поливалентная лекарственная аллергия, то есть сенсибилизация к веществам из трех и более неперекрестных фармакологических групп, возникает не чаще чем в 0,5% случаев.
Десенситизация
В редких случаях, когда применение лекарства, послужившего причиной аллергии, жизненно необходимо и невозможно осуществить его замену препаратом другой фармакологической группы, врач-аллерголог проводит десенсибилизацию к лекарству, которая во всем мире получила название десенситизации.
Метод представляет собой последовательное введение возрастающих доз препарата, начиная с очень малой до терапевтической и напоминает специфическую иммунотерапию аллерговакцинами. Описаны протоколы десенситизации к инсулину, Аспирину и бета-лактамным антибиотикам.
Литература
Клиническая аллергология: Рук-во для практических врачей / Под ред. Р. М. Хаитова. М.: МЕДпресс-информ. 2002. 624 с.
Новиков Д. К., Сергеев Ю. В., Новиков П. Д. Лекарственная аллергия. М.: Национальная академия микологии. 2001. 330 с.
Мясникова Т. Н., Латышева Т. В. Лекарственная аллергия: спектр лекарственных препаратов и особенности клинического течения // Российский аллергологический журнал. № 4. 2004. С. 24–29.
Jones T. A., Como J. A. Assessment of Medication Errors That Involved Drug Allergies at a University Hospital // Pharmacotherapy. 2003. 23 (7).
Е. В. Степанова, кандидат медицинских наук ГУ НИИВС им. Мечникова, РАМН, Москва
Взятие анализов и их транспортировка являются одним из ответственных этапов в работе лабораторий, обеспечивающим успех исследований. Если допущена ошибка на самом первом этапе взятия и траспортировки проб, вся работа лаборатории может оказаться не только бесплодной, но и послужить причиной назначения неадекватного лечения пациенту, от коготорого получен биоматериал.
Общими требованиями к процедуре отбора и транспортировки проб являются:
- Знание оптимальных сроков для взятия материала на исследование;
- Отбор материала из места максимальной локализации возбудителя;
- Отбор материала для исследования в необходимом и достаточном объеме с обеспечением условий, исключающих контаминацию проб;
- По возможности, взятие материала производится до применения антибиотиков и других химиотерапевтических препаратов или после отмены антибиотиков через 10 дней (кроме исследования на дисбактериоз);
- Материал для бактериологических исследований забирают только в стерильную, маркированную посуду;
- Материал доставляется в контейнерах, не допуская опрокидывания и расгерметизации.
- Материал доставляется в лабораторию немедленно или в течение 1-2 часов. При увелечении времени доставки проб до 48 часов необходимо использовать специальные транспортные среды.
Правила отбора проб клинического материала для бактериологических исследований
Разнообразие материала и своеобразие микрофлоры отдельных тканей требует применения определенных методических приемов отбора проб:
- Материал от больных необходимо брать до лечения антибактериальными препаратами или не ранее 10 дней после окончания курса лечения.
- Следует брать материал непосредственно из очага инфекции или исследовать клинический материал, отражающий воспалительный процесс в тех или иных органах и тканях (например, мочу при уроинфекциях, кал при дисбактериозах кишечника и т.д.).
- Важно соблюдать правила асептики для исключения контаминации пробы посторонней микрофлорой.
- При взятии проб можно использовать стерильные ватные тампоны, транспортные среду, шприцы (для крови, гнойного отделяемого и т.д.).
- Материал для бактериологического исследования должен быть доставлен в лабораторию не позже 1-2 часов после отбора проб, так как более длительное пребывание при комнатной температуре приводит к гибели ряда микроорганизмов, в том числе возбудителей инфекционного процесса и размножению в этих материалах посторонней гнилостной микрофлоры.
В случае хранения материала в холодильнике срок хранения можно увеличить до 3-4 часов (это не относится к пробам крови и спиномозговой жидкости). Пренебрежение сроками доставки материала приводит к искажению результатов исследования. Использование транспортных сред удлиняет сроки хранения материала до 24-48 ч.
Правила сбора мочи для женщин
Помыть руки с мылом. Вымойте область наружных половых органов. Во избежание попадания в мочу выделений из влагалища, во время сбора мочи женщинам, живущим половой жизнью, рекомендуется ввести во влагалище тампон. Снять крышку с контейнера и взять его в руку, стараясь не касаться краев. Удерживая половые губы разведенными, выпустите немного мочи в унитаз, приостановите мочеиспускание, а затем, подставив контейнер под струю мочи, наполните его до половины объема (10-30 мл). Не прикасаться контейнером к телу. Плотно закрыть. Доставить в лабораторию в течении 1,5-2 часов.
Правила сбора мочи у грудных детей
Провести туалет наружных половых органов, собирать мочу в одноразовый мочеприемник. Моча выжатая из одноразовых подгузников, исследованию не подлежит. Доставить в лабораторию в течении 1,5-2 часов.
Правила сбора мочи для мужчин
Вымойте руки с мылом. Отведите назад крайнюю плоть (если она не обрезана), головку полового члена вымыть с мылом теплой кипяченой водой, просушить с помощью чистой салфетки. Подготовить контейнер для мочи, слегка открутить крышку так, чтобы ее легко можно было снять. Не дотрагиваться руками до внутренних стенок контейнера и крышки. Выпустить небольшое количество мочи в унитаз (или судно). Приостановите мочеиспускание. Удерживая крайнюю плоть в отведенном положении, направьте струю мочи в контейнер и наполните его до указанного уровня. Тщательно закройте контейнер крышкой. Доставить в лабораторию в течении 1,5-2 часов.
Молоко относится к основным продуктам питания. Особенно важно оно для детей. Его качество контролируется на государственном уровне. Для этого применяются различные методы и комплексы. Среди последних наиболее популярным является экспресс тест для определения антибиотиков в молоке 4sensor (форсенсор).
Нормативные документы анализа молока
Считывающее устройство для тест-полосок ANKAR-100
Тест Twinsensor
Термостат TIAS TF
Тест 4sensor
Инкубатор-термостат HeatSensor HS 00647
Инкубатор-термостат HeatSensor DUO
Также приняты ГОСТы по методике обнаружения в молоке вредных веществ:
ГОСТ 32254-2013 Молоко. Инструментальный экспресс-метод определения антибиотиков
ГОСТ 32901-2014 Молоко и молочная продукция. Методы микробиологического анализа
ГОСТ Р 51600-2010 Молоко и молочные продукты. Микробиологические методы определения наличия антибиотиков
ГОСТ 32219-2013 Молоко и молочные продукты. Иммуноферментные методы определения наличия антибиотиков (ГОСТ Р 53774-2010 с идентичным названием отменен).
Принятие перечисленных выше и многих других документов необходимо по той причине, что молоко загрязняется нежелательными для человека веществами. Это происходит, как неизбежно, так и вследствие халатности производителей.
Среди вредных компонентов, которые попадают в данный продукт, нередко встречаются антибиотики.
Как антибиотики оказываются в молоке?
Коровы болеют довольно часто. Лечат животных разными лекарствами, в том числе, антибиотиками. На сегодняшний день в ветеринарной практике используется более 50 разновидностей препаратов данной группы. В основном, они применяются при респираторных болезнях, мастите (в том числе – для профилактики) и инфекционных заболеваниях. Принятые медикаменты в итоге попадают в молоко, в котором присутствуют не в чистом виде, а в остаточных количествах.
Кроме того, для экономии корма, интенсивного увеличения живого веса (разница в привесе - до 30%) и стимуляции роста молодняка тоже применяются антибиотики. Их включают в кормовые добавки в субтерапевтических (то есть, в меньших, чем для лечения) количествах. Но и эти препараты тоже оказываются в молоке, притом, даже в тех случаях, когда добавки вносились минимально.
Как показывает практика, в фермерских хозяйствах, после выздоровления коровы, ее продукцию редко проверяют на наличие антибиотиков. По санитарным правилам, после того, как буренку пролечили, полученное от нее молоко надо сливать в течение от 5 до 10 дней (точный срок зависит от вида лекарственного препарата). Сдавать его на молзавод нельзя! Тем не менее, в периоды, когда в общем по стране наблюдается недостаток данного сырья, фермеры, чтобы не терять прибыль, иногда выливают такое молоко в общие бидоны. То есть, разбавляют его. В результате, концентрация антибиотиков действительно снижается, но, все равно, они никуда не исчезают.
Какой вред приносят антибиотики?
Первыми от наличия в сырье антибиотиков страдают производители. Указанные лекарственные препараты являются ингибиторами – они замедляют процесс сквашивания, а то и вовсе прекращают его. Поэтому, если такое молоко попадает на линию производства кисломолочных продуктов, то оно нарушает ход технологического процесса, из-за чего компания терпит убытки. Кстати, по этой причине является непреложным тот факт, что в кисломолочке антибиотики отсутствуют по определению.
Накопление лекарств в организме любого потребителя молока и молокопродуктов, приносит большой вред здоровью человека. Снижается иммунитет, может развиться аллергия (в основном – из-за пенициллина) или дисбактериоз. По некоторым данным – наблюдается увеличение веса. Тетрациклин может стать причиной снижения аппетита, вызвать проктит или гастрит, а также фотосенсибилизацию кожи (повышенную чувствительность к УФ лучам). Он вредит печени и способен нарушить состав крови. Стрептомицин вреден для нервной системы. Левомицетин, который ветеринары применяют довольно часто, угнетает кроветворную систему.
Антибиотики подавляют активность ферментов, изменяют микрофлору человеческого организма, распространяя ее устойчивые виды. Кипячения эти медпрепараты не боятся. В сухом молоке их не меньше, чем в исходном сырье, при сушке они не разрушаются.
Методы определения наличия антибиотиков в молоке
Иммунологические и микробиологические методы
К иммунологическим методам относятся экспресс тесты на антибиотики в молоке. Их действие основано на анализе интенсивности реакции специфических рецепторов – белков, связанных с частицами золота. Технология удобная, от лаборанта не требуется специальное химическое образование. Результат получают быстро, в среднем на исследование требуется от 5 до 10 минут. Считывающее устройство не обязательно, в некоторых случаях надо применять инкубатор, для создания необходимой температуры пробы в пределах от + 40 до + 50 град С. Анализ можно делать в полевых условиях, термостаты подключаются к источнику питания 12/24В. Каждый тест рассчитан на определение одной или нескольких (до четырех) групп антибиотиков.
В основу ингибиторных микробиологических методов положено влияние антибиотиков на штаммы микроорганизмов. Наличие медпрепаратов в молоке обнаруживается при диффузии их в агар – определением интенсивности торможения развития тестовых культур, которые были внесены в питательную среду.
Молоко помещают в виалы (небольшие, от 0,3 до 20 мл стеклянные или пластиковые лабораторные флаконы) с питательной средой. В ней содержится штамм бактерий Bacillus strearothermophius calidolactis. А также индикатор кислотности. При росте или снижении рН, он изменяет окраску среды, по которой определяют наличие антибиотиков в пробе.
Виалы инкубируют 3 часа при Т = 64 град С. Если в пробе антибиотиков нет, то бактерии быстро развиваются, кислотность меняется, а вместе с ней – и цвет среды. Если же медикаменты в молоке есть, то они угнетают рост бактерий, рН не меняется, цвет среды остается таким же, как в начале анализа.
Преимущество подобных тестов заключается в возможности в течение одного исследования обнаружить полный спектр антибиотиков и других ингибиторов. Недостаток – сравнительно долгое время работы, обязательное применение инкубатора. Такой способ больше подходит для перерабатывающих предприятий, а не для фермеров. Стоимость ингибиторного микробиологического метода ниже, чем экспресс-теста.
Люминесцентные методы
Эти методы основаны на сенсибилизированной люминесценции ионов Tb (III) и Eu (III). Обычно они применяются для определения медпрепаратов хинолонового и тетрациклинового ряда. Органические лиганды, к которым относятся и антибиотики, характеризуются высокими молярными коэффициентами поглощения. Они интенсивно впитывают энергию возбуждения. При этом, если энергия лиганда в триплетном состоянии больше, чем тот же параметр иона лантанида на резонансном уровне, то она может ему передаваться. Ион возбуждается и начинает излучать кванты света.
Электрохимические методы
Такие способы применяются для обнаружения медикаментов тетрациклиновой группы. Используется ионометрия и амперометрическое титрование. Ионные ассоциаты антибиотиков, с гетерополианионами структуры Кеггина, выступают в роли электродно-активного компонента мембран ионселективных электродов. При амперометрической технологии титрантом является 12-молибдофосфорная кислота. Достоинствами методики являются ее селективность, простота проведения и высокая чувствительность.
Хроматографические методы
Технологии данной группы основаны на определении изменения интенсивности молекулярной постколоночной люминесценции антибиотиков (в основном, тетрациклинового ряда), которая усиливается при образовании комплексов с катионом циркония (IV). Самым эффективным считается метод ВЭЖХ с ультрафиолетовым или флуоресцентным детектированием.
В молочной промышленности применяются, в основном, иммунологические и микробиологические тесты. К первой группе относятся инкубаторные и безинкубаторные способы.
4sensor (Форсенсор)
Назначение форсенсора
Тесты на антибиотики в молоке 4sensor (форсенсор) являются одним из наиболее популярных в данной группе по той причине, что с их помощью можно одновременно определить наличие сразу четырех медикаментов: β-лактамного типа (пенициллина и цефалоспорина), тетрациклиновой группы, левомицетина (хлорамфеникола) и стрептомицина.
Набор рассчитан на работу с различными видами сырья – не только с натуральным молоком, но также с пастеризованным или сухим. Последнее в количестве 10 г смешивается в 90 мл подогретой до 40 град С дистиллированной воды. Можно исследовать сыворотку, в том числе, сухую. Свернувшееся молоко проверять нельзя.
Устройство форсенсора
Тесты на антибиотики в молоке 4 сенсор состоят из двух компонентов:
Микролунка (пробирка), для пробы молока. В ней имеется определенное количество моноклональных белковых антител (рецепторов), меченых коллоидным золотом.
Тест – полоска хроматографической бумаги. Она представляет собой набор мембран с линиями связывания. Каждая мембрана настроена на определенный вид антибиотиков.
Так как в процессе анализа проба молока должна быть подогрета до 40 град С, то для работы с комплектом нужен инкубатор-термостат. Производитель рекомендует применять только Heatsensor . Остальные, как сказано в инструкции к набору, не подходят. В том же документе говорится, что, если инкубатор отсутствует, можно пользоваться водяной баней.
Считывание данных выполняется двумя способами: визуально или с помощью специального аппарата Readsensor . Второй метод позволяет выполнить диагностику более точно, а также зафиксировать результаты исследований.
Порядок работы форсенсора
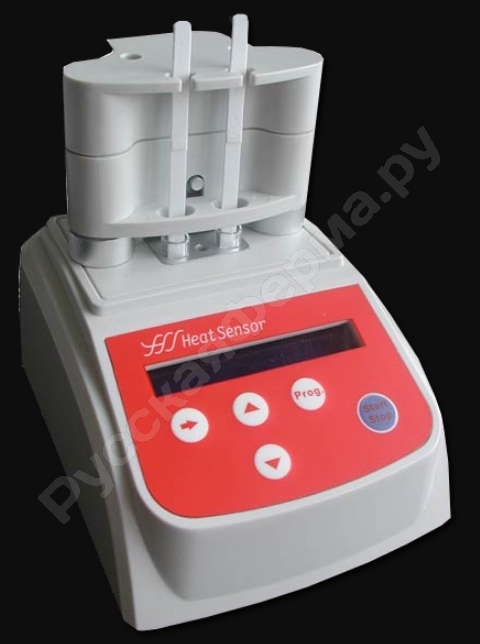
Включить инкубатор Heatsensor. Его можно будет использовать после того, как температура поднимется до 40 град С. На это требуется около 10 минут.
Поставить микролунку в термостат.
По истечении 5 минут (этот период называется первая инкубация, отсчет ведется с помощью вмонтированного в Heatsensor таймера), раздаются звуковой и световой сигналы. Выключить установку.
Поместить в микролунку тест-полоску.
После окончания, выключить прибор, вынуть тест-полоску и положить ее на лист бумаги. Прочитать результат. Это надо сделать в течение 5 минут после окончания анализа, не позже (не зависимо от того, визуально или с помощью Readsensor). Если итоги положительные, их надо подтвердить дополнительным исследованием.
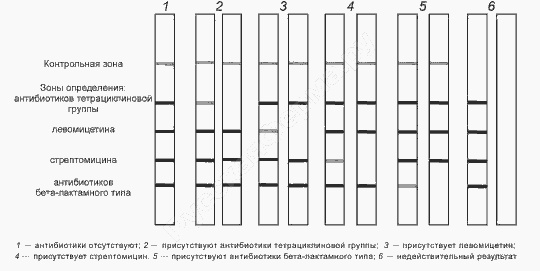
Визуальное считывание результатов работы форсенсора ![Визуальное считывание результатов]()
Начинать расшифровку необходимо с проверки наличия контрольной линии вверху полоски. Если ее нет, анализ следует считать недействительным. Если есть, тогда проверяют тестовые линии – по очереди, сверху вниз: тетрациклин, левомицетин, стрептомицин, бета-лактамы. Проверка заключается в сравнении интенсивности цветовой окраски двух линий – контрольной и тестовой, соответствующей определенному антибиотику .
Если цвет тестовой линии более интенсивный, чем контрольной, это значит, что результат – отрицательный. Данный антибиотик в пробе молока отсутствует, либо содержится на более низком уровне, чем приведен в справочной таблице. Если же тестовая светлее, чем контрольная, равная ей или вовсе отсутствует, то – положительный. Количество этого препарата соответствует нормативному или больше данного значения.
Таким способом надо проверить состояние всех тестовых полос. Если по какой-то из них невозможно понять, светлее она или такая же, как контрольная, значит, результат по ней считается положительным и требует повторного исследования.
Принцип действия форсенсора
В основу технологии положена комплексообразующая реакция антибиотиков четырех указанных выше групп с меченными коллоидным золотом белковыми рецепторами. После проведения анализа, проводится визуальное, или с помощью специального аппарата, определение наличия рецепторов, которые остались свободными.
После того, как молоко нальют в микролунку в термостате и включат прибор на первую инкубацию, находящийся в пробирке реагент суспензируется с пробой. Моноклональные антитела (рецепторы) связываются с веществами, которые проверяются на наличие в молоке (то есть, с антибиотиками).
Через 5 минут нагрева аппарат выключается, и в лунку помещают тест-полоску. Проверяемая жидкость начинает подниматься по полоске, проходя через расположенные на ней зоны поглощения. Если искомых антибиотиков в молоке в достаточном количестве нет, то в этих зонах должны появиться цветные линии. Если есть, то линии окажутся бледными или не появятся совсем, в зависимости от концентрации соответствующего медпрепарата.
Heatsensor
HeatSensor DUO APP032 – это портативный инкубатор-термостат для работы экспресс-методом со всеми тестами Unisensor. Рассчитан на одновременное исследование 2-х проб.
Его основным узлом является металлический нагреватель, расположенный в пластиковом корпусе. Тепловой блок работает по методу электромагнитной индукции. Поддерживает оптимальную для анализа температуру 40 град С, с точностью до плюс-минус 3 град С. По истечению срока инкубации, включается световой и звуковой сигналы. Полоски выбрасываются автоматически. Данные выводятся на дисплей.
Readsensor
У прибора есть несколько опций, которые выбираются, в зависимости от среды и условий анализа. Предусмотрено 2 рабочих режима: длительный и быстрый (последний запрограммирован по умолчанию). В первом случае надо ввести все показания оператора и реагентов. Во втором – только номер пробы.
Справа на приборе есть выдвижная ячейка с отверстием (прорезью) в центре. В нее вставляется тест-полоска. Чтобы молоко с индикатора не попало в оптическую часть аппарата, пропитанный жидкостью фильтр надо удалить.
Результаты появляются на дисплее через 10 секунд после установки полоски в ячейку и включения устройства в режим считывания.
Регулярное и повсеместное использование экспресс-тестов, как и других технологий определения антибиотиков в молоке, является надежным барьером для проникновения медпрепаратов в организм человека через продукты питания. В конечном итоге, это важный элемент здорового образа жизни населения страны.
Читайте также: