Как сделать крекинг алканов
Обновлено: 06.07.2024
Углеводороды разных классов (алканы, алкены, алкины, алкадиены, арены) можно получать различными способами.
Получение алканов
Крекинг алканов с изначально большей длиной цепи
Процесс, используемый в промышленности, протекает в интервале температур 450-500 o C в присутствии катализатора и при температуре 500-700 o C в отсутствие катализатора:
Важность промышленного процесса крекинга заключается в том, что он позволяет повысить выход бензина из тяжелых фракций нефти, которые не представляют существенной ценности сами по себе.
Гидрирование непредельных углеводородов
Газификация каменного угля
в присутствии никелевого катализатора при повышенных температуре и давлении может быть использована для получения метана:
Процесс Фишера-Тропша
С помощью данного метода могут быть получены предельные углеводороды нормального строения, т.е. алканы. Синтез алканов осуществляют, используя синтез-газ (смеси угарного газа CO и водорода H2), который пропускают через катализаторы при высоких температуре и давлении:
Реакция Вюрца
С помощью данной реакции могут быть получены углеводороды с большим числом атомов углерода в цепи, чем в исходных углеводородах. Реакция протекает при действии на галогеналканы металлического натрия:
Декарбоксилирование солей карбоновых кислот
Сплавление твердых солей карбоновых кислот со щелочами приводит к реакции декарбоксилирования, при этом образуются углеводород с меньшим числом атомов углерода и карбонат металла (реакция Дюма):
Гидролиз карбида алюминия
Взаимодействие карбида алюминия с водой, а также кислотами-неокислителями приводит к образованию метана:
Получение алкенов
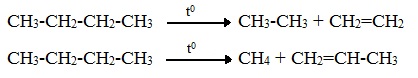
Крекинг алканов
Реакция в общем виде уже была рассмотрена выше (получение алканов). Пример реакции крекинга:
Дегидрогалогенирование галогеналканов
Дегидрогалогенирование галогеналканов протекает при действии на них спиртового раствора щелочи:
Дегидратация спиртов
Данный процесс протекает в присутствии концентрированной серной кислоты и нагревании до температуры более 140 о С:
Обратите внимание, что и в случае дегидратации, и в случае дегидрогалогенирования отщепление низкомолекулярного продукта (воды или галогеноводорода) происходит по правилу Зайцева: водород отщепляется от менее гидрированного атома углерода.
Дегалогенирование вицинальных дигалогеналканов
Вицинальными дигалогеналканами называют такие производные углеводородов, у которых атомы хлора прикреплены к соседним атомам углеродной цепи.
Дегидрогалогенирование вицинальных галогеналканов можно осуществить, используя цинк или магний:
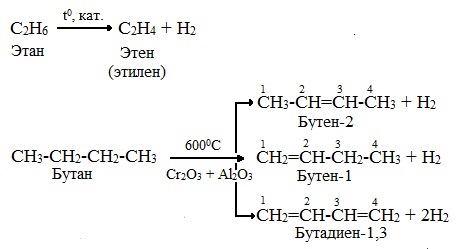
Дегидрирование алканов
Пропускание алканов над катализатором (Ni, Pt, Pd, Al2O3 или Cr2O3) при высокой температуре (400-600 о С) приводит к образованию соответствующих алкенов:
Получение алкадиенов
Дегидрирование бутана и бутена-1
В настоящий момент основным методом производства бутадиена-1,3 (дивинила) является каталитическое дегидрирование бутана, а также бутена-1, содержащихся в газах вторичной переработки нефти. Процесс проводят в присутствии катализатора на основе оксида хрома (III) при 500—650°С:
Метод Лебедева
Ранее (в Советском Союзе) бутадиен-1,3 получали по методу Лебедева из этанола:
Дегидрогалогенирование дигалогензамещенных алканов
Осуществляется действием на галогенпроизводные спиртового раствора щелочи:
Получение алкинов
Получение ацетилена
Пиролиз метана
При нагревании до температуры 1200-1500 о С метан подвергается реакции дегидрирования с одновременным удваиванием углеродной цепи – образуются ацетилен и водород:
Гидролиз карбидов щелочных и щелочноземельных металлов
Действием на карбиды щелочных и щелочно-земельных металлов воды или кислот-неокислителей в лаборатории получают ацетилен. Наиболее дешев и, как следствие, наиболее доступен для использования карбид кальция:
Дегидрогалогенирование дигалогеналканов
Получение гомологов ацетилена
Дегидрогалогенирование дигалогеналканов:
Дегидрирование алканов и алкенов:
Получение ароматических углеводородов (аренов)
Декарбоксилирование солей ароматических карбоновых кислот
Сплавлением солей ароматических карбоновых кислот со щелочами удается получить ароматические углеводороды с меньшим числом атомов углерода в молекуле по сравнению с исходной солью:
Тримеризация ацетилена
При пропускании ацетилена при температуре 400°C над активированным углем с хорошим выходом образуется бензол:
Аналогичным способом можно получать симметричные триалкилзамещенные бензолы из гомологов ацетилена. Например:
Дегидрирование гомологов циклогексана
При действии на циклоалканы с 6-ю атомами углерода в цикле высокой температуры в присутствии платины происходит дегидрирование с образованием соответствующего ароматического углеводорода:
Дегидроциклизация
Также возможно получение ароматических углеводородов из углеводородов нециклического строения при наличии углеродной цепи с длиной в 6 или более атомов углерода (дегидроциклизация). Процесс осуществляют при высоких температурах в присутствии платины или любого другого катализатора гидрирования-дегидрирования (Pd, Ni):
Алкилирование
Получение гомологов бензола алкилированием ароматических углеводородов хлорпроизоводными алканов, алкенами или спиртами:
Не секрет, что бензин получают из нефти. Однако большинство автолюбителей даже не задаются вопросом о том, как происходит этот процесс превращения нефти в топливо для их любимого автотранспорта. Он называется крекингом, с его помощью нефтеперерабатывающие заводы получают не только бензин, но и другие необходимые в современной жизни нефтехимические продукты. Интересна история возникновения этого способа переработки нефти. Изобретателем этого процесса и установки считается русский ученый, а сама установка для этого процесса очень проста и предельно понятна даже не разбирающемуся в химии человеку.
Что представляет собой крекинг
Почему так называется крекинг? Это слово произошло от английского cracking, обозначающего расщепление. По сути это процесс переработки нефти, а также входящих в ее состав фракций. Он производится для того, чтобы получить такие продукты, которые имеют более маленькую молекулярную массу. К таким относится смазочное масло, моторное топливо и другое подобное. Помимо этого, в результате такого процесса производится продукция, необходимая в использовании химической и нефтехимической отраслей.

Крекинг алканов включает сразу несколько процессов, среди которых конденсация и полимеризация веществ. Итогом этих процессов становится образование нефтяного кокса и фракции, закипающей при очень высокой температуре и называемой крекинг-остатком. Температура кипения этого вещества составляет больше 350 градусов. Следует отметить, что, помимо указанных процессов, происходят и другие – циклизация, изомеризация, синтез.
Изобретение Шухова

Способ английского химика Бартона
В начале двадцатого века в нефтехимическую отрасль неоценимый вклад внес англичанин Бартон, занимавшийся поиском способов и решений для получения бензина из нефти. Им был найден абсолютно идеальный способ, то есть реакция крекинга, в результате которой выходило наибольшее количество облегченных бензиновых фракций. До этого английский химик занимался переработкой нефтепродуктов, в числе которых был мазут, для извлечения керосина. Решив проблему с получением бензиновых фракций, Бартон запатентовал свой способ получения бензина.
В 1916 году способ Бартона был применен в промышленных условиях, а всего спустя четыре года после этого более восьмисот его установок уже вовсю работали на предприятиях.
Общеизвестна зависимость температуры закипания вещества от давления на него. То есть, если давление на какую-то жидкость весьма высокое, то, соответственно, будет высокой и температура ее закипания. При понижении давления на это вещество, оно может закипеть уже при более меньшей температуре. Именно эти знания использовал химик Бартон, добиваясь наиболее лучшей температуры, чтобы произошла реакция крекинга. Эта температура составляет от 425 до 475 градусов. Конечно, при таком высоком температурном воздействии на нефть она будет испаряться, а работать с парообразными веществами довольно сложно. Поэтому главной задачей английского химика стало недопущение закипания и испарения нефти. Он стал проводить весь процесс под высоким давлением.

Установка для крекинга
Устройство Бартона состояло из нескольких элементов, в числе которых был котел, функционирующий под высоким давлением. Изготовлен он был из довольно толстой стали, располагался над топкой, та, в свою очередь, была укомплектована дымогарной трубой. Она была направлена вверх к водяному коллектору-охладителю. Затем весь этот трубопровод направлялся к емкости, предназначенной для сбора жидкости. Внизу резервуара размещалась разветвленная труба, каждая трубка которой имела контрольный вентиль.
Как осуществлялся крекинг
Крекинг-процесс происходил следующим образом. Котел заполнялся нефтепродуктом, в частности, мазутом. Постепенно мазут нагревался за счет топки. Когда температура доходила до ста тридцати градусов, из содержимого котла удалялась (испарялась) имеющаяся в нем вода. Проходя по трубе и охлаждаясь, эта вода попадала в сборный резервуар, а оттуда вновь по трубе уходила вниз. В это же время в котле продолжался процесс, во время которого из мазута исчезали другие составляющие – воздух и иные газы. Они проходили тот же путь, что и вода, направляясь в трубопровод.
Избавившись от воды и газов, нефтепродукт был готов к последующему крекингу. Печь растапливали сильнее, температура ее и котла медленно повышалась, пока не достигала 345 градусов. В это время происходило испарение облегченных углеводородов. Проходя по трубе к охладителю, они даже там оставались в состоянии газа, в отличие от водяных паров. Попав в сборную емкость, эти углеводороды следовали в трубопровод, так как выпускной вентиль закрывался и не давал им уйти в канаву. Они возвращались через трубу вновь в емкость, а затем снова повторяли весь путь, не находя выхода.
Соответственно, с течением времени их становилось все больше и больше. Итогом было растущее давление в системе. Когда это давление доходило до пяти атмосфер, легкие углеводороды уже были неспособны испаряться из котла. Углеводороды, сжимаясь, поддерживали равномерное давление в котле, трубопроводе, сборной емкости и холодильнике. Одновременно начиналось из-за высокой температуры расщепление тяжелых углеводородов. В результате они превращались в бензин, то есть в легкий углеводород. Его образование начинало происходить примерно при 250 градусах, легкие углеводороды при расщеплении испарялись, образовывали конденсат в охладительной камере, собираемый в сборном резервуаре. Далее по трубе бензин перетекал в подготовленные емкости, в которых давление было пониженным. Такое давление способствовало удалению газообразных элементов. С течением времени такие газы удалялись, а готовый бензин переливался в нужные резервуары или баки.
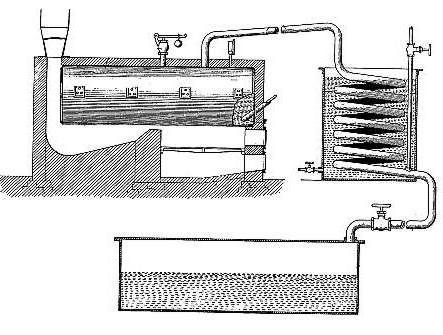
Чем больше легких углеводородов испарялось, тем более упругим и стойким к температурному воздействию становился мазут. Поэтому после превращения половины содержимого котла в бензин дальнейшая работа приостанавливалась. Помогал в установлении количества полученного бензина специально установленный в установку счетчик. Печка гасилась, трубопровод перекрывался. Вентиль трубопровода, который соединял его с компрессором, наоборот, открывался, пары перемещались в этот компрессор, давление в нем было меньше. Параллельно с этим перекрывалась труба, ведущая к полученному бензину, чтобы оборвать связь его с установкой. Дальнейшие действия заключались в ожидании остывания котла, сливе из него вещества. Для последующего использования после этого котел зачищался от налета кокса, и можно было проводить новый крекинг-процесс.
Этапы переработки нефти и установка Бартона
Следует отметить, что возможность расщепления нефти, то есть крекинг алканов, уже давно была замечена учеными. Однако она не применялась при обычной перегонке, так как это расщепление в такой ситуации было нежелательным. Для этого в процессе был задействован перегретый пар. С его помощью нефть не расщеплялась, но испарялась.
За все время своего существования нефтеперерабатывающая отрасль пережила несколько этапов. Так, с шестидесятых годов XIX века до начала прошлого века нефть подвергалась переработке с целью получения только керосина. Он был тогда материалом, веществом, с помощью которого люди получали освещение в темное время. Примечательно, что во время такой переработки, получаемые из нефти облегченные фракции, считались отходами. Они выливались в канавы и уничтожались сжиганием или другим способом.
Установка крекинга Бартона и его метод послужили основополагающим этапом всей нефтеперерабатывающей сферы. Именно этот способ английского химика позволил добиться более высокого результата получения бензина. Выход этого продукта нефтепереработки, а также других ароматических углеводородов возрос в несколько раз.
Потребность в применении крекинга
В начале двадцатого века бензин был, можно сказать, ненужным продуктом нефтепереработки. Автотранспорта, работающего на этом виде топлива, в то время было очень мало, поэтому и топливо было не востребовано. Но с течением времени автопарк стран неуклонно рос, соответственно, требовался и бензин. Только за первые десять-двенадцать лет двадцатого века потребность в бензине возросла в 115 раз!

Получаемый путем простой перегонки бензин, а, точнее, его объемы не удовлетворяли потребителя, да и самих производителей. Поэтому было решено применять крекинг. Это позволило нарастить темп производства. Благодаря этому удалось увеличить количество бензина для нужд государств.
Чуть позже было установлено, что крекинг нефтепродуктов можно было проводить не только лишь на мазуте или солярке. В качестве исходного сырья для этого вполне была годна и сырая нефть. Также производителями и специалистами в этой области было определено, что бензин, полученный способом крекинга, являлся более качественным. В частности, при его использовании в автомобилях они работали более исправно и дольше обычного. Это было связано с тем, что полученный путем крекинга бензин сохранял некоторые углеводороды, сгорающие при обычной перегонке. Эти вещества, в свою очередь, при использовании в двигателях внутреннего сгорания имели свойство воспламеняться и гореть более плавно, в итоге двигатели работали без взрывов топлива.
Каталитический крекинг
Крекинг – это процесс, который можно подразделить на два вида. Он применяется для выработки топлива, например, бензина. В одних случаях может проводиться путем простой термической обработки нефтепродуктов – термический крекинг. В других же случаях возможно осуществление этого процесса не только при помощи высокой температуры, но и с добавлением катализаторов. Такой процесс называется каталитическим.
Используя последний указанный способ переработки, производители получают высокооктановый бензин.
Считается, что этот вид является самым важным процессом, который обеспечивает наиболее глубокую и качественную переработку нефти. Установка каталитического крекинга, внедренная в промышленность в тридцатых годах прошлого века, позволила получить производителям несомненные преимущества для всего процесса. К таким можно отнести эксплуатационную гибкость, относительную простоту совмещения с иными процессами (деасфальтизация, гидроочистка, алкирование и т. д.). Именно благодаря этой универсальности можно объяснить значительную долю использования каталитического крекинга во всем объеме переработки нефти.
Сырье
В качестве сырья при каталитическом крекинге используется вакуумный газойль, представляющий собой фракцию, имеющую пределы кипения от 350 до 500 градусов. При этом окончательная точка кипения устанавливается по-разному и напрямую зависит от содержания металлов. Кроме того, на данный показатель влияет и коксуемость сырья. Она не может быть больше трех десятых процента.

Предварительно требуется и производится гидроочистка такой фракции, в результате которой удаляются всевозможные сернистые соединения. Также гидроочистка позволяет снизить коксуемость.
У некоторых известных на нефтеперерабатывающем рынке компаний существует несколько осуществляемых ими процессов, при которых происходит крекинг тяжелых фракций. К ним можно отнести коксуемый до шести-восьми процентов мазут. Помимо этого, сырьем могут быть остатки гидрокрекинга. Самым, наверное, редким и, можно сказать, экзотическим сырьем считается прямогонный мазут. Подобная установка (технология миллисекунд) имеется в Республике Беларусь на Мозырском нефтеперерабатывающем заводе.
Буквально до последнего времени, когда использовался каталитический крекинг нефтепродуктов, применялся аморфный шариковый катализатор. Он представлял собой трех-пятимиллиметровые шарики. Сейчас же для этой цели применяются катализаторы крекинга объемом не больше 60–80 мкм (цеолитсодержащий микросферический катализатор). Состоят они из цеолитного элемента, располагающегося на алюмосиликатной матрице.
Термический способ
По обыкновению, термический крекинг используется для переработки нефтепродуктов, если нужно получить в итоге продукт с более маленькой молекулярной массой. Например, к таким можно отнести непредельные углеводороды, нефтяной кокс, легкие моторные топлива.
Направление этого способа переработки нефти находится в зависимости от молекулярной массы и природы сырья, а также непосредственно от условий, при которых происходит сам крекинг. Это было подтверждено химиками с течением времени. Одними из главнейших условий, которые влияют на быстроту и направление протекания термического крекинга, считаются температура, давление и длительность процесса. Последний получает видимую фазу при трехстах–трехстах пятидесяти градусах. При описании этого процесса используется кинетическое уравнение крекинга первого порядка. На результат крекинга, а точнее, на состав его продуктов оказывает влияние перемена давления. Причиной этому служит перемена скорости и характеристик вторичных реакций, к которым относятся, как уже упоминалось ранее, полимеризация и конденсация, которыми сопровождается крекинг. Уравнение реакции термического процесса выглядит так: С20Н42 = С10Н20 + С10 Н22. Влияние оказывает на итог и результат еще объем реактивов.

Нужно заметить, что крекинг нефти, осуществляемый перечисленными способами, не является единственным. В производственной деятельности нефтеперерабатывающие предприятия используют и многие другие виды этого процесса переработки. Так, в определенных случаях используется так называемый окислительный крекинг, осуществляемый с использованием кислорода. Применяется в производстве и электрический крекинг. С помощью этого метода производители получают ацетилен путем пропуска сквозь электричество метана.

2.1.9.6. Реакции крекинга алканов
Разложение алканов с расщеплением и С—Н-связей было широко изучено, потому что большое промышленное значение приобрел крекинг нефтяных фракций для увеличения общего выхода продуктов, пригодных для использования в качестве топлив или как нефтехимическое сырье (например, алкены). Выбор процесса крекинга очень сильно зависит от типа требуемого продукта. Имеется два общих типа реакции: термический крекинг, при котором главными продуктами являются алкены, и каталитический крекинг, основной целью которого является получение алканов с высокими октановыми числами; в последнем процессе образуются лишь небольшие количества алкенов.
Члены гомологического ряда алканов имеют общие химические свойства. В обычных условиях алканы химически инертны. Они устойчивы к действию многих реагентов: не взаимодействуют с концентрированной серной и азотной кислотами, с концентрированными и расплавленными щелочами, не окисляются сильными окислителями – КМnО4 и т.п
Видеоопыт "Отношение метана к раствору перманганата калия и бромной воде"
Химическая устойчивость алканов объясняется высокой прочностью σ–связей С ─ С и С ─ Н, а также их неполярностью. Неполярные связи С ─ С и С ─ Н в алканах не склонны к ионному разрыву, но способны расщепляться гомолитически под действием активных свободных радикалов. Поэтому для алканов характерны радикальные реакции (реакции замещения), в результате которых получаются соединения, где атомы водорода замещены на другие атомы или группы атомов.
Алканы вступают в реакции, протекающие по свободно-радикальному (цепному) механизму и протекают обычно на свету или при нагревании. По этому механизму легче всего замещаются атомы водорода у третичных, затем вторичных и первичных атомов углерода. При хлорировании эта закономерность не соблюдается при T>400˚C.
Алканы относятся к углеводородам, в которых отсутствуют кратные связи. Из-за предельности алканов реакции присоединения для них нехарактерны.
Реакции замещения (разрыв связей С ─ Н)
1. Галогенирование (замещение атома водорода атомом галогена — F, Cl, Br с образованием галогеналкана).
Реакция галогенирования алканов протекает по радикальному цепному механизму, т.е. как цепь последовательных превращений с участием свободно-радикальных частиц.
Теорию цепных реакций разработал советский ученый, один из основоположников химической физики, академик Н.Н. Семенов (1896—1986), за что в 1956 г. был награжден Нобелевской премией.
Скорость реакции зависит от активности галогенов, которая уменьшается с увеличением радиуса атома.
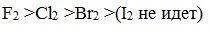
Алканы очень активно реагируют с фтором, реакция алканов с его участием сопровождается взрывом и окислением до СF4.
Реакции хлорирования и бромирования протекают под действием света (фотохимическая цепная реакция) или при 300–400 о C.
Иодирование проходит обратимо, поэтому требуется окислитель для удаления НI из реакции.
Низшие алканы (СН4, С2Н6, С3Н8) можно прохлорировать полностью. В молекуле метана атомы хлора могут заместить от одного до четырех атомов водорода в зависимости от соотношения реагентов
(hv — формула кванта света)
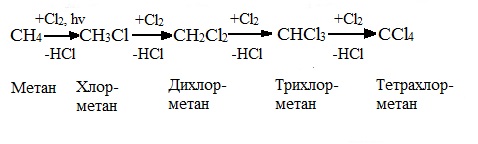
Тривиальное название трихлорметана – хлороформ.
Механизм реакции
Реакция осуществляется в три стадии:
А) Инициирование (зарождение цепи) – гомолитическое расщепление молекулы Сl2 с образованием свободных радикалов хлора:

Свободные радикалы – это атомы или группы атомов с неспаренными электронами (•Сl, •Н, •СН3…)
Б) Развитие цепи (взаимодействие радикала хлора с молекулой алкана, метильного радикала с новой молекулой хлора и т.д.):
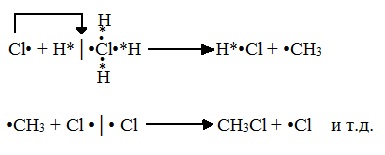
В) Обрыв цепи (происходит при соединении двух радикалов друг с другом):
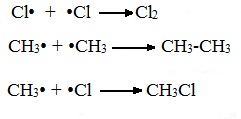
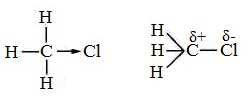
Скорость реакции замещения водорода на атом галогена у галогеналканов выше, чем у соответствующего алкана, это связано с взаимным влиянием атомов в молекуле:
Электронная плотность связи С – Cl смещена к более электроотрицательному атому хлора, в результате этого на нем образуется частичный отрицательный заряд, а на атоме углерода – частичный положительный заряд.
На атоме углерода в метильной группе (-СН3) создаётся недостаток электронной плотности, поэтому он оттягивает на себя электронную плотность от соседних атомов водорода, в результате этого связи С – Н становятся менее прочными и атомы водорода легче замещаются на атомы хлора.
При увеличении углеводородного радикала наиболее подвижными остаются атомы водорода у атома углерода ближайшего к заместителю:
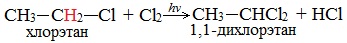
Алканы обесцвечивают раствор брома при нагревании, вступая в реакцию радикального замещения.
Видеоопыт "Взаимодействие алканов с бромом при нагревании"
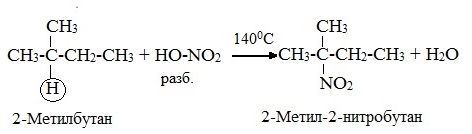
2.Нитрование (замещение атома водорода нитрогруппой – NO2 с образованием нитроалканов R-NO2). Нитрующий реагент – разбавленная азотная кислота HNO3 (НО─NО2).
Нитрование разбавленной азотной кислотой при t = 140 0 С и при повышенном или нормальном давлении - реакция М.И.Коновалова.
В результате реакции образуется смесь изомерных нитросоединений. Наиболее легко замещаются атомы водорода у третичного атома углерода, труднее – у вторичного, наиболее трудно – у первичного:
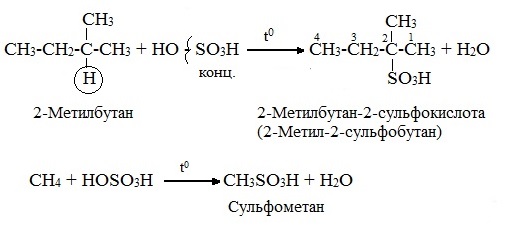
3.Сульфирование (замещение атомов водорода сульфогруппой SO3Н с образованием алкансульфокислот RSO3Н). Сульфирующий реагент – серная кислота Н2SO4 (НО─SO3Н). Сульфирование алканов происходит при действии очень концентрированной Н2SO4 при небольшом нагревании.
Наиболее легко замещается атом водорода у третичного атома углерода:
Реакции окисления

Алканы – соединения с низкими степенями окисления углерода и в зависимости от условий реакции они могут окисляться с образованием различных соединений.
При обычных условиях алканы устойчивы к действию сильных окислителей (КМnO4, К2Сr2О7).
1. Горение (окисление кислородом воздуха при высоких температурах)
А) Полное окисление (избыток О2)
При избытке кислорода происходит полное окисление алканов до СО2, где углерод имеет высшую степень окисления +4, и воды. Горение углеводородов приводит к разрыву всех связей С–С и С–Н и сопровождается выделением большого количества тепла (экзотермическая реакция).
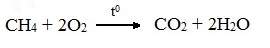
Низшие гомологи (метан, этан, пропан, бутан) образуют с воздухом взрывоопасные смеси, что необходимо учитывать при их использовании. С увеличением молекулярной массы алканы загораются труднее.
Видеоопыт "Горение жидких алканов"
Видеоопыт "Горение твердых углеводородов (на примере парафина)"
Процесс горения углеводородов широко используется для получения энергии (в двигателях внутреннего сгорания, в тепловых электростанциях и т.п.).
Общий вид реакции горения алканов:
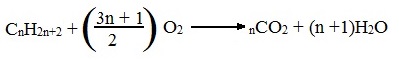
Б) Неполное окисление (недостаток О2)
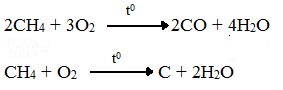
При горении высших алканов ((n >>1)) при недостатке кислорода образуются продукты частичного окисления: угарный газ СО (степень окисления углерода +2), сажа (мелкодисперсный углерод, со степенью окисления 0).
Поэтому высшие алканы горят на воздухе коптящим пламенем, выделяя токсичный угарный газ, представляющий опасность для человека.
Горение метана при недостатке кислорода происходит по уравнениям:
Последняя реакция используется в промышленности для получения сажи из природного газа, содержащего 80-97% метана.
2. Каталитическое окисление
Частичное окисление алканов при относительно невысокой температуре и с применением катализаторов сопровождается разрывом только части связей С–С и С–Н и используется для получения ценных продуктов: карбоновых кислот, кетонов, альдегидов, спиртов.
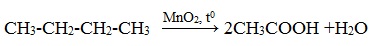
Например, при неполном окислении бутана происходит разрыв связи (С2–С3) и получается две молекулы уксусной кислоты:
Этим способом в промышленности получают уксусную кислоту.
При мягком окислении метана кислородом воздуха в присутствии катализаторов могут быть получены метиловый спирт, формальдегид и муравьиная кислота.
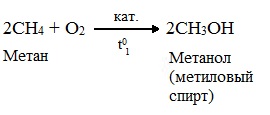
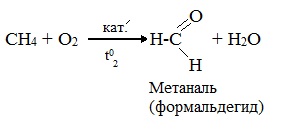
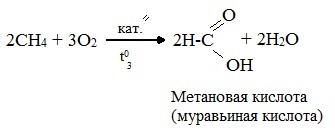
Высшие алканы (n>25) под действием кислорода воздуха в жидкой фазе в присутствии солей марганца превращаются в смесь карбоновых кислот со средней длиной цепи С12–С18, которые используются для получения моющих средств и поверхностно-активных веществ.
Термические превращения алканов (реакции разложения)
1. Крекинг (анг. сracking — расщепление) алканов является основой переработки нефти с целью получения продуктов меньшей молекулярной массы, которые используются в качестве моторных топлив, смазочных масел, а также сырья для химической и нефтехимической промышленности.
Для осуществления этого процесса используют два способа: термический крекинг (при нагревании без доступа воздуха) и каталитический крекинг (более умеренное нагревание в присутствии катализатора).
Термический крекинг — это разрыв связей С ─ С в молекулах алканов с длинными углеродными цепями, в результате которого образуются алканы и алкены с меньшим числом атомов углерода.
Термический крекинг (пиролиз) осуществляется при температуре 450 – 700 0 С:
Крекинг н-гексана (работа Литвишко Алексея, г. Самара)
Каталитический крекинг проводят в присутствии катализаторов (обычно оксидов алюминия и кремния) при температуре 500 0 С и атмосферном давлении. При этом с разрывом молекул происходит реакция изомеризации и дегидрирования.
Крекинг октана (работа Литвишко Алексея, г. Самара)
2.При нагревании метана или этана до температуры 1000 0 С начинается пиролиз – разложение на простые вещества:
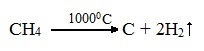
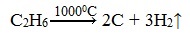
Полученный этим способом углерод является достаточно чистым, в технике называется сажей и используется, например, при производстве автомобильных покрышек.
3. Конверсия метана с образованием синтез – газа (СО + Н2)

Эта реакция используется для получения водорода. Синтез-газ служит сырьем для получения различных углеводородов.
Реакции отщепления
1.Дегидрирование (отщепление водорода; происходит в результате разрыва связей С ─ Н; осуществляется в присутствии катализатора при повышенных температурах).
В ходе пропускания алканов над катализатором (Pt, Pd, Ni, А1203, Сг203) при высокой температуре (400 — 600°С) происходит отщепление молекулы водорода и образование алкена:
2. Если метан нагреть до более высокой температуры (1500 0 С) и быстро охладить, то происходит межмолекулярное дегидрирование и образуется этин (ацетилен):
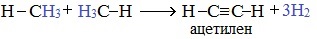
3.Дегидроциклизация (ароматизация) - реакция дегидрирования, которая приводит к замыканию цепи в устойчивый цикл.
Алканы, содержащие в основной цепи больше 4-х атомов углерода, используются для получения циклических соединений.
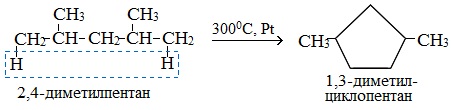
Если основная цепь молекулы алкана содержит 5 (но не более) атомов углерода (н-пентан и его алкильные производные), то при температуре 300 0 С над Pt-катализатором атомы водорода отщепляются от концевых атомов углеродной цепи и образуется пятичленный цикл (циклопентан или его производные):
Алканы с шестью или более углеродными атомами в цепи в присутствии катализатора циклизуются с образованием бензола м его производных:

Реакции перегруппировки (изомеризация)
1.Изомеризация (превращение химического соединения в его изомер):
Нормальные алканы под влиянием катализаторов и при нагревании способны превращаться в алканы с разветвленной цепью без изменения состава молекул. В этих случаях участвуют алканы, молекулы которых содержат не менее 4-х углеродных атомов:

Эта реакция является важной для производства бензина, поскольку наличие в его составе разветвленных углеводородов повышает октановое число, т.е. качество топлива.
Видеоопыт "Установление качественного состава предельных углеводородов"
Рубрики: Алканы Теги: Алканы
В реакции дегидрирлвания, приполучении бутадиена-1,3 неверно указано число атомов водорода у 4 атома углерода
Володя, спасибо за внимательность)
Разве при реакция дегидрирования используется платина? Она же при реакция гидротации используется
Сергей, платина, как катализатор, используется во многих химических реакциях)
Дегидрирование алканов служит основным источником алкенов в промышленности. Процесс проводят при высокой температуре (до 450 °С). В качестве катализатора применяют специальным образом приготовленный триоксид хрома. Из этана так получают этилен, из н-бутана – бутилены, а из изобутана – изобутилены.
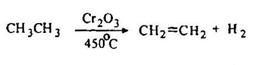
Крекинг алканов проводят при более высокой температуре. Этот процесс протекает менее однозначно с образованием целой гаммы продуктов.
Дегалогенирование вицинальных дигалогеналканов цинковой пылью в водно-спиртовом или уксуснокислом растворе
Дегидратация спиртов (реакция элиминирования)
Наиболее обычным способом получения олефинов в лабораторных условиях является дегидратация (отщепление воды) спиртов. Отщепление воды от спиртов проводят нагреванием спирта при высокой температуре в присутствии сильных минеральных кислот (H2SO4, H3PO4). При этом сначала образуется сложный эфир, который распадаясь наряду с этиленом дает молекулу кислоты. Дегидратацию этанола ведут при 180 °С.
Дегидратацию гомологов этанола ведут при более низкой температуре. Если возможно получение нескольких изомеров, то преимущественно образуется более замещенный алкен.
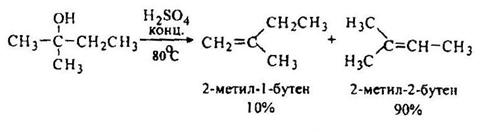
В процессе гидратации часто происходит перемещение двойной связи и строение полученного углеводорода не отвечает строению исходного спирта. Так, например, при дегидратации изоамилового спирта обычно получаются три углеводорода
Легкость дегидратации спиртов:
третичные > вторичные > первичные.
По другому способу пары спирта пропускают над твердым катализатором (Al2O3, оксиды тория или вольфрама). Температура реакции составляет 300-350 °С, а выход алкена приближается к теоретическому.
Дегидратацией спиртов получают также и циклоалкены: например, из циклогексанола получают циклогексен.
Читайте также:

