Как сделать карбид
Обновлено: 03.07.2024
Наш проект живет и развивается для тех, кто ищет ответы на свои вопросы и стремится не потеряться в бушующем море зачастую бесполезной информации. На этой странице мы рассказали (а точнее - показали :) вам Как сделать карбид кальция в домашних условиях . Кроме этого, мы нашли и добавили для вас тысячи других видеороликов, способных ответить, кажется, на любой ваш вопрос. Однако, если на сайте все же не оказалось интересующей информации - напишите нам, мы подготовим ее для вас и добавим на наш сайт!
Если вам не сложно - оставьте, пожалуйста, свой отзыв, насколько полной и полезной была размещенная на нашем сайте информация о том, Как сделать карбид кальция в домашних условиях .
Карбиды – это группа неорганических соединений углерода с металлами, а также с кремнием или бором (поскольку эти элементы проявляют металлические свойства). Карбид кальция – одно из наиболее востребованных веществ этой группы. О свойствах и применении соединения читайте ниже.
История получения
Карбид кальция – соединение, получившее широкое применение в современной промышленности. В 1862 году немецкий химик Фридрих Велер впервые синтезировал молекулу этого вещества. Получение карбида кальция он осуществил следующим образом. Ученый приготовил расплав кальция с цинком, а затем нагрел его с углем. В результате получился карбид. Химическая формула соединения – CaC2. Промышленный способ получения карбида предложил ученый Муассан в 1892 году. Другие названия вещества – ацетиленид кальция, или углеродистый кальций. Кристаллическая решетка соединения выглядит следующим образом:
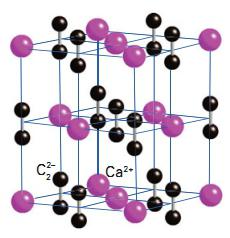
Физические свойства
По своим физическим свойствам карбид кальция является кристаллическим веществом с температурой плавления 2300 о С. Эта цифра является справедливой лишь для чистого соединения. Карбид, содержащий примеси, может иметь другие показатели температуры плавления. Основное агрегатное состояние вещества – твердое, а цвет варьирует от серого до коричневого.
Химические свойства
Карбид кальция хорошо впитывает воду. Этот процесс сопровождается химической реакцией разложения. Важно, что карбидная пыль обладает раздражающим действием на слизистые оболочки, кожу и органы дыхания. Поэтому во время работы с соединением необходимо использовать противогазы либо противопылевые респираторы. С кислородом карбид кальция взаимодействует при высокой температуре с образованием карбоната кальция. Реакция с азотом приводит к синтезу цианамида кальция. Также при высоких температурах карбид кальция вступает в реакции соединения с хлором, фосфором, мышьяком. Но все-таки одним из важнейших свойств соединения считается разложение водой.

Получение
Производство карбида кальция заключается в следующем. Негашеную известь и предварительно измельченный кокс смешивают. Полученную смесь подвергают расплавлению в электрических печах. Кокс и оксид кальция берутся в равных по массе частях. Процесс происходит при температуре 1900 о С. Расплав выходит из печи и в дальнейшем разливается по специальным формам. Затем уже затвердевший карбид кальция дробят и сортируют по размеру кусков. Гранулы вещества разделяются на четыре фракции в соответствии с их размерами: 25×80, 15×25, 8×15, 2×8, которые определяются ГОСТом 1460-56. По своему составу технический карбид кальция содержит 75-80% основного вещества. На долю примесей, таких, как углерод, известь и других, приходится до 25% от общей массы полученной смеси. Кроме того, содержащийся в техническом карбиде сульфид и фосфид кальция обусловливают довольно неприятный его запах. Представим реакцию получения СаС2: СаО + 3С → СаС2 + СО↑. Образование ацетиленида кальция сопровождается поглощением тепла. Поэтому логично предположить, что реакция его разложения, напротив, идет с выделением энергии.

Транспортировка и хранение
По причине того, что влага моментально разлагает карбид с выделением большого количества тепла и образованием взрывоопасного газа ацетилена, хранить вещество необходимо в герметично закупоренных барабанах или бидонах. Следует помнить, что ацетилен легче воздуха и способен скапливаться в верхних зонах помещения. Этот газ, помимо наркотического действия, обладает способностью к самовоспламенению. Поэтому использовать карбид кальция необходимо с большой осторожностью. Расфасовке на производстве уделяется особое внимание. Готовое вещество помещается в специальные барабаны (тара, напоминающая консервные банки). Такая упаковка требует аккуратного вскрытия. При этом должен использоваться инструмент, не приводящий к образованию искр (молоток или специальный нож). В случае попадания карбида на кожу или слизистые оболочки необходимо немедленно промыть пораженный участок водой и обработать место вазелином или жирным кремом. Транспортировка соединения осуществляется с использованием только крытых видов транспорта. Воздушная доставка карбида запрещена. Помещения, где хранится СаС2, должны быть хорошо проветриваемыми. Также не разрешается хранить карбид совместно с другими химическими веществами. Это может привести к нежелательным, а, возможно, и опасным, реакциям. Срок хранения карбида составляет полгода.

Применение
Область применения карбида кальция чрезвычайно широка. В первую очередь это промышленный синтез. Карбид кальция используется для производства синтетического каучука, уксусной кислоты, ацетона, этилена, винилхлорида, стирола. Также он находит применение в получении цианамида кальция. Это вещество ценно своим использованием в синтезе различных удобрений и цианистых веществ. В сельском хозяйстве любому агроному известно такое название, как карбидно-карбамидный регулятор. Он применяется для регуляции роста растений. А для его получения также используется карбид кальция. Кроме того, это соединение находит применение в процессе производства цианамида кальция. Эта реакция основана на нагревании карбида кальция с азотом. Восстановление щелочных металлов также не обходится без применения описываемого нами вещества. Карбид кальция применяется и в процессе газосварки. Например, широко используются карбидные лампы. Принцип их работы основан на взаимодействии в специальной емкости карбида с водой и сгорании на выходе из аппарата конечного вещества реакции – ацетилена. Посмотрите на фото карбидной лампы.

Производство ацетилена
Одной из важнейших областей применения карбида кальция является его использование в получении ацетилена. Заслуга в открытии этого способа также принадлежит немецкому ученому-химику Фридриху Велеру. В основе этого промышленного процесса лежит реакция разложения карбида под воздействием воды. СаС2 + 2 Н2О → С2Н2 + Са(ОН)2↓. На выходе образуется газ ацетилен и гашеная известь, выпадающая в осадок. Процесс сопровождается выделением большого количества тепла. Объем газа на выходе зависит от того, насколько чистый используется для реакции карбид кальция. Ацетилен, образующийся в результате, может иметь различный объем – 1 кг исходного вещества может дать от 235 до 290 литров газа. Что касается скорости протекания реакции, то она зависит как от малого процента примесей в карбиде кальция, так и от температуры воды, а также ее чистоты. Если рассматривать теоретическую реакцию производства ацетилена из карбида, то в ней на 1 кг карбида достаточно 560 мл воды. Однако на практике объем воды для проведения реакции увеличивается. На 1 кг карбида кальция в условиях промышленного синтеза требуется от 5 до 20 литров воды. Такое количество необходимо для того, чтобы ацетилен лучше охлаждался, а также для обеспечения оптимальной безопасности при работе. Ниже изображен немецкий химик Фридрих Велер.

Лабораторный опыт получения ацетилена
Многим из школьных уроков химии знакома реакция взаимодействия карбида с водой. Обычно этот опыт позволяет продемонстрировать реакцию получения ацетилена, а также физические и химические его свойства. Процесс выделения газа при этом происходит достаточно бурно, поэтому трубка, отводящая ацетилен из колбы с действующими веществами, помещается в чашу с водой. Это обеспечивает менее активное и стремительное движение газа. Кроме того, в лабораторных условиях можно использовать и другой способ, чтобы сделать не слишком бурной реакцию разложения такого соединения, как карбид. Ацетилен при этом идет равномерно и спокойно. Для этого вместо воды необходимо взять насыщенный раствор поваренной соли. Также в лаборатории при проведении этой реакции следует осторожно добавлять воду в карбид, помещенный в объемную колбу, а не наоборот.
Давайте разберемся, можно ли его получить в домашних условиях?
1. Ближайший родственник (легко доставаемый) - мел - CaCO3.
Можно ли как-то "убрать" 3 атома кислорода из молекулы?
2. Также несложно получить оксид кальция - CaO.
К нему надо добавить углерод C. Однако вроде нужна огромная температура, так ли это?
3. А гидроксид Ca(OH)2 - может реально вызвать реакцию обмена с образованием воды и CaC2 . Я просто только первый год изучаю химию, пока незнаю что с чем вступает в реакцию, а что нет)))
Надеюсь на вразумительные ответы ;)
Есть описание этого опыта (для домашних условий) из старой ГДРовской книжки по химии. Если интересно, могу скинуть на мыло.
насколько помню в промышлености прокаливают извесь с углеродом (коксом) в элекропечах затраты энергии большие-реакция идет с поглощеним теплоты.
в домашних условиях "однозначно" не получится -кроме больших температур надо изолировать продукцию от воздуха до охлаждения реакция идет при теппературах при которых карбит кальция соедится с кислородом и получишь окись кальция и улекислый газ .Вернее его тоже не получишь он улетучится.
Григорий Сердюков Мастер (1856) окись кальция можно дома сделать - нагреть на газовой плите мел CaCO3 -> CaO + CO2
Нужно для начала построить доменную печь из красного жаростойкого кирпича. потом загрузить в нее уголь разжечь его. потом кокс добавлять ПОТОМУ КАК КОКС НЕ ГОРИТ ПРИ НИЗКИХ ТЕМПЕРАТУРАХ. когда температура дойдет до нормы добавлять кокс с щебнем известНЯковым. три дня печь работает в таком режиме где кокс вернее УГЛЕКИСЛЫЙ ГАЗ И УГАРНЫЙ ГАЗ вступают в реакцию с КИСЛОРОДОМ который находится с извесняковом щебне . ПОТОМ ПЕЧЬ ОСТУЖАЮТ И ПРИ ПОМОЩИ МЕХАНИЗМОВ ВЫГРЕБАЮТ КАРБИД. получается негаШеная известь карбид. при гашении водой выделяется АТИЦИЛЕН и ХЛОР. И МНОГО ТЕПЛА. Гашеной известью можно белить стены дома или комнаты или забора каменного. она в отличии от мела не пачкает. а золу из этой трубы доменной печи можно использовать вместо цемента. что бы зола и пепел не улетали в атмосферу в виде дыма. нужно пропускать дым через большую камеру где стоят мембраны под высоким напряжением с разной полярностью. в процессе ионизации пепел оседает на пластинах в камере. регулярно нужно встряхивать мембраны . что бы наш пепел . зола . будущий цемент падал в накопительный бункер.

Карбид кальция (CaC2) нашёл своё применение в газовой сварке металлов, так как способен выделять большое количество газа – ацетилена (С2Н2). Для этого его засыпают в ацетиленовый генератор, в который заливается вод.
Получение ацетилена из карбида кальция возможно при контакте его с водой. Помещённый карбид в воду, моментально вступает в бурную реакцию. При этом он распадается на гашёную известь с образованием горючего газа.
Химическая формула реакции получения ацетилена из карбида кальция: СаС2 + Н2О = С2Н2 + Ca(ОН).
Горит ацетилен в смеси с кислородом примерно при Т= 3150ºС. Такая особенность позволила применять карбид для сварки и пайки различных металлов газом.
Было научно доказано, что при использовании 1 кг CaC2 с 0,5 л воды, получится 370 л С2Н2 и 1 кг гашённой извести.
Способ получения карбида состоит из следующих этапов:
1. Добытый известняк подвергается отжигу.
2. Смешивая и измельчая известь с коксом, получают шихту.
3. Полученная шихта расплавляется в печах. В процессе расплавления шихты образуется карбид кальция.
4. Полученный карбид измельчается.
Измельчается карбид на гранулы разного размера. Чем больше гранула, тем большее количество ацетилена она произведёт. Размер гранул значительно влияет на время выработки газа.

Выход ацетилена из карбида кальция
От качества полученного CaC2, напрямую зависит выход полученного С2Н2 из 1 кг CaC2.
Согласно ГОСТ 1460-46 выход ацетилена из карбида кальция следующий:
Размеры кусков в мм
Выход ацетилена в л/кг
С уменьшением размера куска, уменьшается выход горючего газа. Это связано с тем, что мелкие куски карбида содержат значительно больше посторонних примесей, которые крошатся из-за хрупкости.
Скорость разложения карбида кальция (газообразования)
Под скоростью разложения подразумевается, какой объём ацетилена выделит 1 кг карбида в 1 минуту времени. Данное значение измеряется в л/кг. Это значение напрямую связано с качеством и размером кусков.
Чем меньше размер кусков, тем быстрее произойдёт разложение карбида кальция. Ещё на разложение может влиять температура воды.
Время полного разложения и получение ацетилена с помощью карбида кальция при температуре воды +17ºС приведено в таблице:
При температуре воды в 20ºС выработка ацетилена из карбида может приостановиться. Если температура воды составляет 40 — 80ºС, тогда процесс газообразования идёт очень медленно. Заиливание происходит только с большими кусками.
Техника безопасности

В связи с тем, что карбид относится к классу взрывоопасных веществ, к хранению его предъявляются следующие требования:
1. Место хранения должно быть сухим. Не допускается хранение возле мест с открытым огнём.
2. Запрещено хранить карбид в гранулах до 2 мм и применять его в генераторах. Это связано с тем, что мелкие гранулы быстро реагируют с водой, что приводит к избыточному давлению в сосуде.
3. Работать с карбидной пылью следует с применением СИЗ.
4. Если карбидная пыль попала в глаза, тогда следует их промыть тёплой воды и обратится к врачу.
5. Перед использованием генератор следует проверить на предмет отсутствия трещин в корпусе.
6. При использовании ацетиленового генератора в помещении запрещено. Размещать его следует на открытом участке с хорошей вентиляцией.
Читайте также:

