Как сделать фенол
Обновлено: 05.07.2024
Гидроксисоединения — являются органическими веществами с молекулами, содержащими, кроме углеводородной цепи, одну или несколько гидроксильных групп ОН.
Классификация гидроксисоединений в химии:
Фенолы — являются органическими соединениями ароматического ряда с молекулами, в которых гидроксильные группы OH− образуют связи с атомами углерода ароматического кольца.
Систематическое наименование фенола — гидроксибензол.
Химическая формула фенола:
Фенол является простейшим представителем класса фенолов. Это токсичное вещество в виде бесцветных кристаллов.
Классификация, электронное строение
Согласно количеству гидроксильных групп, выделяют следующие виды фенолов:
- одноатомные фенолы (аренолы), например, фенол и его гомологи;
- двухатомные фенолы (арендиолы), в том числе, пирокатехин, резорцин, гидрохинон (соответственно 1,2-, 1,3- и 1,4-дигидроксибензолы);
- трехатомные фенолы (арентриолы), включая пирогаллол, гидроксигидрохинон, флороглюцин (соответственно 1,2,3-, 1,2,4- и 1,3,5-тригидроксибензолы);
- многоатомные фенолы.
π –системой бензольного кольца. Данный факт объясняет разницу между фенолами и спиртами.
Физические свойства фенолов:
- одноатомные фенолы, как правило, в обычных условиях имеют вид кристаллических веществ без цвета и со специфическим запахом;
- невысокая температура плавления;
- в малой степени растворимы в воде;
- хорошо растворяются в органических растворителях;
- токсичны;
- потемнение окраски при хранении на воздухе объясняется постепенным окислением веществ.
Фенолы и спирты обладают сходством, которое заключается в реакции со щелочными металлами, в процессе которой выделяется водород. Отличия фенолов от спиртов:
- Отсутствие реакции между фенолом и галогеноводородами, что объясняется очень прочной связью ОН-группы с бензольным кольцом, поэтому ее невозможно заместить.
- Фенол не вступает в реакцию этерификации, эфиры фенола получают косвенным методом.
- Фенол не участвует в реакции дегидратации.
- Фенол характеризуется более сильными кислотными свойствами и может реагировать со щелочами.
По сравнению со спиртами, фенолы вступают в химические реакции с гидроксидами щелочных и щелочноземельных металлов. В результате образуются соли феноляты.
Схема реакции фенола с гидроксидом натрия. Процесс приводит к образованию фенолята натрия:
Взаимодействие фенолов с активными металлами, включая щелочные и щелочноземельные, сопровождается образованием фенолятов. Вступая в реакцию с металлами, фенолы ведут себя, как кислоты.
Реакция фенола с натрием приводит к образованию фенолята натрия и водорода:
Фенол при обычных условиях и при отсутствии катализатора вступает в химическую реакцию с бромной водой. В процессе образуется белый осадок 2,4,6-трибромфенола.
Качественная реакция на фенол:
Когда на фенол воздействует 20% азотная кислота, вещество достаточно легко превращается в смесь орто- и пара-нитрофенолов.
Нитрование фенола при избытке концентрированной H N O 3 сопровождается образованием 2,4,6-тринитрофенола (пикриновой кислоты):
В процессе реакции поликонденсации фенола с формальдегидом образуются фенолоформальдегидные смолы.
C 6 H 5 O H + F e C I 3 → ( C 6 H 5 O ) 3 F e + H C I
Гидрирование (восстановление) фенола сопровождается присоединением водорода к ароматическому кольцу.
В результате химической реакции образуется циклогексанол, являющийся вторичным циклическим спиртом:
С целью получения фенола используют кумольный способ. Каталитическое окисление кумола является промышленным методом синтеза фенола и состоит из нескольких стадий:
- образование кумола путем алкилирования бензола пропеном при наличии фосфорной кислоты:
Суммарную реакцию можно записать в виде уравнения:
Фенолы нашли широкое применение в промышленности. Данные вещества необходимы для производства:
- пластмассы;
- резины;
- лекарственных препаратов;
- моющих средств;
- краски (гуашь);
- ядохимикатов;
- топлива.
Ключевым направлением использования фенолов является выпуск следующих материалов:
- феноло-альдегидные смолы;
- полиамиды;
- полиарилаты;
- полиариленсульфоны;
- поликарбонаты;
- эпоксидные смолы;
- антиоксиданты;
- бактерициды;
- пестициды, в том числе, нитрафен.
Алкилфенолы представляют собой сырье для производства ПАВ, стабилизаторов и присадок к топливу. Двухатомные фенолы и их производные являются составными компонентами дубителей для кожи и меха, модификаторов и стабилизаторов резин и каучуков. Данные вещества используют, чтобы обрабатывать кино- и фотоматериалов. В медицинской сфере фенолы и их производные применяют в качестве следующих средств:

Фенол (гидроксибензол, карболовая кислота) – это о рганическ ое соединение ароматического ряда с формул ой C6H5OH. Относится к одноименному классу – фенолы.
В свою очередь, Фено́лы — это класс органических соединений ароматического ряда, в молекулах которых гидроксильные группы OH − связаны с атомами углерода ароматического кольца.
По числу гидроксильных групп различают :
- одноатомные фенолы (аренолы): фенол и его гомологи;
- двухатомные фенолы (арендиолы): пирокатехин, резорцин, гидрохинон;
- трёхатомные фенолы (арентриолы): пирогаллол, гидроксигидрохинон, флороглюцин;
- многоатомные фенолы.

Соответственно, собственно фенол, как вещество, представляет собой простейший представитель группы фенолов и имеет одно ароматическое ядро и одну гидроксильную группу ОН .
Свойства фенола
Свежеперегнанный фенол представляет собой бесцветные игольчатые кристаллы с температурой плавления 41 °С и температурой кипения 182 °С. При хранении, особенно во влажной атмосфере и в присутствии небольших количеств солей железа и меди, он быстро приобретает красную окраску. Фенол смешивается в любых соотношениях со спиртом, водой (при нагревании свыше 60 °С), хорошо растворим в эфире, хлороформе, глицерине, сероуглероде.
Из-за наличия -OH гидроксильной группы, фенол имеет химические свойства характерные для спиртов, так и ароматических углеводородов.
По гидроксильной группе фенол вступает в следующие реакции:
- Так как фенол обладает немного более сильными кислотными свойствами, чем у спирты, то под воздействием щелочей он образует соли — феноляты (к примеру, фенолят натрия — C6H5ONa ):
- В результате взаимодействия фенола с металлическим натрием также получается фенолят натрия:
- Фенол непосредственно не этерифицируется карбоновыми кислотами, получение эфиров осуществляют путем взаимодействия фенолятов с ангидридами или галогенангидридами кислот:
- При перегонке фенола с цинковой пылью идет реакция замещения гидроксильной группы водородом:
Реакции фенола по ароматическому кольцу:
- Фенол вступает в реакции электрофильного замещения по ароматическому кольцу. Группа ОН, являясь одной из самых сильных донорных групп (вследствие уменьшении электронной плотности на функциональной группе), увеличивает реакционную способность кольца к этим реакциям и направляет замещение в орто- и пара-положения. Фенол легко алкилируется, ацилируется, галогенируется, нитруется и сульфируется.
- Реакция Кольбе — Шмитта служит для синтеза салициловой кислоты и её производных (ацетилсалициловой кислоты и других).
Качественные реакции на фенол:
- С хлоридом железа(III) (качественная реакция на фенол):
Реакция присоединения
- Гидрированием фенола в присутствии металлических катализаторов Pt/Pd , Pd/Ni , получают циклогексиловый спирт:
Окисление фенола
Вследствие наличия гидроксильной группы в молекуле фенола, устойчивость к окислению много ниже нежели, чем у бензола. В зависимости от природы окислителя и условия проведения реакции получаются различные продукты.
- Так под действием перекиси водорода в присутствии железного катализатора образуется небольшое количество двухатомного фенола — пирокатехина:
- При взаимодействии более сильных окислителей (хромовая смесь, диоксид марганца в кислой среде) образуется пара-хинон.
Получение фенола
Получают фенол из каменноугольной смолы (продукта коксования) и синтетическим путем.
В каменноугольной смоле коксохимического производства содержится от 0,01 до 0,1% фенолов, в продуктах полукоксования от 0,5 до 0,7%; в масле, образующемся при гидрогенизации, и в сточной воде, вместе взятых,— от 0,8 до 3,7%. В смоле бурого угля и сточных водах полукоксования содержится от 0,1 до 0,4% фенолов. Каменноугольную смолу перегоняют, отбирая фенольную фракцию, выкипающую при 160—250 °С. В состав фенольной фракции входят фенол и его гомологи (25—40%), нафталин (25—40%) и органические основания (пиридин, хинолин). Нафталин отделяют фильтрованием, а оставшуюся часть фракции обрабатывают 10—14%-ным раствором едкого натра.
Образовавшиеся феноляты отделяют от нейтральных масел и пиридиновых оснований путем продувки острым паром, а затем обрабатывают диоксидом углерода. Выделенные сырые фенолы подвергают ректификации, отбирая последовательно фенол, крезолы и ксиленолы.
Большая часть фенола, производимого в настоящее время в промышленном масштабе, получается различными синтетическими методами
Синтетические методы получения фенола
- По бензолсульфонатному методу бензол смешивают с купоросным маслом. Полученный продукт обрабатывают содой и получают натриевую соль бензолсульфокислоты, после чего раствор упаривают, отделяют выпавший сульфат натрия, а натриевую соль бензолсульфокислоты сплавляют со щелочью. Образовавшийся фенолят натрия либо насыщайте диоксидом углерода, либо добавляют серную кислоту до начала выделения диоксида серы и отгоняют фенол.
- Хлорбензольный метод заключается в прямом хлорировании бензола газообразным хлором в присутствии железа или его солей и омылении образующегося хлорбензола раствором едкого натра или при гидролизе в присутствии катализатора.
- Модифицированный метод Рашига основан на окислительном хлорировании бензола хлористым водородом и воздухом с последующим гидролизом хлорбензола и выделением фенола перегонкой.
- Кумольный метод заключается в алкилировании бензола, окислении полученного изопропилбензола в гидропероксид кумола и последующем разложении его на фенол и ацетон: Изопропилбензол получают действием на бензол чистого пропилена или пропан-пропиленовой фракции нефтекрекинга, очищенной от других ненасыщенных соединений, влаги, меркаптанов и сероводорода, отравляющих катализатор. В качестве катализатора используют трихлорид алюминия, растворенный в полиалкилбензоле, например. в диизопропилбензоле. Алкилирование ведут при 85 °С и избыточном давлении 0,5 МПа, что обеспечивает протекание процесса в жидкой фазе. Изопропилбензол окисляют в гидропероксид кислородом воздуха или техническим кислородом при 110—130°С в присутствии солей металлов переменной валентности (железо, никель, кобальт, марганец) Разлагают гидропероксид разбавленными кислотами (серной или фосфорной) или небольшими количествами концентрированной серной кислоты при 30—60 °С. После ректификации получают фенол, ацетон и некоторое количество α-метилстирола. Промышленный кумольный метод, разработанный в СССР, является экономически наиболее выгодным по сравнению с другими методами получения фенола. Получение фенола через бензолсульфокислоту связано с расходованием больших количеств хлора и щелочи. Окислительное хлорирование бензола связано с большим расходом пара—в 3—6 раз большим, чем при применении других методов; кроме того, при хлорировании происходит сильная коррозия аппаратуры, что требует применения специальных материалов. Кумольный метод прост по аппаратурному оформлению и позволяет получать одновременно два технически ценных продукта: фенол и ацетон.
- При окислительном декарбоксилировании бензойной кислоты сначала проводят жидкофазное каталитическое окисление толуола в бензойную кислоту, которая в присутствии Сu 2+ превращается в бензолсалициловую кислоту. Этот процесс может быть описан следующей схемой: Бензоилсалициловая кислота разлагается водяным паром на салициловую и бензойные кислоты. Фенол образуется в результате быстрого декарбоксилирования салициловой кислоты.
Применение фенола
Фенол используют как сырье для производства полимеров: поликарбоната и эпоксидных смол (сначала синтезируют бисфенол А, а затем – эти полимеры), фенолфольмальдегидных смол, циклогексанола (с последующим получением нейлона и капрона).
В процессе нефтепереработки при помощи фенола проводят очистку масел от смолистых веществ, серосодержащих соединений и полициклических ароматических углеводородов.
Кроме того, фенол служит сырьем для производства ионола, неонолов (ПАВ), креозолов, аспирина, антисептиков и пестицидов.
Фенол хороший консервант и антисептик. Его используют для дезинфекции в животноводстве, в медицине, в косметологии.
Токсические свойства фенола
Фенол токсичен (класс опасности II). При вдыхании фенола нарушаются функций нервной системы. Пыль, пары и раствор фенола при попадании на слизистые оболочки глаз, дыхательных путей, кожу, вызывают химические ожоги. При попадании на кожу фенол всасывается в течение нескольких минут и начинает воздействовать на ЦНС. В больших дозах может вызывать паралич дыхательного центра.Смертельная доза для человека при попадании внутрь 1—10 г, для детей 0,05—0,5 г.
Список литературы:
Кузнецов Е. В., Прохорова И. П. Альбом технологических схем производства полимеров и пластических масс на их основе. Изд. 2-е. М., Химия, 1975. 74 с.
Кноп А., Шейб В. Фенольные смолы и материалы на их основе. М., Химия, 1983. 279 с.
Бахман А., Мюллер К. Фенопласты. М., Химия, 1978. 288 с.
Николаев А. Ф. Технология пластических масс, Л., Химия, 1977. 366 с.
Автор: Коршак В.В.
Источник: Коршак В.В., Технологии пластических масс, 3-е издание, 1985 год
Дата в источнике: 1985
Фенолы – это простые органические вещества, образованные на основе бензола. При нормальных условиях представляют собой твердые ядовитые вещества, обладающие специфическим ароматом. В современной промышленности эти химические соединения играют далеко не последнюю роль. По объемам использования фенол и его производные входят в двадцатку наиболее востребованных химических соединений в мире. Они широко применяются в химической и легкой промышленности, фармацевтике и энергетике. Поэтому получение фенола в промышленных масштабах – одна из основных задач химической промышленности.
Обозначения фенола
Нумерация атомов фенола ведется от того атома углерода, который соединен с гидроксогруппой ОН. Последовательность продолжается в таком порядке, чтобы другие замещенные атомы получили наименьшие номера. Производные фенола существуют в виде трех элементов, характеристики которых объясняются различием их структурных изомеров. Различные орто-, мета-, паракрезолы являются лишь видоизменением основной структуры соединения бензольного кольца и гидроксильной группы, базовая комбинация которой и представляет собой фенол. Формула этого вещества в химической записи выглядит как C6H5OH.
Физические свойства фенола
Визуально фенол представляет собой твердые бесцветные кристаллы. На открытом воздухе они окисляются, придавая веществу характерный розовый оттенок. При нормальных условиях фенол довольно плохо растворяется в воде, но с повышением температуры до 70 о этот показатель резко возрастает. В щелочных растворах это вещество растворимо в любых количествах и при любых температурах.

Химические свойства
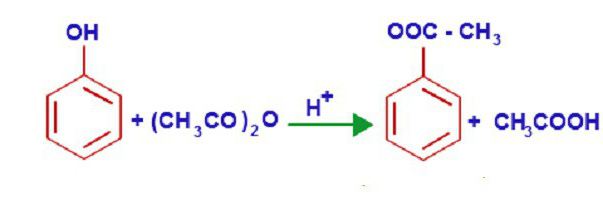
Уникальные свойства фенола объясняются его внутренней структурой. В молекуле этого химического вещества р-орбиталь кислорода образует единую п-систему с бензольным кольцом. Такое плотное взаимодействие повышает электронную плотность ароматического кольца и понижает этот показатель у атома кислорода. При этом полярность связей гидроксогруппы значительно увеличивается, и водород, входящий в ее состав, легко замещается любым щелочным металлом. Так образуются различные феноляты. Эти соединения не разлагаются водой, как алкоголяты, но их растворы очень похожи на соли сильных оснований и слабых кислот, поэтому они имеют достаточно выраженную щелочную реакцию. Феноляты взаимодействуют с различными кислотами, в результате реакции восстанавливаются фенолы. Химические свойства этого соединения позволяют ему взаимодействовать с кислотами, образуя при этом сложные эфиры. Например, взаимодействие фенола и уксусной кислоты приводит к образованию финилового эфира (фениацетата).
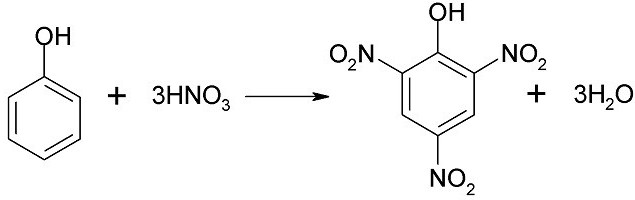
Широко известна реакция нитрирования, в которой под воздействием 20% азотной кислоты фенол образует смесь пара- и ортонитрофенолов. Если воздействовать на фенол концентрированной азотной кислотой, то получается 2,4,6-тринитрофенол, который иногда называют пикриновой кислотой.
Фенол в природе
Как самостоятельное вещество фенол в природе содержится в каменноугольной смоле и в отдельных сортах нефти. Но для промышленных нужд это количество не играет никакой роли. Поэтому получение фенола искусственным способом стало приоритетной задачей для многих поколений ученых. К счастью, эту проблему удалось разрешить и получить в итоге искусственный фенол.
Свойства, получение
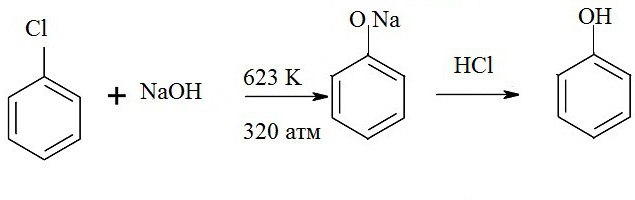
Применение различных галогенов позволяет получать феноляты, из которых при дальнейшей обработке образуется бензол. Например, нагревание гидроксида натрия и хлорбензола позволяет получить натрия фенолят, который при воздействии кислоты распадается на соль, воду и фенол. Формула такой реакции приведена здесь:
Ароматические сульфокислоты также являются источником для получения бензола. Химическая реакция проводится при одновременном плавлении щелочи и сульфокислоты. Как видно из реакции, сначала образуются феноксиды. При обработке сильными кислотами они восстанавливаются до многоатомных фенолов.
Фенол в промышленности
В теории, получение фенола самым простым и многообещающим способом выглядит таким образом: при помощи катализатора бензол окисляют кислородом. Но до сих пор катализатор для этой реакции так и не был подобран. Поэтому в настоящее время в промышленности используются другие методы.
Непрерывный промышленный способ получения фенола состоит во взаимодействии хлорбензола и 7% раствора едкого натра. Полученную смесь пропускают через полуторакилометровую систему труб, нагретых до температуры в 300 С. Под воздействием температуры и поддерживаемого высокого давления исходные вещества вступают в реакцию, в результате которой получат 2,4-динитрофенол и другие продукты.
Не так давно был разработан промышленный способ получения фенолсодержащих веществ кумольным методом. Этот процесс состоит из двух этапов. Сначала из бензола получают изопропилбензол (кумол). Для этого бензол алкируют с помощью пропилена. Реакция выглядит следующим образом:
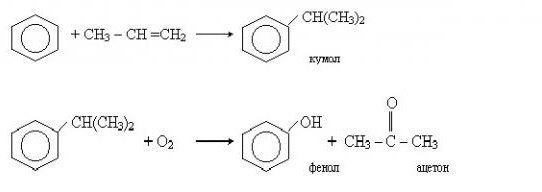
После этого кумол окисляют кислородом. На выходе второй реакции получают фенол и другой важный продукт — ацетон.
Получение фенола в промышленных масштабах возможно из толуола. Для этого толуол окисляется на кислороде, содержащемся в воздухе. Реакция протекает в присутствии катализатора.
Примеры фенолов
Ближайшие гомологи фенолов называются крезолами.
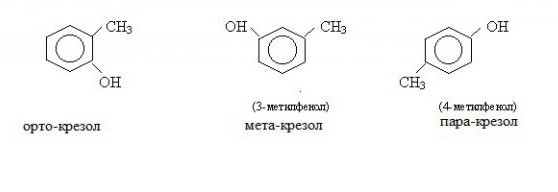
Существуют три разновидности крезолов. Мета-крезол при нормальных условиях представляет собой жидкость, пара-крезол и орто-крезол – твердые вещества. Все крезолы плохо растворяются в воде, а по своим химическим свойствами они почти аналогичны фенолу. В естественном виде крезолы содержатся в каменноугольной смоле, в промышленности их применяют при производстве красителей, некоторых видов пластмасс.
Примерами двухатомных фенолов могут служить пара-, орто- и мета-гидробензолы. Все они представляют собой твердые вещества, легко растворимые в воде.
Единственный представитель трехатомного фенола – пирогаллол (1,2,3-тригидроксибензол). Его формула представлена ниже.
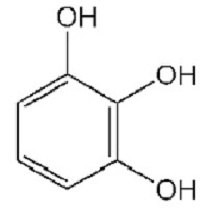
Пирогаллол является довольно сильным восстановителем. Он легко окисляется, поэтому его используют для получения очищенных от кислорода газов. Это вещество хорошо известно фотографам, его используют как проявитель.
Фенолы – производные ароматических углеводородов, в молекулах которых гидроксильные группы непосредственно связаны с атомами углерода бензольного кольца. Функциональная группа, как и у спиртов, — OH.
Фенол – твердое бесцветное кристаллическое вещество, низкоплавкое, очень гигроскопичное, с характерным запахом. На воздухе фенол окисляется, поэтому его кристаллы приобретают вначале розоватый оттенок (рис. 1), а при длительном хранении темнеют и становятся более красными. Он малорастворим в воде при комнатной температуре, но быстро и хорошо растворяется при 60 – 70 o С. Фенол легкоплавок, его температура плавления 43 o С. Ядовит.

Рис. 1. Фенол. Внешний вид.
Получение фенола
В промышленных масштабах фенол получают из каменноугольной смолы. Среди лабораторных методов наиболее часто использую следующие:
— щелочное плавление солей аренсульфоновых кислот
— кумольный метод (окисление изопропилбензола)
Химические свойства фенола
Химические превращения фенола протекают в основном с расщеплением:
— взаимодействие с металлами
— взаимодействие с щелочами
— взаимодействие с ангидридами карбоновых кислот
— взаимодействие с галогенангидридами карбоновых кислот
— взаимодействие с FeCl3 (качественная реакция на фенол – появление фиолетовой окраски, исчезающей при добавлении кислоты)
— нитрование (образование пикриновой кислоты)
3) единого 6π-электронного облака бензольного кольца
Применение фенола
Фенол в больших количествах используется для производства красителей, фенолформальдегидных пластмасс, лекарственных веществ.
Из двухатомных фенолов в медицине применяют резорцин как антисептик и вещество для некоторых клинических анализов, а гидрохинон и другие двухатомные фенолы используют при обработке фотоматериалов в качестве проявителей.
В медицине для дезинфекции помещений и мебели применяют лизол, в состав которого входят разные фенолы.
Некоторые фенолы используют как антиоксиданты – вещества, предотвращающие порчу пищевых продуктов при их долгом хранении (жиров, масел, пищевых концентратов).
Примеры решения задач
| Задание | Водный раствор, содержащий 32,9 г фенола, обработали избытком брома. Рассчитайте массу образовавшегося бромпроизводного. |
| Решение | Запишем уравнение реакции взаимодействия фенола с бромом: |
В результате этого взаимодействия образуется 2,4,6-трибромфенол. Вычислим количество вещества фенола (молярная масса равна 94 г/моль):
Тогда масса 2,4,6-трибромфенола будет равна (молярная масса –331 г/моль):
| Задание | Как получить фенол из иодобензола? Рассчитайте массу фенола, который может быть получен из 45,9 г иодобензола. |
| Решение | Запишем уравнение реакции получения фенола из иодобензола: |
Вычислим количество вещества иодобензола (молярная масса равна 204 г/моль):
Читайте также:

