Сделать вывод как влияет образование гальванопары на процесс растворения цинка в кислоте
Добавил пользователь Alex Обновлено: 16.09.2024
Коррозия цинка – разрушение металла под воздействием агрессивной коррозионной среды.
Для процесса Zn 2+ + 2e → Zn стандартный электродный потенциал цинка составляет -0,76 В.
Температура плавления цинка - 419,6 °C.
Плотность цинка - 7,133 г/см 2 .
Коррозия цинка может проходить как с водородной, так и кислородной деполяризацией.
Максимальная устойчивость цинка и цинковых покрытий отмечается в интервале рН 9 – 11. При более низких или высоких значениях коррозия цинка значительно увеличивается.
Коррозия цинка в воде
Коррозия цинка в воде наблюдается при температуре выше 55 °C. С повышением температуры скорость коррозии увеличивается, максимум наблюдается при температуре 70 °C. После этого разрушение металла проходит очень медленно. Это связано с образованием в воде на поверхности цинка продуктов коррозии. При температурах до 55 °C и выше 90 – 95 °C продукты коррозии обладают достаточно высокими защитными свойствами, образуя на поверхности плотную сплошную пленку. Максимальная скорость коррозии цинка объясняется образованием рыхлой пленки, состоящей с Zn(OH)2, которая не имеет хороших защитных свойств, т.к. легко отслаивается.
В нейтральных растворах коррозия цинка проходит с кислородной деполяризацией.
В морской воде цинковое покрытие стали можно назвать достаточно эффективным. За год расходуется около 0,03 мм цинка. Срок службы цинкового покрытия, толщиной 0,13 мм составляет около 4 – 5 лет, что достаточно много для такой агрессивной среды. Для алюминия и его сплавов, находящихся в морской воде, цинк является протектором.
Для уменьшения скорости коррозии цинка в водной среде применяют следующие ингибиторы: кремненатриевую и двухромовонатриевую соль, гексаметафосфат натрия, ланолин, буру.
Атмосферная коррозия цинка
Коррозия цинка в атмосферных условиях не протекает. Это связано с образованием на поверхности тонкой защитной пленки основного оксида цинка – ZnO. Достаточно высокой коррозионной стойкостью отличается цинк, находясь и в морской атмосфере. Поверхность покрывается гидроксидом цинка и его основными углекислыми солями. Находясь в морской атмосфере цинковое покрытие, толщиной 0, 03 мм хорошо защищает поверхность изделия на протяжении восьми лет.
Промышленная атмосфера (с примесями SO2, SO3, HCl) негативно сказывается на коррозионную стойкость цинка. Срок службы цинкового покрытия такой же толщины ограничивается четырьмя годами. Сельская атмосфера особого негативного влияния не оказывает, срок службы – около 11 лет.
Коррозия цинка в кислотах
Как цинк обычной чистоты, так и его оксид корродируют при контакте с кислотами. Очень чистый цинк с растворами кислот и щелочей не реагирует даже при повышении температуры. Реакция начинается только при добавлении сульфата меди (CuSO4). Коррозия цинка также наблюдается в растворах щелочных, кислых солей.
В кислотах и подкисленных средах коррозия цинка проходит с водородной деполяризацией, т.е. выделением водорода.
Коррозия цинка в соляной кислоте протекает интенсивно, с образованием хлорида цинка и выделением водорода по реакции:
Одним из направлений применения соляной кислоты является именно получение хлорида цинка.
Коррозия цинка в серной кислоте также протекает довольно интенсивно, с образованием сульфата цинка и выделением водорода по реакции:
Коррозия цинка в щелочах
Цинк активно реагирует со щелочами, образую гидроксоцинкаты.
Интенсивно проходит коррозия цинка при контакте с раствором аммиака:
При этом образуется аммиачный комплекс [Zn(NH3)4](OH)2.
При контакте цинка с металлом, имеющим более электроположительный потенциал, скорость коррозии цинка значительно возрастает. Цинк используют как протектор для более благородных металлов.
Хотя цинк и является достаточно коррозионностойким металлом – он не нашел применения в пищевой промышленности, т.к. при контакте с кислыми пищевыми продуктами образует токсичные соли.
По своим химическим свойствам цинк относится к весьма активным элементам. Цинк легко растворяется в кислотах и щелочах. В растворах сильных кислот и щелочей растворение цинка происходит с выделением водорода.
Растворение цинка в растворах кислот — процесс электрохимический, скорость растворения зависит от состава (содержание примесей) и структуры металла, его предварительной обработки, а также от типа коррозионной среды. В растворах соляной и азотной кислот коррозия цинка значительно выше, чем в растворе серной кислоты такой же концентрации.
Выпадающие на цинке в процессе его растворения продукты коррозии, особенно с низким перенапряжением выделения водорода (например, Cu), еще больше ускоряют разрушение металла за счет увеличения площади катодных участков. Сплавы цинка, содержащие Al, имеют более высокую стойкость в кислотных средах. Олово и свинец не влияют на скорость коррозии цинка.
Цинк — сильный восстановитель, он может замещать многие металлы (Mg, Mn, Fe, Ni, Cu, Cd) в их солях. В азотной кислоте цинк восстанавливает ион азота до нитрата аммония.
В щелочах цинк растворяется с образованием амфотерных оксидов, например, Na2ZnО2. В щелочных растворах с pH до 12 на цинке могут образовываться защитные пленки. Поэтому щелочные растворы, практически не вызывают коррозии цинка и его сплавов. Современные быстродействующие моющие средства вызывают коррозию цинка. В более сильных щелочах с рН>12,5 и в едком аммонии цинк нестоек.
В своих соединениях цинк двухвалентен. Ион Zn2+ бесцветен и может существовать в нейтральных и кислых растворах. В процессе нейтрализации кислого раствора при pH около 6,0 осаждается гидроксид Zn(ОН)2.
Большинство солей цинка бесцветно и хорошо растворимо в воде. Наиболее важная в технике соль цинка — сульфат цинка ZnSО4*7H2O (цинковый купорос).
Сухой кислород при комнатной температуре не действует на цинк, но при 200—400°C на поверхности цинка образуется пленка оксида цинка ZnO.
Азот, углекислый газ, оксид углерода, сухой аммиак и хлор не вызывают коррозии цинка. Ацетилен вызывает коррозию цинка только в присутствии влаги.
Сероводород действует на цинк при комнатной температуре, однако образующийся на поверхности сульфид предохраняет цинк от дальнейшего воздействия сероводорода.
Цинк стоек во многих органических жидкостях, не являющихся сильными кислотами, концентрированном спирте эфире, ацетоне, глицерине, бензине, бензоле и их смесях, обезжиривателях на основе трихлорэтилена. Цинк почти не подвергается действию сернистых соединений, растворенных в сырой нефти, в отсутствии воды. Однако, цинк подвергается воздействию топлив, содержащих большие количества серы. Цинковые и оцинкованные емкости не рекомендуется применять для хранения кислых пищевых продуктов. Сухие продукты в оцинкованной таре хранить допускается.
Поведение цинка в атмосферных условиях зависит от многих факторов, из которых основными являются: состав, влажность и температура воздуха, продолжительность воздействия на металл атмосферных осадков.
Коррозионная стойкость цинка в атмосферных условиях во многом определяется наличием на нем защитных пленок.
Определяющее влияние на скорость образования, состав, структуру и свойства защитных пленок на цинке оказывает pH среды. Зависимость скорости коррозии пинка от pH среды приведена на рис. 1.


С увеличением содержания кислорода в воде коррозия цинка, как правило, возрастает и имеет равномерный характер. При недостатке кислорода в электролите цинк подвергается точечной коррозии.
В жесткой воде коррозия цинка, как правило, меньше, чем в дистиллированой воде, и зависит от pH. При этом, если pH среды меньше того значения, при котором вода находится в равновесии с карбонатом кальция, то последний будет стремиться раствориться, а не осаждаться на металле. Такой эффект обычно наблюдается в воде, содержащей большое количество углекислого газа.
Особо опасными в воде являются примеси металлов более электроположительных, чем цинк. Например, при содержании в воде 0,00005 г/л меди оцинкованные трубы выходят из строя втрое быстрее, чем в обычной жесткой воде.
Присутствие в воде углекислого газа усиливает коррозию цинка, так как под действием СО2 основные и гидроксидные продукты коррозии переходят в основные карбонаты, которые обладают меньшим защитным свойством, чем гидроксиды.
Хлориды сильно ускоряют коррозию цинка. Так, хлориды щелочных металлов сильно уменьшают способность цинка к образованию защитных пленок. Они проникают сквозь образовавшиеся пленки и вызывают увеличивающуюся во времени коррозию. Однако в присутствии солей магния и кальция, образующих на цинке известковые отложения, активирующее действие ионов хлора на коррозию цинка подавляется. В присутствии ионов магния (12 г/л) скорость коррозии цинка в воде, содержащей 30 г/л хлорида, уменьшается почти в 50 раз [13]. Поэтому скорость коррозии цинка в морской воде относительно невелика.

Цинк и его сплавы имеют явно выраженный неблагородный потенциал. В ряду напряжений потенциал цинка находится в области более электроотрицательных значений, чем потенциал железа и других конструкционных металлов. Стандартный электродный потенциал цинка П°Zn⇔Zn2+ равен —0,762 В, а стационарный потенциал в 0,5 моль/л растворе NaCl около —0,83 В. Потенциал цинка зависит от концентрации водородных ионов (величины pH). Зависимость электродного потенциала цинка от pH среды показана на рис. 3. В деаэрированной водопроводной воде потенциал цинка составляет —0,877 В. В процессе коррозии в водопроводной воде с образованием твердых продуктов коррозии потенциал цинка становится более положительным. Так, в аэрированной водопроводной воде потенциал цинка облагораживается до —0,68 В. С изменением температуры водопроводной воды потенциал цинка изменяется до значений —0,3—0,25 В с повышением температуры воды до 70—80°С. Это явление приводит к изменению полярности потенциалов в системе Fe—Zn.
В морской воде цинк корродирует довольно равномерно. В начальный период скорость коррозии цинка в морской воде выше, чем в пресной, но со временем она значительна замедляется. На поверхности цинка образуются пленки из продуктов коррозии светлого цвета, состоящие главным образом из основных хлоридов цинка, гидроксидов, основных карбонатов цинка следующего состава: ZnCl2*Zn(OH)2; ZnCl2*6Zn (OH)2; Zn(OH)2; Zn(OH)2CO3. Эти соединения труднорастворимы в воде. Кроме того, в образовании пленок участвуют также гидроксиды, основные хлориды и карбонаты кальция и магния. В конечном итоге на поверхности цинка образуется защитный слой, который предохраняет его от коррозии даже в быстротекущей морской воде.
Периодическое смачивание увеличивает коррозию цинка. При смачивании (1—2 раза в сутки) коррозия цинка увеличивается в 1,5—2 раза, но при частых смачиваниях (1—12 раз в час) коррозия цинка сильно возрастает и в 10—20 раз превышает коррозию в объеме электролита.
Коррозионная стойкость цинка в почве зависит от природы почвы, ее физико-химических свойств (текстуры, удельной массы, являющейся мерой компактности почвы величины pH, удельного электрического сопротивления). Большое значение имеет природа и концентрация ионов, образуемых химическими солями, растворенными во влаге почв. Если на цинке образуется пленка из нерастворимых продуктов коррозии, то процесс разрушения металла замедляется или совсем прекращается. В некоторых почвах на цинке или оцинкованной стали образуется пленка, главным образом из силиката цинка, которая сообщает дополнительную защиту металлу.
Однако следует отметить, что цинк обладает недостаточной стойкостью в большинстве почв, особенно плохо аэрированных и с высоким содержанием кислот и растворимых солей.
Большой экспериментальный и практический материал по коррозионной стойкости цинка и его сплавов систематизирован и обобщен в работах.
Курс общей и неорганической химии
(для студентов биологического факультета (биофизиков)
и для студентов факультета биоинженерии и биоинформатики)
Программа курса. Материалы лекций. Презентации лекций. Программа сетевых контрольных мероприятий
Лектор - Загорский Вячеслав Викторович - ст.н.сотр., к.х.н., д.п.н.
Окислительно-восстановительные процессы.
Гальваническая пара медь-цинк в соляной кислоте.
Ускорение реакции цинка с соляной кислотой
Zn + 2HCl = ZnCl2 + H2
Реакцию выделения водорода при взаимодействии цинка с соляной кислотой можно ускорить, если добавить к соляной кислоте немного растворимой соли меди (II). Менее активная медь выделится на поверхности цинка в виде рыхлого темного осадка с большой поверхностью. При этом электроны будут переходить с цинка на медь, и именно на поверхности меди будет бурно выделяться водород. С поверхности цинка, не закрытой пузырьками водорода, ионы цинка быстрее переходят в раствор. В результате выделение водорода после добавления соли меди заметно ускорится.
Автор (постановка, съемка, монтаж)
Загорский В.В.
Ассистенты
Петрова Е.П., В.Б. Бернард, Н.Н. Маряхина, Д. Свистунова
Подготовка Интернет-публикации
Миняйлов В.В.
Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
Статья посвящена вопросу переработки гидротехногенных образований ГОКов медноколчеданных месторождений с целью извлечения ионов цинка в виде кондиционного продукта. Рассмотрена актуальность переработки техногенных вод, формирующихся на территории горных предприятий, занимающихся переработкой медно-цинковых руд. Исследована возможность применения метода гальванокоагуляции для селективного извлечения Zn из техногенных вод медноколчеданных месторождений. Представлены результаты влияния кинетических и физико-химических факторов на селективность и полноту извлечения цинка из растворов. Выявлены зависимости влияния рН, концентрации на показатели извлечения цинка. Установлено эффективное соотношение гальванопары Fe:С, обеспечивающее максимальные показатели извлечения цинка из водных растворов. Представлены кинетические зависимости протекания процесса гальванокоагуляционного извлечения цинка в области получения рациональных продуктов. Дана характеристика фазового состава образующегося цинксодержащего продукта. Рассмотрен механизм гальванокоагуляционного извлечения цинка с использованием гальванопары Fe:С. Определены рациональные параметры селективного извлечения цинка из технических растворов.

2. Баранов Э.Н., Куликовский В.Е. Морфогенез колчеданных залежей Верхнеуральского рудного района Южного Урала // Придонные гидротермальные постройки. – Свердловск: УрО АН СССР, 1988. – С. 43–68.
3. Виноградова О.О., Погорелов В.И., Феофанов В.А. Применение гальванокоагуляции для очистки промышленных сточных вод // Цветные металлы. – 1993. –№ 11. – С. 59–60.
4. Зозуля В.В., Прокопенко В.А., Лавриненко Е.Н., Перцов Н.В. О механизме процессов в гальванопаре железо-углерод (кокс) в аэрированном растворе, содержащем ионы тяжелых металлов Укр. хим. журн. – 2002. – Т. 66, № 7. – С. 48–50.
5. Мишурина О.А.Технология электрофлотационного извлечения марганца в комплексной переработке гидротехногенных георесурсов медноколчеданных месторождений – автореферат диссертации на соискание ученой степени кандидата технических наук // Магнитогорский государственный технический университет им. Г.И. Носова. – Магнитогорск, 2010.
6. Мишурина О.А. Электрофлотационное извлечение марганца из гидротехногенных ресурсов горных предприятий // Вестник Магнитогорского государственного технического университета им. Г.И. Носова. – 2009. – № 3. – С. 72–74.
7. Мишурина О.А., Муллина Э.Р. Химические закономерности процесса селективного извлечения марганца из техногенных вод // Вестник Магнитогорского государственного технического университета им. Г.И. Носова. – 2012. – № 3. – С. 58–62.
8. Мишурина О.А., Чупрова Л.В., Муллина Э.Р. Деманганация сточных вод растворами хлорной извести // Альманах современной науки и образования. – 2013. – № 9 (76). – С. 115–118.
9. Мишурина О.А., Чупрова Л.В., Муллина Э.Р. Химические превращения кислород-содержащих ионов хлора при разных значения диапазона рН // Международный журнал прикладных и фундаментальных исследований. – 2014. – № 2–2. – С. 43–46.
10. Прокопенко В.А, Лавриненко Е.Н., Перцов Н.В. Роль гальванического контакта железа с углеродом в образовании дисперсных оксидов-гидроксидов железа в воде и растворах электролитов // Коллоид, журн. – 2001. – Т. 63, № 4. – С. 505–509.
11. Прокопенко В.А., Лавриненко Е.Н., Мамуня С.В. Влияние формы катиона на процесс формирования дисперсных фаз ферритов тяжёлых металлов в гальваноконтакте железо-углерод // Вiснuк ОНУ. – 2005. – Т. 10. Вып. 2. – С. 155–164.
12. Рязанцев А.А., Батоева А.А., Батоев В.Б., Тумурова Л.В. Гальванокоагуляционная очистка сточных вод // Химия в интересах устойчивого развития. – 1996. – Т. 4, № 3. – С. 233–241.
14. Чантурия В.А., Шадрунова И.В., Медяник Н.Л., Мишурина О.А. Технология электрофлотационного извлечения марганца из техногенного гидроминерального сырья медноколчеданных месторождений Южного Урала // Физико-технические проблемы разработки полезных ископаемых. – 2010. – № 3. – С. 89–96.
Технологический процесс разработки и переработки рудных месторождений сопровождается образованием значительного количества техногенных вод. Учитывая объемы гидротехногенных образований, а также высокие концентрации ионов тяжелых и цветных металлов, данные воды можно классифицировать как техногенное гидроминеральное сырье, переработка которого позволит более полно использовать природные ресурсы. Кроме того, ужесточение экологической политики государства выводит на ведущие позиции решение вопросов по переработке техногенных образований с целью снижения концентраций канцерогенных веществ до норм ПДК и организации цикла оборотного водоснабжения на предприятиях [5–9, 14].
Наиболее перспективно для переработки цинксодержащих техногенных вод использовать метод гальванокоагуляции. Эффективность данного метода обусловлена простотой аппаратурного оформления, дешевизной используемых материалов, а также возможностью селективного извлечения ионов цинка из высокоминерализованных кислых растворов [3, 4, 10, 11].
Изучение закономерностей извлечения цинка из однокомпонентных растворов проводилось в несколько этапов. На первом этапе исследований изучены кинетические закономерности извлечения цинка из однокомпонентных растворов с концентрацией от 250 до 750 мг/дм3. Результаты исследований представлены на рис. 1.
Анализ полученных результатов показал, что при 10-минутной обработке растворов происходит снижение концентрации в сливе гальванокоагулятора на 10–20 %. При этом отмечено, что чем меньше исходная концентрация, тем более эффективно происходит удаление цинка из раствора за один и тот же промежуток времени.
Для концентрации 500 мг/дм3 изучена кинетика извлечения в промежутке времени до трех минут. В сливе одновременно с цинком определяли концентрацию железа. Отмечено, что рост концентрации железа не является эквивалентным снижению концентрации цинка, а при увеличении времени обработки до одной минуты происходит одновременное снижение концентраций металлов, что видимо, является следствием связывания их в ферриты.
Это предположение подтверждается ростом удельного веса ферритного осадка (рис. 2) при увеличении времени обработки раствора.
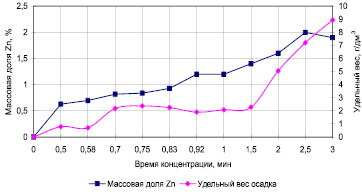
Рис. 2. Влияние времени обработки на удельный выход и массовую долю цинка в осадке
За одну минуту обработки при содержании цинка в растворе 500 мг/дм3 выход ферритного осадка составил 2,0 г/дм3, а за три минуты увеличился до 8,6 г/дм3. Рост массовой доли цинка в осадке наблюдается в течение 2,5 минут и затем стабилизируется в области 1,7–1,9 %.
Эту закономерность нельзя объяснить тем, что в растворе содержится повышенное количество железа в растворенной форме, которое, с увеличением времени очистки, как в первом, так и во втором случае, окисляясь кислородом воздуха, переходит в гидратную форму и выпадает в осадок. В этом случае происходило бы разубоживание осадка по цинку. Вероятнее всего за промежуток времени 2,5 минуты в системе достигается некое равновесие между переводом в жидкую фазу железа вследствие растворения анода и связывания его в ферриты совместно с цинком.
Результаты исследования влияния температуры раствора на показатели извлечения цинка показали, что отклонение температуры раствора от 20 градусов в ту или иную сторону приводит к повышению концентрации железа в сливе гальванокоагулятора. Концентрация цинка снижается до температуры 30–40 градусов, а затем начинает возрастать, что является следствием повышения растворимости образующихся цинксодержащих соединений при повышении температуры.
При анализе влияния рН на показатели гальванокоагуляционного извлечения ионов цинка установлено, что с увеличением исходного значения рН раствора с 5,2 до 6,5 возрастает извлечение ионов цинка с 75 до 87 %, массовая доля цинка увеличивается с 5,5 до 6,78 % и наблюдаются максимальные значения удельного выхода осадка и массовой доли цинка. Максимальное извлечение ионов цинка характерно для области рН более 8,5. Это объясняется протеканием процесса кислотно-основного осаждения ионов цинка в виде гидроксида Zn(OH)2. Следовательно, для гальванокоагуляционного извлечения цинка оптимальная область рН обрабатываемых растворов от 5,2 до 6,5.
Сравнительный анализ скорости перевода цинка и железа в осадок (рис. 3) позволил утверждать, что в предварительно аэрированном растворе происходит интенсификация процесса растворения и окисления анодного железа, однако скорость перехода в осадок железа повышается незначительно (от 0,55 до 0,57 мг/с). Скорость перехода цинка в ферритный осадок повышается после предварительной аэрации более значимо с 0,50… до 0,59 мг/с.
Повышение скорости перехода цинка в осадок в случае предварительной аэрации растворов подтверждено изучением кинетических закономерностей – изменения остаточной концентрации цинка в процессе гальванокоагуляции при обработке раствора сульфата цинка различных концентраций. Установлено, что скорость снижения остаточной концентрации цинка в растворе заметно возрастает после аэрации в первые четыре минуты контакта раствора с гальванопарой.
Изучение фазового состава образующейся дисперсной фазы проводили рентгеноструктурным методом.
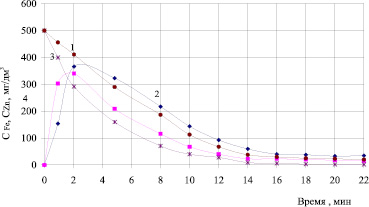
Рис. 3. Кинетика изменения концентрации ионов железа 2, 4 и цинка 1, 2 в растворах с концентрацией CZn2+ = 500 мг/дм3 в процессе гальванокоагуляции с предварительной аэрацией 3, 4 и без предварительной аэрации 1, 2
В качестве образцов исследования были взяты представительные пробы осадков, полученных при одинаковой длительности контакта раствора с гальванопарой и предварительной аэрацией раствора. Анализ проб показал, что значительная масса осадка приходится на долю мелкодисперсного кокса, который вымывается из гальванокоагулятора в результате истирания при непрерывном вращении барабана.
Обработанные результаты рентгенофазового анализа цинксодержащего осадка, полученного из сульфатсодержащих растворов, приведены в таблице.
Рентгенофазовым анализом осадков, полученных при обработке однокомпонентного раствора, не подверженного предварительной аэрации, содержащего ионы цинка, фиксируется наличие фаз магнетита Fe3O4, франклинита ZnFe2O4, гематита Fe2О3, лепидокрокита FeOOH, гидроксидов цинка и железа(III) Zn(OH)2 и Fe(OH)3, вюстита FeO, цинкита ZnO. В осадках, полученных при обработке раствора цинкового купороса с концентрацией 500 мг/дм3 и рН 5,5, обнаружена фаза смитсонита ZnCО3.
Учитывая рыхлую поверхность образующегося Fe(OH)3, процесс сорбции при гальванокоагуляционной обработке раствора, теоретически может протекать с захватом как катионов Zn2+, ZnОН+ , так и ZnO, Zn(ОН)2.
Фазовые составы осадков, полученных без предварительной аэрации / с аэрацией
Цинк расположены в побочной подгруппе II группы (или в 12 группе в современной форме ПСХЭ) и в четвертом периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение цинка и свойства
Электронная конфигурация цинка в основном состоянии :
+30Zn 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2
3s 3p 3d
Характерная степень окисления цинка в соединениях +2.
Физические свойства
Цинк при нормальных условиях — хрупкий переходный металл голубовато-белого цвета (быстро тускнеет на воздухе, покрываясь тонким слоем оксида цинка).

Температура плавления цинка 420°С, температура кипения 906°С, плотность 7,13 г/см 3 .
Нахождение в природе
Среднее содержание цинка в земной коре 8,3·10 -3 мас.%. Основной минерал цинка: сфалерит (цинковая обманка) ZnS..

Цинк играет важную роль в процессах, протекающих в живых организмах.
В природе цинк как самородный металл не встречается.
Способы получения
Цинк получают из сульфидной руды. На первом этапе руду обогащают, повышая концентрацию сульфидов металлов. Сульфид цинка обжигают в печи кипящего слоя:
2ZnS + 3O2 → 2ZnO + 2SO2
Чистый цинк из оксида получают двумя способами.
При пирометаллургическом способе , который использовался издавна, оксид цинка восстанавливают углём или коксом при 1200—1300 °C:
ZnO + С → Zn + CO
Далее цинк очищают от примесей.
В настоящее время основной способ получения цинка — электролитический (гидрометаллургический) . При этом сульфид цинка обрабатывают серной кислотой:
При это получаемый раствор сульфата цинка очищают от примесей (осаждением их цинковой пылью) и подвергают электролизу.
При электролизе чистый цинк осаждается на алюминиевых катодах, с которых его удаляют и подвергают плавлению в индукционных печах. Таким образом можно получить цинк с высокой чистотой (до 99,95 %).
Качественные реакции
Качественная реакция на ионы цинка — взаимодействие избытка солей цинка с щелочами . При этом образуется белый осадок гидроксида цинка.

Например , хлорид цинка взаимодействует с гидроксидом натрия:
ZnCl2 + 2NaOH → Zn(OH)2 + 2NaCl

При дальнейшем добавлении щелочи амфотерный гидроксид цинка растворяется с образованием комплексной соли тетрагидроксоцинката:

Обратите внимание , если мы поместим соль цинка в избыток раствора щелочи, то белый осадок гидроксида цинка не образуется, т.к. в избытке щелочи соединения цинка сразу переходят в комплекс:
Химические свойства
1. Цинк – сильный восстановитель . Цинк – довольно активный металл, но на воздухе он устойчив, так как покрывается тонким слоем оксида, предохраняющим его от дальнейшего окисления. При нагревании цинк реагирует со многими неметаллами .
1.1. Цинк реагируют с галогенами с образованием галогенидов:
Реакция цинка с иодом при добавлении воды:
1.2. Цинк реагирует с серой с образованием сульфидов:
Zn + S → ZnS
1.3. Цинк реагируют с фосфором . При этом образуется бинарное соединение — фосфид:
1.4. С азотом цинк непосредственно не реагирует.
1.5. Цинк непосредственно не реагирует с водородом, углеродом, кремнием и бором.
1.6. Цинк взаимодействует с кислородом с образованием оксида:
2Zn + O2 → 2ZnO
2. Цинк взаимодействует со сложными веществами:
2.1. Цинк реагирует с парами воды при температуре красного каления с образованием оксида цинка и водорода:
Zn 0 + H2 + O → Zn +2 O + H2 0
2.2. Цинк взаимодействуют с минеральными кислотами (с соляной, фосфорной и разбавленной серной кислотой и др.). При этом образуются соль и водород.
Например , цинк реагирует с соляной кислотой :
Zn + 2HCl → ZnCl2 + H2↑
Демонстрация количества выделения водорода при реакции цинка с кислотой:
Цинк реагирует с разбавленной серной кислотой:
2.3. Цинк реагирует с концентрированной серной кислотой . В зависимости от условий возможно образование различных продуктов. При нагревании гранулированного цинка с концентрированной серной кислотой образуются оксид серы (IV), сульфат цинка и вода:
Порошковый цинк реагирует с концентрированной серной кислотой с образованием сероводорода, сульфата цинка и воды:
2.4. Аналогично: при нагревании гранулированного цинка с концентрированной азотной кислотой образуются оксид азота (IV) , нитрат цинка и вода :
При нагревании цинка с очень разбавленной азотной кислотой образуются нитрат аммония , нитрат цинка и вода :
2.5. Цинк – амфотерный металл, он взаимодействует с щелочами. При взаимодействии алюминия с раствором щелочи образуется тетрагидроксоалюминат и водород:
Zn + 2KOH + 2H2O = K2[Zn(OH)4] + H2
Цинк реагирует с расплавом щелочи с образованием цинката и водорода:
В отличие от алюминия, цинк растворяется и в водном растворе аммиака:
2.6. Цинк вытесняет менее активные металлы из оксидов и солей .
Например , цинк вытесняет медь из оксида меди (II):
Zn + CuO → Cu + ZnO
Еще пример : цинк восстанавливает медь из раствора сульфата меди (II):
CuSO4 + Zn = ZnSO4 + Cu
И свинец из раствора нитрата свинца (II):
Восстановительные свойства цинка также проявляются при взаимодействии его с сильными окислителями: нитратами и сульфитами в щелочной среде, перманганатами, соединениями хрома (VI):
Оксид цинка
Способы получения
Оксид цинка можно получить различными методами :
1. Окислением цинка кислородом:
2Zn + O2 → 2ZnO
2. Разложением гидроксида цинка при нагревании:
3. Оксид цинка можно получить разложением нитрата цинка :
Химические свойства
Оксид цинка — типичный амфотерный оксид . Взаимодействует с кислотными и основными оксидами, кислотами, щелочами.
1. При взаимодействии оксида цинка с основными оксидами образуются соли-цинкаты.
Например , оксид цинка взаимодействует с оксидом натрия:
2. Оксид цинка взаимодействует с растворимыми основаниями (щелочами). При этом в расплаве образуются соли—цинкаты, а в растворе – комплексные соли . При этом оксид цинка проявляет кислотные свойства.
Например , оксид цинка взаимодействует с гидроксидом натрия в расплаве с образованием цинката натрия и воды:
Оксид цинка растворяется в избытке раствора щелочи с образованием тетрагидроксоцинката:
3. Оксид цинка не взаимодействует с водой.
ZnO + H2O ≠
4. Оксид цинка взаимодействует с кислотными оксидами . При этом образуются соли цинка. В этих реакциях оксид цинка проявляет основные свойства.
Например , оксид цинка взаимодействует с оксидом серы (VI) с образованием сульфата цинка:
5. Оксид цинка взаимодействует с растворимыми кислотами с образованием солей.
Например , оксид цинка реагирует с соляной кислотой:
ZnO + 2HCl = ZnCl2 + H2O
6. Оксид цинка проявляет слабые окислительные свойства .
Например , оксид цинка при нагревании реагирует с водородом и угарным газом:
ZnO + С(кокс) → Zn + СО
ZnO + СО → Zn + СО2
7. Оксид цинка — твердый, нелетучий. А следовательно, он вытесняет более летучие оксиды (как правило, углекислый газ) из солей при сплавлении.
Например , из карбоната бария:
Гидроксид цинка
Способы получения
1. Гидроксид цинка можно получить пропусканием углекислого газа, сернистого газа или сероводорода через раствор тетрагидроксоцинката натрия:
Чтобы понять, как протекает эта реакция, можно использовать несложный прием: мысленно разбить исходное вещество Na2[Zn(OH)4] на составные части: NaOH и Zn(OH)2. Далее мы определяем, как реагирует углекислый газ с каждым из этих веществ, и записываем продукты их взаимодействия. Т.к. Zn(OH)2 не реагирует с СО2, то мы записываем справа Zn(OH)2 без изменения.
2. Гидроксид цинка можно получить действием недостатка щелочи на избыток соли цинка.
Например , хлорид цинка реагирует с недостатком гидроксида калия с образованием гидроксида цинка и хлорида калия:
Химические свойства
1. Гидроксид цинка реагирует с растворимыми кислотами .
Например , гидроксид цинка взаимодействует с азотной кислотой с образованием нитрата цинка:
2. Гидроксид цинка взаимодействует с кислотными оксидами .
Например , гидроксид цинка взаимодействует с оксидом серы (VI) с образованием сульфата цинка:
3. Гидроксид цинка взаимодействует с растворимыми основаниями (щелочами). При этом в расплаве образуются соли—цинкаты, а в растворе – комплексные соли . При этом гидроксид цинка проявляет кислотные свойства.
Например , гидроксид цинка взаимодействует с гидроксидом калия в расплаве с образованием цинката калия и воды:
Гидроксид цинка растворяется в избытке щелочи с образованием тетрагидроксоцинката:
4. Г идроксид цинка разлагается при нагревании :
Соли цинка
Нитрат и сульфат цинка
Нитрат цинка при нагревании разлагается на оксид цинка, оксид азота (IV) и кислород:
Сульфат цинка при сильном нагревании разлагается аналогично — на оксид цинка, сернистый газ и кислород:
Комплексные соли цинка
Для описания свойств комплексных солей цинка — гидроксоцинкатов, удобно использоваться следующий прием: мысленно разбейте тетрагидроксоцинкат на две отдельные частицы — гидроксид цинка и гидроксид щелочного металла.
Например , тетрагидроксоцинкат натрия разбиваем на гидроксид цинка и гидроксид натрия:
Na2[Zn(OH)4] разбиваем на NaOH и Zn(OH)2
Свойства всего комплекса можно определять, как свойства этих отдельных соединений.
Таким образом, гидроксокомплексы цинка реагируют с кислотными оксидами .
Например , гидроксокомплекс разрушается под действием избытка углекислого газа. При этом с СО2 реагирует NaOH с образованием кислой соли (при избытке СО2), а амфотерный гидроксид цинка не реагирует с углекислым газом, следовательно, просто выпадает в осадок:
Аналогично тетрагидроксоцинкат калия реагирует с углекислым газом:
А вот под действием избытка сильной кислоты осадок не выпадает, т.к. амфотерный гидроксид цинка реагирует с сильными кислотами.
Например , с соляной кислотой:
Правда, под действием небольшого количества ( недостатка ) сильной кислоты осадок все-таки выпадет, для растворения гидроксида цинка кислоты не будет хватать:
Аналогично с недостатком азотной кислоты выпадает гидроксид цинка:
Если выпарить воду из раствора комплексной соли и нагреть образующееся вещество, то останется обычная соль-цинкат:
Гидролиз солей цинка
Растворимые соли цинка и сильных кислот гидролизуются по катиону. Гидролиз протекает ступенчато и обратимо, т.е. чуть-чуть:
I ступень: Zn 2+ + H2O = ZnOH + + H +
II ступень: ZnOH + + H2O = Zn(OH )2 + H +
Более подробно про гидролиз можно прочитать в соответствующей статье.
Цинкаты
Соли, в которых цинк образует кислотный остаток (цинкаты) — образуются из оксида цинка при сплавлении с щелочами и основными оксидами:
Для понимания свойств цинкатов их также можно мысленно разбить на два отдельных вещества.
Например, цинкат натрия мы разделим мысленно на два вещества: оксид цинка и оксид натрия.
Na2ZnO2 разбиваем на Na2O и ZnO
Тогда нам станет очевидно, что цинкаты реагируют с кислотами с образованием солей цинка :
Под действием избытка воды цинкаты переходят в комплексные соли:
Сульфид цинка
ZnS + 2HCl → ZnCl2 + H2S
Под действием азотной кислоты сульфид цинка окисляется до сульфата:
(в продуктах также можно записать нитрат цинка и серную кислоту).
Концентрированная серная кислота также окисляет сульфид цинка:
При окислении сульфида цинка сильными окислителями в щелочной среде образуется комплексная соль:
Z nS + 4NaOH + Br2 = Na2[Zn(OH)4] + S + 2NaBr
Читайте также:
- Пероксид ацетона своими руками
- Рулевая рейка форд галакси ремонт своими руками
- Ремонт кпп zf 5s42 своими руками
- Приспособление для монтажа кедрала своими руками
- Как сделать чтобы яндекс навигатор работал без интернета

