Перхлорат калия как сделать
Добавил пользователь Alex Обновлено: 04.10.2024

Изучая по химии кислород, вы дошли до раздела "Получение кислорода в лаборатории путем разложения неорганических веществ". "Разложение воды, марганцовки, перекиси водорода, оксидов тяжелых и нитратов активных металлов. так, вроде бы все понятно. Получение кислорода из бертолетовой соли? Это еще что за зверь?!" - стандартный ход мыслей каждого учащегося, просматривающего этот параграф в учебнике. В школе бертолетову соль не учат, так что приходится наводить справки о ней самостоятельно. Сегодня в этой статье я попытаюсь как можно подробнее ответить на вопрос о том, что такое бертолетова соль.
Происхождение названия
Сначала поговорим о ее названии. Соль - это отдельный класс неорганических веществ, в химической формуле которых такая схема расположения элементов: Ме-n- кисл.ост., где Ме - металл, кисл.ост - кислотный остаток, n - число атомов (может не присутствовать, если валентность металла и кислотного остатка одинакова). Кислотный остаток берут из какой-либо неорганической кислоты. Химическая формула этой соли - KClO3. Металл, который в ней присутствует, - калий, значит, она является калиевой. Источник остатка ClO3 - хлорноватая кислота HClO3. Итого, бертолетова соль является калиевой солью хлорноватой кислоты. Также ее еще называют хлоратом калия, а прилагательное "бертолетова" к ней приписывают из-за имени ее первооткрывателя.
История открытия
Впервые была получена в 1786 году французским химиком Клодом Бертолле. Он пропустил хлор сквозь горячий концентрированный раствор гидроксида калия (фото).
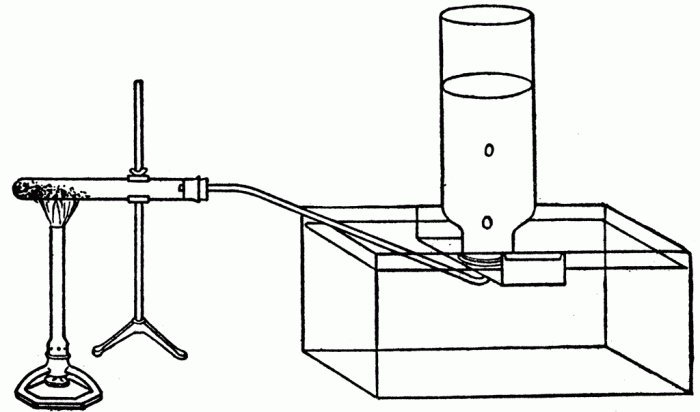
Бертолетова соль: получение
Получение хлоратов промышленным способом (в том числе и бертолетовой соли) основывается на реакции диспропорционирования гипохлоритов, которые получаются при взаимодействии хлора с растворами щелочей. Оформление процесса может быть разным: из-за того что самый многотоннажный продукт - гипохлорит кальция, из которого состоит хлорная известь, наиболее распространенным процессом является осуществление реакции обмена между хлоратом кальция (он получается при нагревании гипохлорита кальция) и хлоридом калия (он кристаллизуется из маточного раствора). Еще хлорат калия можно получить благодаря модифицированному методу Бертолле бездиафрагменным электролизом хлорида калия. Образующиеся хлор и гидроксид калия тут же взаимодействуют. Продутом их реакции является гипохлорит калия, который далее диспропорционирует на исходный хлорид калия и хлорат калия.
Химические свойства

Если температура нагревания достигает 400 о С, происходит разложение бертолетовой соли, при котором выделяется кислород и промежуточно образуется перхлорат калия. С катализаторами (оксид марганца (4), оксид железа (3), оксид меди и т.п.) температура, при которой происходит этот процесс, становится гораздо меньшей. Бертолетова соль и сульфат аммония могут реагировать в водно-спиртовом растворе и образовывать при этом хлорат аммония.
Применение
Смеси восстановителей (фосфора, серы, органических соединений) и хлората калия являются взрывчатыми и чувствительными к ударам и трению (фото выше). Чувствительность увеличивается, если присутствуют броматы и соли аммония. Из-за высокой чувствительности составы, в которых присутствует бертолетова соль, почти не применяются в производстве военных и промышленных взрывчатых веществ. Иногда ее используют в пиротехнике в качестве источника хлора для составов с цветным пламенем.

Также она содержится в спичечных головках и очень редко может являться инициирующим взрывчатым веществом (хлоратный порох детонировал шнур и был терочным составом ручных гранат вермахта). Да и в СССР хлорат калия входит в состав запала коктейля Молотова, приготовленного по особой рецептуре. Растворы бертолетовой соли раньше иногда использовались как слабый антисептик, наружное лекарственное средство для полоскания горла. В начале ХХ века бертолетову соль использовали для получения кислорода в лаборатории. Однако по причине высокой опасности ее перестали применять. Также при помощи нее в лабораторных условиях получают диоксид хлора (проводят реакцию восстановления хлората калия щавелевой и добавляют серную кислоту).
Заключение
Теперь вы знаете про бертолетову соль всё. Она может быть как полезной, так и чрезвычайно опасной для человека. Если вы имеете дома спички, то каждый день наблюдаете одну из отраслей применения бертолетовой соли в быту.

Калий перхлорат , то калиевая соль из хлорной кислоты с химической формулой KClO 4 , представляет собой белое кристаллическое твердое вещество , которое обладает сильным огнем , промотирующим действия и может образовывать взрывоопасные смеси с большим количеством окисляющихся веществами. В случае перхлората калия хлор находится в степени окисления + VII, наивысшей из возможных.
Оглавление
Производство
В настоящее время перхлорат калия производится в перхлоратных ячейках , в которых происходит электролиз водных растворов хлората натрия . На аноде , хлорат анионы образуются путем анодного окисления, триоксида хлора или dichlorohexoxide , который гидролизует к хлората и перхлората . Полученный перхлорат натрия после того, как остальная часть хлората натрия с восстанавливающими агентами, такими как соляная кислота или сульфит натрия, была разрушена добавлением хлорида калия с образованием осадка перхлората калия. Поскольку триоксид хлора разлагается до диоксида хлора и кислорода при высоких температурах , перхлоратные ячейки, в отличие от хлоратных, должны работать при низких температурах. Платина , аналогичные благородные металлы или химически стойкие электропроводящие оксиды, такие как диоксид марганца или диоксид свинца, обычно используются в качестве анодного материала в перхлоратных ячейках .
В качестве альтернативы перхлорат калия может быть получен путем химического окисления хлората калия путем добавления сильных окислителей, таких как персульфаты или перманганаты, и подходящих катализаторов к водным растворам хлората калия .
Третий способ получения перхлорат калия является тепловая диспропорционирования из хлората калия , в результате чего один моль хлорида калия, один моль перхлората калия и один моль кислорода образуются из двух молей хлората калия .
характеристики
В чистом виде перхлорат калия образует ромбические призмы , размер которых может достигать нескольких сантиметров. Кристаллическая система является орторомбической , пространственная группа Pnma (пространственная группа № 62) с параметрами решетки a = 8,834 Å , b = 5,65 Å и c = 7,24 Å, изотипична сульфату бария . Даже слегка загрязненный перхлорат калия образует только очень тонкие кристаллические иглы. Он плохо растворяется в холодной воде, не гигроскопичен и не образует гидратов . Он плохо растворяется в полярных органических растворителях. Шаблон: room group / 62
| Растворимость в различных растворителях при 25 ° C | ||||||||||||
| растворитель | вода | Метанол | Спирт этиловый | н-пропанол | ацетон | Ацетат этила | ||||||
| растворимость | в г / 100 г растворителя | 2,062 | 0,105 | 0,012 | 0,010 | 0,155 | 0,001 | |||||
Он также обладает сильным окислительным действием, поскольку выделение кислорода из перхлората калия является слабо экзотермическим процессом. Однако выделяемая энергия очень мала и недостаточна для нагрева дополнительного перхлората выше температуры разложения, поэтому чистый перхлорат калия не может взрывоопасно разлагаться.
С другой стороны, в водном растворе перхлорат калия имеет гораздо более слабый окислительный эффект, чем его родственные, менее окисленные хлор-кислородные соли, такие как гипохлорит калия . Перхлорат калия окисляет даже кипящую соляную кислоту лишь в незначительной степени, тогда как гипохлорит калия реагирует с соляной кислотой даже при комнатной температуре с сильным пенообразованием и сильным выделением хлора .
использовать
Перхлорат калия часто используется в пиротехнике из-за его сильного огнестойкого эффекта и хорошего срока хранения, например, в качестве окислителя в молниях .
Он редко используется в ракетных двигателях, так как был вытеснен из этой области применения связанной с ним солью перхлората аммония .
Инструкции по технике безопасности
Смеси перхлората калия с фосфором , серой или металлическими порошками могут воспламениться даже при низких температурах. Их можно сильно взорвать простым ударом молотка . Поэтому при хранении хлоратов и перхлоратов важно следить за тем, чтобы в контейнере для хранения было как можно меньше грязи.
Однако перхлораты более стабильны по сравнению с хлоратами (из-за степени окисления хлора + VII) и поэтому заменили хлораты при использовании в пиротехнических смесях.
Индивидуальные доказательства
веб ссылки
-
Эта страница последний раз была отредактирована 20 мая 2021 в 18:09.
Производство кислородные соединения хлора

Хлорокислородные кислоты и их соли являются окислителями. Окислительную активность и кислотные свойства их можно изобразить в виде следующего ряда:
Увеличение кислотных свойств
Увеличение окислительной активности
Получение гипохлорита натрия
Гипохлорит натрия — энергичный окислитель и применяется при отбеливании высококачественных тканей из растительных волокон, а также в металлургии цветных металлов. Он хорошо растворим в воде и не дает, подобно хлорной извести, крупинок, которые могли бы повредить тонкий текстильный материал. Гипохлорит натрия не стоек и со временем разлагается. Его получают химическим способом взаимодействием хлора и щелочи по реакции:
Сl2 + 2NaOH → NaClO + NaCl + Н2O
Электролитический способ получения гипохлорита натрия был открыт около 1882 г., почти одновременно в России (А. П. Лидов и В. А. Тихомиров) и за границей . Этот способ основан на получении хлора и его взаимодействии со щелочью в одном и том же аппарате — электролизере. Если вести электролиз раствора NaCl в ванне без диафрагмы, то на катоде будет выделяться водород и образовываться щелочь, а на аноде идти разряд ионов хлора. Образующийся на аноде хлор растворяется в электролите и взаимодействуя со щелочью, дает гипохлорит натрия. Последний в значительной степени диссоциирует с образованием ионов СlO — , которые способны к дальнейшему анодному окислению. Поляризационная кривая окисления СlO — лежит при менее электроположительных потенциалах, чем кривая разряда ионов Сl — , вследствие чего по мере накопления СlO — будет происходить все более интенсивное их окисление:
6СlO — +3Н2O — 6 е → 2СlO3 — + 6Н + + 4Сl — +1,5O2
Этот процесс ведет к снижению выхода по току в расчете на гипохлорит натрия. Поэтому электролиз следует вести в условиях, обеспечивающих минимальное перенапряжение при выделении хлора, и при невысокой концентрации СlO — в прианодном слое электролита. Повышенная температура снижает перенапряжение при выделении хлора, но приводит к ускорению разложения гипохлорита натрия. Полученный гипохлорит на катоде восстанавливается:
Чтобы воспрепятствовать восстановлению гипохлорита, в элек« тролит добавляют небольшие количества (0,1%) Na2Cr2O7, СаСl2 или канифольного мыла. Эти добавки вызывают образование пленок на поверхности катода, препятствующих подходу к нему ионов СlO — .
Процесс электролиза проводят при температуре электролита 20—25° С. Исходный электролит содержит 150—160 г/л NaCl. Можно применять графитовые аноды и катоды. В одной из предложенных конструкций электролизеров графитовые электроды включаются биполярно. Плотность тока достигает 1400 а/м 2 . Напряжение между электродами 3,7—4,2 в. В начале процесса выход по току достигает 95%, при накоплении 10—12 г/л активного хлора выход по току падает до 50—55%. При этих условиях расход энергии на 1 кг активного хлора достигает 6,5 кет • ч, а расход NaCl 12— 14 кг.
Химический способ получения гипохлорита натрия оказывается более экономичным, требует меньше хлорида натрия, дает более концентрированный и чистый продукт. Поэтому электролитический способ получения гипохлорита натрия может конкурировать с ним только в том случае, когда получение хлора и его хранение затруднено.
Получение хлоратов
Хлораты — сильные окислители и поэтому их применяют для приготовления пиротехнических составов. КСlO3 используют в спичечном производстве. Смесь Са(СlO3)2 и СаСl2 в виде раствора применяют для уничтожения травы на железнодорожных путях. Хлораты также служат исходным сырьем для получения перхлоратов.
Промышленный способ электролитического получения хлоратов был разработан французскими учеными Галлем и Монтлором в 1886 г.
Электрохимически ионы ClO 3 образуют в нейтральной растворе, как указано выше, за счет разряда ионов СlO — .
На 2 г-ион ClO — 3 требуется затратить 6 F электричества и кроме того, 1 2 F нужно израсходовать на образование 6 г-ион СlO — .
Таким образом, на каждый электрохимически полученный г-ион нужно затратить 9 F. Из них 3 F идет на образование 1,5 г-ат кислорода. Следовательно, теоретически выход по току на хлорат не может превышать 66,7%. В кислой среде выходы по току могут превышать эту величину, так как наряду с разрядом СlO — идет образование хлората чисто химическим путем за счет окисления иона гипохлорита хлорноватистой кислотой:
2HClO + NaClO → NaClO3 + 2HCl
Для получения 1 г-мол NaClO3 по этой реакции необходимо всего 6F (по 2F на образование каждого г-мол НСlO и NaClO). Побочной реакцией на аноде является разряд ионов ОН — (или восстановление молекул воды). Следовательно, нужно выбрать условия, обеспечивающие высокое перенапряжение выделения кислорода. Поэтому в качестве материала анода применяют графит. Раньше применяли также платиновые и магнетитовые аноды. Низкие температуры способствуют повышению перенапряжения кислорода и, следовательно, высоким выходам по току, но при повышенных температурах ускоряется реакция химического образования хлората. Катодный процесс сводится к выделению водорода. Так как хлорноватистая кислота и гипохлорит натрия связываются в хлорат, то концентрация их остается невысокой, и при этих условиях выхода по току хлората могут превосходить 90%.
Образовавшийся хлорат подвергается восстановлению на катоде. Для предотвращения восстановления применяют защиту катода пленкой основных соединений хрома. С этой целью в электролит вводят 5—6 г/л Na2Cr2O7.
Для поддержания слабокислой реакции в электролит систематически вводят небольшие количества НСl (концентрация ее в электролите 0,5—0,6 г/л). Добавка в раствор Na2Cr2O7, кроме предотвращения катодного восстановления хлората, является, в известных пределах, регулятором и индикатором кислотности, за счет реакции:
При образовании щелочи равновесие сдвигается слева направо. Избыточная щелочь нейтрализуется ионами водорода, а цвет раствора меняется от оранжевого до желтого. Наоборот, при подкислении равновесие сдвигается влево, избыточная кислота связывается, а цвет раствора становится оранжевым за счет образования бихромата. Электролиз обычно ведут при рН = 6—7, и температуре 40—50° С, так как при более высоких температурах стой кость графитовых анодов резко уменьшается. Регулировка темпе ратуры производится при помощи железных змеевиков с охлаждающей водой, которые, во избежание коррозии, находятся под катодной защитой.
Если присутствие хромовых соединений в хлорате недопустимо, то электролиз можно вести без добавления Na2Cr2O7 с высокой катодной плотностью тока и охлаждаемыми катодами.
Существуют ванны разных конструкций на нагрузку от 1000 до 20 000 а.
Хлорат натрия NaClO3 имеет ограниченное применение, так как эта соль гигроскопична, однако непосредственное получение КСlO3 в электролизере затруднительно ввиду невысокой растворимости этой соли. Поэтому ведут электролиз смешанного электролита NaCl и КCl, который получается в виде оборотного продукта после выделения КСlO3 согласно обменной реак ции:
При получении КСlO3 электролизом смешанного электролита раствор, поступающий в ванны, содержит 70— 100 г/л КСlO3; 180 —220 г/л NaCl; 100—130 г/л КСl и 5—6 г/л Na2Cr2O7 при содержании НСl 0,6—0,7 г/л. Ванны располагаются каскадом. Из нижней ванны каскада получают раствор, содержащий: 150— 200 г/л КСlO3 80—120 г/л NaClO3; 60—70 г/л КCl; 140—160 г/л NaCl. Этот раствор подается в аппарат с мешалкой, где нагревается до 100° С и реагирует с КО, добавляемым в твердом виде. После этого в растворе содержится: 270— 300 г/л КСlO3; 180—200 г/л NaCl и 100—130 г/л КCl. Раствор охлаждают до ,35—40° С и выделяют кристаллы
В случае необходимости кристаллы КСlO3 подвергают перекристаллизации. Маточный раствор корректируют до первоначального состава и возвращают на электролиз,
Условия электролиза для смешанного электролита не изменяются. Расход энергии несколько ниже, чем для NaClO3и составляет около 6000 квт • ч на 1 т КСlO3.
На получение 1 т КСlO3 расходуют 0,61—0,65 т КCl; 15—20 кг НCl; 1,5—2,0 кг K2Cr2O7.
Получение перхлоратов и хлорной кислоты
В хлорной кислоте содержится 64% кислорода. В ряду кислородных кислот хлора это наиболее сильная и устойчивая кислота. Ее применяют в гальванотехнике, фотографии, в некоторых гальванических элементах и как окислитель. Хлорнокислые соли (перхлораты) используют в пиротехнике и в технологии взрывчатых веществ. Перхлорат магния применяют как осушающее вещество.
Перхлораты могут быть получены химическим и электрохимическим путями. Электрохимический способ получения перхлоратов и хлорной кислоты был открыт Стадионом. При электрохимическом способе электролизу подвергается раствор хлората натрия. Образующийся при этом перхлорат натрия перерабатывается путем конверсии в перхлорат калия или аммония, а также в хлорную кислоту. Самостоятельное использование перхлората натрия ограничено вследствие его высокой гигроскопичности.
При электролизе анодная реакция протекает по уравнению:
На катоде разряжаются ионы водорода:
Суммарная реакция в ванне может быть представлена уравнением:
Следовательно, в ванне не должно происходить, заметного изменения кислотности.
Потери тока происходят вследствие частичного разряда ОН — и при малой концентрации СlO — 3 в конце процесса, становятся значительными. Для нормального хода электролиза необходимо поддерживать кислотность в пределах 0,1—0,15 г/л НСl. При избытке кислоты происходит химическое разложение хлората, возможен также разряд ионов хлора на аноде.
Анодным материалом может служить только платина, применяемая в виде тонкой фольги, проволоки или сетки или платинированный титан. Лучшими катодными материалами являются никель, нержавеющая сталь и графит. При использовании железных катодов рекомендуется во избежание восстановления вводить в электролит 0,5% Na2Cr2O7.
В исходном электролите содержится 500—700 г/л NaClO3. К концу электролиза содержание NaClO4 доходит до 900—1000 г/л (за счет увеличения молекулярного веса и отчасти испарения воды). Электролиз ведут при 30—60°С с анодной плотностью тока 3000—7000 а/м 2 и с катодной 1000—2000 а/м 2 . Начальный выход по току около 95%, к концу процесса при концентрации NaClO3 ниже 50 г/л выход по току падает до 40%. Средний выход по току составляет 85%. Напряжение на ванне при межэлектродном расстоянии 10 мм, температуре 40° С и анодной плотности тока 4000 а/м 2 равно около 6,0 в. Расход энергии при этих условиях 3000—3-200 квт • ч на 1 т NaClO4. Для получения KCl O4 проводят конверсию с хлоридом калия, а для получения NH4ClO4 рекомендуется вести обменное разложение с (NH4)2SO4, так как при использовании хлорида аммония одновременно с перхлоратом аммония выделяется NaCl.
В качестве анода можно использовать электролитически осажденную РbО2. С этой целью проводят электролиз раствора Рb (NO3 )2 с никелевым, угольным или танталовым (предварительно никелированным или платинированным) анодом. Во избежание катодного осаждения свинца к электролиту добавляют Сu(NO3)2. На аноде осаждается слой РbО2 толщиной около 3 мм. При использовании РbО2 в качестве анода для получения перхлоратов к раствору NaClO3 добавляют 0,5 г/л NaF и не вводят N а2Сr2O7. Анодную плотность тока поддерживают равной 1500 а/м 2 , а катодную 700 а/м 2 . Процесс протекает при напряжении 4,7—5,7 в с выходом по току 90%.
Наличие в перхлорате более 0,2% хлората значительно повышает его взрывоопасность. Поэтому стремятся к полному окислению хлората в перхлорат. При этом однако к концу процесса резко падает выход по току и на аноде выделяются значительные количества кислорода. Небольшой остаток хлората в электролите можно разрушить добавкой соляной кислоты.
Получение перхлората натрия возможно и непосредственно из раствора NaCl, перетекающего через каскад электролизеров.
Хлорную кислоту можно получить действием концентрированной соляной кислоты на твердый NaClO4:
При проведении этой реакции необходимо пользоваться перхлоратом с содержанием хлората не свыше 0,5%, в противном случае возникает опасность взрыва.
Хлорид натрия в этих условиях почти количественно выпадает в осадок.
Хлорную кислому можно получать и непосредственно электролизом. Еще в 1898 г. Габер и Гринберг показали, что хлорная кислота может быть получена на гладком платиновом аноде непосредственно электролизом разбавленных растворов соляной кислоты. При этом на аноде протекают одновременно реакции окисления молекул воды и ионов хлора, образования хлорноватой кислоты и окисления
СlO — 3 до СlO — 4. Последний процесс в зависимости от условий электролиза и концентрации соляной кислоты может протекать с выходом по току от 0 до 45— 50%). Сильное влияние на выход по току хлорной кислоты оказывает плотность тока. Как показали опыты К. Г. Ильина и Д..|П. Семченко, при анодной плотности тока 500 а/м 2 выход по току едва достигает 15%. а на аноде в основном выделяется хлор. С возрастанием плотности тока выход по току в расчете на хлорную кислоту возрастает, а при 4000 а/м 2 достигает 40—45%. Диаграмма баланса анодных реакций при этой плотности тока и температуре 25° С.
Выход по току данного продукта определяется величиной отрезка между линиями, ограничивающими поле этого продукта на перпендикуляре, восстановленном из точки, отвечающей концентрации соляной кислоты. Из рис. 196 следует, что при концентрации НСl 0,1 моль/л на выделение хлора расходуется примерно 25% тока, на выделение кислород; 30%, на образование НСlO4 —40% и на катодное восстановлен анодных продуктов — 5%,. Образования НСlO3 в этих условиях почти не происходит. Концентрация соляной кислоты также оказывает очень сильное влияние на характер анодных процессов. С ростом концентрации соляной кислоты большое развитие получает процесс выделения хлора, а доля тока, идущая на выделение кислорода, падает.
При средних концентрациях значительная часть тока расходуется на образование хлорноватой кислоты. Максимальный выход по току хлорной кислоты соответствует 0,1 н. раствору НСl. При более высоких и более низких концентрациях соляной кислоты выход по току хлорной кислоты падает, и, например, при 0,4 моль/л НСl практически становится равным нулю.
Для образования на аноде хлор ной кислоты требуется высокое перенапряжение выделения хлора и кислорода, чему способствует низкая температура электролита. Так, если в условиях описанных выше опытов поднять температуру при электролизе с 25 до 50° С, то выход по току хлорной кислоты уменьшится примерно в 2 раза.
Анодный потенциал процесса образования НСlO4 очень высок и достигает при плотности тока 4000 а/м 2 и температуре 20° С 3 ,4 в.
При длительной работе и непрерывном добавлении соляной кислоты возможно получение растворов, содержащих значительные концентрации хлорной кислоты.
Статья на тему Кислородные соединения хлора
Похожие страницы:
Содержание статьи1 ЧТО ТАКОЕ ЖЕЛЕЗНЕНИЕ1.1 Растворы для железнения1.2 Какие применяют аноды ЧТО ТАКОЕ ЖЕЛЕЗНЕНИЕ Железнение — это нанесение слоя железа.
ХЛОРИД НАТРИЯ ( Натрий хлор , поваренная соль , каменная соль ) NaCl . Получают из природных источников , соляные.
Кислородные соединения галогенов Галогены не соединяются непосредственно с кислородом, поэтому их кислородные соединения получаются только косвенным путем и представляют собой.
ХЛОРОВОДОРОД И СОЛЯНАЯ КИСЛОТА В лаборатории хлороводород получают действием серной кислоты на хлорид натрия: NaCl + H2SO4 = HCI +.
ЧТО ТАКОЕ КАДМИРОВАНИЕ Это нанесение на поверхность металлических изделий слоя кадмия. Кадмиевые покрытия (толщиной 7—20 мкм) защищают изделия (преим. стальные).
Что такое сульфат натрия Na2SO4 Получение сульфата натрия Получают при получении соляной кислоты из хлорида натрия с серной кислотой (.
Перхлора́т ка́лия, хлорноки́слый ка́лий — химическое соединение, калиевая соль хлорной кислоты с формулой K Cl O 4, очень сильный окислитель. Часто используется аббревиатура ПХК.
Содержание
Общие сведения
Бесцветное кристаллическое вещество, кристаллы имеют ромбическую (β-) форму. При 299,5 °C происходит переход в кубическую (α-) форму. Температура плавления 610 °C. Молекулярная масса 138,55 а. е. м.Плохо растворим в воде - 2,03 г на 100 г воды при 25 градусах Цельсия. Негигроскопичен, в отличие от почти всех перхлоратов.
Химические свойства
Перхлорат калия как окислитель может взаимодействовать с широким кругом горючих веществ, например, с глюкозой:

Применение
Основные способы применения перхлората калия связаны с его окисляющими свойствами:
- в фейерверках
- в твёрдых ракетных топливах
- в составе взрывчатых веществ — перхлоратитов
- в воспламенителях
- в хлопушках
- в петардах
В современных твёрдых ракетных топливах и взрывчатых веществах практически не используется, взамен него применяют перхлорат аммония. В медицине перхлорат калия используется, как средство от токсического зоба и как радиопротектор, выпускается в виде таблеток по 0,25 грамма.
Ссылки
-
(англ.)
- Источник: Иванов В.М., Семененко К.А., Прохорова Г.В., Симонов Е.Ф. Аналитическая химия натрия. -М.: Наука, 1986. C. 19.
- Соединения калия
- Взрывчатые вещества
- Ракетное топливо
- Перхлораты
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое "Перхлорат калия" в других словарях:
перхлорат калия — хлорнокислый калий … Cловарь химических синонимов I
Перхлорат натрия — Перхлорат натрия … Википедия
КАЛИЯ ЙОДИД — Действующее вещество ›› Калия йодид (Potassium iodide) Латинское название Kalii iodidum АТХ: ›› H03CA Препараты йода Фармакологические группы: Гормоны щитовидной железы, их аналоги и антагонисты (включая антитиреоидные средства) ›› Макро и… … Словарь медицинских препаратов
калия перхлорат — kalio perchloratas statusas T sritis chemija formulė KClO₄ atitikmenys: angl. potassium hyperchlorate; potassium oxide; potassium perchloride rus. калий хлорнокислый; калия перхлорат ryšiai: sinonimas – kalio tetraoksochloratas … Chemijos terminų aiškinamasis žodynas
Гексахлоростаннат(IV) калия — Общие Систематическое наименование Гексахлоростаннат(IV) калия Химическая формула K2[SnCl6] Физические свойства Состояние (ст. усл.) б … Википедия
Карбонат калия — Карбонат калия … Википедия
Дихромат калия — У этого термина существуют и другие значения, см. хромпик. Дихромат калия … Википедия
Читайте также:

