Карбидизация титана своими руками
Обновлено: 03.07.2024
Карбид титана является одним из перспективных аналогов вольфрама. Он не уступает последнему по физико-механическим свойствам, а изготовление этого соединения является более экономичным. Наиболее широко он применяется при производстве твердосплавного режущего инструмента, а также в нефтяном и общем машиностроении, авиационной и ракетной промышленности.
Описание и история открытия
Карбид титана занимает особое место среди соединений переходных металлов периодической системы химических элементов. Он отличается особой твердостью, жаростойкостью и прочностью, что и определяет его широкое применение в качестве основы для твердых сплавов, не содержащих вольфрам. Химическая формула этого вещества – TiC. Внешне оно представляет собой порошок светло-серого цвета.
Вам будет интересно: Станки для мебельного производства: виды, классификация, производитель, характеристика, инструкция по использованию, спецификация, установка и особенности эксплуатации
Вам будет интересно: Маркировка люминесцентных ламп: обозначение, классификация и расшифровка

Его производство началось в 20-е годы XX в., когда компании, занимающиеся выпуском лампочек накаливания, искали альтернативу дорогостоящей технологии изготовления вольфрамовых нитей. В результате был изобретен способ получения цементированного карбида. Данная технология была менее затратной, так как сырье – двуокись титана, было более доступным.
В 1970 г. началось применение нитрита титана, что дало возможность увеличить вязкость цементированных соединений, а добавки из хрома и никеля позволили повысить коррозионную стойкость карбида титана. В 1980 г. был разработан процесс спекания порошка под воздействием равномерного сжатия (прессования). Это позволило улучшить качество материала. Спеченные твердосплавные порошки в настоящее время применяются в тех областях техники, где требуется высокая устойчивость к температурам, износу и окислению.
Химические характеристики
Вам будет интересно: Легендарный нож НКВД - "финка"
Химические свойства карбида титана определяют его практическое значение в технике. Это соединение обладает следующими характерными особенностями:
- устойчивость к воздействию HCl, HSO4, H3PO4, щелочей;
- высокая коррозионная стойкость в щелочных и кислых растворах;
- отсутствие взаимодействия с расплавами цинка, основными видами металлургического шлака;
- активное окисление только при температурах свыше 1100 °C;
- смачиваемость расплавами стали, чугуна, никеля, кобальта, кремния;
- образование TiCl4 в среде хлора при t>40 °C.

Физико-механические свойства
Основными физико-механическими характеристиками данного вещества являются:
Получение
Производство карбида титана осуществляется несколькими методами:
- Углетермическим способом из диоксида титана и твердых науглероживающих материалов (68 и 32 % в смеси соответственно). В качестве последних чаще всего используют сажу. Сырье сначала спрессовывают в брикеты, которые затем помещают в тигель. Насыщение углеродом протекает при температуре 2000 °C в защитной атмосфере водорода.
- Прямой карбидизацией порошка титана при температуре 1600 °C.
- Псевдоплавлением – нагрев порошка металла с брикетами сажи по двухступенчатой схеме до 2050 °C. Сажа растворяется в расплаве титана, а на выходе получаются зерна карбида размером до 1 тыс. мкм.
- Воспламенением в вакууме смеси порошка титана и сажи (предварительно брикетированных). Реакция горения длится несколько секунд, затем состав охлаждают.
- Плазмохимическим способом из галогенидов. Этот метод позволяет получить не только твердосплавный порошок, но и покрытия, волокна, монокристаллы. Наиболее распространенной смесью является хлорид титана, метан и водород. Процесс ведется при температуре 1200-1500 °C. Поток плазмы создают с помощью дугового разряда или в высокочастотных генераторах.
- Из стружки титановых сплавов (гидрирование, измельчение, дегидрирование, насыщение углеродом или карбидизация с сажей).
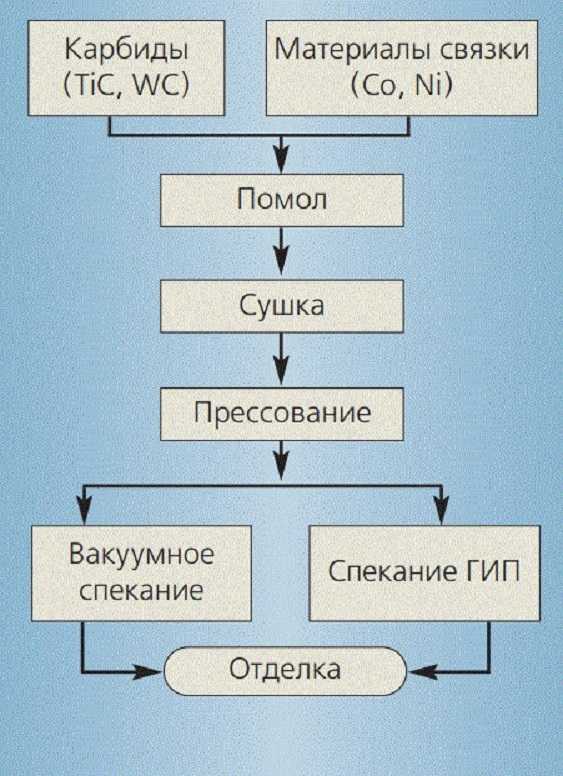
Продукт, изготовленный одним из этих способов, обрабатывают в размольных агрегатах. Измельчение в порошок производится до размеров частиц 1-5 мкм.
Волокна и кристаллы
Получение карбида титана в виде монокристаллов проводится несколькими способами:

Волокна получают путем осаждения хлорида титана в газовой среде (пропан, тетрахлорметан в смеси с водородом) при температуре 1250-1350 °C.
Применение карбида титана
Данное соединение используется в качестве компонента при изготовлении жаропрочных, жаростойких и твердых безвольфрамовых сплавов, износостойких покрытий, абразивных материалов.
Твердосплавные системы с карбидом титана применяются для производства следующих изделий:
- инструменты для обработки металлов резанием;
- детали прокатных станков;
- жаростойкие тигли, детали термопар;
- футеровка печей;
- детали реактивных двигателей;
- неплавящиеся сварочные электроды;
- элементы оборудования, предназначенного для перекачки агрессивных материалов;
- абразивные пасты для полировки и доводки поверхностей.

Детали изготавливают методами порошковой металлургии:
- спеканием и горячим прессованием;
- шликерным литьем в гипсовые формы и спеканием в графитовых печах;
- прессованием и спеканием.
Покрытия
Покрытия из карбида титана позволяют увеличить эксплуатационные характеристики деталей и одновременно сэкономить на дорогостоящих материалах. Для них характерны следующие свойства:
- высокая износостойкость и твердость;
- химическая стабильность;
- малый коэффициент трения;
- низкая склонность к холодной сварке;
- окалиностойкость.

Слой карбида титана наносится на основной материал несколькими способами:
- Осаждением из газовой фазы.
- Плазменным или детонационным напылением.
- Лазерной наплавкой.
- Ионно-плазменным напылением.
- Электроискровым легированием.
- Диффузионным насыщением.
На основе карбида титана и никелевых жаропрочных сплавов делают также кермет – композиционный материал, который позволяет увеличить износостойкость деталей в жидких средах в 10 раз. Использование этого композита перспективно для увеличения срока службы насосного оборудования и другой техники, к которым относятся нагнетательные штуцеры для поддержания пластового давления, факельные горелки, буровые долота, запорная арматура.
Карбидостали
Карбиды вольфрама и титана применяются для изготовления карбидосталей, которые по своим свойствам занимают промежуточное положение между твердыми сплавами и быстрорежущими сталями. Тугоплавкие металлы обеспечивают им высокую твердость, прочность и износостойкость, а стальная матрица – вязкость и пластичность. Массовая доля карбида титана и вольфрама может составлять 20-70 %. Такие материалы получают методами порошковой металлургии, указанными выше.

Карбидостали используются для производства режущего инструмента, а также деталей машин, работающих в условиях сильного механического и коррозионного износа (подшипники, зубчатые колеса, втулки, валы и другие).

Термодинамические расчеты показывают, что прежде всего будут происходить реакции карбидообразования. Процесс карбидообразования по суммарной реакции (6) протекает через образование ряда промежуточных оксидов, которые образуют непрерывный ряд твердых растворов с карбидом титана. Повышение температуры или понижение давления сдвигает равновесие системы Ti — TiCxOу — С — CO в сторону замещения кислорода углеродом. Практически чистый карбид титана может быть получен при атмосферном давлении и Температуре около 2430 °С. При давлении ниже 1000 Па и температуре выше 1300 °C достигается полное обескислороживание твердого раствора и выделяется металлический титан вследствие протекания реакции:

а также связанной с ней реакции (5), протекающей при этих условиях в левую сторону.
Металлический титан может быть получен восстановлением его диоксида углеродом при температуре около 3000 °С в вакууме по суммарной реакции:

Однако по указанным выше причинам металл всегда в значительной степени загрязнен углеродом, кислородом, а также азотом (последний попадает в печь вследствие подсосов и хорошо растворяется в системе Ti — О — Cl.
Процесс взаимодействия диоксида титана с молекулярным водородом протекает до образовании низших оксидов.
При 1050 °С диоксид титана восстанавливается водородом до Ti3O5 по реакции

Самый слабый восстановитель диоксида титана из числа рассматриваемых металлов — натрий Он начинает реагировать с диоксидом титана лишь при 900 °C и восстанавливает его только до низших оксидов.
Восстановление кремнием идет лучше, но при этом образуются сплавы кремния с титаном.
Восстановление диоксида титана магнием начинается уже при 575 °C и постепенно развивается до 750 °С, но при дальнейшем подъеме температуры протекает медленно. Равновесная концентрация кислорода в титане при контакте с MgO и жидким магнием составляет 1,6—2,8 % (по массе). Восстановлению магнием мешает образование твердых растворов MgO—TiO. В атмосфере водорода при температуре выше 600 °C восстановление магнием сопровождается образованием гидрида титана.
Наиболее сильным восстановителем является кальций. Свежеобразованный оксид кальция легко растворяется в разбавленных минеральных и органических кислотах и поэтому может быть сравнительно легко удален после процесса восстановления. Восстановление кальцием в инертной среде при атмосферном давлении начинается при 500 °С Равновесная концентрация кислорода в титане при контакте с CaO и жидким кальцием составляет 0,07 — 0,12 % (по массе) при температуре 900-1020 °C.
Титан получают кальциетермическим способом в стальном реакторе в среде аргона при 1000—1100 °C. Процесс протекает по реакции

Образующиеся одновременно с титаном твердый оксид кальция мешает кристаллизации металла, который вследствие этого получается в виде высокодисперсного порошка с крупностью частиц несколько микрометров. При дальнейшей гидрометаллургической переработке такой порошок сильно окисляется.
Для укрупнения кристаллов титана (до размера 100 мкм и более) и повышения полноты протекания процесса в шихту добавляют в качестве флюса вещества, растворяющие оксид кальция, например CaCI3 или BaCI2. Эти вещества, образуя с оксидом кальция легкоплавкую смесь, переводят ее в шлаки, что улучшает условия кристаллизации и спекания образующихся частиц титане.
Хлорид кальция, помимо растворения оксида кальция, оказывает на процесс другое положительное воздействие — он растворяет также металлический кальций. Это приводит к протеканию следующего процесса:

К недостаткам кальция как восстановителя прежде всего следует отнести значительную концентрацию в нем азота, который в основном переходит в титан. Дополнительное рафинирование кальция повышает его и без того высокую стоимость.
Гидрид кальция получают путам нагрева кусков кальция в токе сухого чистого водорода до 400—600 °С. Диоксид титана восстанавливают в атмосфере водорода при температуре около 1000 °C по реакции:

Процecc ведут в стельном аппарате, куда загружают смесь порошка гидрида кальция и диоксида титана.
В результате восстановления и последующей гидрометаллургической обработки получается тонкий порошок гидрида титана. Несмотря на то, что величина частиц порошка составляет 3—5 мкм, при гидрометаллургической переработке он окисляется в незначительной степени, так как гидрид титана обладает более высокой коррозионной стойкостью, чем титан.
Компактный титан получается при нагревании прессованных изделий или брикетов из гидрида титана до 600—1000 °C в вакууме. Полученный таким образом металл содержит существенно меньшее количество кислорода, чем исходный гидрид, так как оксиды титана частично восстанавливаются атомарным водородом. Недостаток способа — высокая стоимость кальция, так как для приготовления гидрида кальция необходимо употреблять рафинированный металл.
Алюминий привлекает к себе внимание как дешевый восстановитель. Многие сплавы титана содержат алюминий, что делает особенно заманчивым получение титана алюминотермическим способом. В этом случае отпадает необходимость полностью избавляться от примеси алюминия и появляется возможность вести процессе целью получении Ti—Al сплава или Ti—Al лигатуры.
Алюминотермическое восстановление диоксида титана освоено в промышленных масштабах применительно к получению ферротитана. Если этот процесс вести с предварительным подогревом шихты, то можно получить сплав с 25—27 % титана. Использование диоксид в при этом не превышает 55 %.
Процесс получения Ti — Al сплавов протекает по реакции:

Теплоты реакции не хватает для расплавления продуктов реакции, приходится подогревать шихту.
Сплав, богатый титаном (до 70 %), и с наименьшей концентрацией неметаллических примесей, можно получить алюминотермическим восстановлением диоксида титана с последующим экстрагированием алюминия из сплава металлами, которые можно легко отогнать: магнием, цинкомагниевым сплавом. Титан остается в твердом виде в смеси с жидким сплавом, который не удается слить полностью. Магний и цинк удаляют из оставшегося в титане сплава вакуумной сепарацией.
Для обогащения Ti—Al сплавов титаном может быть применена также отгонка алюминия через субхлорид. При температуре 1000 °C и выше в среда инертного газа над сплавом пропускают пары трихлорида алюминия. Процесс основан на известной реакции:

которая при высоких температурах протекает вправо, а при понижении температуры — в обратном направлении. По мере обогащении сплава титаном вместе с алюминием возгоняется также титан вследствие образовании его хлорида. Таким способом сплав может быть обогащен до концентрации титана 80 % Без значительных его потерь.
Из сплава, полученного алюминотермическим способом, титан может быть выделен путем электролиза: при этом получается металл приемлемого качестве. Недостаток этой схемы — сложность конструктивного оформления электролизера, который должен работать на небольших плотностях тока.
Ни одна из рассмотренных здесь схем одно- или двухстадийного восстановления пока не имеет промышленного применении.
структуру карбидных осадков, начиная от нитевидйьгх кристаллов, "усов" (очень низкие температуры и малые концентрации углеводородов в газовой смеси) и кончая грубыми, шероховатыми осадками, состоящими из отдельных правильно ограниченных монокристаллов относительно больших размеров (высокие температуры). Гладкие, мелкозернистые осадки получают при средних температурах (1000—1100 °С) и умеренных концентрациях углеводородов в газовой фазе.
В последнем случае на начальной стадии процесса на подложке образуются зародыши, которые, разрастаясь, сливаются в сплошное покрытие. В дальнейшем толщина покрытия растет, как указывалось выше, по параболическому закону.
Кристаллическая ориентация карбида титана на стадии зародыше-образования зависит от состава и состояния подложки. В частности, при использовании в качестве подложки пластин сплава ТТ10К8Б при температуре 1050 °С сначала в слое преобладает ориентация зерен с плоскостями (200), параллельными поверхности основы, а затем, начиная с толщины покрытия 5 мкм, с плоскостями (111) [184].
Основными производителями оборудования для процесса CVD являются: акционерное общество "Берна Олтен" (Швейцария) и фирма "Сиентифик коатингз" (США), которые предлагают целый ряд моделей установок [185]. На рис. 73 представлена схема установки для нанесения покрытий методом CVD.
Имеются три типа установок для нанесения покрытий: однокамерная колпаковая печь модели 1Н-1 (для нанесения покрытий с добавками или без добавок оксида алюминия); двухкамерная колпаковая печь модели 1Н-2; соединение двух колпаковых печей моделей 2Н-4 с четырьмя камерами. Все камеры имеют примерно одинаковые внутренние размеры: высота 900, диаметр 360 мм. Температура нанесения покрытий составляет 750—10'50°С в зависимости от материала покрытия; скорость осаждения 3 мкм/ч. Потребляемая мощность одной печи 50—60 кВт.
Акционерное общество "Райнебург-Гема" (Швейцария) предлагает новую систему Компыс-статик, предназначенную для нанесения порошковых покрытий методом CVD с микропроцессорным управлением [186].
Технология получения покрытий из карбида титана заключается в следующем: деталь, на которую необходимо нанести, покрытие, тщательно очищается и помещается в реактор для нанесения покрытия. Герметизированный реактор вакуумируется для устранения кислорода, который является вредной примесью, и заполняется защитным газом. После нагрева реактора с деталями до температуры нанесения покрытия защитная атмосфера заменяется химически активными газами. В процессе нанесения покрытия давление химически активных газов (например, метана) должно поддерживаться постоянным. В качестве побочного продукта образуется НС1, который необходимо постоянно удалять
Рис. 73. Схема установки для ванесеиия покрытий методом CVD:
1 - газ; 2 — печь; 3 - фильтр; 4 — испаритель; 5 — реактор; б — насос
и нейтрализовать в водном растворе NaOH. Понижение давления способствует десорбции хлористого водорода с поверхности детали, на которую наносится покрытие. После нанесения покрытия химически активные газы заменяются инертным газом и изделия охлаждаются до комнатной температуры. Для получения высококачественного слоя карбида титана необходимо использовать очень чистые (прежде всего по кислороду) газы с минимальным содержанием влаги. За одну загрузку обрабатывается большое количество деталей.
Покрытия на твердосплавном режущем инструменте 187
Зарубежные и отечественные твердосплавные предприятия непрерывно наращивают мощности по производству неперетачиваемых пластин с покрытиями на основе карбида титана. Например, в ФРГ объем производства неперетачиваемых пластин с покрытиями от общего выпус-
Изобретение относится к металлургии тугоплавких соединений. Способ получения карбида титана включает использование в качестве исходных компонентов субхлорида алюминия, тетрахлорида титана и углерода. Углерод подают на реакцию в форме порошка или нити. Синтез карбида титана проводят в две стадии. На первой стадии получают карбид алюминия из субхлорида алюминия и углерода при температуре 1100-1250°C. На второй стадии получают карбид титана из карбида алюминия и тетрахлорида титана при температуре 800-900°C. Изобретение позволяет повысить выход карбида титана, устранить стадию улавливания продукта из газового потока. 2 ил., 3 пр.


Формула изобретения
Способ получения карбида титана, включающий в себя использование в качестве исходных компонентов субхлорида алюминия, тетрахлорида титана и углерода, отличающийся тем, что углерод подают на реакцию в форме порошка или нити, а синтез карбида титана из него проводят в две стадии через получение на первой стадии карбида алюминия из субхлорида алюминия и углерода, и на второй стадии - карбида титана из карбида алюминия и тетрахлорида титана.
Описание изобретения к патенту
Изобретение относится к металлургии тугоплавких соединений, а именно к способу получения карбида титана.
Все известные способы синтеза карбида титана можно разделить на четыре группы. К первой, основной группе следует отнести карботермический синтез карбида титана восстановлением диоксида титана по реакции [Кипарисов С.С., Левинский Ю.В., Петров А.Л. Карбид титана: получение, свойства, применение / М.: Металлургия, 1987. - 216 с.]:
На практике карбидизацию оксида титана ведут при высокой температуре ~ 2000°C, что можно отнести к существенным недостаткам этого способа. При этой температуре смесь диоксида титана с сажей, спрессованная в брикеты, выдерживается в атмосфере водорода или аргона. Другим недостатком способа является наличие свободного углерода в продукте >1%, поскольку для исключения кислородсодержащих соединений твердофазную реакцию восстановления оксида титана ведут при стехиометрическом избытке углерода. Остающийся свободный углерод трудно извлечь из продукта. Кроме того, для твердофазных реакций необходимо предварительное очень тщательное механическое смешение двух реагентов, что также существенно удорожает процесс. Наконец, большинство карботермических способов синтеза TiC требует длительного (десятки часов) размола полученного продукта синтеза.
Общими недостатками для всех способов первой группы является относительно малая скорость химических превращений, характерная для большинства твердофазных реакций, высокая температура синтеза и необходимость тщательного перемешивания исходных реагентов.
К этой же группе синтеза следует отнести способ получения волокон карбида титана золь-гель методом с использованием вискозного волокна [Raman V., Dhakate S.R., Sahare p.D. Synthesis of titanium carbide whiskers (TiCW) through sol-gel process from rayon fibers // Journal of materials science letters. 2000, 19, P.1897-1898]. Изопропоксид титана Ti(OC 3 H 7 ) смешивают с изопропанолом и ацетилацетоном в мольном соотношении 1:2 чтобы подавить выпадение из раствора диоксида титана. Ацетилацетон образует с титаном растворимый хелатный комплекс. Смесь алкоксида титана, изопропанола и ацетилацетона в мольном соотношении 1:2:2 помешается в магнитную мешалку на 5 часов для получения золя TiO 2 , используемого далее для пропитки волокон вискозы, которые служат источником углерода. Весовое отношение алкоксида титана и вискозного волокна 2:1. Вискозные волокна пропитывались гелем TiO 2 , высушивались при 60°C и далее нагревались со скоростью 100-50 градусов в час под аргоном до температуры 1420°C, а затем охлаждались с такой же скоростью до комнатной температуры.
Недостатком этого способа, кроме указанных выше, является большая длительность общего времени синтеза TiC, доходящая до 30 часов и использование дорогостоящих химических реагентов.
Ко второй группе способов синтеза TiC следует отнести прямой синтез из элементного титана и углерода спеканием их при высокой температуре либо периодическим внепечным способом самораспространяющегося высокотемпературного синтеза (СВС), либо непрерывным способом в высокотемпературной печи. Так, известны СВС - способы получения TiC из смеси порошков титана и сажи. [Дрозденко В.А., Боровинская Н.И. и др. Патент RU 2038296 C1, 1995; Мержанов А.Г., Дрозденко В.А. и др. Патент RU 1570225 A1, 2003]. Недостатком этих способов является использование дорогостоящего титанового порошка, а так же аппаратурное оформление процесса, обуславливающее его периодичность и необходимость измельчения полученного компактного TiC.
Известны способы непрерывного получения TiC из смеси порошков титана и сажистого углерода [Александровский С.В., Мушков С.В. и др. Патент RU 2066700, 1996; Александровский С.В., Ли Д.В. Patent RU 2175988, 2001]. В нем синтез ведут в непрерывном режиме в герметичном реакторе, нагретом до 1000-1050°C. При этом объем реактора превышает объем загружаемой смеси титанового порошка и сажи в 250-500 раз. Как вариант, для повышения производительности исходную смесь предварительно выдерживают в вакууме. Недостатком является использование дорогостоящего порошка титана, низкая объемная производительность реактора и необходимость последующего измельчения полученного TiC.
К общим недостаткам способов второй группы можно отнести необходимость тщательного перемешивания исходных реагентов, измельчения полученного карбида титана и его высокую стоимость.
По химизму процесса к этой же группе можно отнести способ синтеза TiC взаимодействием титанового порошка с продуктами разложения метана или других газообразных углеводородов [Kim Y. - J., Chung K, Kang S. - J.L. In situ formation of titanium carbide in titanium powder compacts by gas-solid reaction // Composite: Part A 32 (2001) P.731-738]. В этом способе отпадает необходимость в перемешивании реагентов, поскольку один из них находится в газовой фазе, но выход карбида титана не превышает 30%, и он входит в состав композита Ti-TiC, что затрудняет его использование в соединениях, не содержащих элементный титан.
Известен способ синтеза карбида титана напылением углерода из материала анода в водородной плазме на поверхность титана, служащей катодом [Достовалов В.А., Гордиенко Н.С. и др. Патент RU 2424352, 2011]. Недостатками данного способа, кроме общих недостатков плазмохимических способов, являются: возможность получения только тонкой пленки карбида на поверхности титана, трудность равномерного покрытия поверхности сложной формы, низкая производительность, лимитированная в том числе скоростью эрозионных процессов на поверхности графитового анода.
Известен способ получения покрытий TiC осаждением титана из потока металлической плазмы, генерируемой вакуумно-дуговым разрядом в парах бензола [Быстрое Ю.А., Ветров Н.З., Лисенков А.А. Плазмохимический синтез карбида титана на медных подложках // Письма в ЖТФ, 2011, Т.37, вып.15, с.33-39].
К общим недостатком плазмохимических способов следует отнести сложность аппаратурного оформления и большие затраты электрической энергии, необходимые для поддержания химических превращений в плазме, а также использование водорода.
К четвертой группе способов синтеза карбида титана следует отнести металлотермические способы, в основе которых лежат обобщенные реакции:
mTiCl x +M n C m nMCl mx/n + m TiC
TiCl x +nM+CCl y nMCl (x+y)/n +TiC
На первой обобщенной реакции основан способ получения карбида титана с использованием карбида кальция (CaC 2 ) в качестве реагента M n C m (n=1, m=2) [Абрамов Д.С., Нечаев Н.И. и др. SU 1809586 А1, 2000]. Синтез осуществляют введением в расплав солей низших хлоридов титана и карбида кальция при температуре 700-800°C Недостатками этого способа является необходимость предварительного получения низших хлоридов титана, растворимых в солевых расплавах и дорогостоящего карбида кальция, а также неизбежность последующего измельчения полученного порошка.
На второй реакции основаны многочисленные способы магниетермического восстановления в расплаве смеси тетрахлорида титана и углерода [Александровский С.В., Мушков С.В. и др. Патент RU 2083708 С1, 1997; Александровский С.В. Патент RU 2130424 C1, 1999]. В них ПС получают восстановлением смеси тетрахлоридов титана и углерода (или TiCl 4 и C 2 Cl 4 [Александровский С.В., Ли Д.В., Сизяков В.М. Получение нанопорошков карбида титана магнивтермическим восстановлением смеси хлоридов // Известия вузов. Цветная металлургия. 2004, № 5, с.60-65]) магнием с последующей вакуумной сепарацией. В таком синтезе используют аппаратуру, предназначенную для получения титановой губки магниетермией. Как вариант, для облегчения измельчения полученного карбида титана до порошка требуемой крупности перед восстановлением смесь тетрахлоридов или магний насыщают водородом.
Недостатком способа является необходимость использования металлического магния, а также стадий вакуумной сепарации и измельчения полученного продукта.
Наиболее близким аналогом к заявляемому способу относится алюминотермический субхлоридный способ синтеза карбида титана смешением в газовой фазе субхлорида алюминия, тетрахлорида титана и безкислородного углеродсодержащего газа (например, углеводородов (C n H m ), хлоруглеводородов (C n H m Cl k ) или хлоруглеродов (CCl 4 , C 2 Cl 6 )) [Закиров Р.А., Парфенов О.Г., Пашков Г.Л. Субхлоридный синтез в металлургии титана // Доклады Академии Наук. - 2009. - Т.425. - № 5, С.631-633; Zakirov R.A., Parfenov O.G., Pashkov G.L. Subchloride Synthesis in Titanium Metallurgy // Doklady Chemistry, 2009, Vol.425, Part 2, P.77-79]. Синтез карбида титана, например, из углеводорода ведется из газовой фазы при температуре 1000K n H m n/3Al 4 C 3 +2n/3AlCl 3 +m/2Н 2
Или реагировать с элементным углеродом (n=1, m=0):
Углеродсодержащее вещество подают на реакцию в форме порошка, нити или пленки
Для синтеза предлагается использовать частицы термостойкого твердого углеродного вещества, например, сажи, угля, графита, графена, фуллерена или углеродных волокон. Попутно образующийся AlCl 3 возгоняется при T>180°C и практически не загрязняет твердый карбид алюминия.
Реакция (2) на поверхности углеродной частицы интенсивно протекает при температуре 1100-1250°C. При T 1250°C появляются технологические трудности защиты стенок реактора от химической эрозии.
На второй стадии при нормальном давлении осуществляется синтез карбида титана по реакции:
Температура в реакторе не превышает 900°C с тем, чтобы подавить попутное образование TiCl 3 , которое становится заметным уже при температуре 1000°C и выше, и сопровождается травлением титана в карбиде избыточным тетрахлоридом по реакции:
По завершении второй стадии остающийся карбид алюминия, адсорбированные остатки хлорсодержащих соединений и металлический алюминий, попавший в твердый продукт на первой стадии, удаляют отмывкой TiC в соляной кислоте.
Введение в реакцию на каждой стадии одного твердого и одного газофазного реагента избавляет от необходимости предварительного смешения реагентов и улавливания целевого продукта химической реакции из газового потока.
Полученный TiC, подвергался рентгеноструктурному и элементному анализу. Фотография растрового электронного микроскопа исходных частиц сажи и полученного порошка TiC представлена на рис.1. Размер агломератов частиц сажи, используемой для получения карбида алюминия, составляет около 30 мкм. Порошок синтезированного TiC состоял из агломератов ~10-20 мкм, объединяющих частицы размером 100÷300 нм. Примеси свободного углерода, алюминия, карбида алюминия, титана и алюминидов титана не превышали 0.1%, выход карбида титана по отношению к вводимому в систему тетрахлориду титана был не менее 90%. При введении в реакцию углеродных волоков вместо сажи получали волокна карбида титана с длиной и диаметром, близкими к длине и диаметру исходного углеродного волокна (рис.2).
Сущность предлагаемого изобретения поясняется примерами 1-3.
Примеры осуществления способа:
На первой стадии над ацетиленовой сажей массой 150 мг пропускались пары субхлорида алюминия в течение 60 минут при температуре 1250°C. Субхлорид подавался в трехкратном избытке относительно стехиометрии. В полученных частицах карбида алюминия свободный углерод не обнаруживался. На второй стадии полученный карбид алюминия выдерживался при температуре 900°C в парах четыреххлористого титана также в течение 60 минут. Полученный продукт отмывался в растворе соляной кислоты для удаления непрореагировавшего карбида алюминия и осевшего при диспропорциокировании алюминия. Выход карбида титана составлял 90%.
Первая стадия осуществляется при тех же параметрах, что и в примере 1. На второй стадии температура составляла 800°C. Понижение температуры второй стадии позволяет снизить скорость травления TiC четыреххлористым титаном и таким образом увеличить выход продукта и также предотвратить выделение свободного углерода. Выход карбида титана превышал 98%.
Режимы синтеза TiC выбирались как в Примере 2, но вместо сажи в реактор вводились углеродные волокна. В результате синтеза образовывались волокна в форме трубок карбида титана. Фотография волокон TiC с разным увеличением представлена на рис.2.
Читайте также:

