Как сделать химические элементы
Добавил пользователь Алексей Ф. Обновлено: 19.09.2024
— Юрий Цолакович, расскажите, пожалуйста, немного о том, как проходит синтез химических элементов в лабораторных условиях.
Давайте вернемся к синтезу. Вещество, из которого состоит Земля, возникло в результате Большого взрыва. А элементы, которые мы видим на Земле, появились во время становления и формирования нашей планеты. Этот процесс мы можем видеть и сейчас: если масса звезды больше массы Солнца, она эволюционирует определенным образом, и в конце концов мы наблюдаем так называемую вспышку сверхновой. Происходит синтез химических элементов, и все заканчивается возникновением нейтронной звезды. Вспышка длится несколько секунд. В нашей галактике такое происходит примерно один раз в тысячу лет, в других — чаще. Эти вспышки — это и есть космические лучи, выбросы вещества во Вселенную, которые регистрируются нашими детекторами. Так возникают элементы в природе.
— От водорода до урана, насколько я помню?
Сейчас мы, имея возможность сливать ядра, можем идти дальше и дальше, синтезируя все новые элементы.
— У Периодической таблицы есть границы? Есть предел элементов, которые можно синтезировать?
— Конечно. Все в мире имеет начало и имеет конец. А где границы таблицы и чем они определяются… Собственно, этот вопрос и был основным мотивом для меня заниматься этим делом. Мотив был подогрет еще тем, что само ядерное вещество, о котором я говорил, не аморфно, оно имеет внутреннюю структуру. Если она проявляется, можно продлить время существования ядра, до сверхтяжелых элементов.
— Продлить насколько?
— Знаете, есть такое научное предсказание: если уйти достаточно далеко от урана, то будет зона — остров — со сверхтяжелыми элементами, достаточно долгоживущими. В середине этого острова будут элементы, которые будут жить миллионы и даже миллиарды лет. А это уже интересно, потому что возраст Земли исчисляется миллиардами лет. Не значит ли это, что такие элементы надо искать в недрах Земли? Но искали везде, и в космосе, и в Земле… Не нашли. Ну, это ни о чем не говорит: может, они были, но распались, потому что время их жизни немного меньше. Но вот что касается острова стабильности — он был предметом интенсивных исследований с момента появления этой теории, с 1969 года.
— Вы правы, новые ядра штучны. Мы были счастливы, когда получали один атом в день, в неделю… Новая установка, конечно, увеличит это количество, возможно, в сотни раз, но этого все равно будет недостаточно для накопления видимого количества вещества.

Все, что нас окружает, мы сами, Земля, на которой мы живем, состоит из самых разнообразных веществ. А из чего состоят сами вещества? Ведь их можно дробить на более мелкие части, а те, в свою очередь, на еще более мелкие. Где предел такого деления? Что представляют собой частицы, которые дальше уже нельзя раздробить обычными способами? Над этими вопросами задумывались ученые еще в глубокой древности.
Атомное строение веществ
Первые представления об атомах как мельчайших, далее неделимых частицах веществ появились у философов Древней Греции еще за 400 лет до н. э. Они считали, что каждое вещество составлено из присущих только ему атомов, т. е. существуют атомы, например, мяса, песка, дерева, воды и т. д. Другими словами, сколько есть веществ, столько и видов атомов.
Доказательств существования атомов в то время, конечно, не было, и это учение было забыто почти на две тысячи лет. И только в самом начале XIX в. идея атомного строения веществ была возрождена английским ученым Дж. Дальтоном.
Согласно его теории все вещества состоят из очень маленьких частиц — атомов. В процессе химических превращений атомы не разрушаются и не возникают вновь, а только переходят из одних веществ в другие. Они являются как бы деталями конструктора, из которых можно собирать всевозможные изделия.
Атомы — мельчайшие, химически неделимые частицы.
Химические элементы
Общее число атомов во Вселенной невообразимо велико. Однако видов атомов сравнительно немного. Каждый такой определенный вид атомов называется химическим элементом.
Химический элемент — определенный вид атомов.
Позже, после изучения строения атома, вы узнаете более точное определение этого понятия.
Всего в настоящее время известно 118 химических элементов. Атомы одного и того же элемента имеют одинаковые размеры, практически одинаковое строение и массу. Атомы разных элементов различаются между собой, прежде всего, строением, размерами, массой и целым рядом других характеристик.
На заметку: Из 118 химических элементов в природе встречается только 92, а остальные 26 получены искусственно с помощью специальных физических методов.
Из атомов такого небольшого числа химических элементов построены все вещества, существующие в природе и полученные химиками в лабораториях. А это более 60 млн веществ. Все они представляют собой самые различные сочетания атомов тех или иных элементов. Так же, как из 33 букв алфавита составлены все слова русского языка, из атомов относительно небольшого числа элементов состоят все известные вещества.
Символы химических элементов
Каждый элемент имеет свое название и условное обозначение — химический символ (знак).
Химический символ (знак) — условное обозначение химического элемента с помощью букв его латинского названия.
Символы химических элементов состоят из одной или двух букв их латинских названий. Понятно, что вторая буква нужна, чтобы различать элементы, в названиях которых первая буква одинакова. Например, элемент углерод обозначается первой буквой С его латинского названия — Carboneum (карбонеум), а элемент медь — двумя первыми буквами Cu его латинского названия — Cuprum (купрум).
Современные символы и названия наиболее распространенных элементов, необходимые вам на начальном этапе изучения химии, приведены в таблице под спойлером.
| Название химического элемента | Химический знак элемента | Относительная атомная масса (округленная) |
| Азот | N | 14 |
| Алюминий | Al | 27 |
| Водород | H | 1 |
| Железо | Fe | 56 |
| Золото | Au | 197 |
| Калий | K | 39 |
| Кальций | Ca | 40 |
| Кислород | O | 16 |
| Кремний | Si | 28 |
| Магний | Mg | 24 |
| Медь | Cu | 64 |
| Натрий | Na | 23 |
| Ртуть | Hg | 201 |
| Свинец | Pb | 207 |
| Сера | S | 32 |
| Серебро | Ag | 108 |
| Углерод | C | 12 |
| Фосфор | P | 31 |
| Хлор | Cl | 35,5 |
| Цинк | Zn | 65 |
Если вы хотите познакомиться с названиями и символами всех химических элементов, загляните сюда. Там представлена периодическая система элементов, о которой вы узнаете позже.
Распространенность химических элементов в природе крайне неравномерна. Самый распространенный элемент в земной коре (слое толщиной 16 км) — кислород О. Его содержание составляет 49,13 % от общего числа атомов всех элементов. Доли остальных элементов показаны на рис. 28.

В организме человека на долю атомов кислорода приходится 65 % от массы тела, в то время как доля атомов углерода — 18 %, водорода — 10 %, азота — 3 % (см. рис. 29).

Во всей нашей Галактике почти 92 % от общего числа всех атомов приходится на долю водорода Н, 7,9 % — на долю гелия He и только 0,10 % — на атомы всех остальных элементов. Именно эти два самых легких элемента составляют основу звездной материи.
Краткие выводы урока:
- Атомы — мельчайшие, химически неделимые частицы.
- При химических реакциях атомы не исчезают и не возникают из ничего, а только переходят из одних веществ в другие.
- Каждый отдельный вид атомов называется химическим элементом. Он имеет свое название и обозначение — химический символ (знак).
- Атомы разных химических элементов различаются массой, размерами и строением.
Различные процессы, происходящие с веществами, сопровождаются разрывом и образованием различных связей. Чтобы представить происходящее в понятном виде используют специальные уравнения. С их помощью можно предсказать, что произойдёт при взаимодействии элементов даже без опытов. Это фактически отражение реакций в доступном виде. Существуют определённые правила, позволяющие решать химические уравнения, которые необходимо знать при изучении химии.
- Основные термины и понятия
- Виды химических реакций
- Окислительно-восстановительный процесс
- Классический алгоритм
- Решение методом полуреакций
- Использование онлайн-расчёта

Основные термины и понятия

Составление уравнений химических реакций невозможно без знания определённых обозначений, показывающих, как проходит реакция. Объединение атомов, имеющих одинаковый ядерный заряд, называют химическим элементом. Ядро атома состоит из протонов и нейтронов. Первые совпадают с числом атомного номера элемента, а значение вторых может варьироваться. Простейшими веществами называют элементы, состоящие из однотипных атомов.
Любой химический элемент описывается с помощью символов, условно обозначающих структуру веществ. Формулы являются неотъемлемой частью языка науки. Именно на их основе составляют уравнения и схемы. По своей сути они отражают количественный и качественный состав элементов. Например, запись HNO3 сообщает, что в соединении содержится одна молекула азотной кислоты, а оно само состоит из водорода, азота и кислорода. При этом в состав одного моля азотной кислоты входит по одному атому водорода и азота и 3 кислорода.
Символика элементов, условное обозначение, представляет собой химический язык. В значке содержится информация о названии, массовом числе и порядковом номере. Международное обозначение принято, согласно периодической таблице Менделеева, разработанной в начале 1870 года.
Взаимодействующие между собой вещества называются реагентами, а образующиеся в процессе реакции — продуктами. Составление и решение химических уравнений фактически сводится к определению результатов реакций, поэтому просто знать формулы веществ мало, нужно ещё уметь подбирать коэффициенты. Располагаются они перед формулой и указывают на количество молекул или атомов, принимающих участие в процессе. С правой стороны от химического вещества ставится индекс, указывающий место элемента в системе.
Записывают уравнения в виде цепочки, в которой указываются все стадии превращения вещества начиная с левой части. Вначале пишут формулы элементов в исходном состоянии, а затем последовательно их преобразование.
Виды химических реакций
Химические явления характеризуются тем, что из двух и более элементов образуются новые вещества. Уравнения описывают эти процессы. Впервые с объяснениями протекания реакций знакомят в восьмом классе средней образовательной школы на уроках неорганической химии. Ученикам демонстрируют опыты, в которых явно наблюдаются различия в протекании реакций.
Всего существует 4 типа химического взаимодействия веществ:

- Соединение. В реакцию могут вступать 2 простых вещества: металл и неметалл или неметалл и неметалл. Например, алюминий с серой образуют сульфид алюминия. Кислород, взаимодействуя с водородом, превращается в воду. Объединятся могут 2 оксида с растворимым основанием, как оксид кальция с водой: CaO + H2O = Ca (OH)2 или основной оксид с кислотным: CaO + SO3 = CaSO4.
- Разложение. Это процесс обратный реакции соединения: было одно вещество, а стало несколько. Например, при пропускании электрического тока через воду получается водород и кислород, а при нагревании известняка 2 оксида: CaCO3 = CaO + CO2.
- Замещение. В реакцию вступают 2 элемента. Один из них простой, а второй сложный. В итоге образуются 2 новых соединения, при котором атом простого вещества заменяет сложный, как бы вытесняя его. Условие протекания процесса: простое вещество должно быть более активным, чем сложное. Например, Zn + 2HCl = ZnCl2 + H2. Величину активности можно узнать из таблицы ряда электрохимических напряжений.
- Обмен. В этом случае между собой реагируют 2 сложных элемента, обменивающиеся своими составными частями. Условием осуществления такого типа реакции является обязательное образование воды, газа или осадка. Например, CuO + 2HCl = CuCl2 + H2O. Чтобы узнать, смогут ли вещества прореагировать, используют таблицу растворимости.
Основными признаками химических реакций является изменение цвета, выделение газа или образование осадка. Различают их по числу веществ, вступивших в реакцию и образовавшихся продуктов. Правильное определение типа реакции особо важно при составлении химических уравнений, а также определения свойств и возможностей веществ.
Окислительно-восстановительный процесс

Составление большинства реакций сводится к подбору коэффициентов. Но при этом могут возникнуть трудности с установлением равновесия, согласно закону сохранения массы веществ. Чаще всего такая ситуация возникает при решении заданий, связанных с расстановкой количества атомов в уравнениях окислительно-восстановительных процессов.
Под ними принято понимать превращения, протекающие с изменением степени окисления элементов. При окислении происходит процесс передачи атомом электронов, сопровождающийся приобретением им положительного заряда или ионом, после чего он становится нейтральным. При этом также происходит процесс восстановления, связанный с присоединением элементарных частиц атомом.
Для составления уравнений необходимо определить восстановитель, окислитель и число участвующих в реакции электронов. Коэффициенты же подбирают с помощью метода электронно-ионного баланса (полуреакций). Его суть состоит в установлении равенства путём уравнивания количества электронов, отдаваемых одним элементом и принимаемым другим.
Классический алгоритм
В основе решения задач этим методом — закон сохранения массы. Согласно ему, совокупная масса элементов до реакции и после остаётся неизменной. Другими словами, происходит перегруппировка частиц. Если рассматривать решение химического уравнения поэтапно, оно будет состоять из трёх шагов:
- Написания формул элементов, вступающих в реакцию с левой стороны.
- Указания справа формулы образующихся веществ.
- Уравнивания числа атомов с добавлением коэффициентов.
Перед тем как переходить к сложным соединениям, лучше всего потренироваться на простых. Например, нужно составить уравнение, описывающее взаимодействие двух сложных веществ: гидроксида натрия и серной кислоты. При таком соединении образуется сульфат натрия и вода.

Согласно алгоритму, в левой части уравнения необходимо записать реагенты, а в правой продукты реакции: NaOH + H2SO 4 → Na 2SO4 + H2O. Теперь следует уравнять коэффициенты. Начинают с первого элемента. В примере это натрий. В правой части содержится 2 его атома, а в левой один, поэтому необходимо возле реагента поставить цифру 2. Затем нужно уровнять водород. В результате получится выражение: 2 NaOH + H2SO 4 → Na2 SO4 +2H2O.
Ещё одним наглядным примером является процесс реакции тринитротолуола с кислородом. При их взаимодействии образуется: C7H5N3O6 + O2 → CO2 + H2O + N2. Исходя из того, что слева находится нечётное число атомов H и N, а справа чётное, нужно их уравнять: 2C7H5N3O6 + O2 → CO2 + H2O + N2.
Теперь становится понятным, что 14 и 10 атомов углерода и водорода должны образовать 14 долей диоксида и 5 молекул воды. При этом 6 атомов азота превратятся в 3. Итоговое уравнение будет выглядеть как 2C7H5N3O6 + 10,5O2 → 14CO2 + 5H2O + 3N2.
Перед тем как начинать тренировку по составлению уравнений, следует научиться расставлять валентность. Это параметр, равный числу соединившихся атомов каждого элемента. Фактически это способность к соединению. Например, в формуле NH3 валентность атома азота равна 3, а водорода 1.
Решение методом полуреакций
Алгоритм для решения примеров химических уравнений проще рассмотреть на конкретном задании. Пускай необходимо описать процесс окисления пирита азотной кислоты с малой концентрацией: FeS2 + HNO3. Решать этот пример необходимо в следующей последовательности:

- Определить продукты реакции. Так как кислота является сильным окислителем, сера получит максимальную степень оксидации S6+, а железо Fe3+. HNO3 может восстановиться до одного из двух состояний NO2 или NO.
- Исходя из состава ионов и правила, что вещества, переходящие в газовую форму или плохо растворимые, записываются в молекулярном виде, верным будет записать: FeS2 — Fe3+ + 2SO2−4. Гидролизом можно пренебречь.
- В записи уравнивают кислород. Для этого в левую часть добавляют 8 молекул воды, а в правую 16 ионов водорода: FeS2 + 8H20 — Fe3+ + 2SO2−4 + 16H+. Так как заряда в левой части нет, а в правой он равный +15, то серное железо должно будет отдать 15 электронов. Значит, уравнение примет вид: FeS2 + 8H20 — 15e → Fe3+ + 2SO2−4 + 16H+.
- Теперь переходят к реакции восстановления нитрата иона: NO-3 →NO. Для её составления нужно отнять у оксида азота 2 атома кислорода. Делают это путём прибавления к левой части 4 ионов водорода, а правой — 2 молекул воды. В итоге получится: NO-3 + 4H+ → NO + 2H2O.
- Полученную формулу уравнивают добавлением к левой части 3 электронов: NO-3 + 4H+ 3e → NO + 2H2O.
- Объединяют найденные выражения и записывают результат: FeS2 + 8H20 + 5NO-3 + 20H+ → Fe3+ + 2SO2−4 + 16H+ + 5NO + 10H2O.
Уравнение можно сократить на 16H + и 8H2O. В итоге получится сокращённое выражение окислительно-восстановительной реакции: FeS2 + 5NO - 3 + 4 H + = Fe3 + + 2SO 2- 4 + 5NO + 2H2O.

Такой алгоритм считается классическим, но для упрощения понимания лучше использовать способ электронного баланса. Процесс восстановления переписывают как N5+ + 3e → N2+. Степень же окисления составить сложнее. Сере нужно приписать степень 2+ и учесть, что на 1 атом железа приходится 2 атома серы: FeS2 → Fe3++ 2S6+. Запись общего баланса будет выглядеть: FeS2 + 5N5+ = Fe3+ + 2S6+ + 5N2+.
Пять молекул потратятся на окисление серного железа, а ещё 3 на образование Fe (NO3)3. После уравнения двух сторон запись реакции примет вид, аналогичный полученному с использованием предыдущего метода.
Использование онлайн-расчёта

Простые уравнения решать самостоятельно довольно просто. Но состоящие из сложных веществ могут вызвать трудности даже у опытных химиков. Чтобы получить точную формулу и не подбирать вручную коэффициенты, можно воспользоваться онлайн-калькуляторами. При этом их использовать сможет даже пользователь, не особо разбирающийся в науке.
Чтобы расстановка коэффициентов в химических уравнениях онлайн происходила автоматически, нужно лишь подключение к интернету и исходные данные. Система самостоятельно вычислит продукты реакции и уравняет обе стороны формулы. Интересной особенностью таких сайтов является не только быстрый и правильный расчёт, но и описание правил с алгоритмами, по которому выполняются действия.
Химия в Майнкрафт ПЕ
Ну, что же дальше? Думаю, не стоит долго "лить воду". Давайте приступим к самому важному.
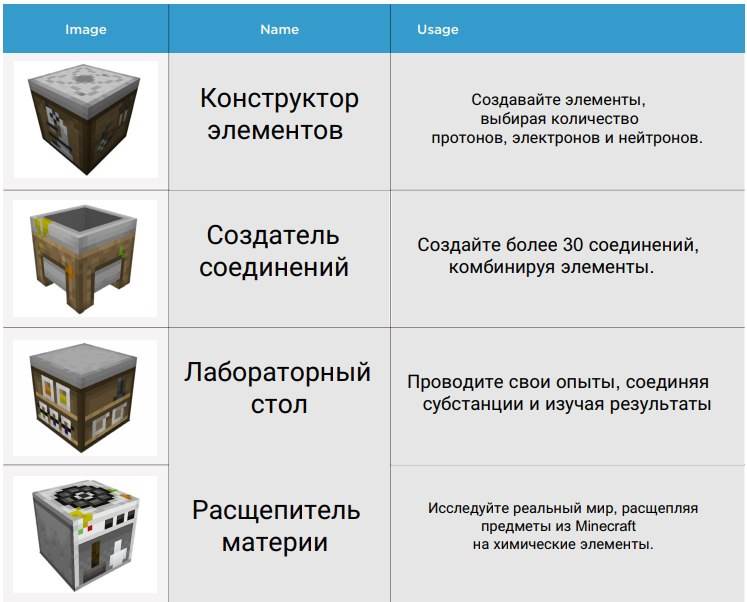
Для начала нам необходимо 4 вот таких вот стола.
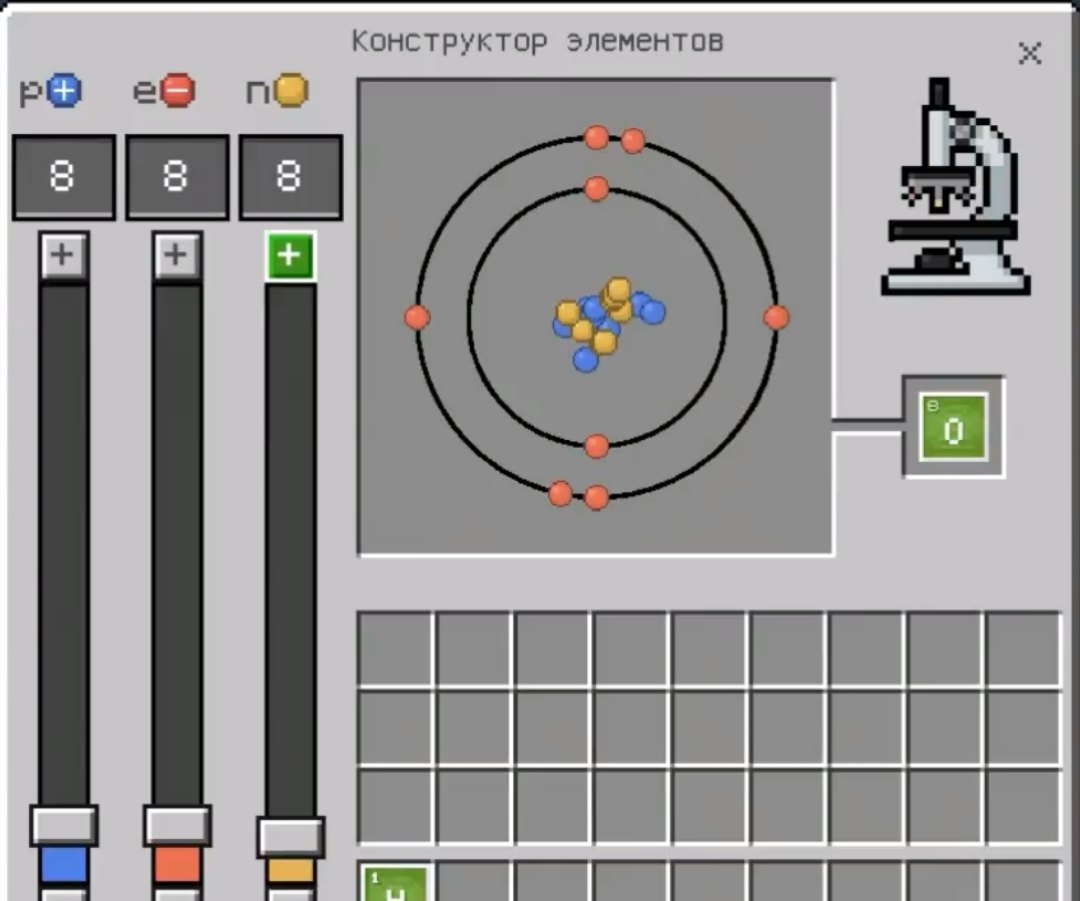
Теперь мы обсудим каждый из столов. Первый стол, о котором я бы хотел Вам рассказать — конструктор элементов. Этот стол создан для того, чтобы создавать различные элементы из химической таблицы Д.И. Менделеева. Чтобы создать нужный нам элемент, мы должны подобрать необходимое количество электронов, протонов и нейтронов при помощи ползунков слева. В данном случае я создал кислород, установив все значения на 8.
Теперь я расскажу Вам о лабораторном столе. На нем мы можем крафтить, используя соединения, созданные на столе под названием "создатель соединений". На самом деле, на нем можно скрафтить не очень большое количество предметов. Но все же, это тоже очень интересный объект. Его скриншоты я прикладывать не буду. Он довольно простой и также очень похож на обычный стол для крафтов.
Ну и наконец-то, самый интересный стол, который называется рассоединитель. Что же мы можем сделать при помощи него? Данный стол расщепляет самые различные предметы в Minecraft Pocket Edition. Смотрите, что я получил, рассоединив на нем блоки травы. Так что мы можем сделать вывод, что рассоединитель — это предмет, который дает нам еще один альтернативный способ получения химических элементов.
Но, это была лишь вводная часть нашего гайда. Дальше самое интересное.
Предметы, которые можно создать при помощи химии
Чтобы активировать бенгальский огонь, необходимо использовать долгое нажатие на экран. Также Вы можете держать бенгальский огонь в обоих руках. Теперь Вы можете праздновать Новый Год в Майнкрафт ПЕ еще более веселее.
Дорогие друзья. На самом деле можно расписать еще огромное количество различных предметов, которые Вы сможете создать в Minecraft Pocket Edition при помощи такой замечательной науки как Химия. Ожидайте еще огромное количество гайдов, в которых я расскажу Вам, что еще можно создать в МКПЕ благодаря химии. Делитесь данной информацией со своими друзьями и заходите на наш сайт, у нас Вы найдете огромное множество интереснейшей информации о MCPE.
Одной из новинок является воздушный шар. Вы можете использовать воздушный шар на мобах, чтобы те взлетали в воздух.
Еще одна новая функция — Лабораторный Стол, который в основном похож на таблицу крафта, но со своим собственным интерфейсом и функциями.

За исключением лабораторного стола, есть ещё несколько новых блоков:
Эта карта является руководством, которое научит Вас различным крафтам, рецептам и так далее.

Вы можете включить эти функции в своём мире, просто включив экспериментальные функции в настройках игры.
ИНТЕРЕСНЫЕ ХИМИЧЕСКИЕ СОЕДИНЕНИЯ
Привет, друзья мои. Как Вы уже знаете, совсем недавно, а именно несколько дней назад, вместе с новыми фичами для Bedrock Edition игры, в игру пришёл абсолютно новый раздел, который добавляет в игру предметы из химии. Да, теперь Вы можете изучать химию прямо в Minecraft, это выглядит очень даже забавно и самое главное — интересно.
Сегодня мы решили рассказать Вам о самых интересных соединениях. Самое главное — не забудьте одеть халат, тут будет опасно! Что-ж начнём.
ГЕЛИЕВЫЙ ШАРИК
Да, именно гелиевый шарик. Зачем? Ну…надо. Без лишних вопросов. Я тут учитель или Вы?!
Для крафта гелиевого шарика нам пригодится:
- Латекс — C5H8
- Краситель (любой, но фиолетовый лучше)
- Поводок
- Гелий (He)
Приступим к крафту. Чтобы изготовить Латекс нам нужно сделать вещество с формулой С5H8. Как мы поняли нам нужно пять углерода (C) и восемь водорода (H). Добыть их можно через Расщепитель Материи, ну а после объединить их в Создателе Соединений. Таких нам надо 6 штук. Когда мы получим Латекс, нам остаётся добыть лишь краситель и поводок (думаю, Вы знаете, где их найти). Также не забывайте про Гелий (He), он нам тоже пригодится.
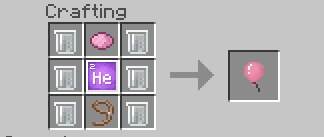
Вот вам и рецепт!
Как видно по скриншоту выше, рецепт не особо-то и трудный. Объедините их также, как и на рецепте и Вы получите шарик. Уиии!
БЕНГАЛЬСКИЙ ОГОНЬ
Вот то, что нам надобно:
- Любой хлорид, возьмём ртуть— HgCl2
- Обычная палка
- Магний (Mg)
Думаю, объяснять не надо зачем он нужен. Приступим к изготовлению. Для начала получите хлорид Вашего вещества. Да, всё там же, в Создателе Соединений и Расщепителе Материи. Возьмите все эти штуки и не забудьте про Магний (Mg), он очень даже нужен. Вот Вам рецепт, поставьте всё так как на рисунке и Ваша потенциальная угроза на Новый Год готова. Веселитесь!
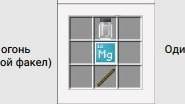
ВОТ ВАМ РЕЦЕПТ. КАЧЕСТВО НЕ ЛУЧШЕЕ, И ТАК СОЙДЁТ
ФАКЕЛА — РАЗНОЦВЕТНЫЕ И НЕ ОЧЕНЬ)
Факелы появились уже давным-давно, но всё ещё активно используются обществом. Ну а как же? Как бы Вы добывали свои алмазы в шахтах без освещения? Лампы? Вы пока активируете его Вас уже успеют съесть орды зомби. Так что — без факелов никуда!
Сегодня же мы создадим разноцветные и подводные факела. Давно мечтали об этом? Я тоже. Для этого нам пригодиться:
Чтобы изготовить разноцветный факел, нам нужен хлорид, но сначала нам надо определиться с цветом:
- Зеленый — хлорид вольфрама WCl3
- Сиреневый — хлорид магния MgCl2
- Красный — хлорид меркурия (ртути) HgCl2
- Синий — хлорид церия CeCl3
Теперь же, определившись с цветом, выбираем один из них. Делаем это всё там же. И.…момент истинны, добавляем палочку. Вуаля! Факелочки для Вашей вечеринки готовы. Ну, а для подводного факела нам надо соединить магний (Mg) и обычную палку. Готово! Факела для Вашей….подводной(?!) вечеринки готовы.


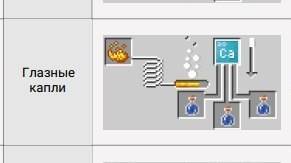
ГЛАЗНЫЕ КАПЛИ
Я уверен нам все 100%, Вы все до полуночи сидите и играете в Minecraft. Я ведь…не один такой, правда? И я уверен, что Ваши глаза просто умоляют о пощаде. Чтобы же достроить короб…Ваш дом и угодить своим глазам, я представляю Ваше вниманию — глазные капли!
Очевидно, в Minecraft они нужны для кое-чего другого, а именно лечения слепоты.
Для крафта нам понадобится:
Возможно, Вы уже привыкли ко всяким там Создателям Соединений и Расщепителям Материи и так далее. Но в этот раз мы вернёмся ко всеми нами уважаемому блоку — варочной стойке. Серьезно, после стольких лет…всегда.
Итак, берём сначала укропа….кхм, то есть, сделав неловкое зелье и засунув его в варочную стойку, просто добавьте туда немного кальция (Ca) и Ваш чудо-эликсир готов. Капайте себе в глаза и вперёд за приключениями.
МАЛО ЛИ КТО-ТО НЕ ПОНЯЛ…
АНТИДОТ
Специально для любителей старой классики или просто игр начала нулевых. Ибо в последний раз я встречал это слово, лишь играя в игру The Hobbit 2003 года. Прекрасные были времена!
Антидот получается посредством объединения таких вещей, как:
И снова всё надо пихать в варочную стойку. И, кстати, не забывайте, что после Combat Update Вам нужен огненный порошок в качестве топлива. Разместите пузырьки с неловким зельем снизу и начните варить серебро (Ag), спустя пару мгновений Ваш антидот готов. Выпейте его и он вылечит все Ваши отравления…сразу скажу: от диареи не помогает…пробовал.

…
Нуууу, думаю это всё, если же Вам вдруг это понравилось, то не забывайте ставить лайк. Возможно, скоро меня снова наймут и дадут денюшек за перевод, мы снова опубликуем очередное пособие по этому химическому обновлению. Но если так приглядеться, то оно достаточно лёгкое (говорит чел, который всё списал).
В общем желаю Вам успехов в изучении химии в Minecraft и в реальном мире, не получайте троек (у меня их уже 2) и играйте в своё удовольствие, но главное не долго, хотяя…после тех капель мне явно стало лучше.
Специальное образовательное издание Майнкратфа, созданная для школ, Minecraft Education Edition уже радует многих. Узнай о крутых фишках Эдукатион Эдишн на андроиде и способах похимичить!

Официальный релиз на ПК произошел 1 ноября 2016 года, а в сентябре 2018 года данное издание появилось в издании Minecraft Bedrock Edition и Windows 10 Edition. Ниже в статье мы подробно расписали как включить Minecraft Education Edition и его основные отличия от обычной мобильной версии!
Отличия Minecraft Education Edition от Bedrock Edition
В большинстве своем, данная версия не сильно отличается от обычной версии игры, но в ней был добавлен ряд элементов, нацеленных именно на обучение игрока.

- Во-первых, появились разные привилегии: преподаватель и ученик. У них несколько разный функционал, расскажем об этом позднее.
- Во-вторых, появилось два новых моба: NPC и Агент, обладающие новыми функциями. С помощью первого можно открывать пособия и гиперссылки, с помощью этого учитель сможет объяснять ученикам новый материал. В то время как Агент используется для практики игроков в программировании: с помощью специального интерфейса игроки могут запрограммировать Агента на выполнение различных задач.
Наверняка, каждый знает о таком блоке, как барьер, с помощью него вы можете ограничить проход в не желаемые зоны другим игрокам.
В Образовательном Издании появилась улучшенная версия данного блока, граница. Настроив границу вы предотвратите выход игроков за её территорию. Но при этом, учителя спокойно смогут выходить за её территорию. Огромный потенциал как для обучения, так и для создания своих карт.

Все вышеописанное никак вас не заинтересовало? Вероятно, это потому что там очень мало возможностей. Именно поэтому и появилось химическое обновление, которое кардинально изменило геймплей игры!
Химическое обновление
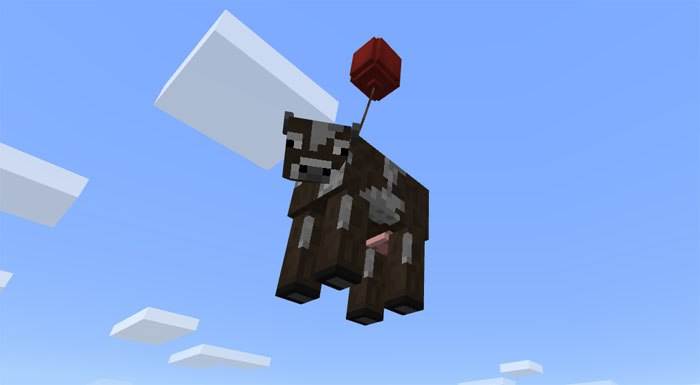
Единственное обновление chemistry education для данной версии добавило в игру возможность химичить. Были добавлены многие химические элементы, теперь вы можете создать воздушный шар, с помощью которого вы можете поднимать себя и мобов вверх.
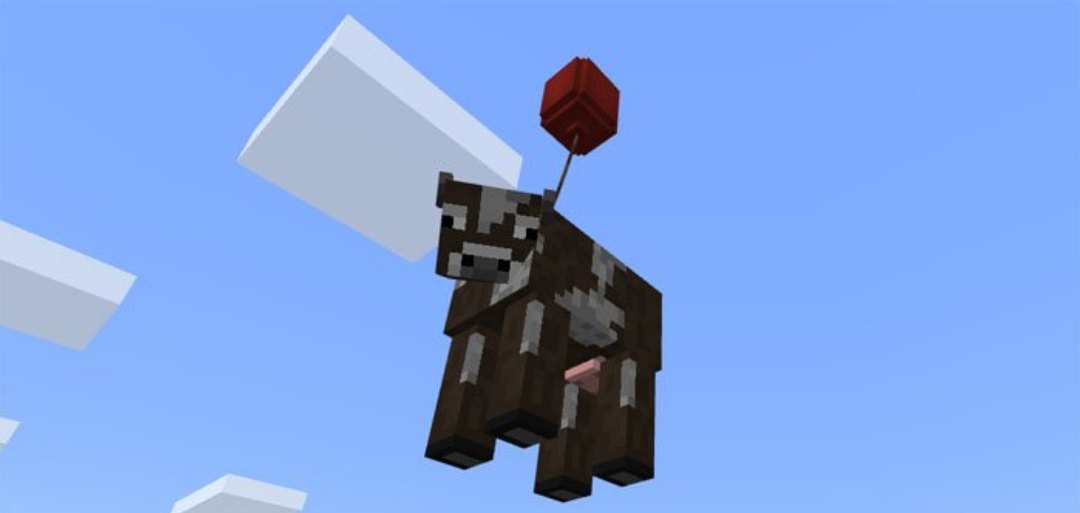
По скриншоту с летающей коровой сложно понять, что и как в этом обновлении, поэтому Редакция сделала для вас небольшой гайд, с помощью которого вам будет куда легче понять Химическое обновление, особенно если вы не проходили Химию в школе.
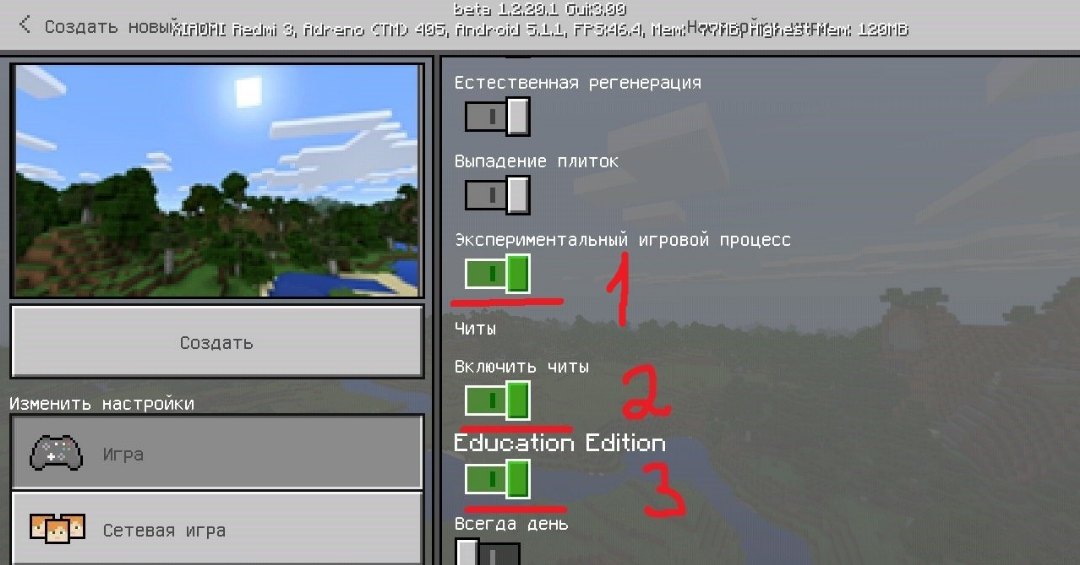
Как включить Химию в Майнкрафт ПЕ?
Для того, чтобы химическое обновление работало, не надо его скачивать, вам всего лишь потребуется установить версию не ниже Майнкрафт ПЕ 1.2.20. Создайте новый мир, установив настройки генерации, как на скриншоте ниже:
Весь химический процесс происходит за четырьмя столами, скрафтить их в выживании невозможно, но в креативе они находятся рядом друг с другом и найти их не составит труда.

Следующий стол позволяет вам скрещивать, а если быть точнее, то соединять элементы. Так например из двух элементов водорода и одного кислорода мы сможем получить воду!

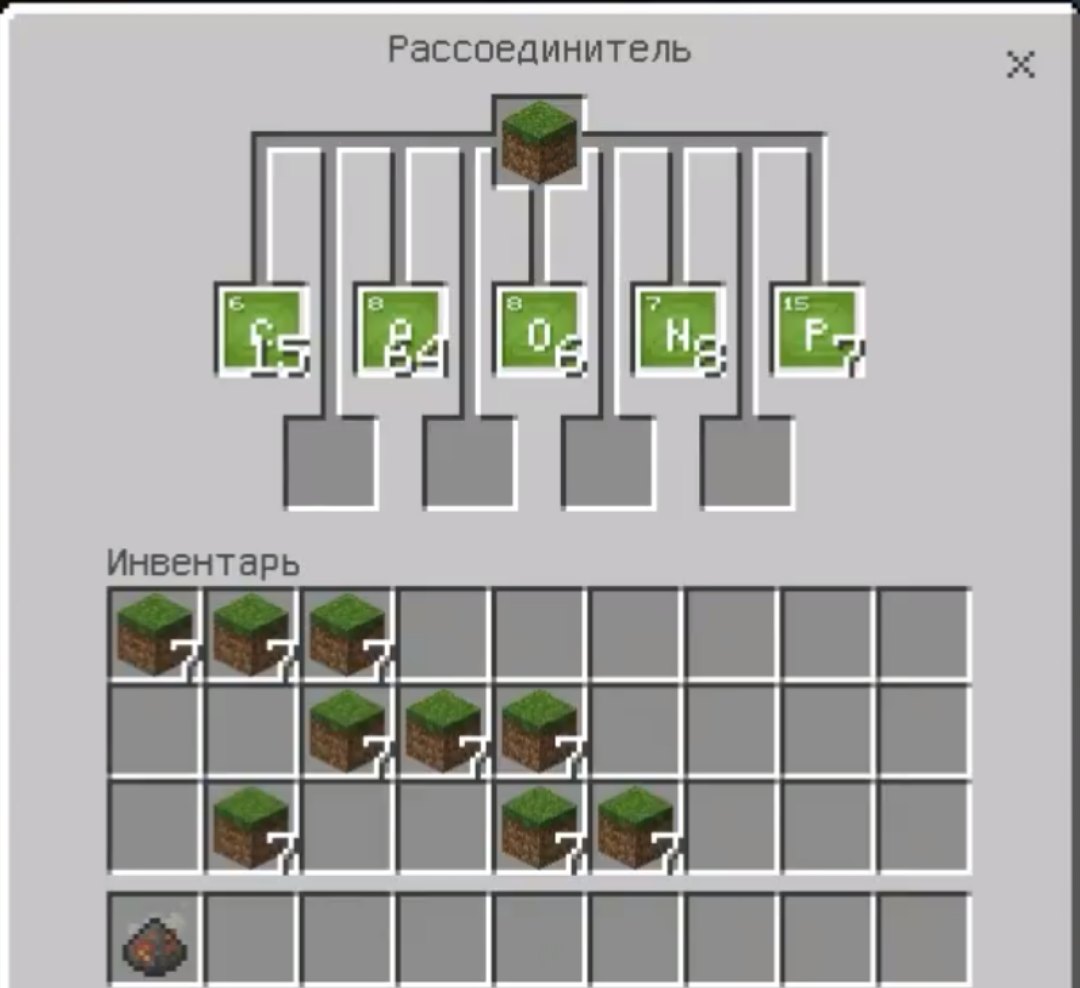
Альтернативным способом получить элементы является рассоединитель: он позволяет получить химические элементы из уже существующих блоков. Вот например, на картинке снизу я расщепил блок земли и получил из него большое количество химических элементов.
Если вы решили, что на этом функционал новой версии заканчивается, то вы очень сильно ошибаетесь. Все новые рецепты появятся в книге крафтов.
Как сделать воздушный шарик в Майнкрафт Эдукатион Эишн?
Сейчас я расскажу вам, как скрафтить с помощью химических элементов воздушный шарик.
- Для начала скрафтите 8 молекул кислорода и 5 молекул Углерода, а также одну молекулу гелия.
- После этого в создателе соединений вам потребуется создать латекс, обладающий формулой C5H8.
- Теперь нам потребуется самый обычный верстак , на котором вам нужно выложить следующий рецепт крафта.
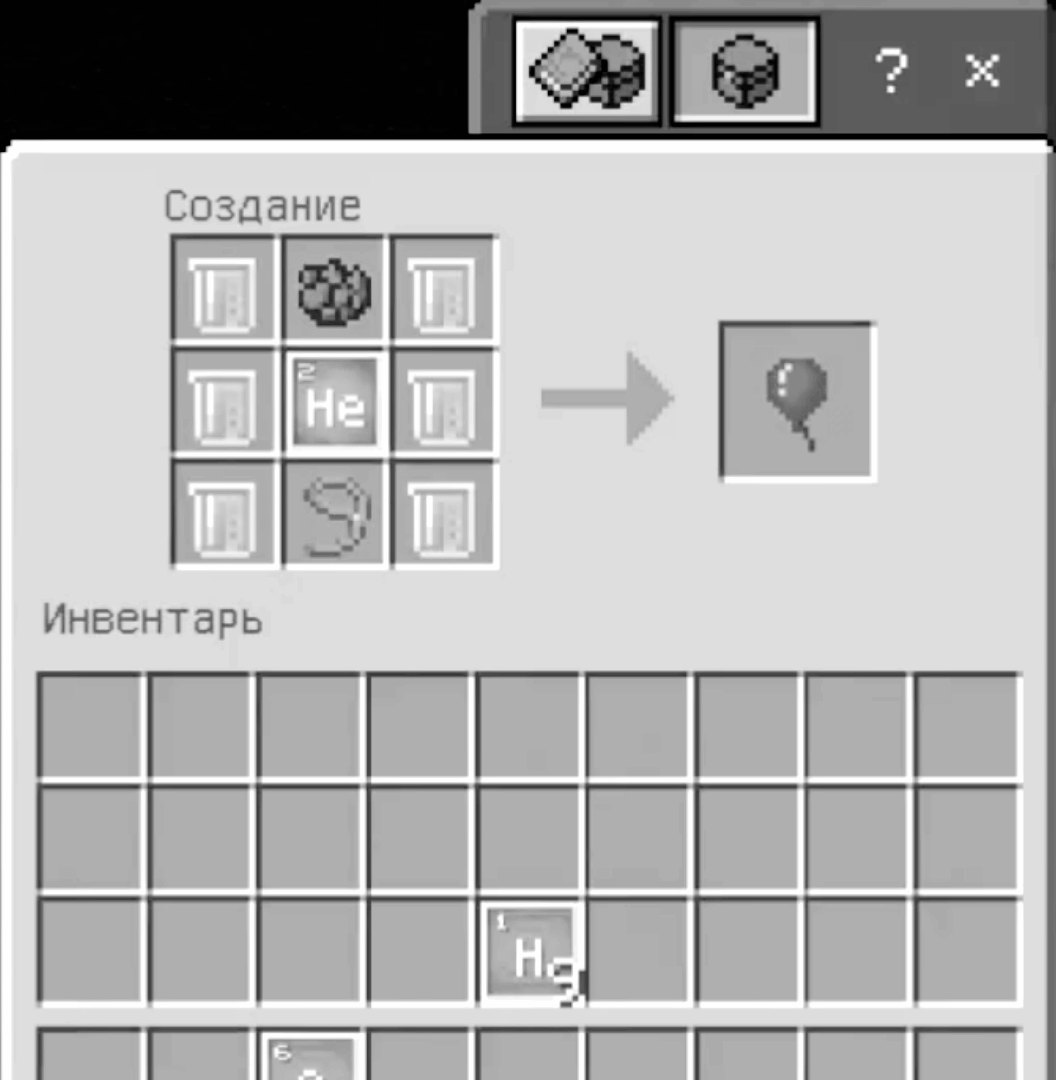
Привязав данный шар к любому дружелюбному мобу он взлетит. Вот такая простая химия.
Карта для Minecraft Education Edition
Читайте также:

