Как сделать укол траумель в предплечье
Добавил пользователь Алексей Ф. Обновлено: 28.09.2024
Рассмотрены подходы к патогенетической терапии остеоартроза с применением препаратов, хорошо изученных в ходе клинических исследований и обладающих доказанной безопасностью длительного применения.
Mechanisms of Zeel T preparation effect on pathogenic processes underlying development of osteoarthrosis
The article focuses on approaches to pathogenic therapy of osteoarthrosis using preparations which were thoroughly studied during clinical trials and which were proven to be safe for long-term application.
Дегенеративно-дистрофические заболевания суставов и позвоночника занимают первое место по распространенности среди всех заболеваний опорно-двигательной системы. Остеоартроз (ОА) — дегенеративно-дистрофическое заболевание суставов, при котором проявления вторичного (реактивного) синовита, хондрита, остеита, преимущественно субхондральной костной ткани, и воспалительного процесса в периартикулярных мягких тканях почти постоянно имеют место. Боли в суставах, позвоночнике и околосуставных мягких тканях встречаются более чем у 30% населения земного шара и классифицируются как ревматические болезни. На долю остеоартроза (артроза) приходится 60–70% всех заболеваний суставов, артрозом болеют 10–12% населения, поражение околосуставных мягких тканей составляет 25% первичных обращений к ревматологу.
Частота заболеваний нарастает с возрастом. Наиболее распространенным заболеванием суставов является деформирующий остеоартроз, наблюдающийся в 97% особенно у лиц старше 65 лет. Согласно данным центров по контролю и профилактике заболеваний США (Center for Disease Control and Prevention, CDC), распространенность артрита и хронических заболеваний суставов в разных возрастных группах составляет: 18–44 лет — 19%, 45–64 лет — 42%, старше 65 лет — 59%. После 50 лет артроз встречается у 27,1%, а после 70 лет — у 90% населения. При этом в последние годы отмечается уменьшение возраста начала заболевания. Опрос респондентов старше 40 лет показал, что более половины из них (71%) страдает от болей в суставах в возрасте 40–49 лет, 52,3% констатируют суставные боли и даже у 20-летних они встречаются в 4% случаев.
Несмотря на огромное количество исследований, посвященных лечению артроза, по мнению ряда авторов, большинству больных (до 75%) лечение не приносит выраженного облегчения, и качество их жизни остается неудовлетворительным. В повседневной практике наибольшее распространение для купирования болей и воспаления получили нестероидные противовоспалительные средства (НПВС). При медикаментозном лечении остеоартроза необходимо учитывать, что речь идет главным образом о длительном применении препаратов, причем чаще — у старших возрастных групп пациентов. Кроме того, одновременный прием нескольких лекарственных препаратов повышает риск побочных эффектов в 3,5 раза. Поэтому растет актуальность поиска новых методов и лекарственных препаратов, предназначенных для терапии ОА, которые не только купировали бы симптоматику заболевания, но и активно действовали на патогенез ОА. К числу таких препаратов, хорошо изученных в ходе клинических исследований и обладающих доказанной безопасностью длительного применения, относится и препарат Цель Т.
Лечение препаратом Цель Т относится к патогенетической терапии, так как обладает не только противовоспалительным эффектом, но и направлено на коррекцию механизмов патологии. Так, органные компоненты обеспечивают восстановление хрящевой ткани, растительные ингредиенты оказывают комплексное противовоспалительное и обезболивающее действие, сера и гидрид кремнезема участвуют в метаболизме хряща, а биокатализаторы активируют клеточное дыхание и окислительно-восстановительные процессы в тканях, тем самым улучшая их регенерацию и нормализуя обмен веществ.
В настоящее время в научном мире признана важная роль субклинического хронического воспаления в патогенезе ОА [16]. Острая стадия воспалительного процесса, как правило, начинается внезапно, в течение нескольких часов, и сопровождается классическими симптомами (покраснением, повышением температуры пораженных структур, отеком и дальнейшим нарушением функций). При этом фиксируется повышение уровня нейтрофилов, а также провоспалительных медиаторов — ИЛ-1 и ФНО-α. Было отмечено, что при развитии ОА отмечается положительная ассоциация повышения уровня ИЛ-1, ФНО-α, ИЛ-6, ИЛ-7, ИЛ-17 и ИЛ-18 и поражения хрящевой ткани, что ведет к дальнейшему развитию ОА [15, 17, 18].
Напротив, хроническое воспаление может развиваться в течение длительного времени и продолжаться несколько недель, месяцев и даже лет. Маркеры хронического воспаления (например, С-реактивный белок) могут быть повышены у пациентов с ОА и опосредованы ИЛ-6 — основным цитокином, выделяемым макрофагами [19]. ИЛ-6 также может играть важную роль в процессе ангиогенеза, что является еще одним фактором, влияющим на патогенез ОА [20, 21].
Результат острого воспалительного процесса заключается в устранении действия патогенного фактора и вызванных им нарушений, а также в восстановлении тканей до первоначального состояния. При хроническом воспалении эти процессы могут протекать параллельно, но сустав не возвращается в первоначальное состояние даже после окончания острого воспаления. Кроме того, при хроническом воспалении увеличивается количество макрофагов и лимфоцитарных инфильтратов. Таким образом, хроническое воспаление можно рассматривать как ошибочную попытку со стороны хондроцитов, направленную на устранение поражения и восстановление тканей.
Некоторые ферменты, например циклооксигеназа (ЦОГ) и липооксигеназа (ЛОГ), являются катализаторами воспалительных реакций, продуцируя медиаторы воспаления и боли. ЦОГ отвечает за продукцию липидных медиаторов (в том числе, простагландинов, простациклина и тромбоксанов) (рис. 1).
Различают две основные формы циклооксигеназы: ЦОГ-1 экспрессируется в большинстве клеток, а ЦОГ-2 продуцируется воспалительными агентами (такими как цитокины) [22]. Основное количество простагландина Е2 (ПГE2) синтезируется из арахидоновой кислоты с помощью фермента ЦОГ-2 и конечных Е-синтаз простагландина [23, 24]. ПГE2 является субстанцией с выраженным сосудорасширяющим действием, в результате чего жидкость попадает из сосудов в окружающие ткани, приводя к образованию отеков. ПГE2 считается основным медиатором воспаления и боли [23, 25].
ЛОГ отвечает за продукцию лейкотриенов, которые являются липидными сигнальными молекулами, синтезированными также из арахидоновой кислоты. В качестве примера можно привести лейкотриен B4 (ЛТB4), который синтезируется из 5-ЛОГ. Этот лейкотриен привлекает лейкоциты, также участвующие в патогенезе воспалительного ответа.
Помимо прямого участия в патогенезе воспаления, данные медиаторы (простагландины и лейкотриены) в пораженном ОА суставе снижают порог восприятия боли, тем самым усиливая существующий болевой синдром [26].
Традиционно для купирования болевого синдрома в пораженных суставах назначаются НПВС, действие которых направлено на ингибирование активности ЦОГ. НПВС первого поколения (например, напроксен) были неселективными и ингибировали как ЦОГ-1, так и ЦОГ-2. Однако ингибирование ЦОГ-1, широко представленной в разных клетках и вырабатывающей простагландины, защищающие желудок и почки от поражений [22], как предполагается, приводит к развитию серьезных побочных эффектов, характерных для неселективных НПВС. Препараты второго поколения (например, целекоксиб, вальдекоксиб) селективно действуют только на ЦОГ-2.
Однако ингибирующее действие НПВС на ЦОГ-2 связано с повышением активности 5-ЛОГ (так как в основе данного процесса лежит использование одного и того же субстрата — арахидоновой кислоты) и, следовательно, повышением его доступности для 5-ЛОГ, что приводит к активации продукции лейкотриенов [6]. Усиленная продукция лейкотриенов ведет к развитию язвенной болезни желудка [34], а также увеличению спазмов гладких мышц дыхательных путей и ассоциированных с ними сосудов, повышая риск и частоту астматических приступов [27, 28].
Кроме того, повышение уровня ЛТB4 ассоциировано с хроническими воспалительными заболеваниями суставов (например, ревматоидным артритом); оно поддерживает воспалительный процесс и разрушение суставных структур при данной патологии [28].
В отличие от обычных НПВС и селективных ингибиторов ЦОГ-2, препарат Цель Т обладает модулирующим действием как на каскады ЦОГ-1 и ЦОГ-2, так и на 5-ЛОГ [6]. Как показывает клинический опыт, подобное двойное ингибирование позволяет купировать боль и воспаление, при этом избегая поражения структур пищеварительного тракта [29]. Двойное ингибирование позволяет избежать сдвига каскада арахидоновой кислоты в сторону усиленной продукции лейкотриенов и поражения слизистой оболочки желудка [28], что наблюдается при ингибировании только каскада ЦОГ.
Проведенные исследования показали наличие у препарата Цель Т и его отдельных растительных ингредиентов выраженного действия на каскады ЦОГ/ЛОГ [6, 8]. В первой работе (R. Jaggi и соавт.) в условиях in vitro изучалась способность препарата Цель Т и его компонентов ингибировать синтез ЛТB4 ферментом 5-ЛОГ и ингибировать синтез ПГE2 ферментами ЦОГ-1 и ЦОГ-2. При этом действие препарата Цель Т на каскад ЦОГ оценивали путем инкубации с очищенным ферментом ЦОГ-1 и иммуноферментного анализа для измерения продукции ПГE2, а действие на 5-ЛОГ оценивали путем инкубации и иммуноферментного анализа для измерения продукции ЛТB4. По результатам работы было показано, что препарат Цель Т обладает ингибирующим действием на продукцию ЛТB4, IC50 составляет 10 мкг/мл, а также ингибирующим действием на продукцию ПГE2 очищенными ферментами ЦОГ-1 (IC50 = 50 мкг/мл) и ЦОГ-2 (IC50 = 60 мкг/мл), ингибируя также синтез ПГE2 по данным клеточного анализа (IC50 = 10 мкг/мл). Также было выяснено, что некоторые растительные компоненты препарата Цель Т сами ингибируют синтез ЛТB4 ферментами 5-ЛОГ, в том числе экстракты Arnica montana (IC50 = 20 мкг/мл), Sanguinaria canadensis (IC50 = 2 мкг/мл), Rhus toxicodendron (IC50 = 5 мкг/мл). Сера в составе препарата Цель Т также ингибирует синтез ЛТB4, по данным исследования, на 45%. Ряд растительных компонентов препарата Цель Т ингибирует продукцию ПГE2 ферментами ЦОГ: Arnica montana (IC50 = 80 мкг/мл), Sanguinaria canadensis (IC50 = 40 мкг/мл), Rhus toxicodendron (IC50 = 20 мкг/мл), Solanum dulcamara (IC50 = 40 мкг/мл) ингибируют продукцию ПГE2 очищенными ферментами ЦОГ-1. Arnica montana (IC50 = 110 мкг/мл), Sanguinaria canadensis (IC50 = 50 мкг/мл), Rhus toxicodendron (IC50 = 20 мкг/мл), Solanum dulcamara (IC50 = 150 мкг/мл) также ингибируют продукцию ПГE2 очищенными ферментами ЦОГ-2.
Таким образом, проведенное в условиях in vitro исследование подтвердило наличие у препарата Цель Т двойного механизма ингибирования каскадов 5-ЛОГ и ЦОГ (ЦОГ-1 и ЦОГ-2). Растительные компоненты препарата Цель Т — Arnica montana, Sanguinaria canadensis, Rhus toxicodendron — достоверно ингибируют как 5-ЛОГ, так и ЦОГ-1 и ЦОГ-2 каскады воспалительной реакции. Компонент Solanum dulcamara ингибирует активность ферментов ЦОГ-1 и ЦОГ-2 (хотя во втором случае его действие не столь выражено), но не ингибирует 5-ЛОГ.
Отдельное исследование H. Tunon и соавт. [8] было посвящено только оценке действия экстракта Solanum dulcamara на синтез простагландинов и индуцированного фактором активации тромбоцитов (ФАТ) экзоцитоза в условиях in vitro. Для этого действие экстракта Solanum dulcamara изучалось с помощью методов химического анализа. Исследование подтвердило, что экстракт Solanum dulcamara характеризуется выраженным противовоспалительным действием, основанным на ингибировании биосинтеза простагландинов и ФАТ-индуцированного экзоцитоза.
К числу других факторов, поддерживающих развитие ОА, относится образование новых кровеносных сосудов, которое является обязательной частью эмбрионального развития, но редко встречается у взрослых организмов, за исключением некоторых попыток организма по реконструкции и регенерации пораженных тканей, как в случае с ОА. Медиаторы воспаления могут прямо или косвенно стимулировать ангиогенез. Воспалительные клетки, отвечающие за этот эффект, включают макрофаги и тучные клетки, которые присутствуют в синовиальной оболочке при ОА. Макрофаги, как правило, находятся там, где развивается аномальный ангиогенез, например при синовите и опухолях. Ангиогенез может играть важную роль в активации или поддержании воспаления, но не при его запуске. С другой стороны, ангиогенез может быть самоподдерживающимся, поскольку он увеличивает воспалительную клеточную инфильтрацию и тем самым увеличивает число клеток, секретирующих ангиогенные факторы, такие как фактор роста сосудистого эндотелия (VEGF) и фактор роста фибробластов (FGF-1) [20, 21].
Васкуляризация хряща, обычно не имеющего сосудов, костно-хрящевого стыка является особенностью развития ОА. При росте человека ангиогенез необходим для нормального эндохондрального окостенения, чтобы закрыть длинные трубчатые кости. Этот процесс опосредован фактором роста сосудистого эндотелия, который секретируют гипертрофированные хондроциты. При остеоартрите рост остеофитов на границе сустава также происходит в процессе костно-хрящевого окостенения. В хрящевое продолжение суставной поверхности проникают кровеносные сосуды, и окостенение начинается от субхондральных структур [20].
Наличие у препарата Цель Т антиангиогенного действия и его отличная переносимость делают его идеальным вариантом для лечения хронического воспаления, наблюдаемого при ОА.
Сангвинарин, алкалоид, выделенный из корня Sanguinaria canadensis, является одним из компонентов препарата Цель Т и известен своим антиангиогенным действием: он подавляет базальный и VEGF-индуцированный рост новых сосудов. Согласно исследованиям G. Bassini и соавт. [9, 10], сангвинарин достоверно (p
А. А. Марьяновский, доктор медицинских наук, профессор
ГБОУ ВПО РНИМУ им. Н. И. Пирогова МЗ РФ, Москва
Активные компоненты: Arnica montana (Arnica) (арника монтана (арника)) D2 2,2 мкл, Calendula officinalis (Calendula) (календула оффициналис (календула)) D2 2,2 мкл, Hamamelis virginiana (Hamamelis) (гамамелис виргиниана (гамамелис)) D1 0,22 мкл, Achillea millefolium (Millefolium) (ахиллея миллефолиум (миллефолиум)) D3 2,2 мкл, Atropa bella-donna (Belladonna) (атропа белла-донна (белладонна)) D2 2,2 мкл, Aconitum napellus (Aconitum) (аконитум напеллус (аконитум)) D2 1,32 мкл, Mercurius solubilis Hahnemanni (меркуриус солубилис Ганемани) D6 1,1 мкл, Hepar sulfuris (Hepar sulfuris calcareum) (гепар сульфурис (гепар сульфурис калькареум)) D6 2,2 мкл, Chamomilla recutita (Chamomilla) (хамомилла рекутита (хамомилла)) D3 2,2 мкл, Symphytum officinale (Symphytum) (симфитум оффицинале — (симфитум)) D6 2,2 мкл, Beilis perennis (беллис переннис) D2 1,1 мкл, Echinacea (эхинацея) D2 0,55 мкл, Echinacea purpurea (эхинацея пурпурея) D2 0,55 мкл, Hypericum perforatum (Hypericum) (гиперикум перфоратум (гиперикум)) D2 0,66 мкл;
Вспомогательные компоненты: натрия хлорид для установления изотонии около 9 мг/мл, вода для инъекций до 2,2 мл.
Описание
Фармакотерапевтическая группа
Код АТХ
Фармакологическое действие
Многокомпонентный гомеопатический препарат, действие которого обусловлено компонентами, входящими в его состав.
Показания
Препарат применяется в комплексной терапии при вывихах, растяжениях, переломах костей, отёках мягких тканей после операции и травм, воспалительных процессах различных органов и тканей, особенно опорно-двигательного аппарата (тендовагинит, бурсит, стилоидит, эпикондиллит, периартрит), артрозах.
Противопоказания
Повышенная индивидуальная чувствительность к компонентам препарата. Известная повышенная чувствительность к Achillea millefolium (Тысячелистник обыкновенный), Chamomilla recutita (Ромашка аптечная), Calendula officinalis (Ноготки лекарственные), Beilis perennis (Маргаритка многолетняя), Echinacea (Эхинацея), Arnica montana (Арника горная) или иным растениям семейства сложноцветных. Туберкулез, лейкозы, коллагенозы, рассеянный склероз, синдром приобретенного иммунного дефицита, вирус иммунодефицита человека и другие аутоиммунные заболевания. Возраст до 12 лет в связи с недостаточностью клинических данных.
Применение при беременности и в период грудного вскармливания
Применение препарата возможно, если ожидаемая польза для матери превышает потенциальный риск для плода и ребёнка. Необходима консультация врача.
Способ применения и дозы
По 1-2 ампуле 1-3 раза в неделю внутримышечно, околосуставно.
Курс лечения 4-5 недель. Кратность применения и длительность курса назначает врач.
Примечание: рекомендуется одновременный прием нескольких лекарственных форм препарата (например, таблетки или капли вместе с мазью и инъекциями).
Как вскрыть ампулу?
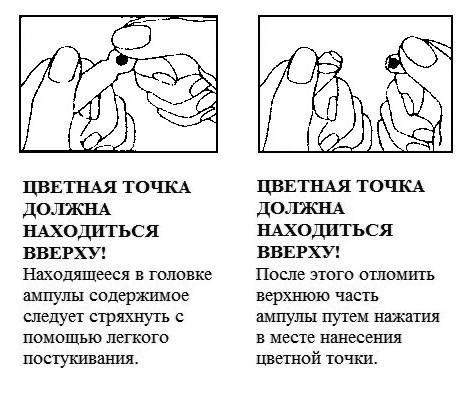
Побочное действие
Возможны аллергические реакции. Очень редко появление красноты, припухлости, зуда в месте инъекции. Также в редких случаях повышенное слюноотделение после приёма препарата. При обнаружении побочных эффектов необходимо прекратить прием препарата и проконсультироваться с врачом.
Передозировка
До настоящего времени о случаях передозировки не сообщалось.
Взаимодействие с другими лекарственными средствами
Назначение комплексных гомеопатических препаратов не исключает использование других лекарственных средств, применяемых при данном заболевании.
Особые указания
При приёме гомеопатических лекарственных средств могут временно обостряться имеющиеся симптомы (первичное ухудшение). В этом случае, а также при появлении побочных эффектов, следует прекратить применение препарата и проконсультироваться с врачом.
Активное вещество:
1 ампула содержит: Arnica montana (Arnica) (арника монтана (арника)) D2 2,2 мкл, Calendula officinalis (Calendula) (календула оффициналис (календула)) D2 2,2 мкл, Hamamelis virginiana (Hamamelis) (гамамелис виргиниана (гамамелис)) D1 0,22 мкл, Achillea millefolium (Millefolium) (ахиллея миллефолиум (миллефолиум)) D3 2,2 мкл, Atropa bella-donna (Belladonna) (атропа белла-донна (белладонна)) D2 2,2 мкл, Aconitum napellus (Aconitum) (аконитум напеллус (аконитум)) D2 1,32 мкл, Mercurius solubilis Hahnemanni (меркуриус солубилис Ганемани) D6 1,1 мкл, Hepar sulfuris (Hepar sulfuris calcareum) (гепар сульфурис (гепар сульфурис калькареум)) D6 2,2 мкл, Chamomilla recutita (Chamomilla) (хамомилла рекутита (хамомилла)) D3 2,2 мкл, Symphytum officinale (Symphytum) (симфитум оффицинале (симфитум)) D6 2,2 мкл, Bellis perennis (беллис переннис) D2 1,1 мкл, Echinacea (эхинацея) D2 0,55 мкл, Echinacea purpurеа (эхинацея пурпурея) D2 0,55 мкл, Hypericum perforatum (Hypericum) (гиперикум перфоратум (гиперикум)) D2 0,66 мкл
Вспомогательные вещества:
Натрия хлорид для установления изотонии около 9 мг/мл, вода для инъекций до 2,2 мл.
Описание:
Бесцветная прозрачная жидкость без запаха.
Форма выпуска:
Раствор для внутримышечного и околосуставного введения гомеопатический. По 2,2 мл в ампулы из бесцветного стекла гидролитического класса 1. На каждую ампулу нанесены насечка и цветная точка. По 5 ампул укладывают в открытую пластиковую контурную ячейковую упаковку. По 1 открытой пластиковой контурной ячейковой упаковки с 5 ампулами помещают вместе с инструкцией по применению в пачку картонную.
Противопоказания
Повышенная индивидуальная чувствительность к компонентам препарата. Известная повышенная чувствительность к Achillea millefolium (Тысячелистник обыкновенный), Chamomilla recutita (Ромашка аптечная), Calendula officinalis (Ноготки лекарственные), Bellis perennis (Маргаритка многолетняя), Echinacea (Эхинацея), Arnica montana (Арника горная) или иным растениям семейства сложноцветных. Туберкулез, лейкозы, коллагенозы, рассеянный склероз, синдром приобретенного иммунного дефицита, вирус иммунодефицита человека и другие аутоиммунные заболевания. Возраст до 12 лет в связи с недостаточностью клинических данных.
Показания к применению
Препарат применяется в комплексной терапии при вывихах, растяжениях, переломах костей, отеках мягких тканей после операции и травм, воспалительных процессах различных органов и тканей, особенно опорно-двигательного аппарата (тендовагинит, бурсит, стилоидит, эпикондиллит, периартрит), артрозах.
Взаимодействие с другими лекарственными средствами
Назначение комплексных гомеопатических препаратов не исключает использование других лекарственных средств, применяемых при данном заболевании.

Нестероидные противовоспалительные препараты используются достаточно широко для подавления воспалительных процессов в организме. НПВП доступны в различных формах выпуска: таблетки, капсулы, мази. Они обладают тремя основными свойствами: жаропонижающими, противовоспалительными и болеутоляющими.
Лучший нестероидный противовоспалительный препарат может подобрать только врач, отталкиваясь от индивидуальных особенностей пациента. Самолечение в данном случае может быть чревато развитие серьезных побочных реакций или же передозировки. Предлагаем ознакомиться со списком препаратов. Рейтинг разработан на основании соотношения цена-качество, отзывов пациентов и мнения специалистов.
Как работают НПВП?

Нестероиды ингибируют агрегацию тромбоцитов. Терапевтические свойства объясняются блокадой фермента циклооксигеназы (ЦОГ-2), а также снижением синтеза простагландина. По мнению специалистов они оказывают влияние на симптомы заболевания, но не устраняют причину его возникновения. Поэтому не следует забывать о средствах, с помощью которых должны быть устранены первичные механизмы развития патологии.
Если у пациента обнаружена непереносимость НПВП, тогда они заменяются лекарствами других категорий. Часто в таких случаях применяют комбинацию противовоспалительного и болеутоляющего средства.
- при ревматических болях;
- при воспалительных заболеваниях;
- при дегенеративных процессах в организме.
Как показывает практика, нецелесообразно заменять одно лекарство другим той же группы, если при приеме обнаруживается недостаточный терапевтический эффект. Удвоение дозы может привести только к клинически незначительному увеличению воздействия.
- дисфункции кишечника;
- внутреннее кровоизлияние;
- язва желудка и двенадцатиперстной кишки;
- отек нижних конечностей и лица;
- повышение артериального давления;
- аллергические реакции.
- Капсулы или таблетки следует запивать большим количеством воды (не менее 200 мл). Таким образом, предотвращается разрушение слизистой оболочки желудка.
- Не рекомендуется принимать два разных препарата в один и тот же день. В противном случае побочные эффекты могут увеличиваться без повышения эффективности.
- Прежде чем принимать лекарства, нужно внимательно прочитать инструкцию.
Классификация НПВП

Нестероидные противовоспалительные средства классифицируются в зависимости от того, являются ли они селективными для ЦОГ-2 или нет. Таким образом, с одной стороны, есть неселективные НПВП, а с другой – селективные ЦОГ-2.
Таблица - Условная классификация на 4 группы по механизму действия
ацетилсалициловая кислота (низкие дозы).
Неселективные ингибиторы ЦОГ
Преимущественно селективные ингибиторы ЦОГ-2
Высокоселективные (специфические) ингибиторы ЦОГ-2
Альтернативный вариант: хондропротекторы, назначаются при наличии серьезных противопоказаний. Они также эффективны против суставных патологий и остеохондроза, не оказывая на внутренние органы и системы отрицательного действия. Хондропротекторы снижают необходимость в использовании парацетамола и НПВП.
Рейтинг нестероидных противовоспалительных препаратов

НПВП нового поколения широко используются в различных областях медицины в качестве терапевтических средств. Их назначают в терапии патологических процессов в области суставов, т. к. действующие и вспомогательные компоненты не разрушают хрящевые структуры.
Предлагаем список нестероидных противовоспалительных препаратов нового поколения, которые обладают избирательным действием. Они эффективно справляются с поставленными задачами, но могут вызвать побочные реакции. Именно поэтому рекомендована предварительная консультация с врачом. Без врачебного контроля принимать НПВП можно не более 3 дней подряд.
Открывает список нестероидных противовоспалительных препаратов для суставов. Производное фенилпропионовой кислоты находится на первом месте среди лучших НПВП. Таблетки используются для лечения всех видов боли, в том числе тех, которые возникают в контексте артрита или артроза. По данным Всемирной Организации Здравоохранения, это лекарство доступно во всем мире и считается одним из самых безопасных среди аспирина, парацетамола и др.
Активное вещество ингибирует фермент, так называемую циклооксигеназу, которая превращается в простагландины и тромбоксаны (вещества, которые вызывают воспаление мышечных тканей). Уменьшает выделение таких веществ, что делает его эффективным для облегчения дискомфорта, вызванного воспалением.

Производитель: Борисовский завод медицинских препаратов, Республика Беларусь
Г.А. Батищева, О.А. Мубаракшина, М.Н. Сомова, Д.В. Пешехонов
Воронежский государственный медицинский университет им. Н.Н. Бурденко, Воронеж
Остеоартроз – наиболее часто встречающееся заболевание суставов и обусловлен рядом различных факторов. По использованию традиционной терапии остеоартроза накоплен значительный клинический опыт, однако большинство назначаемых лекарственных препаратов имеет ряд нежелательных побочных эффектов и противопоказаний к применению. Использование антигомотоксических препаратов во многом решает эту проблему, что было подтверждено в рандомизированном контролируемом исследовании MOZArT. Данные исследования свидетельствуют, что сочетанное применение препаратов Цель Т и Траумель С может рассматриваться как эффективный метод купирования болевого синдромов при остеоартрозе коленного сустава. Несомненным преимуществом данного подхода к лечению является высокая безопасность терапии.
ОА является многофакторным заболеванием. Относительная значимость факторов риска и взаимодействие между ними могут варьироваться в зависимости от пораженного сустава, различных стадий заболевания и индивидуальных особенностей организма пациента [3].
Факторы риска развития ОА:
- Возраст. Биологические изменения в результате старения (уменьшение мышечной силы, истончение хряща, нарушенная проприоцепция) снижают способность сустава справляться с негативными факторами внешней среды [4].
- Пол. У женщин вероятность наличия ОА выше, чем у мужчин, и заболевание протекает тяжелее [4, 5].
- Генетические факторы. К основным, способствующим развитию ОА относятся генетические факторы. Результаты ряда исследований показали, что предрасположенность к ОА передается по наследству [6].
- Питание. Множественные механизмы усвоения питательных веществ могут оказывать воздействие на развитие ОА и включать защиту от оксидативного стресса и комплексную модуляцию воспалительных реакций [7].
- Расовая/этническая принадлежность. Распространенность ОА и модели локализации (суставы, пораженные ОА) варьируются в различных расовых и этнических группах. Исследования показали различия (обычно в сторону увеличения) распространенности ОА коленного сустава среди чернокожих по сравнению с белым населением и среди азиатов по сравнению с белым населением [6, 8].
- Ожирение – давно признанный фактор риска развития ОА, в особенности ОА коленного сустава. Есть данные, свидетельствующие о связи ожирения с потерей и повреждением хряща, что повышает вероятность развития ОА [9].
- Травмы являются одним из важнейших факторов риска ОА. Особенно актуален этот фактор риска для коленного сустава: разрыв связок и другие травмы суставных структур тесно связаны с ранним началом ОА [10].
- Профессиональная деятельность. Существуют подтверждения, будто профессии, требующие постоянных наклонов либо сгибания коленного сустава на протяжении длительного времени, представляют риск развития ОА коленного сустава, особенно в случае работы, требующей избыточного стояния на коленях, сидения на корточках, подъема по лестнице или подъема грузов [6, 7].
- Анатомические особенности. Слабость мышц, поддерживающих коленный сустав, может повысить вероятность развития ОА коленного сустава или ухудшить его течение. Любое отклонение от нейтрального или коллинеарного положения бедра, колена и лодыжки влияет на распределение нагрузки на коленный сустав [6, 7].
- Слабость связок. Потенциальным фактором риска коленного ОА является нестабильность коленного сустава. В ряде случаев варусно-вальгусная нестабильность коленного сустава, не пораженного артритом, при ОА предшествует развитию заболевания [1, 7].
Дегенеративные изменения в суставах при ОА включают субхондральный склероз кости, синовит, потерю объема суставного хряща и появление остео-фитов в результате костно-хрящевого разрастания сустава. Примерно у 60% людей, страдающих ОА, эти изменения сопровождаются другими симптомами, включающими эритему, отек и боль в суставах, в результате чего часто отмечается утренняя скованность, ограничение подвижности сустава и ограничения различных видов деятельности в повседневной жизни [3, 8].
Несмотря на современные достижения хирургии суставов, основным методом лечения остается консервативный. Консервативное лечение включает комбинацию нефармакологических (лечебная физкультура, массаж, тракционная, мануальная терапия и т.д.) и фармакологических, неинвазивных и инвазивных методов. Медикаментозное лечение включает анальгетики, нестероидные противовоспалительные средства, внутрисуставные инъекции глюкокортикостероидов и внутрисуставные инъекции гиалуроновой кислоты, направленные на повышение вязкости синовиальной жидкости (вискосапплементарная терапия). Добавки хондроитинсульфата и глюкозамина также во многих случаях используются пациентами, несмотря на недостаток доказательств их эффективности [11].
Внутрисуставные инъекции гиалуроната, дулоксетин и опиоиды рекомендуются для лечения пациентов, у которых наблюдалась неадекватная реакция на начальную терапию. Опиоидные анальгетики рекомендуются для применения пациентами, которые либо не желают подвергаться, либо имеют противопоказания к полной артропластики сустава после безуспешной консервативной терапии [12].
По стандартной терапии ОА накоплен большой практический опыт, но большинство назначаемых в ее рамках препаратов характеризуется выраженными побочными эффектами и ограничениями по длительности применения, при этом качество жизни пациентов остается неудовлетворительным. В ряде ретроспективных аналитических исследований были сделаны выводы, согласно которым неселективные нестероидные противовоспалительные средства представляют повышенный риск подобных эффектов со стороны желудочно-кишечного тракта [13, 14]. В данных аналитических исследованиях рассматривались сведения о пациентах, подвергавшихся долгосрочной терапии хронических заболеваний, часто с сопутствующими воспалительными заболеваниями, такими как ОА. Внутрисуставные инъекции кортикостероидов оказывают краткосрочный эффект, обычно от одной до четырех недель. Кроме того, существует мнение, будто долгосрочное применение подобных процедур может способствовать разрушению сустава и атрофии тканей [15, 16]. Поиски альтернативы стандартным медикаментозным средствам остается одной из актуальных задач в лечении ОА.
Одним из таких подходов является использование гомотоксикологического подхода к лечению. Анти-гомотоксические препараты уникальны по принципу лечебного воздействия. Их основное преимущество – эффективность в лечении заболевания или отдельных его симптомов без развития местных и системных побочных эффектов, характерных для многих синтетических препаратов. При правильном подборе и соблюдении режима дозирования терапевтический эффект наступает достаточно быстро и сохраняется намного дольше, чем при применении традиционных лекарственных средств [17].
Антигомотоксические препараты изготовляют из натуральных природных компонентов, в т.ч. из минеральных веществ, экстрактов растений, вытяжек из органов животных и других. Все эти компоненты обрабатывают согласно принципам гомеопатической технологии последовательного разведения и динамизации компонентов. Соответственно, в антигомотоксических препаратах биологически активным началом служат не концентрированные вещества, а их микродозы. Поступающие в организм микродозы не вызывают лекарственной нагрузки на организм. Они стимулируют в организме ауторегуляционные процессы, оказывают детоксикационное действие. Поэтому антигомотоксические препараты относят к лекарственным средствам биорегуляционной медицины [17].
В терапии ОА в настоящее время широко используются такие биорегуляционные препараты, как Траумель и Цель Т. Траумель содержит 14 компонентов природного происхождения, подобранных так, чтобы охватывать различные аспекты воспалительных явлений. Его механизм действия отличается от действия традиционных противовоспалительных препаратов и заключается в комплексном взаимодействии с системой цитокинов, регулирующей воспалительный ответ [17, 18].
Комплексный и многоцелевой механизм действия препарата Цель Т основан на действии его отдельных компонентов и направлен на хроническое воспаление, предотвращение патологических изменений хряща и эндохондральных структур, изменение биохимических свойств хряща и защиту хрящевой ткани от повреждений [17, 19–21].
Комбинация Траумель и Цель Т считается рациональной и широко применяется в клинической практике. Благодаря своим многокомпонентным уникальным формулам Траумель и Цель Т воздействуют на метаболизм, регулируют и поддерживают нужную микросреду в тканях сустава.
Ослабление действия некоторых провоспалительных медиаторов в дополнение к стимуляции агентов, способствующих разрешению воспаления, приводит к модулированию острой воспалительной реакции. Это сводит к минимуму клинические проявления боли и отека, одновременно продолжая поддерживать нормальную защитную функцию иммунной системы. Если уже начали развиваться хроническое воспаление и болевой синдром, действие Траумель и Цель Т направлено на регуляцию и восстановление нарушенного гомеостаза и механизмов защиты.
Комбинированное применение Траумель С и Цель Т может подходить пациентам, которые не переносят или не желают использовать традиционные противовоспалительные препараты, а также для тех, кому противопоказана такая терапия. При необходимости Цель Т и Траумель могут безопасно применяться в сочетании с традиционными методами терапии [17].
Имеющиеся научные и клинические данные указывают на эффективность препаратов Цель Т и Траумель С при болевых синдромах, вызванных ОА (гонартрозом) при внутрисуставном и ряде других форм введения.
Материал и методы
В связи с этим эффективность сочетанного применения препаратов Цель Т и Траумель С была изучена в клиническом исследовании MOZArT [22]. Оно стало первым многоцентровым двойным слепым рандомизированным исследованием для сравнения эффективности и безопасности совместного введения препаратов Цель Т и Траумель С для пациентов при гонартрозе в сочетании с болевым синдромом средней степени тяжести по сравнению с применением плацебо – физиологического раствора.
Двести тридцать два пациента с гонартрозом и обусловленным им болевым синдромом средней степени тяжести были случайным образом распределены по группам (основная [n=119] и контрольная [плацебо; n=113] группы). Затем в течение 15 дней получали внутрисуставные инъекции либо смесью двух указанных препаратов (Траумель С и Цель Т), либо физиологического раствора хлорида натрия, согласно единой технике внутрисуставного введения препаратов. По начальным и демографическим характеристикам пациенты обеих групп не имели статистических различий.
Первичной конечной точкой было изменение интенсивности боли в колене в конце исследования по сравнению с исходным состоянием в соответствии с оценкой по шкале WOMAC (Western Ontario and McMaster Universities Arthritis Index).
В качестве вторичных критериев оценки эффективности были выбраны показатели ригидности пораженного сустава (по шкале WOMAC), параметры физического функционирования сустава, изменения интенсивности болевого синдрома после пройденной дистанции (по 100-балльной Визуальной аналоговой шкале), а также общая оценка проведенной терапии пациентами и лечащими врачами.
Результаты исследования
1. Martel-Pelletier J., Barr A.J., Cicuttini F.M., Conaghan P.G., Cooper C., Goldring M.B., Goldring S.R., Jones G., Teichtahl A.J., Pelletier J.P. Osteoarthritis. Nat. Rev. Dis. Primers. 2016;2:16072.
3. Braun H.J., Gold G.E. Diagnosis of osteoarthritis: imaging. Bone 2012;51(2):278–88.
4. Srikanth V.K., Fryer J.L., Zhai G., Winzenberg T.M., Hosmer D., Jones G. A meta-analysis of sex differences prevalence, incidence and severity of osteoarthritis. Osteoarthritis Cartilage. 2005;13(9):769–81.
5. Wluka A.E., Cicuttini F.M., Spector T.D. Menopause, oestrogens and arthritis. Maturitas. 2000;35(3):183–99.
6. Zhang Y., Jordan J.M. Epidemiology of Osteoarthritis. Clin. Geriatr. Med. 2010;26(3):355–69.
8. Felson D.T., Lawrence R.C., Dieppe P.A., Hirsch R., Helmick C.G., Jordan J.M., Kington R.S., Lane N.E., Nevitt M.C., Zhang Y., Sowers M., McAlindon T., Spector T.D., Poole A.R., Yanovski S.Z., Ateshian G., Sharma L., Buckwalter J.A., Brandt K.D., Fries J.F. Osteoarthritis: new insights. Part 1: the disease and its risk factors. Ann. Intern. Med. 2000;133(8):635–46.
9. Thomas A.C., Hubbard-Turner T., Wikstrom E.A., Palmieri-Smith R.M. Epide-miology of Posttraumatic Osteoarthritis. J. Athl. Train. 2016 May 4
10. Mezhov V., Ciccutini F.M., Hanna F.S., Brennan S.L., Wang Y.Y., Urquhart D.M., Wluka A.E. Does obesity affect knee cartilage? A systematic review of magnetic resonance imaging data. Obes. Rev. 2014;15(2):143–57.
11. Wandel S., Juni P., Tendal B., Nüesch E., Villiger P.M., Welton N.J., Reichenbach S., Trelle S. Effects of glucosamine, chondroitin, or placebo in patients with osteoarthritis of hip or knee: network meta-analysis. BMJ. 2010;341:c4675.
12. Bannuru R.R., Schmid C.H., Kent D.M., Vaysbrot E.E., Wong J.B., McAlindon T.E. Comparative effectiveness of pharmacologic interventions for knee osteoarthritis: a systematic review and network meta-analysis. Ann. Intern. Med. 2015;162(1):46–54.
13. Laine L., Smith R., Min K., Chen C., Dubois R.W. Systematic review: the lower gastrointestinal adverse effects of non-steroidal antiinflammatorydrugs. Aliment. Pharmacol. Ther. 2006;24(5):751–67. Review.
14. Rostom A., Muir K., Dube C., Jolicoeur E., Boucher M., Joyce J., Tugwell P., Wells G.W. Gastrointestinal safety of cyclooxygenase-2 inhibitors: a Cochrane Collaboration systematic review. Clin. Gastroenterol. Hepatol. 2007;5(7):818–28.
15. Leong R.W., Chan F.K. Drug-induced side effects affecting the gastrointestinal tract. Expert. Opin. Drug Saf. 2006;5(4):585–92.
18. Fernandes J.C., Martel-Pelletier J., Pelletier J.P. The role of cytokines in osteoarthritis pathophysiology. Biorheology. 2002;39(1–2):237–46.
19. Basini G., Santini S.E., Bussolati S., Grasselli F. Sanguinarine inhibits VEGF-induced Akt phosphorylation. Ann. N. Y. Acad. Sci. 2007;1095:371–76.
20. Stančíková M., Bély M., Švík K., Metelmann H.W., Schmolz M.W., Ištok R., Fano R. Effects of Zeel comp. on experimental osteoarthritis in rabbit knee. Rheumatologia. 1999;13(3):101–8.
21. Schmolz M., Heine H. Homöopathische Substanzen aus der antihomotoxischen Medizin modulieren die Synthese von TGF-β1 in menschlichen Vollblutkulturen. Biol. Med. 2001;30(2):61–5.
22. Lozada C., del Rio E., Reitberg D., et al. A multi-center double-blind, randomized, controlled trial (db-RCT) to evaluate the effectiveness and safety of co-administered Traumeel® (Tr14) and Zeel® (Ze14) intra-articular (IA) injections versus IA placebo in patients with moderateto-severe pain associated with OA of the knee. Arthritis Rheumatol. 2014;66(Suppl.):S1266. Abstract no. 2896.
Читайте также:

