Как сделать трилон б 0 01
Обновлено: 05.07.2024
Динатриевая соль этилендиаминтетрауксусной кислоты (комплексон-III, трилон Б, хелатон III) — органическое соединение, натриевая соль этилендиаминтетрауксусной кислоты, представляет собой белый кристаллический порошок или кристаллы белого цвета. Хорошо растворяется в воде и щелочах, очень слабо растворяется в спирте; рН 1%-ного водного раствора 4,5; рН препарата с массовой долей 5% 4-5,5. Образует очень устойчивые комплексные соединения с большинством катионов. Вступает в реакцию с сильными окислителями. При хранении не допускать контакта с алюминием, цинком, никелем, медью и медными сплавами.
Содержание
Описание
ТРИЛОН Б является торговым названием динатриевой соли этилендиаминтетрауксусной кислоты и представляет собой кристаллический порошок белого цвета. Данное название введено фирмой BASF и использовалась как торговая марка для данного вещества, но очень быстро вошло в обиход и используется другими фирмами для обозначения продукта. Используются также тринатриевая и тетранатриевая соль этилендиаминтерауксусной кислоты, но для связывания одного и того же количества ионов их надо брать в большем количестве. ТРИЛОН Б это ион коагулянт. Схема действия его основана на извлечении ионов металла из нерастворимых солей металлов и замещения их на ионы натрия, почти все соли которого растворимы в воде, причём независимо от валентности металла 1 молекула трилона реагирует с 1 молекулой соли металла. Это ценное свойство нашло огромное применение в аналитике.
Аналогичное взаимодействие происходит с ионами меди железа (II и III) магния, марганца. Причём ТРИЛОН Б не является окислителем, и не взаимодействует с металлами, находящимися в нулевой степени окисления.

Применение
Основная функция: делает нерастворимые соли металлов растворимыми.
- в аналитической химии для качественного и количественного определения многих катионов и анионов, напр.: Ca, Mg, Cu, Co, Ni, Zn, Fe, Mo, Al, редкоземельных элементов, Tc, U, SO4 2− , PO4 3− , CN − и др. (см. Комплексонометрия), при потенциометрических, полярографических и амперометрических определениях, благодаря возможности вещества образовывать с ионами металлов комплексоны, окрашенные в различный цвет. Причём цвет раствора будет зависеть от иона металла, с которым образован комплекс;
- в производстве медицинских препаратов и при отравлениях тяжелыми металлами;
- в производстве бытовой химии и синтетических моющих средств;
- при консервировании и др;
- в реставрации для удаления следов коррозии с изделий из бронзы и других цветных металлов, особо хорошо себя проявляет в очистке изделий из серебра (Внимание! Препарат может безнадёжно испортить изделие, нарушив патину!);
- в промышленности для промывки теплоэнергетического оборудования, труб, котлов; водоподготовки в котельных и теплосетях; в виде стабилизатора в процессах полимеризации; в целлюлозно-бумажной промышленности; при производстве каучука. Для очистки трубопроводов котлов и нагревательных элементов от накипи и ржавчины, уменьшающих полезное сечение. Аналогично, Трилон Б применяют для очистки автомобильных систем охлаждения, защиты стиральных машин как отдельный препарат или в комплексе со стиральным порошком;
- аммиачный раствор трилона Б (5% аммиака, 3% трилона Б) позволяет быстро и эффективно восстанавливать свинцовые аккумуляторы за счет десульфации свинцовых пластин;
- в фотографии Трилон Б применяют в качестве водоумягчителя в различных растворах. При приготовлении таких растворов на дистиллированной воде, Трилон Б можно исключать из состава. Однако, в рецептах отбеливающих растворов в цветной фотографии Трилон Б служит для получения непосредственно в растворе железной соли трилона Б, которая обладает свойством окислять металлическое серебро. В таких растворах исключать Трилон Б нельзя. Тем не менее, подобная рецептура получения железной соли Трилона Б использовалась только в старых процессах Agfa/Orwo и для цветных материалов СССР, выпуск которых полностью прекращен в конце 1990-х годов. В современных процессах C-41, E-6 и RA-4 железная соль Трилона Б по-прежнему применяется для этой цели, однако подобный способ ее получения непригоден по причине загрязнения раствора, поэтому необходимо использовать чистый реактив.
Опасность для человека
Может вызвать раздражение кожных покровов, слизистых оболочек глаз и дыхательных путей и симптомы бронхита.
Средства индивидуальной защиты
Противопылевой респиратор, средства защиты лица, глаз.
Меры первой помощи
Вынести пострадавшего на свежий воздух, снять загрязненную одежду. Глаза и кожные покровы тщательно и обильно промыть водой. Оттягивать веки от глазных яблок для более полного промывания. При проглатывании прополоскать рот, дать воды для питья.
Тема:Приготовление и стандартизация раствора трилона Б.Определение общей жесткости воды.
Цель работы:научиться приготавливать раствор трилона Б и стандартизировать его, определять общую жесткость воды
Общие положения
Химическая формула трилона Б (кислой натриевой соли этилендиаминтетрауксусной кислоты) – Na2H2C10H12O8N2 ∙2H2O (сокращенно – Na2H2Y). Молярная масса составляет 372,30 г/моль. Число эквивалентов равно 2 (независимо от степени окисления катионов металла). Следовательно, молярная масса эквивалента трилона Б равна 1/2 моль, т.е. 186,15 г/моль. Для работы чаще всего используют растворы с молярной концентрацией эквивалента 0,01 – 0,1 моль/дм 3 .
Общая жесткость воды показывает содержание миллимоль гидрокарбонатов, сульфатов, хлоридов кальция и магния в 1 л воды.
Методика выполнения лабораторного исследования
И оформление отчета
1. Приготовление раствора трилона Б:
Для приготовления 100 мл раствора трилона Б, имеющего молярную концентрацию эквивалента 0,1 моль/дм 3 , необходимо взять навеску m тр.Б г, рассчитанную по следующей формуле:
где Nтр.Б – молярная концентрация эквивалента раствора трилона Б, моль/дм 3 ,
Этр.Б – молярная масса эквивалента трилона Б, г/моль,
Vтр.Б – объем приготовляемого раствора трилона Б, мл.
Рассчитанную навеску или близкую к ней по массе точно взвешивают на аналитических весах, переносят через воронку в мерную колбу объемом 100 мл. Пустую пробирку, после пересыпания навески, снова взвешивают на аналитических весах. Оформляют результаты взвешивания следующим образом:
mпробирки на технических весах =
mпробирки с навеской на технических весах =
mпробирки с навеской на аналитических весах =
mпробирки на аналитических весах =
Дистиллированной водой доводят объем раствора в мерной колбе до метки, предварительно полностью растворив навеску. Колбу плотно закрывают и тщательно перемешивают.
Рассчитывают титр приготовленного раствора Ттр.Б г/см 3 , по следующей формуле:

Ттр.Б = =
где mнавески – масса точная навески трилона Б, г,
Vколбы – объем мерной колбы для приготовления раствора, мл.
Далее рассчитываем нормальность приготовленного раствора Nтр.Б моль/дм 3 , по формуле:

Nтр.Б = =
где Ттр.Б – титр приготовленного раствора трилона Б, г/см 3 ,
Этр.Б – молярная масса эквивалента трилона Б, г/моль.
Титр приготовленного раствора проверяют методом пипетирования по стандартному раствору сульфата магния (х.ч.), приготовленному из фиксанала. Молярная концентрация эквивалента раствора сульфата магния - 0,1 моль/дм 3 .
Пипеткой на 10 мл отбирают в 3 конические колбы для титрования приготовленный из фиксанала раствор сульфата магния. Затем в каждую колбу добавляют 5 мл раствора аммонийно-буферной смеси (отмеривают мерным цилиндром) и 3-4 капли спиртового раствора индикатора кислотного хрома темно-синего. Раствор окрасится в винно-красный цвет вследствие образования комплексного соединения индикатора с катионами магния.
Раствор в колбах титруют приготовленным раствором трилона Б (его заливают в бюретку) при тщательном перемешивании до перехода винно-красной окраски в сине-фиолетовую.
Для точного установления точки эквивалентности в титруемый раствор добавляют еще 1 каплю трилона Б. Появление синей окраски свидетельствует о конце титрования и о полном связывании катионов Mg 2+ в прочное внутрикомплексное соединение Na2[MgY]. Титрование проводят 3 раза и находят средний объем трилона Б.
Молярную концентрацию эквивалента трилона Б N(Nа2Н2Y) моль/дм 3 , вычисляют по формуле:
где V(Nа2Н2Y) – объем трилона Б, пошедший на титрование, мл,
N(MgSО4) – молярная концентрация эквивалента раствора магний сульфата, моль/дм 3 ,
V(MgSО4) – аликвотный объем раствора сульфата магния, мл.
Выразив из этой формулы N(Nа2Н2Y), получаем:
Расчет титра трилона Б Т(Nа2Н2Y) г/см 3 , производим по следующей формуле:
где N(Nа2Н2Y) - молярная концентрация эквивалента раствора трилона Б, моль/дм 3 ,
М(1/2Nа2Н2Y) - молярная масса эквивалента трилона Б, г/моль.
Результаты анализа сводят в таблицу:
| Величина | Значение |
| Объем раствора MgSО4, см 3 | |
| Объем раствора трилона Б, см 3 1-е титрование 2-е титрование 3-е титрование | |
| Средний объем раствора трилона Б, см 3 | |
| N(MgSО4), моль/дм 3 | |
| N(Nа2Н2Y), моль/дм 3 | |
| Т(Nа2Н2Y), г/см 3 |
Определение общей жесткости воды.
В коническую колбу на 250 мл вносят 100 мл исследуемой воды, отмеренной мерной колбой (мутную воду предварительно фильтруют).
Затем прибавляют 5 мл аммонийно-буферной смеси, 5-7 капель спиртового раствора индикатора кислотного хрома темно-синего и титруют раствором трилона Б. К концу титрования раствор трилона Б прибавляют по каплям, тщательно встряхивая смесь в колбе. Титрование продолжают до изменения вишнево-красной окраски раствора в фиолетовую и от одной капли – в синюю.
Определение проводят три раза. Результаты заносят в таблицу 1. Если на титрование 100 мл воды расходуется больше 5 мл раствора трилона Б с N(Nа2Н2Y) = 0,1моль/дм 3 , то это указывает, что в отмеренном объеме воды суммарное содержание кальция, магния больше 0,5 ммоль/л.
В таких случаях определение следует повторить, взяв меньший объем воды и разбавив его в мерной колбе до 100 мл дистиллированной водой.
Нечеткое изменение окраски раствора в точке эквивалентности указывает на присутствие в воде катионов Cu 2+ , Zn 2+ , Mn 2+ , мешающих определению. Для устранения влияния мешающих катионов к отмеренной для титрования пробе воды прибавляют 1-2 мл раствора сульфида натрия с массовой доле й Na2S = 1,5 – 2%. После этого, не отделяя осадка сульфидов меди (II), цинка, марганца (II), проводят титрование раствором трилона Б.
Общую жесткость воды Жо мг-экв/л, вычисляют по следующей формуле:
где NNа2Н2Y – нормальность трилона Б, моль/дм 3 ,
VNа2Н2Y – объем трилона Б, израсходованного на титрование, мл,
100 – объем воды, взятый на титрование, мл;
1000 – 1 л воды, в котором определяют жесткость воды.
Результаты определения свести в таблицу.
| Величина | Значение |
| Объем мерной колбы, мл | |
| Объем раствора трилона Б, см 3 1-е титрование 2-е титрование 3-е титрование | |
| Средний объем раствора трилона Б, см 3 | |
| N(Nа2Н2Y), моль/дм 3 | |
| Общая жесткость воды, мг-экв/л |
Контрольные вопросы:
1. Перечислите известные вам комплексоны.
2. Объясните сущность метода комплексонометрии.
3. Объясните сущность методики общей жесткости воды.
4. Опишите условия титрования трилона Б.
5. Объясните, как фиксируется точка эквивалентности в комплексонометрии.
6. Объясните, что показывает общая жесткость воды.
7. Составьте уравнения реакций, характеризующих общую жесткость воды.
8. Установите преимущества метода комплексонометрии перед другими методами титриметрического анализа.
9. Составьте уравнение реакции, протекающей между трилоном Б и сульфатом магния.
10. Обоснуйте необходимость добавления аммонийно-буферной смеси к титруемому раствору в методе комплексонометрии.
11. Приведите способы расчета титра и нормальности трилона Б.
Список литературы:
1. Жванко, Ю. Н. Аналитическая химия и технохимический контроль в общественном питании / Ю. Н. Жванко, Г. В. Панкратова, З. И. Мамедова. – М.: Высшая школа, 1980. – с. 114 – 118.
2. Шапиро, М. А. Аналитическая химия: учебник / М. А. Шапиро, С. А. Шапиро. – М.: Высшая школа, 1979. – с.279 – 281.
Трилон Б придаёт растворимость нерастворимым солям многих металлов. Его действие основано на извлечении ионов металла из молекул нерастворимых солей металлов и замещения в них ионами натрия, почти все соли которого растворимы в воде, причём независимо от валентности металла 1 молекула трилона реагирует с 1 молекулой соли металла. Грубо говоря, идет разрыхление и растворение самого налёта, но металл в реакции участия не принимает.
Я покупал его в русхиме в фасовке по 1кг за 450 рублей. В озоне столько же хотят за 300г, в Чип и Дип за 200г

Сфера применения довольно обширна: в лекарствах для лечения отравлений тяжелыми металлами, в аналитической химии, в реставрационных работах, в промышленности для чистки теплоэнергетического оборудования, в сельском хозяйстве, при консервировании, раньше применяли во время проявки фотографий для смягчения воды, аммиачным раствором проводят десульфатацию свинцовых аккумуляторов. В википедии можно почитать подробнее.
Я же изначально планировал только чистить чайник и бойлер от накипи — для человека состав безопасен если не пытаться втирать его в глаза, так что сразу после получения налил в подопытного литр воды, засыпал столовую ложку порошка и несколько капель ПАВ(мыло, средство для мытья посуды), чтобы налет лучше смачивался. Количество нужно подбирать так, чтобы количество реактива совпадало с количеством накипи, можно взять чуть с запасом. Раствор не боится высокой температуры, так что можно смело вскипятить воду, что ускорит процесс очистки. На средней картинке фото сразу после кипячения и после того как вода к вечеру остыла. Решил на ночь еще раз нагреть раствор, после чего накипи стало еще меньше, ну и утром поверхность уже была чистой, хотя местами остались матовые пятна, видимо там были области перегрева.




Результат меня порадовал и пакет занял место в шкафчике кухни как средство от накипи, вспомнил о нем когда нашел потерянные в снегу ключи. Закинул их в стакан, засыпал неполную чайную ложку порошка и пару капель фейри. Через час раствор начал менять цвет, а на поверхности металла появились пузырьки. Дело было вечером, так что решил оставить откисать до утра


Результат, как по мне, неплохой. Ничего не натирал, просто прополоскал под краном. Можно даже подумать, что сначала были сфотографированы чистые ключи, а потом уже ржавые, но если присмотреться, можно заметить помутнения в местах, где ржавчина успела поесть слой металла


Кстати, гифки же подвезли, так что ниже можно посмотреть на протекающую реакцию. Чем больше налета и чем он рыхлее, тем она активнее. Для воспроизведения анимации нужно нажать на картинку и немного подождать. Слева биты и экстракторы, оставленные под дождем, справа болт передней подвески автомобиля, который несколько лет провел не в лучших условиях


Так же блестящий слой пожрало еще с одного болта, но всё лучше, чем было изначально


Нумизматам лучше отвернуться. Знакомый хотел почистить монеты томатной пастой, якобы она бережно снимает окисленный слой, предложил ему альтернативу. Сказал, что хочет еще отполировать, чтобы смотрелась как новая, но я в этом уже не участвовал


Еще пригодился для чистки грелки детских бутылочек. Нагревательная пластина спрятана под пластиковой решеткой, со временем на ней накапливается налет и она начинает шуметь во время подогрева, что плохо сказывается на качестве сна маленького ребенка и его родителей. Первый раз насыпал чайную ложку порошка и закипятил, потом где-то раз в неделю добавлял по 1/5 ложки для профилактики и по ночам можно было наслаждаться тишиной, да и внешний вид лучше стал



Так же несколько раз чистил контакты в ИБП. Такие окислы растворяются довольно быстро, хватает 30-60 минут



Ну и наверное самый показательный пример. Нашел кусок водопроводной трубы, которая на 90% состояла из ржавчины снаружи и известкового налета изнутри. Насыпал в теплую воду 4 столовых ложки Трилона, добавил немного моющего средства, чтобы раствор проник во все труднодоступные места и оставил на сутки




Оставлю несколько ссылок на магазины: Русхим Новохим Ozon (ощутимо дороже)
Итоги
Довольно полезное и необычное вещество, странно, что в наше время составы с ним не так распространены, как кислотосодержащие, видимо из-за того, что процесс протекает медленнее, а людям сейчас некогда ждать. Да и современные чайники раньше из строя выйдут, чем их успеет кислотой разъесть за время чисток. В котельных, кстати, альтернативы ему вроде еще не нашли — сложно подобрать что-то не агрессивное, но при этом эффективное и недорогое.
Для человека он относительно безопасен, главное не поедать его в больших количествах и не втирать в слизистые
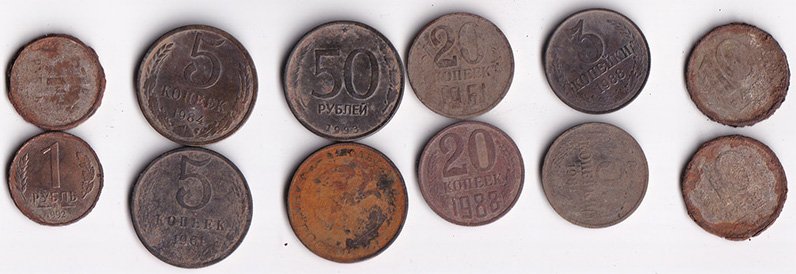
Монеты до чистки
Результат чистки очень сильно зависит от состояния поля под окислами, поэтому для опыта выбраны по два экземпляра одного типа. Для эксперимента парами взяты следующие монеты:
- Латунь – 3 и 5 копеек СССР;
- Нейзильбер – 20 копеек СССР;
- Сталь, плакированная латунью – 1 рубль РФ 1992 года;
- Сталь, плакированная мельхиором – 10 рублей РФ 1993 года;
- Алюминиевая бронза – 50 рублей РФ 1993 года.

Отмачивание окислов на латунных гривенниках
То, что раствор работает, можно понять по смене его цвета с прозрачного на голубоватый, а при долгой выдержке – и чернильно-синий. Следует периодически вынимать монеты и счищать слой растворённых окислов, переворачивая при очередном укладывании в сосуд с раствором. После очистки монеты следует промыть водой и высушить.
Выше пример с латунью, который наглядно иллюстрирует, что естественный цвет возвращается лишь к монетам с минимальными повреждениями монетного поля. Здесь же выясняется, почему надо следить, чтобы предметы не перекрывали друг друга. Монеты, закрытые другими экземплярами, очищаются фрагментарно. Тёмные округлые следы на гривенниках в нижнем ряду – это контуры монет, которые лежали сверху и препятствовали эффективной чистке.

Значок до чистки и после неё
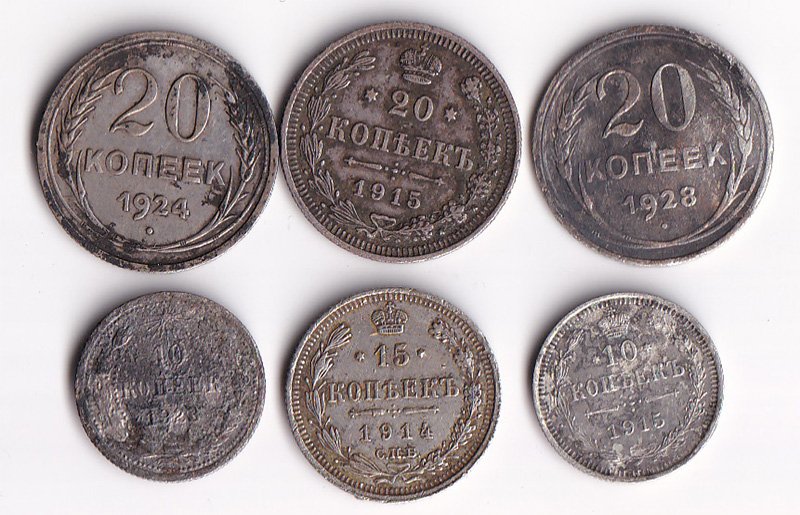
Разменное серебро до чистки
Читайте также:

