Как сделать таблицу по химии 8 класс количество вещества
Добавил пользователь Morpheus Обновлено: 04.10.2024
Оборудование: некоторые Ме и неМе количеством 1 Моль, 1мМоль, 1кМоль.
- Постановка цели урока.
- Повторение домашнего задания.
Задание из рабочей тетради у доски.
а) калия 1S 2 2S 2 2P 6 3S 2 3P 6 4S 1
б) кальция 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2
в) алюминия 1s 2 2s 2 2p 6 3s 2 3p 1
Упр. 3. Схемы образования химической связи для Ме.
б) Ca 0 -2e → Ca 2+
в) Al 0 -3e → Al 3+
Упр. 2. а) 1s 1 ; б) 1s 2 2s 2 2p 6 3s 2 3p 5 ; в) 1s 2 2s 2 2p 3 .
Упр. 3. Схемы образования химической связи.
Работа по карточкам.
- В какую частицу превращается атом, отдав или приняв электроны до завершения внешнего уровня?
- Определите тип химической связи молекул: I 2 , CH 4 , AlCl 3 .
- В какую частицу превращается атом, отдав или приняв электроны до завершения внешнего уровня?
- Определите тип химической связи молекул: N 2 , H 2 O, MgCl 2 .
- В какую частицу превращается атом, отдав или приняв электроны до завершения внешнего уровня?
- Определите тип химической связи молекул: Cl 2 , CO 2 , NaI.
- Где расположены элементы – Ме в таблице Д.И.Менделеева?
- Перечислите особенности строения атомов элементов – Ме.
- Название – свойство – область применения.
- Где расположены элементы – неметаллы в таблице Д.И.Менделеева?
- Что такое аллотропия? (Аллотропия углерода, кислорода, фосфора?)
Задания: Работа по ПС.
Что изучает химия? (наука о веществах) А в чем измерять вещества?
Температура измеряется в градусах, путь в метрах, масса – в граммах, килограммах.
Какие бы вы предложили единицы измерения?
Может быть, вспомнить из каких частиц состоит вещество?
- из молекул, атомов.
Но отсчитать нужное число молекул и атомов технически невозможно из-за малого размера. Вот если бы найти способ, в котором объединились бы масса (её измерить просто) и число молекул (атомов). И ученые придумали. Если брать столько граммов вещества, какова его относительная молекулярная масса, сколько же там будет содержаться молекул?
Для О 2 – 32г / Mr(O 2 ) = 32 /
Для O 3 – 48г / Mr(O 3 ) = 48 /
Для H 2 O – 18г / Mr(H 2 O) = 18 /
Оказалось, что в 32г O 2 , в 48г О 3 , в 18г H 2 O и т.д. содержится одинаковое число молекул, равное 6∙10 23 . Это число назвали числом Авогадро (обозначается N A ).
Сделаем вывод: если мы возьмём такую массу вещества, которая равна атомной массе по величине, но взята в граммах, то там будет всегда (для любого вещества) 6,02∙10 23 атомов этого вещества.
Запись на доске.
N A = 6,02∙10 23 – постоянная Авогадро
Вот это количество вещества, которое содержит 6,02∙10 23 молекул какого – либо вещества, и назвали молем .
Что такое моль? (работа с учебником).
Моль – количество вещества, в котором содержится 6,02∙10 23 молекул, атомов или ионов, т.е. структурных единиц.
Бывает моль молекул, моль атомов, моль ионов.
n = N/N A , N = N A ∙ n, N A = N/n,
где n – число молей, N – число атомов или молекул, N A – постоянная Авогадро.
кМоль = 10 3 Моль, мМоль = 10 -3 Моль.
- 0,5 Moль – 3,01∙10 23
- 10 Моль – 60,02∙10 23
А что нужно сделать, чтобы отмерить 1 Моль вещества?
Ответ: нужно взять столько граммов этого вещества, какова его Mr.
Вопрос: Чему равна масса 1 Моля вещества?
Масса 1 Моль вещества называется молярной массой, обозначается М .
И вычисляется по формуле:
M = m/n, единицы измерения: г/Моль, кг/Моль, мг/Моль.
А в тысячу раз большая единица количества вещества (киломоль, кМоль). А в тысячу раз меньшая единица количества вещества (миллимоль, мМоль).
Вывод: Масса Моль измеряется в г/Моль, масса кМоль измеряется в кг/кМоль, масса мМоль измеряется в мг/Моль.
Предлагается задача: Я взяла 64г О 2 . Какое количество вещества (сколько Молей) я взяла? (Два)
В химической практике, имея дело с веществами, а не с отдельными атомами или молекулами, химики редко используют массы, измеряемые в атомных единицах. Масса порции реагирующих веществ или продуктов реакции чаще измеряется в граммах или в более крупных единицах.
Чтобы перейти от молекул к порциям веществ, воспользуемся единицей измерения, которая называется моль.
Химик и физик из Франции Жозеф Луи Гей-Люссак в 1808 году изучал интересную химическую реакцию, в которой в результате взаимодействия двух газов – хлороводорода и аммиака – получалось кристаллическое вещество – хлорид аммония.

Оказалось, что для реакции требуются одинаковые объемы хлороводорода и аммиака. Если одного из этих газов вначале будет больше, то по окончании реакции этот избыток оставался неиспользованным.

Гей-Люссак привел свои наблюдения в статье, но никаких выводов из них не сделал. Важные заключения через три года привел итальянский химик Амедео Авогадро. В 1811 году, в результате экспериментов и расчетов, Авогадро пришел к мысли, что равные объемы газов, находящихся при одинаковых условиях, содержат одно и то же число молекул.
Гипотеза Авогадро долго считалась спорной, поскольку не подтверждалась расчетами, основанными на ошибочном мнении о немолекулярном строении простых газообразных веществ. Однако в 1865 году австрийский физик и химик Иоганн Лошмидт предпринял попытку рассчитать число молекул газа в заданном объеме.
Когда гипотеза Авогадро была признана, ученые получили возможность правильно определять состав молекул химических соединений, рассчитывать атомные и молекулярные массы. Эти знания позволяли легко рассчитывать массовые соотношения веществ в химических реакциях. Пользоваться этими соотношения очень удобно: измеряя массу веществ в граммах, ученые как бы оперировали молекулами.
Количество вещества, численно равное относительной молекулярной массе, но выраженное в граммах, назвали грамм-молекулой или молем.

Моль – это количество вещества, содержащее столько структурных единиц (атомов, молекул), сколько содержится атомов в 0,012 кг углерода.
Согласно Международной системе единиц СИ моль является единицей измерения особой физической величины – количества вещества. Под количеством вещества (обозначается греческой буквой ν) понимают число структурных единиц этого вещества (атомов, молекул и др.).

Самое важное заключается в том, что 1 моль любого вещества содержит одно и то же число молекул. Это число называется постоянной или числом Авогадро. Она обозначается символом NA. Постоянная Авогадро рассчитана давно и представляет собой очень большое число.
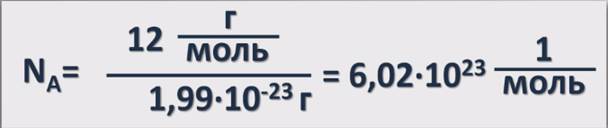
Если массу 1 моля углерода 12 г/моль разделить на массу 1 атома углерода 1,9910-23 г, то получится число, равное 6,02·1023. Поскольку это число обозначает количество частиц в 1 моле, единицы его пишут как 1/моль, моль-1 или обратный моль.
Чтобы как-то представить это число, скажем лишь, что оно больше, чем число стаканов воды, которое содержится в Мировом океане, а 6,02·1023 зёрен пшеницы имели бы массу порядка 2·1016 тонн.

Для сбора такого урожая потребовалось бы более 2 миллионов лет. Из примеров ясно: применение числа Авогадро для отсчета макротел бессмысленно. Главное его назначение – определение количества частиц (атомов и молекул) микромира и связь единиц микро и макромира.
Зная количество вещества, можно судить о числе частиц в определенной его порции и брать вещества для реакций в необходимых количествах. Таким образом, химики могут определять число атомов и молекул путём взвешивания порций веществ. Приведём примеры таких расчётов. Чтобы вычислить количество вещества, зная число частиц, используем формулу 2 где ν – количество вещества в молях, N – число частиц вещества, NА – постоянная Авогадро.
Задача.Какое количество вещества содержит 1,505·1023 молекул воды?
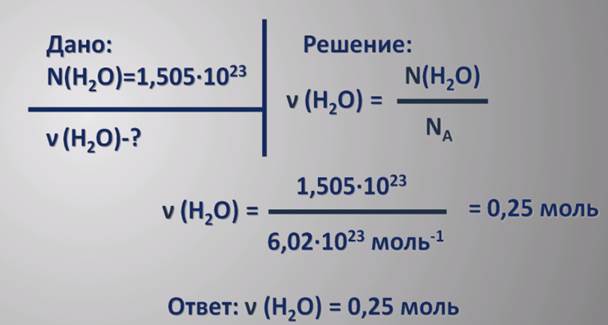
В химии редко используется такая величина как число частиц. Гораздо легче использовать величины, которые легко измерить. Такой величиной является масса вещества. Как же связаны между собой масса и количество вещества? Зная число молекул вещества в одном моле и массу одной молекулы, можно подсчитать массу одного моля вещества. Например, известно, что масса молекулы воды равна
2,992·10-23г. Умножив ее на постоянную Авогадро, 6,02·1023 обратных молей, мы получим
18 г/моль – массу одного моля воды или молярную массу воды.
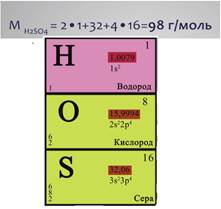
Молярной массой называется масса вещества, взятого в количестве 1 моль. Измеряется она в г/моль и обозначается латинской буквой М. Чтобы найти молярную массу вещества, нет необходимости проделывать столь сложные расчеты. Достаточно помнить, что молярная масса численно равна относительной молекулярной массе и имеет размерность г/моль.
Например, относительная молекулярная масса серной кислоты Н2SО4 равна 2·1+32+4·16=98, следовательно, молярная масса серной кислоты Н2SО4 равна 98 г/моль.
Молярную массу используют для перевода количества вещества в массу и наоборот. Для расчетов используют формулу: количество вещества ν равно отношению массы вещества m к молярной массе этого вещества М.
Решим задачу. Вычислить количество вещества азотной кислоты массой 75,6 г.

Если требуется найти массу, зная количество вещества, формулу преобразуют: масса вещества m равна произведению количества вещества ν на молярную массу этого вещества М.
2 Химия - наука о веществах.
3 Как и в каких единицах можно измерить вещество?
4 Для измерения вещества выбрана особая единица, которая соединяет в себе число молекул и массу. Это- МОЛЬ.
5 В порции вещества содержится 6 ·10 23 молекул (атомов) данного вещества, если ее масса численно равна относительной молекулярной массе этого вещества.
6 Пример: 1) Аr (Н)=1, => 1 г водорода содержит 6 ·10 23 атомов водорода 2) Аr (Na)=23, => 23 г натрия содержат 6 ·10 23 атомов натрия 3) Mr (N 2 )=28, => 28 г азота содержат 6 ·10 23 молекул азота
7 Рабочая тетрадь с печатной основой - стр. 46
8 Определение Количество вещества - это физическая величина, которая определяется числом структурных единиц этого вещества (молекул, атомов, ионов); обозначается n; измеряется в моль.
9 Определение Моль-это такое количество вещества, которое содержит 6 ·10 23 молекул, атомов этого вещества.
10 Постоянная Авогадро -это физическая величина, которая показывает содержание молекул, атомов в 1 моль вещества, обозначается N A, численно равна 6 ·10 23
11 Формула для определения числа частиц вещества N- число частиц (молекул, атомов и др.) N=N A · n n= N/NA
12 Определите число молекул, содержащихся в 2 моль водорода. N (H 2 )= 6 ·10 23 ·2= =12 ·10 23 молекул
13 3 моль водорода - 5 моль кислорода - 1 моль оксида углерода - 2 моль азота - 1 моль хлора - 4 моль воды -
14 Молярная масса Это физическая величина, которая показывает массу 1 моль вещества, Обозначается М Численно равна относительной молекулярной массе, Мr Измеряется в г/моль
15 Количество вещества n = m/M m=n·M
16 Заполняем таблицы 6 и 7, стр. 49 Решаем задачи 8, стр 49 8, стр 49 10, стр 50 10, стр 50
17 Домашнее задание Параграф 15 В тетради с печатной основой Задание 9,11,12, стр. 50

Презентация для проведения урока химии в 8 классе по теме "Количество вещества". Позволяет учащимся повторить основные величины (массу и объем) и их единицы измерения, знакомит с новыми понятиями-количество вещества, моль, молярная масса. Знакомит с расчетами по химической формуле, содержит образец решения задач, а так же - материал для самостоятельной работы учащихся с последующей самопроверкой или взаимопроверкой.

КОМИТЕТ ПО ОБРАЗОВАНИЮ
Государственное бюджетное общеобразовательное учреждение
средняя общеобразовательная школа № 518
Выборгского района Санкт-Петербурга
Количество вещества.
Якубенок Мария Львовна

Количество вещества

Химия - наука о веществах.
Как и в каких единицах можно измерить вещество?

Обозначение
Единицы измерения
л, мл, м 3
(кмоль, ммоль)


Один моль – это такое количество вещества,
в котором содержится 6 ∙ 10 23 структурных частиц
этого вещества(атомов, молекул, ионов)
Количество вещества определяется числом частиц вещества.
В 1 моль любого вещества содержится 6 ∙ 10 23 его частиц.
Читайте также:

