Как сделать реакцию замещения
Добавил пользователь Владимир З. Обновлено: 04.10.2024
Реакция замещения это реакция в которых одни функциональные группы входящие в состав химического соединения меняются на другие группы.
Как написать хороший ответ? Как написать хороший ответ?
- Написать правильный и достоверный ответ;
- Отвечать подробно и ясно, чтобы ответ принес наибольшую пользу;
- Писать грамотно, поскольку ответы без грамматических, орфографических и пунктуационных ошибок лучше воспринимаются.
Мореплаватель — имя существительное, употребляется в мужском роде. К нему может быть несколько синонимов.
1. Моряк. Старый моряк смотрел вдаль, думая о предстоящем опасном путешествии;
2. Аргонавт. На аргонавте были старые потертые штаны, а его рубашка пропиталась запахом моря и соли;
3. Мореход. Опытный мореход знал, что на этом месте погибло уже много кораблей, ведь под водой скрывались острые скалы;
4. Морской волк. Старый морской волк был рад, ведь ему предстояло отчалить в долгое плавание.

Данный видеофрагмент объясняет учащимся сущность реакций замещения, знакомит их с рядом активности металлов, прогнозированием протекания реакций между металлами и кислотами, металлами и солями, в уроке есть несколько демонстраций, которые помогут учащимся в описании лабораторного опыта по этой теме.
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Реакции замещения"

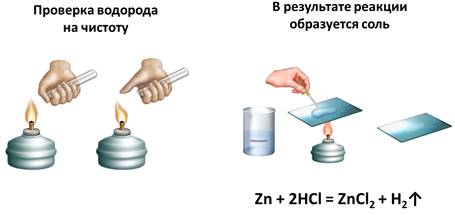
В результате этой реакции – между цинком и соляной кислотой – образуется соль (хлорид цинка). Это можно доказать, если немного этого раствора поместить на предметное стекло и выпарить. В результате вода испарится, а на стеле будут кристаллы соли. Теперь составим уравнение этой реакции: в реакцию вступает цинк и соляная кислота, в результате чего образуется соль – хлорид цинка и выделяется водород.
Zn + 2HCl = ZnCl2 + H2↑
Проведем дугой эксперимент. Нальем в четыре пробирки раствора соляной кислоты. В первую пробирку поместим кальций, во вторую – магний, в третью – цинк, в четвертую – медь. Понаблюдаем за процессом, будет ли выделение водорода во всех случаях, ведь в реакцию вступает металл и соляная кислота? Самое интенсивное выделение водорода наблюдается в первой пробирке, где был металл кальций, во второй пробирке – с металлом магнием – менее интенсивное, с цинком еще менее интенсивное, а с медью реакция не протекает, т.к. выделение водорода и вовсе не наблюдается.

Поэтому, для прогнозирования протекания реакции между металлом и кислотой, нужно использовать ряд активности металлов, или ряд напряжений металлов. Как видите, в этом ряду есть и водород, который металлом не является. Металлы, которые стоят в ряду напряжений металлов до водорода, способны вытеснять его из растворов кислот, те металлы, которые стоят в этом ряду после водорода, этой способностью не обладают.
Самые активные металлы находятся вначале ряда, менее активные – в конце. Т.к. кальций более активный, то выделение водорода в растворе кислоты шло интенсивнее, чем у магния или цинка. Медь не вытесняет водород из раствора кислот, потому как этот металл стоит в конце ряда. В этом вы сами убедились из предыдущего опыта.
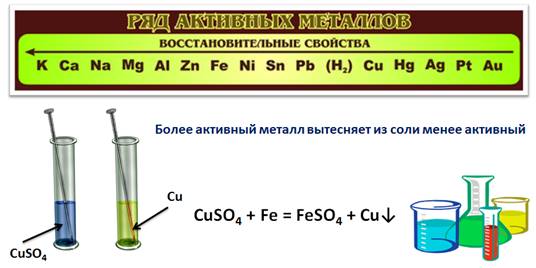
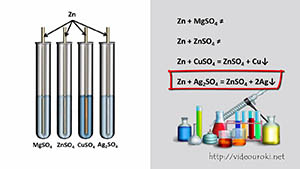
Ряд активности металлов используют также для прогнозирования реакций между металлом и раствором соли. Для этого нужно знать, что более активный металл вытесняет из раствора соли менее активный.
Проведем эксперимент: поместим в химический стакан с раствором сульфата меди (II) железный гвоздь. Через некоторое время на гвозде появляется красный налет, а раствор соли изменяет свою окраску. Красный налет – это выделившаяся медь, раствор изменил окраску, т.к. в результате реакции образовался раствор сульфата железа (II).
CuSO4 + Fe = FeSO4 + Cu↓
Если цинк поместить в растворы сульфатов магния, цинка, меди и серебра, то из всех этих растворов он вытеснит только медь в виде красного налёта и серебро в виде серебристо-белого налета. Магний более активный металл, чем цинк, т.к. в ряду активности стоит левее цинка, поэтому реакция не прошла, как и реакция цинка с раствором сульфата цинка.

Если поместить медь в раствор нитрата серебра, то через некоторое время на меди появляется серебристо-белый налет из-за образовавшегося серебра. Как видим, реакция протекает, т.к. медь стоит в ряду напряжений металлов левее серебра, т.е. является более активным металлом, чем серебро.

Все рассмотренные реакции являются реакциями замещения. Теперь можно сделать вывод, что реакции замещения – это реакции, в результате которых атомы простого вещества замещают атомы одного из химических элементов в сложном веществе.
Когда химические вещества вступают во взаимодействие, химические связи между их атомами разрушаются и образуются новые, уже в других сочетаниях. В результате одни вещества превращаются в другие.
Рассмотрим реакцию горения метана, происходящую в конфорке газовой плиты:
.jpg)
Молекула метана (CH₄) и две молекулы кислорода (2O₂) вступают в реакцию, образуя молекулу углекислого газа (CO₂) и две молекулы воды (2H₂O). Связи между атомами углерода (С) и водорода (H) в метане, а также между атомами кислорода (O) разрываются, и образуются новые связи между атомами углерода и кислорода в молекуле углекислого газа (CO₂) и между атомами водорода и кислорода в молекуле воды (H₂O).
Картинка даёт наглядное представление о том, что произошло в ходе реакции. Но зарисовывать сложные химические процессы такими схемами неудобно. Вместо этого учёные используют уравнения химических реакций.
Химическое уравнение — это условная запись химической реакции с помощью формул и символов.
Их записывают в виде схемы, в которой отражён процесс превращения. В левой части располагаются формулы реагентов — веществ, вступающих в реакцию. Завершается уравнение продуктами реакции — веществом или веществами, которые получились в результате.
Новые вещества образуются потому, что изменяются связи между атомами, но сами атомы не возникают из ниоткуда и не исчезают в никуда. На рисунке видно, что атом углерода из состава метана перешёл в состав углекислого газа, атом водорода — в состав воды, а атомы кислорода распределились между молекулами углекислого газа и воды. Число атомов не изменилось.
Согласно закону сохранения массы, общая масса реагентов всегда равна общей массе продуктов реакции. Именно поэтому запись химической реакции называют уравнением.
Виды химических реакций
Вещества вступают в реакции по-разному, можно выделить четыре наиболее частых варианта:
.jpg)
- Соединение. Два или несколько реагентов образуют один продукт. В реакцию могут вступать как простые вещества, так и сложные. Например, простые вещества водород и кислород взаимодействуют и образуют сложное — воду:
.jpg)
Сложное вещество негашёная известь соединяется с водой, и образуется новое сложное вещество — гашёная известь:
.jpg)
- Разложение. Обратный процесс: одно вещество распадается на несколько более простых. Например, если нагреть известняк, получаются негашёная известь и углекислый газ:

Стрелка вверх означает, что образовался газ. Он улетучивается и больше не участвует в реакции.
- Замещение. В реакции участвуют два вещества — простое и сложное. Если атомы химического элемента в простом веществе более активны, они замещают атомы одного из менее активных химических элементов в составе сложного вещества.
В примере атомы цинка замещают атомы водорода в составе хлороводорода, и образуется хлорид цинка:

- Обмен. Два сложных вещества обмениваются составными частями, в результате получаются два новых сложных вещества. В такой реакции обязательно образуется вода, газ или осадок.
.jpg)
Стрелка вниз означает, что вещество выпало в осадок, поскольку оно нерастворимо.
Коэффициенты в уравнениях химических реакций
Чтобы составить уравнение химической реакции, важно правильно подобрать коэффициенты перед формулами веществ.
Коэффициент в химических уравнениях означает число молекул (формульных единиц) вещества, необходимое для реакции. Он обозначается числом перед формулой (например, 2NaCl в последнем примере).
Коэффициент не следует путать с индексом (числом под символом химического элемента, например, О₂). Индекс обозначает количество атомов этого элемента в молекуле (формульной единице).
.jpg)
Чтобы узнать общее число атомов элемента в формуле, нужно умножить его индекс на коэффициент вещества. В примере на картинке (2H₂O) — четыре атома водорода и два кислорода.
Подобрать коэффициент — значит определить, сколько молекул данного вещества должно участвовать в реакции, чтобы она произошла. Далее мы расскажем, как это сделать.
Алгоритм составления уравнений химических реакций
Для начала составим схему химической реакции. Например, образование оксида магния (MgO) в процессе горения магния (Mg) в кислороде (O₂). Обозначим реагенты и продукт реакции:
.jpg)
Чтобы схема стала уравнением, нужно расставить коэффициенты. В левой части схемы два атома кислорода, а в правой — один. Уравняем их, увеличив число молекул продукта:
.jpg)
Теперь число атомов кислорода до и после реакции одинаковое, а число атомов магния — нет. Чтобы уравнять их, добавим ещё одну молекулу магния. Когда количество атомов каждого из химических элементов в составе веществ уравнено, вместо стрелки можно ставить равно:
.jpg)
Уравнение химической реакции составлено.
Рассмотрим реакцию разложения. Нитрат калия (KNO₃) разлагается на нитрит калия (KNO₂) и кислород (О₂):
.jpg)
В обеих частях схемы по одному атому калия и азота, а атомов кислорода до реакции 3, а после — 4. Необходимо их уравнять.
Для начала удвоим коэффициент перед реагентом:
.jpg)
Теперь в левой части схемы шесть атомов кислорода, два атома калия и два атома азота. В левой по-прежнему по одному атому калия и азота и четыре атома кислорода. Чтобы уравнять их, в правой части схемы нужно удвоить коэффициент перед нитритом калия.
.jpg)
Снова посчитаем число атомов каждого химического элемента в составе веществ до и после реакции: два атома калия, два атома азота и шесть атомов кислорода. Равенство достигнуто.
Химические уравнения не только позволяют предсказать, что произойдёт при взаимодействии тех или иных веществ, но и помогают рассчитать их количественное соотношение, необходимое для реакции.
Записали!
Скоро с вами свяжется консультант, расскажет об обучении в нашей онлайн-школе.
Проверьте вашу электронную почту — там письмо о том, что стоит сделать перед консультацией.
Записали!
Скоро с вами свяжется консультант, расскажет об обучении в нашей онлайн-школе.
Проверьте вашу электронную почту — там письмо о том, что стоит сделать перед консультацией.
Записали!
Скоро с вами свяжется консультант, расскажет об обучении в нашей онлайн-школе.
Проверьте вашу электронную почту — там письмо о том, что стоит сделать перед консультацией.

У нас вы сможете учиться в удобном темпе, делать упор на любимые предметы и общаться со сверстниками по всему миру.
Общий вид реакций замещения:

Примером реакции замещения может служить фотолитическое хлорирование метана:

В зависимости от способа расщепления связи, реакции замещения делятся на гомолитические (радикальные) и гетеролитические. Последние, в свою очередь, из-за типа атакующего реагента относят к нуклеофильным или электрофильным реакциям [2] .
В органической химии реакции замещения имеют важнейшее значение. Детальное изучение типового механизма реакции позволяет не просто предсказать её результат для конкретных реагентов, но и получить представление о выборе оптимальных температурных условий её протекания, подборе растворителя или возможного катализатора.
Содержание
Реакции нуклеофильного замещения
В реакциях нуклеофильного замещения атакующей частицей является нуклеофил, то есть отрицательно заряженная частица или частица со свободной электронной парой. Уходящая группа носит название нуклеофуг.
Реакции нуклеофильного замещения более характерны для алифатических систем.
Общий вид реакций нуклеофильного замещения:

Наиболее распространено два типа механизмов реакций нуклеофильного замещения [3] :
- SN1 — мономолекулярное нуклеофильное замещение: двухстадийный процесс — на первой (медленной) стадии образуется промежуточный карбкатион, который на второй (быстрой) стадии реагирует с нуклеофилом.
- SN2 — бимолекулярное нуклеофильное замещение: одностадийный процесс без образования интермедиата.
Примером реакции нуклеофильного замещения может служить гидролиз алкилгалогенидов:

Наиболее распространенные нуклеофильные группы [4] :


Реакции электрофильного замещения
В реакция электрофильного замещения атакующей частицей является электрофил, то есть положительно заряженная частица или частица с дефицитом электронов. Уходящая частица носит название электрофуг.
Реакции электрофильного замещения более характерны для ароматических систем.
Общий вид реакций электрофильного замещения:

Для ароматических систем существует только один (основной) механизм электрофильного замещения SEAr, который включает в себя образование промежуточного положительно заряженного интермедиата, у которого на второй стадии отщепляется уходящая группа [3] .
У алифатических соединений встречаются как механизмы SE1, так и SE2, аналогичные механизмам SN1 и SN2.
Пример реакции электрофильного замещения:
Наиболее распространенные электрофильные группы:

Реакции радикального замещения
В реакция радикального замещения атакующей частицей являются свободные радикалы.
Общий вид реакций радикального замещения:

Примером реакции радикального замещения может служить приведенная выше реакция хлорирования метана.
Примечания
- Химические реакции
- Реакции в органической химии
- Реакции замещения
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое "Реакции замещения" в других словарях:
Реакции нуклеофильного замещения — (англ. nucleophilic substitution reaction) реакции замещения, в которых атаку осуществляет нуклеофил реагент, несущий неподеленную электронную пару.[1] Уходящая группа в реакциях нуклеофильного замещения называется нуклеофуг. Все … Википедия
Реакции электрофильного замещения — (англ. substitution electrophilic reaction) реакции замещения, в которых атаку осуществляет электрофил частица, заряженная положительно или имеющая дефицит электронов. При образовании новой связи уходящая частица электрофуг … Википедия
Реакции радикального замещения — (англ. substitution radical reaction) реакции замещения, в которых атаку осуществляют свободные радикалы частицы, содержащие один или несколько неспаренных электронов. Реакции радикального замещения обозначают SR. Содержание 1… … Википедия
Реакции электрофильного присоединения — (англ. addition electrophilic reaction) реакции присоединения, в которых атаку на начальной стадии осуществляет электрофил частица, заряженная положительно или имеющая дефицит электронов. На конечной стадии образующийся… … Википедия
Реакции нуклеофильного присоединения — (англ. addition nucleophilic reaction) реакции присоединения, в которых атаку на начальной стадии осуществляет нуклеофил частица, заряженная отрицательно или имеющая свободную электронную пару. На конечной стадии образующийся… … Википедия
Реакции радикального присоединения — (англ. addition radical reaction) реакции присоединения, в которых атаку осуществляют свободные радикалы частицы, содержащие один или несколько неспаренных электронов. При этом радикалы могут атаковать как другие радикалы, так и… … Википедия
Реакции присоединения — (англ. addition reaction) в органической химии так называются химические реакции, в которых одни химические соединения присоединяются к кратным (двойным или тройным) связям другого химического соединения. Присоединение может… … Википедия
Реакции синхронного присоединения — реакции присоединения, в которых атака на оба атома кратной связи осуществляется одновременно. Другое название реакций этого типа реакции циклоприсоединения, так как конечным продуктом таких реакций являются циклические субстраты. Существует две… … Википедия
ЗАМЕЩЕНИЯ РЕАКЦИИ — ЗАМЕЩЕНИЯ РЕАКЦИИ, химические реакции, в результате которых атомы (см. АТОМ) или группы атомов простого вещества (см. ПРОСТОЕ ВЕЩЕСТВО) замещают атомы или группы атомов в молекуле сложного вещества (см. СЛОЖНОЕ ВЕЩЕСТВО): 2Na + 2H2O ® 2NaOH + H2 … Энциклопедический словарь
Реакции элиминирования — Элиминирование (от лат. elimino изгоняю) это отщепление от молекулы органического соединения атомов или атомных групп без замены их другими. Реакция элиминирования может проходит в одну стадию (по механизму E2), либо в две стадии … Википедия
Читайте также:

