Как сделать препарат для микроскопа
Добавил пользователь Alex Обновлено: 04.10.2024
Далеко не всё, что есть под рукой, имеет смысл класть на предметный столик и пытаться рассмотреть в окуляр микроскопа. Например, непрозрачные объекты (палец, монета) рассмотреть совсем не удастся, да и для рассматривания вполне достаточно сильной лупы.
Обычно для микроскопирования используют специально приготовленные микропрепараты. При приготовлении микропрепарата берется предметное стекло (размер 25 × 75 мм), на которое помещается рассматриваемый объект; обычно для лучшей сохранности и удобства использования объект накрывается сверху тонким покровным стеклом (размер 18 × 18 мм).
По способу приготовления и времени хранения различают:
- постоянные препараты – объект помещен в прозрачную твердеющую среду (обычно канадский бальзам) и накрыт покровным стеклом; такие препараты могут храниться годами и десятилетиями, однако их приготовление весьма трудоемко (объект должен быть тщательно подготовлен: обезвожен, окрашен и др.);
- временные препараты – объект помещен в жидкую среду (вода, физиологический раствор, глицерин-желатин и др.), такие препараты годны для использования в течение нескольких часов, однако с ними можно проводить опыты (например, заменять воду солевым раствором определенной концентрации, добавлять краситель и др.).
В таблице представлены типы препаратов в зависимости от характера исследуемого объекта.
Тип
Описание
Постоянный/ временный
Пример
1
Целый организм или его небольшие части (конечности, ротовой аппарат). Обычно требуют обработки (осветления)
2
Объект заливается в пластичный материал (парафин, акрил) и после его затвердевания разрезается на тонкие пластины с помощью микротома (приспособления для получения тонких срезов)
3
Токослойный препарат без покровного стекла (обычно препарат крови): капля с помощью полированного стекла размазывается по поверхности предметного стекла тонким слоем, высушивается
Временный, реже постоянный
4
Тонкая (толщина 0,03-0,02 мм) пластинка горной породы или другого твердого образца (кости, окаменелости), приклеенная к покровному стеклу
В некоторых случаях временный препарат можно рассматривать непосредственно, не накрывая покровным стеклом. Такой препарат будет практически невозможно рассмотреть резко сразу весь – какая-то часть его будет в фокусе, а остальное – нет. Но если рассматривать такой препарат с малым увеличением микроскопа, можно рассмотреть некоторые интересные объекты.
Микропрепарат клеток мякоти арбуза (без покровного стекла)
Так же в виде открытых временных препаратов можно вырастить кристаллы разных солей (ацетилсалициловой кислоты, или аспирина; медного купороса, или сульфата меди; красной кровяной соли, или гексацианоферрата калия). На предварительно очищенное от пыли и отпечатков пальцев наносится несколько капель водного или спиртового раствора соли (для лучшего качества кристаллов раствор предварительно лучше профильтровать, так как это позволит уменьшить количество точек кристаллизации и получить более крупные и аккуратные кристаллы). Каплям дают высохнуть (можно провести эксперимент с одним из стекол, нагрев его, с целью ускорения выпаривания, а другому дать растворителю испариться, а кристаллам – выпасть самостоятельно). Также можно рассматривать полуготовый микропрепарат на этапе процесса кристаллизации: можно увидеть, как кристалл увеличивается прямо на глазах или как вокруг зародыша твердого вещества возникает течение жидкости из-за разницы концентраций ионов.
Простой и эффектный способ изготовления микропрепаратов без срезов, позволяющий рассмотреть рельеф поверхности изучаемого объекта (например, листа растения, покровов тела насекомого) – метод реплик. При этом берется объект (например, лист растения), и на него наносится тонкий слой прозрачного лака для ногтей (достаточно небольшого пятна 5 × 10 мм). После того, как лак высохнет (примерно через 5-7 минут), к лаковому пятну приклеивается кусок липкой ленты; так реплика отделяется, после чего ее кладут на предметное стекло и рассматривают под микроскопом.
Реплика поверхности листа, видны устьичные клетки и жилка
(микроскоп Микромед С-13, малое увеличение).
1.1. Приготовление временного препарата
Техника приготовления временного препарата хорошо известна по школьным опытам с кожицей лука. Кладем предметное стекло на стол (препараты всегда держат за боковые грани предметного стекла). В центр стекла помещаем 1-2 капли воды и объект исследования Берем покровное стекло за боковые грани и осторожно накрываем им сверху каплю с объектом. Правильнее упереть покровное стекло одной из граней в предметное и медленно уменьшать угол между стеклами так, чтобы накрыть каплю с объектом. Это уменьшает возможность появления пузырьков воздуха.
Накрывание объекта покровным стеклом
1.2. Приготовление мазка крови
Мазки крови для исследования крови готовят следующим образом.
Описание
Фотография
1
Поместите небольшую каплю крови на лежащее на горизонтальной поверхности предметное стекло, с помощью стеклянной капиллярной пипетки (или непосредственно из места укола пальца перенесите выступившую каплю крови на конец стерильного предметного стекла, стараясь не касаться стекла проколотым участком кожи).
2
Чистое шлифованное стекло помещается коротким ребром под углом 45° к предметному стеклу у края капли. Ждем, пока кровь расплывется под ребром стекла.
3
Как только кровь растеклась по ребру, быстрым движением от капли проводим по предметному стеклу. Не следует сильно нажимать на стекло, так как при этом могут разрушиться форменные элементы крови.
4
2. Некоторые особенности микроскопирования
Использование микроскопов на малом и большом увеличении достаточно хорошо известно по школьным опытам и не требует особо сложных навыков.
2.1. Имерсионный объектив
Если в ващем распоряжении имеется микроскоп с иммерсионным объективом (он маркируется 100× МИ и черным кольцом, и имеет подвижную часть объектива, обращаемую к микропрепарату), то у вас есть возможность рассмотреть объекты с большим увеличением (однако для этого имеет смысл использовать мазки).
- Выведите из хода лучей сухой объектив (поверните барабан объективов так, чтобы ни один объектив не был обращен к препарату).
- На препарат нанесите одну каплю иммерсионного (кедрового) масла; желательно иммерсионным маслом также немного смазать линзу этого объектива.
- Повернув барабан объективов, введите иммерсионный объектив в ход лучей (до щелчка фиксации).
- Опустите объектив до соприкосновения с каплей иммерсионного масла, затем, наблюдая в микроскоп, с помощью винтов грубой и точной фокусировки, произведите настройку на резкость.
При работе с иммерсионным объективом потребуется максимальная освещенность. После окончания исследования иммерсионный объектив нужно протереть мягкой оптической тряпочкой или батистовой, слегка смоченной специальной жидкостью для чистки оптики. Важно: любые другие виды объективов протирать нельзя!
Применение вместо кедрового масла других масляных жидкостей не рекомендуется, т. к., если показатель преломления используемой иммерсии (например, вазелинового масла с показателем 1,48162) отличается от показателя преломления кедрового масла (показатель 1,515), возможно снижение контраста, нечеткость изображения, уменьшение разрешающей способности.
2.2. Фотографии в косом освещении и темном поле
Для объемных препаратов (тотальные препараты насекомых, водорослей и др.) интересно использовать освещение, отличное от обычного просвечивающего. Для регулировки освещения в микроскопах используется конденсор – поворотное устройство с отверстиями разного диаметра и расположения. Используя специальные варианты конденсора, можно изменить характер освещения препарата, подчеркнув объем рассматриваемого объекта.
В таблице сравнивается работа с освещением разных типов.
Тип освещения
Способ создания
Вид зрачка объектива с вынутым окуляром
Пример
1
Свет проходит через поле зрения равномерно.
2
Свет проходит через препарат под углом, так как конденсор закрывает часть отверстия. Этого эффекта можно добиться притеняя рукой или другой преградой часть светового потока перед зеркалом микроскопа
3
Специальный конденсор закрывает центральную часть поля зрения, так что свет проходит с краев. При определенной тренировке такого эффекта также можно добиться, частично притеняя часть светового потока перед зеркалом микроскопа
3. Съемка
Фотографирование настроенного на резкость микропрепарата с помощью камеры планшета особых трудностей не представляет, так как мы непосредственно контролируем то, что именно будем снимать. Настройки камеры планшета также зависят от типа устройства, которое вы используете; так как камера планшета обычно имеет достаточно большую глубину резкости, даже при настройках камеры по умолчанию можно получить вполне качественное изображение.
Планшетный компьютер и микроскоп: съемка, фотография, кадр с выносками и обозначениями
Для изучения микроорганизмов производят микроскопирование как живых, так и убитых микробов в неокрашенном и окрашенном виде. Микроскопический препарат готовят на предметном стекле - пластинке из тонкого стекла (76х26 мм) с хорошо отшлифованными краями. Предметные стекла, употребляемые при микробиологическом исследовании, должны быть кристально чисты и абсолютно обезжирены. На поверхности обезжиренного стекла вода легко расплывается и не образует капель шаровидной формы.
Новые стекла перед употреблением кипятят в 1%-ном растворе соды 10 мин, промывают водой, слабой соляной кислотой и хорошо прополаскивают в дистиллированной воде. Стекла, бывшие в употреблении, необходимо обработать раствором серной кислоты в течение 2 ч, хорошо промыть в воде и прокипятить 10 мин в 4%-ном растворе соды. Ополоснутые затем дистиллированной водой стекла протирают чистой полотняной тряпочкой.
В лаборатории всегда следует иметь запас готовых для работы стекол. Хранить предметные стекла лучше всего в банке с притертой пробкой, погруженными в смесь спирта с эфиром, взятых в равных объемах. Из банки предметные стекла достают пинцетом. Покровные стекла - вырезанные квадратом или прямоугольником тонкие стеклышки (толщиной 0,15-0,17 мм) размерами 18х18 мм, 20х20 мм, 18х24 мм.
Исследование микроорганизмов в живом виде
Приготовленный на предметном стекле препарат дрожжей накрывают покровным стеклом и рассматривают с объективом 40Х. В таком препарате обычно хорошо видны прозрачные овальные или круглые клетки дрожжей с ядрами и оболочками, которые хорошо заметны в клетках живых дрожжей. Мертвые клетки, как правило, более мелкие по сравнению с живыми м окрашены в синий цвет.
Препарат живых бактерий готовится подобно препарату дрожжей, но бактерии можно рассматривать и без добавления краски. На поверхность покровного стекла наносится капля иммерсионного масла, и препарат рассматривается с иммерсионным объективом 90 X, лучше всего в затемненном поле (т.е. с прикрытой диафрагмой). Если культура бактерий подвижная, то хорошо видны быстрые разнохарактерные движения отдельных клеток.
Для приготовления препарата плесневых грибов очень осторожно (чтобы не разрушить органов спороношения) специальной иглой (можно препаровальной) или ботаническим пинцетом снимают кусочек пленки гриба и переносят его в каплю воды, предварительно нанесенную на предметное стекло. Препарат осторожно, слегка придавливая, накрывают покровным стеклом и рассматривают под микроскопом с объективом 8Х. При этом увеличении хорошо различается строение органов спороношения плесневых грибов. Для подробного изучения отдельных деталей строения (гиф, сумок и т.д.) препарат рассматривают с объективом 40X. При этом обязательно следует регулировать освещение с помощью диафрагмы для получения более четкого изображения рассматриваемых деталей.
При приготовлении препаратов в раздавленной капле нужно помнить следующее:
1. При опускании покровного стекла на каплю следует прикоснуться его ребром к краю капли и, постепенно наклоняя, опустить стекло.
2. Капля не должна быть большой, чтобы жидкость не переливалась за края и не попадала на верхнюю сторону покровного стекла. Избыток воды снимают кусочком фильтровальной бумаги.
3. Одиночные пузырьки воздуха, оставшиеся под покровным стеклом, обычно не мешают наблюдению. Но если пузырьков много, препарат следует приготовить заново.
4. Препарат не должен быть слишком густым, чтобы микроорганизмы не заслоняли друг друга.
5. Приготовленные препараты рассматривают немедленно (особенно живых бактерий), так как в противном случае вода высыхает и клетки бактерий теряют подвижность.
6. Бактериологическую петлю (или иглу) перед каждым очередным пассажем и после него (нанесение капли воды на стекло, снятие культуры с агара и ее размешивание, взятие краски и т.д.) следует обязательно докрасна прокаливать в пламени горелки.
После прокаливания петлю быстро охлаждают на воздухе (держат 2-3 сек, ни к чему не прикасаясь) и приступают к выполнению очередного этапа работы.
Исследование микроорганизмов в фиксированном и окрашенном виде
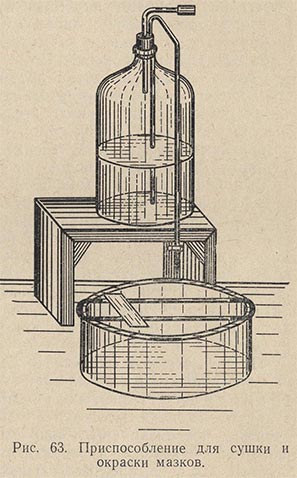
Приготовление мазка. На чистое обезжиренное предметное стекло платиновой петлей наносят материал (рис. 62). Если он жидкий, то каплю, взятую петлей, непосредственно равномерно распределяют по поверхности предметного стекла тонким слоем на площади примерно в 1 см2. Если же изучается агаровая культура, то на предметное стекло предварительно наносят каплю стерильной воды, в которой тонким слоем распределяется исследуемая культура. Получается так называемый мазок. Все манипуляции по приготовлению мазка необходимо выполнять с соблюдением правил асептики (над пламенем горелки стерилизуют петли, концы сосудов с исследуемым материалом, ватные пробки и пр.). Сделав мазок, его сушат при комнатной температуре, поместив на специальный сушильный столик (рис. 63). Хороший мазок после сушки должен давать едва заметный налет. Препарат с густым мазком для наблюдения малопригоден.
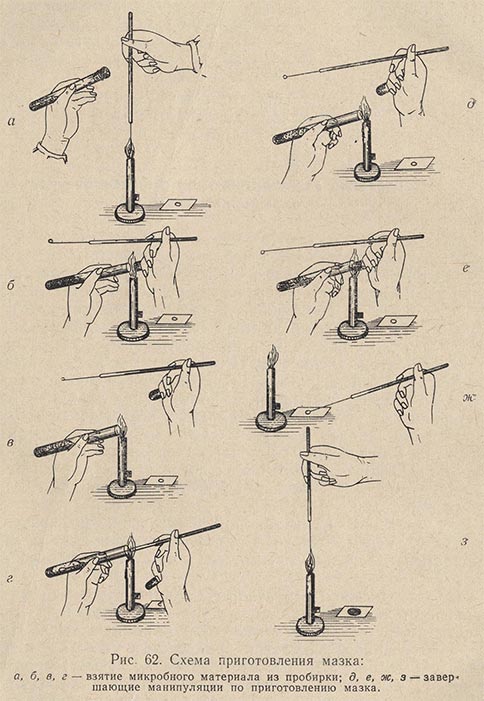
Для ускорения высыхания можно осторожно подсушить мазок над пламенем горелки. Предметное стекло в этом случае над пламенем горелки держат так, чтобы мазок был обращен вверх.
Фиксация мазка. Предметное стекло с высушенным мазком, обращенным вверх от пламени горелки, проводят 3-4 раза на границе между светлой и темной частью пламени. Цель фиксации - убить микробные клетки, прикрепить их к стеклу и облегчить окрашивание. Мертвые клетки гораздо лучше воспринимают краску, чем живые. Препарат в общей сложности не должен находиться в пламени более 2 сек. Излишнего нагревания мазков нужно избегать, так как при этом сильно изменяется структура клеток, мазок будет плохо окрашиваться. При недостаточной же фиксации мазка его можно смыть при последующей окраске. Практически достаточность нагревания определяют прикладывая предметное стекло к руке. При этом должен чувствоваться легкий ожог.
Окраска мазков. В лабораторной практике пользуются простыми и сложными методами окраски микробов. Сложные, или дифференциальные, способы окраски, как уже указывалось, применяются для детального изучения структуры клеток. При простой окраске препаратов на фиксированный мазок наливают несколько капель какого-либо красящего раствора (метиленовой сини, разведенного фуксина и пр.). Для получения более чистых препаратов рекомендуется красящий раствор наливать на отрезок фильтровальной бумаги, которой покрывают мазок. Раствор краски в среднем выдерживают на мазке 2-3 мин (в зависимости от вида краски). Фуксин красит интенсивно, причем окрашиваются одинаково хорошо все виды бактерий. Продолжительность окрашивания раствором фуксина вполне достаточна на протяжении 1-2 мин. Щелочную метиленовую синь оставляют для окрашивания мазка на 2-3 мин. Она красит менее сильно, но препарат получается более изящный, к тому же различные бактерии приобретают окраску различной интенсивности. При окраске метиленовой синью у крупных клеток (например, дрожжевых) дифференцируется ядро и цитоплазма. Раствор генцианвиолета держат для окраски 3-5 мин.
По истечении указанного срока краску сливают с предметного стекла. Если на мазок помещалась фильтровальная бумага, ее нужно осторожно снять пинцетом и затем промыть мазок легкой струей дистиллированной воды (можно и водопроводной). Струю воды следует направлять на ребро предметного стекла, а не на мазок. Промытый препарат высушивают на воздухе при комнатной температуре или с помощью полосок фильтровальной бумаги.
На сухой мазок наносят каплю кедрового масла. Не следует кедровое масло наносить на влажный (а тем более на мокрый) мазок. При этом возникает эмульсия воды в кедровом масле и четкость изображения в микроскопе резко снижается.
Сущность сложных методов окраски заключается в том, что препарат окрашивают не одной, а двумя и большим количеством контрастных красок. В микробиологической практике сложный метод окраски микробов по Граму имеет весьма важное значение при дифференциации микробов.
Техника окраски микробов методом Грама состоит в следующем. На фиксированный мазок кладут полоску фильтровальной бумаги и наливают карболовый раствор генцианвиолета на 1-2 мин. Затем краску сливают. Сняв бумажку и не промывая препарат водой, наносят на мазок раствор Люголя также на 1-2 мин (мазок чернеет). По истечении указанного времени раствор Люголя сливают с предметного стекла и погружают стекло в стаканчик со спиртом для обесцвечивания. Предметное стекло слегка покачивают в спирте, выдерживая 30-60 сек. Быстро промывают мазок водой и дополнительно окрашивают разведенным фуксином в течение 1-2 мин. Фуксин сливают, препарат промывают водой, высушивают и микроскопируют.
Выполнить окраску микробов по Граму можно, пользуясь модификацией этого метода, предложенной Синевым. Вместо раствора карболового генцианвиолета используют фильтровальную бумагу, пропитанную этим раствором и высушенную. На фиксированный мазок накладывают полоску такой бумаги, наносят несколько капель стерильной воды, так чтобы бумажка оказалась смоченной, и окрашивают препарат в течение 2 мин. Затем бумажку снимают, на препарат наливают раствор Люголя и далее поступают так же, как указано выше при окраске по Граму.
По отношению к окраске по Граму все бактерии разделяют на две группы: грамположительные (грампозитивные) и грамотрицательные (грамнегативные). Первые в результате окраски остаются окрашенными в фиолетовый цвет; вторые - обесцвечиваются спиртом и при дополнительном окрашивании фуксином приобретают красный цвет. Объясняется это тем, что у грамположительных бактерий в цитоплазме клеток содержатся специфические белки и магниевая соль рибонуклеиновой кислоты, которые с генцианвиолетом и йодом образуют комплекс фиолетового цвета, не разрушающийся под действием спирта. У грамотрицательных бактерий магниевая соль рибонуклеиновой кислоты в клетках отсутствует, и такого комплекса при окраске генцианвиолетом и йодом в цитоплазме не образуется. Генцианвиолет и йод в дальнейшем легко обесцвечиваются спиртом.
Приготовление красящих растворов
При бактериологическом исследовании для окраски микробов применяются основные анилиновые краски. Чаще всего употребляются: основной фуксин (красная краска), метиленовая синь (синяя краска), генцианвиолет, кристаллвиолет, метилвиолет (фиолетовые краски). Эти краски продаются в виде аморфных или кристаллических порошков, из которых готовят красящие растворы.
Исходным материалом для приготовления необходимых рабочих красок являются насыщенные спиртовые растворы указанных красителей. Спиртовые растворы готовят впрок и сохраняют в склянках с притертыми пробками. Сами по себе спиртовые растворы для окраски микробов не применяются.
Насыщенный спиртовой раствор красителя получают растворением 1 г его в 10 мл 96%-ного этилового спирта (этанола). Краска обычно полностью не растворяется, и на дне флакона остается небольшой осадок. Полученный спиртовой раствор настаивают 3-5 дней, ежедневно взбалтывая.
Рабочий водно-спиртовой раствор краски получают смешивая 1 мл насыщенного спиртового раствора с 10 мл дистиллированной воды. Для повышения красящей способности в качестве протравы к водно-спиртовым растворам красок добавляют карболовую кислоту.
Рецепты приготовления наиболее употребительных красок.
Карболовый фуксин Циля. 10 мл насыщенного спиртового раствора основного фуксина смешивают со 100 мл 5%-ной карболовой кислоты. Можно приготовить красящий раствор и непосредственно из сухого красителя. Для этого 1 г основного фуксина растирают в ступке с 5 г кристаллической карболовой кислоты. Для лучшего растирания рекомендуется добавить несколько капель глицерина. Затем понемногу приливают 10 мл 96%-ного спирта. К равномерно растертой массе постепенно приливают 100 мл дистиллированной воды, перемешивают и оставляют на 1-2 суток. Затем фильтруют через бумажный фильтр. Фуксин Циля стоек и может сохраняться очень долго. Его употребляют для окраски спор и кислотоустойчивых бактерий, трудно воспринимающих краску.
Фуксин Пфейфера (разведенный фуксин). 1 мл карболового фуксина Циля смешивают с 9 мл дистиллированной воды. Раствор нестоек, поэтому его приготовляют непосредственно перед окраской препаратов. Используют для простой окраски мазков и дополнительной окраски их по методу Грама.
Карболовый генцианвиолет. 10 мл насыщенного спиртового раствора генцианвиолета смешивают со 100 мл 5%-ной карболовой кислоты или 1 г генцианвиолета растирают в ступке с 5 г кристаллической карболовой кислоты, постепенно добавляют 10 мл 96%-ного спирта и 100 мл дистиллированной воды.
Щелочная метиленовая синь (по Лефлеру). К 100 мл дистиллированной воды прибавляют 30 мл насыщенного спиртового раствора краски и 1 мл 1%-ного раствора едкого кали (КОН). Раствор фильтруют. Краска очень прочная, причем красящая способность старой краски выше, чем свежеприготовленной.
Водный раствор метиленовой сини. 1 г метиленовой сини растворяют в 100 мл дистиллированной воды.
Раствор Люголя. 2 г йодистого калия растворяют в 5 мл дистиллированной воды, прибавив 1 г кристаллического йода. Объем доводят водой до 300 мл. Раствор Люголя должен иметь слабощелочную или нейтральную реакцию. При кислой реакции его нейтрализуют (по лакмусу) двууглекислой содой. Раствор следует хранить в склянках из темного стекла, предохраняя от действия света.
Приготовление пропитанной генцианвиолетом фильтровальной бумаги для окраски микробов по Граму в модификации Синева. Раствор карболового генцианвиолета помещают на сутки в термостат при 37 °С, затем фильтруют через бумажный фильтр. Фильтрат выливают в тарелку и погружают в него нарезанную полосками фильтровальную бумагу на 1-2 мин. Пропитанная краской бумага подсушивается, нарезается кусочками (2х4 см) и сохраняется в темных склянках с притертой пробкой. Срок хранения неограниченный.
Примечание. Свежеприготовленные карболовые растворы красок имеют на поверхности пленку с металлическим блеском. Эти растворы стойкие и сохраняются довольно долго. Однако при слишком длительном хранении они могут стать непригодными; в этом случае металлический блеск на поверхности их пропадает, а на дне образуется мелкий порошкообразный осадок.
Под лупой можно рассматривать части растений непосредственно, без всякой обработки.Чтобы рассмотреть что-либо под микроскопом, нужно приготовить микропрепарат. Объект помещают на предметное стекло. Для лучшей видимости и сохранности его кладут в каплю воды и покрывают сверху очень тонким покровным стеклом. Такой препарат называют временным, после работы его можно смыть со стекла. Но можно сделать и постоянный препарат, который будет служить многие годы. Тогда объект заключают не в воду, а в специальное прозрачное смолистое вещество, которое быстро затвердевает, прочно склеивая предметное и покровное стёкла. Существуют разнообразные красители, с помощью которых окрашивают препараты. Так получают постоянные окрашенные препараты.
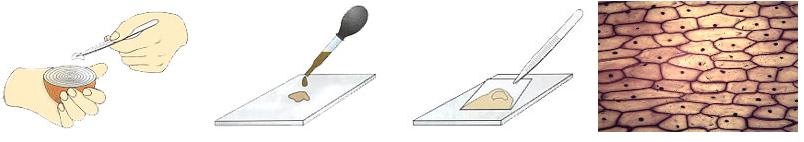
Что делаем. Приготовьте микроскоп к работе, настройте свет. Предметное и покровное стёкла протрите салфеткой. Пипеткой капните каплю слабого раствора йода на предметное стекло (1).

Что делать. Возьмите луковицу. Разрежьте её вдоль и снимите наружные чешуи. С мясистой чешуи оторвите иголкой кусочек поверхностной плёнки пинцетом. Положите его в каплю воды на предметном стекле (2).

Осторожно расправьте кожицу препаровальной иглой (3).

Что делать. Накройте покровным стеклом (4).

Временный микропрепарат кожицы лука готов (5).

Что делаем. Приготовленный микропрепарат начните рассматривать при увеличении в 56 раз (объектив х8, окуляр х7). Осторожно передвигая предметное стекло по предметному столику, найдите такое место на препарате, где лучше всего видны клетки. Что наблюдаем. На микропрепарате видны продолговатые клетки, плотно прилегающие одна к другой (6).

Что делаем. Можно рассмотреть клетки на микроскопе при увеличении в 300 раз (объектив х20, окуляр х15).

Что наблюдаем. При большом увеличении (7) можно рассмотреть плотную прозрачную оболочку с более тонкими участками — порами. Внутри клетки находится бесцветное вязкое вещество — цитоплазма (окрашена йодом).
В цитоплазме находится небольшое плотное ядро, в котором находится ядрышко. Почти во всех клетках, особенно в старых, хорошо заметны полости — вакуоли.
Вывод: живой растительный организм состоит из клеток. Содержимое клетки представлено полужидкой прозрачной цитоплазмой, в которой находятся более плотное ядро с ядрышком. Клеточная оболочка прозрачная, плотная, упругая, не даёт цитоплазме растекаться, придаёт ей определённую форму. Некоторые участки оболочки более тонкие — это поры, через них происходит связь между клетками. Таким образом, клетка — это единица строения растения.
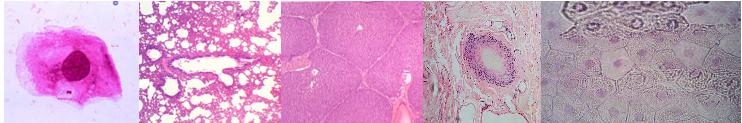
Многие производители оптических приборов выпускают детские микроскопы с уже готовыми препаратами в комплекте. Также сегодня можно купить и различные наборы готовых препаратов, так называемых слайдов, по 10, 25, 50 и даже 100 штук стеклышек разных тематик. И хотя такие наборы сравнительно недешевое удовольствие, тем не менее, они могут оказаться очень интересными и полезными как для ребенка, так и для студента медицинского института, ведь многие из препаратов просто нереально приготовить в домашних условиях.
Так среди готовых препаратов Вы можете найти образцы бактерий, срезы легких, печени, кожи человека и животных и прочие интересные образцы, которые не так уж легко, а то и вообще невозможно встретить в повседневной жизни.
Но, помимо подобных готовых препаратов, Вы можете также исследовать и различные объекты, доступные в домашних условиях. Для приготовления объектов для исследования под микроскопом Вам понадобятся предметное и покровное стекло, которые можно купить в магазинах оптических приборов.
Одним из наиболее популярных образцов, которые Вы сможете самостоятельно приготовить – это пленочка лука. Для этого сначала необходимо очистить лук от сухой шелухи, а затем аккуратно (можно с помощью пинцета) снять тонкую пленочку. На предметное стекло необходимо капнуть несколько капель воды, а затем аккуратно разместить на нем пленочку лука. Если пленочка немного скомкалась, возьмите иголочку и расправьте ею образец на стекле. После этого с помощью пипетки капните каплю раствора йода и накройте образец покровным стеклом.
Подобным образом Вы можете приготовить еще массу различных образцов из растений, овощей и пр. Следует помнить, что при исследовании объекта под биологическим микроскопом необходимо брать плоские прозрачные предметы. Биологические микроскопы предназначены для исследования в проходящем свете и имеют нижнюю подсветку, поэтому срезы растений должны быть как можно тоньше и аккуратнее. С этой целью был изобретен такой прибор, как микротом. Микротом – это такой инструмент, с помощью которого можно легко приготовить очень тонкие срезы биологических тканей. Так в комплект ко многим детским микроскопам входят микротомы, конечно же, не профессиональные, а более безопасные для Вашего малыша. Но даже если в Вашем распоряжении среди аксессуаров для препарирования нет микротома, Вы можете воспользоваться обычным лезвием или канцелярским ножом. Не стоит забывать о мерах предосторожности и безопасности Вашего ребенка, поэтому лучше не позволяйте малышу брать лезвие, нож или микротом без Вашего присмотра.
Также Вы можете исследовать под микроскопом кристаллы сахара, соли, корень волоса, плесень (например, вырастить в чайнике чайную плесень).
Если приготовленный образец Вам не очень понравился, Вы можете попробовать очень аккуратно разъединить покровное и предметное стекло (такие препараты, которые не закрепляются надолго, называются временными), промыть их, вытереть, высушить и использовать в дальнейшем для приготовления других препаратов. Будьте особенно осторожны, так как покровные и предметные стекла очень тонкие и хрупкие, легко трескаются, а также не давайте детям играться со стеклами. Если же Вы хотите сохранить этот препарат, то перед тем, как накрывать его покровным стеклом, капните немного закрепителя (напр. пихтовую смолу или прозрачный клей) по краям образца (такой препарат будет называться постоянным). Затем придавите его и дайте высохнуть (около суток).
Вот теперь, после того как Вы успешно выполнили и этот шаг, можно приступать к самому процессу наблюдения и исследования! Желаем Вам успехов!

Обзор
Подсчёт эритроцитов в камере Горяева. Увеличение: 100×.
Автор
Редакторы

Спонсор конкурса — дальновидная компания Thermo Fisher Scientific. Спонсор приза зрительских симпатий — фирма Helicon.
Вот уже два года, как я наблюдаю за этим миром у себя дома, и год, как делаю фотоснимки. За это время я успел увидеть собственными глазами, какие бывают клетки крови, что опадает с крыльев бабочек и молей, как бьётся сердце у улитки. Конечно, многое можно было бы почерпнуть из учебников, видеолекций и с тематических веб-сайтов. Единственное, что осталось бы не почерпнутым — это ощущение присутствия и близости к тому, чего не видно невооружённым глазом. То, что прочитано в книге или увидено в телепередаче, скорее всего, сотрется из памяти в весьма сжатые сроки. Что увидено лично в объектив микроскопа — останется с тобой навсегда. И останется не столько сам образ увиденного, сколько понимание, что мир устроен именно так, а не иначе. Что это не просто слова из книжки, а личный опыт. Опыт, который в наше время доступен каждому.
Что купить?
Наблюдение при больших увеличениях требует хорошего освещения в силу небольшой апертуры соответствующих объективов. Канули те времена, когда препарат исследовали в отражённом от зеркала свете. Сейчас микроскопы представляют собой комплексные оптико-механо-электрические приборы, в которых всецело используются достижения научно-технического прогресса. В современных устройствах имеется своя лампочка, свет от которой распространяется через специальное устройство — конденсор, — которое и освещает препарат. В зависимости от типа конденсора можно выделить различные способы наблюдения, самыми популярными из которых являются методы светлого и тёмного поля. Первый метод, знакомый многим ещё со школы, предполагает, что препарат освещается равномерно снизу. При этом в тех местах, где препарат оптически прозрачен, свет распространяется от конденсора в объектив, а в непрозрачной среде свет поглощается, приобретает окраску и рассеивается. Поэтому на белом фоне получается тёмное изображение — отсюда и название метода.
С темнопольным конденсором всё иначе. Он устроен так, что лучи света, выходящие из него, направлены в разные стороны, кроме непосредственно отверстия объектива. Поэтому они проходят сквозь оптически прозрачную среду, не попадая в поле зрения наблюдателя. С другой стороны, лучи, попавшие на непрозрачный объект, рассеиваются на нём во все стороны, в том числе и в направлении объектива. Поэтому в итоге на тёмном фоне будет виден светлый объект. Такой метод наблюдения хорош для исследования прозрачных объектов, которые на светлом фоне не являются контрастными. По умолчанию большинство микроскопов являются светлопольными. Поэтому, если вы планируете расширить набор методов наблюдения, то стоит выбирать модели микроскопов, в которых предусмотрена установка дополнительного оборудования: конденсоров, устройств фазового контраста, поляризаторов и т.п.
Конечно, это не весь список параметров, которые следует учитывать при покупке микроскопа. Иногда бывает важно обратить внимание на устройство и расположение предметного столика и рукояток для управления им. Стоит выбрать и тип осветителя, которым может быть как обычная лампа накаливания, так и светодиод, который светит ярче и греется меньше. Также микроскопы могут иметь индивидуальные особенности. Но основное, что стоило бы сказать об их устройстве, пожалуй, сказано. Каждая дополнительная опция — это добавка к цене, поэтому выбор модели и комплектации — это удел конечного потребителя.
Как смотреть?
Любительское наблюдение не предполагает исключительных навыков ни в работе с микроскопом, ни в подготовке препаратов. Конечно, можно купить далеко не дешёвые наборы уже готовых препаратов, но тогда не таким ярким будет ощущение вашего личного присутствия в исследовании, да и готовые препараты рано или поздно наскучат. Поэтому, купив микроскоп, стоит задуматься о реальных объектах для наблюдения. Кроме того, вам понадобятся хоть и специальные, но доступные средства для подготовки препаратов.
Наблюдение в проходящем свете предполагает, что исследуемый объект является достаточно тонким. Даже не каждая кожура с ягоды или фрукта сама по себе обладает необходимой толщиной, поэтому в микроскопии исследуют срезы. В домашних условиях достаточно адекватные срезы можно делать обычными лезвиями для бритья. При определённой сноровке можно достигнуть толщины среза в несколько клеточных слоёв, что во многом повысит дифференцируемость объектов препарата. В идеале стоит работать с моноклеточным слоем ткани, ибо несколько слоёв клеток, наложенных друг на друга, создают нечёткое и сумбурное изображение.
Для взятия образцов крови следует приобрести скарификаторы, пипетки и вату. Всё это есть в продаже в медицинских магазинах и аптеках. Кроме того, для сбора объектов из дикой природы следует запастись маленькими пакетиками и баночками. Брать с собой баночку для набора воды из ближайшего водоёма при выезде на природу должно стать у вас хорошей привычкой.
Что смотреть?
Микроскоп приобретён, инструменты закуплены — пора начинать. И начать следует с самого доступного. Что может быть доступнее кожуры репчатого лука (рис. 1 и 2)? Являясь тонкой сама по себе, кожура лука, будучи подкрашенной йодом, обнаруживает в своём строении чётко дифференцируемые ядра. Этот опыт, хорошо знакомый со школы, пожалуй, и стоит провести первым. Саму кожуру лука нужно залить йодом и оставить окрашиваться на 10–15 минут, после чего нужно промыть её под струёй воды.
Кроме того, йод можно использовать для окраски картофеля (рис. 3). Не стоит забывать, что срез необходимо делать как можно более тонким. Буквально 5–10 минут пребывания среза картофеля в йоде проявят пласты крахмала, которые окрасятся в синий цвет. Йод является достаточно универсальным красителем. Им можно окрашивать широкий спектр препаратов.

Рисунок 1. Кожица лука (увеличение: 1000×). Окраска йодом. На фотографии дифференцируется ядро в клетке.
Фотография автора статьи.

Рисунок 2. Кожица лука (увеличение: 1000×). Окраска Азур-Эозином. На фотографии в ядре дифференцируется ядрышко.
Фотография автора статьи.

Рисунок 3. Зерна крахмала в картофеле (увеличение: 100×). Окраска йодом.
Фотография автора статьи.

Рисунок 4. Крыло божьей коровки (увеличение: 400×).
Фотография автора статьи.

Рисунок 5. Крыло бибионида (увеличение: 400×).
Фотография автора статьи.

Рисунок 6. Крыло бабочки боярышницы (увеличение: 100×).
Фотография автора статьи.
Кроме того, можно поверхностно изучить строение конечностей членистоногих (рис. 8), рассмотреть хитиновые плёнки — например, на спине таракана (рис. 9). При должном увеличении можно убедиться, что такие плёнки состоят из плотно прилегающих (возможно, сросшихся) чешуек.

Рисунок 7. Чешуйки с крыльев моли (увеличение: 400×).
Фотография автора статьи.

Рисунок 8. Конечность паука (увеличение: 100×).
Фотография автора статьи.

Рисунок 9. Плёнка на спине таракана (увеличение: 400×).
Фотография автора статьи.

Рисунок 10. Кожура чёрного винограда (увеличение: 1000×).
Фотография автора статьи.

Рисунок 11. Кожура сливы (увеличение: 1000×).
Фотография автора статьи.

Рисунок 12. Лист клевера (увеличение: 100×). Некоторые клетки содержат тёмнокрасный пигмент.
Фотография автора статьи.
Достаточно доступным для исследования объектом является зелень: трава, водоросли, листья (рис. 12 и 13). Но, несмотря на повсеместную распространённость, выбрать и приготовить хороший образец бывает не так-то просто.
Самым интересным в зелени являются, пожалуй, хлоропласты (рис. 14 и 15). Поэтому срез должен быть исключительно тонким. Нередко приемлемой толщиной обладают зелёные водоросли, встречающиеся в любых открытых водоёмах.

Рисунок 13. Лист земляники (увеличение: 40×).
Фотография автора статьи.

Рисунок 14. Хлоропласты в клетках травы (увеличение: 1000×).
Фотография автора статьи.

Рисунок 15. Хлоропласты в клетках водоросли (увеличение: 1000×).
Фотография автора статьи.
Там же вы встретите и плавучие водоросли и других водных микроорганизмов (рис. 16). Вам также может посчастливиться встретить малька улитки или другого животного, живущего в водоёме (рис. 17 и 18). Маленький детёныш улитки, будучи достаточно оптически прозрачным, позволяет разглядеть у себя биение сердца (видео 1).

Рисунок 16. Плавающая водоросль со жгутиком (увеличение: 400×).
Фотография автора статьи.

Рисунок 17. Детёныш улитки (увеличение: 40×).
Фотография автора статьи.

Рисунок 18. Мазок крови. Окраска Азур-Эозином по Романовскому (увеличение: 1000×). На фотографии эозинофил на фоне эритроцитов.
Фотография автора статьи.
Сам себе учёный
Видео 1. Биение сердца улитки (увеличение оптического микроскопа 100×).
После исследования простых и доступных препаратов естественным желанием является усложнение техник наблюдения и расширение класса изучаемых объектов. Для этого, во-первых, понадобится литература по специальным методам исследования, а, во-вторых, специальные средства. Эти средства, хотя и являются своими для каждого типа объектов, всё-таки обладают некоторой общностью и универсальностью. Например, всеобще известный метод окраски по Граму, когда разные виды бактерий после окраски дифференцируются по цветам, может быть применён и при окраске других, не бактериальных, клеток. Близким к нему по сути является и метод окраски мазков крови по Романовскому. В продаже имеется как уже готовый жидкий краситель, так и порошок, состоящий из таких красящих веществ, как азур и эозин. Все красители можно купить в специализированных медико-биологических магазинах, либо заказать в интернете. Если же по каким-то причинам вы не можете достать краситель для крови, можно попросить лаборанта, делающего вам анализ крови в больнице, приложить к анализу стёклышко с окрашенным мазком вашей крови.
Продолжая тему исследования крови, нельзя не упомянуть камеру Горяева — устройство для подсчёта форменных элементов крови. Будучи важным инструментом для оценки количества эритроцитов в крови ещё в те времена, когда не было устройств для автоматического анализа её состава, камера Горяева также позволяет измерять размеры объектов благодаря нанесённой на неё разметке с известными размерами делений. Методы исследования крови и других жидкостей с помощью камеры Горяева описаны в специальной литературе.
Заключение
В данной статье я постарался рассмотреть основные моменты, связанные с выбором микроскопа, подручных средств и основные классы объектов для наблюдения, которые нетрудно встретить в быту и на природе. Как уже было сказано, специальные средства наблюдения предполагают наличие хотя бы начальных навыков работы с микроскопом, поэтому их обзор выходит за рамки данной статьи. Как видно из фотографий, микроскопия может стать приятным хобби, а может быть, для кого-то даже и искусством.
В современном мире, где разнообразные технические средства и устройства находятся в шаговой доступности, каждый сам решает, на что ему потратить собственные деньги. Из развлекательных соображений это может быть дорогостоящий ноутбук или телевизор с запредельным размером диагонали. Но находятся и те, кто отводит свой взор от экранов и направляет его либо далеко в космос, приобретая телескоп, либо, смотря в окуляр микроскопа, проникают взглядом глубоко внутрь. Внутрь той природы, частью которой мы являемся.
Читайте также: