Как сделать общую характеристику неметаллам
Обновлено: 04.07.2024

Все неорганические вещества делятся на простые соединения: металлы; неметаллы. И сложные: бинарные соединения; основания; кислоты; соли.
Как располагаются неметаллы в таблице Менделеева? Из 118 известных на данный момент химических элементов 96 являются металлами, и только 22 относятся по общей характеристике элементов к неметаллам. На долю неметаллических химических элементов приходится большая часть массы живых организмов. А в состав земной атмосферы входят как простые, так и сложные вещества, образованные элементами-неметаллами.
Расположение неметаллических элементов в Периодической системе

В короткопериодном варианте – в главных подгруппах -неметаллы. Общую характеристику рассмотрим ниже. Неметаллы расположены правее и выше диагонали Бора и Астата. В длиннопериодном варианте – в конце справа в группах IVA, VA, VIA, VIIA, VIIIA.
Из всех открытых на сегодняшний день химических элементов неметаллических элементов немного – всего 22. Из них 16 активных элементов и 6 инертных газов. Однако химия неметаллов богаче, чем химия всех металлов. Неметаллические элементы играют огромную роль в существовании жизни на Земле.
Общая характеристика неметаллов
Атомы неметаллических элементов содержат на внешнем уровне от четырех до семи электронов и по восемь электронов у инертных газов, за исключением водорода (один электрон) и гелия (2 электрона). Поэтому в общей характеристике строения атомов неметаллов - это способность и принимать и отдавать электроны, играя роль как окислителей, так и восстановителей.
Таким образом, в соединениях неметаллические элементы проявляют как отрицательные, так и положительные степени окисления. Характерные значения валентности и степени окисления неметаллов связаны со строением их внешнего электронного уровня
Так, например, сера может проявлять валентность 2, 4, 6 за счет разъединения электронов. В природе неметаллы, кроме кислорода, азота, водорода, серы и инертных газов, существуют в виде соединений: сульфидов, оксидов, хлоридов, силикатов, сульфатов, карбонатов, фосфатов различных металлов.
Неметаллические элементы в свободном виде существуют в виде простых веществ – неметаллов. Рассмотрим их строение, свойства и применение. Атомы неметаллов связаны между собой ковалентной связью. Формы существования неметаллов различны. Водород, иод, хлор, фтор, бром, существуют только в виде двухатомных молекул H2, I2, Cl2, F2 Br2. Причина состоит в том, что у них есть только одна возможность образовать общую пару за счет единственного неспаренного электрона.
Аллотропия неметаллов
С увеличением числа неспаренных электронов для элементов появляется возможность образования простых веществ разного состава – аллотропных видоизменений. Так, кислород образует две аллотропных модификации.
Водород H2, фтор F2, хлор Cl2, азот N2, кислород O2, озон O3 – довольно легкие неполярные молекулы, которые слабо взаимодействуют друг с другом. Поэтому все перечисленные вещества – газы при обычной температуре.
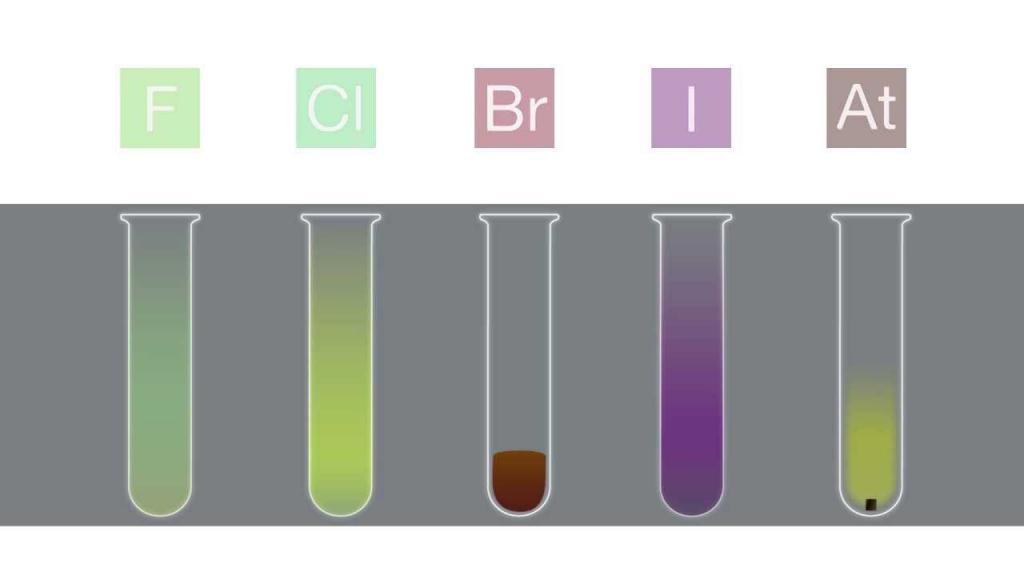
Бром Br2 – жидкость, а I2 – твердое вещество. В твердом виде все они имеют молекулярную кристаллическую решетку.
Методы получения
Первым пунктом общей характеристики неметаллов можно считать методы их получения. Неметаллы получают различными способами:
- Отделением от других веществ из природных соединений. Например, разделение жидкого воздуха на кислород, азот и остаточные инертные газы.
- Восстановлением из соединения, если неметалл в нем имеет положительную степень окисления. Например, восстановление водорода из воды электролизом: +1 –2 0 Катод (-) 2H2O + 2е = H2+ 2OH - .
- Окислением из соединения, в котором неметалл имеет отрицательную степень окисления. Например, окисление хлорид-ионов при электролизе раствора или расплава хлорида натрия: Анод (+) 2Cl - - 2е = Cl 0 2↑.
Также различают промышленные и лабораторные способы получения неметаллов.
Физические свойства
Второй пункт общей характеристики неметаллов - их физические свойства. В основном неметаллы обладают атомной или молекулярной кристаллической решеткой. Часть из них хорошо проводят электрический ток, либо являются полупроводниками. Третий пункт в изучении общей характеристики неметаллов состоит в рассмотрении их химических свойств.
Неметаллы могут служить в химических реакциях, как окислителями, так и восстановителями. Исключение составляет фтор F2, который всегда играет роль окислителя. Поэтому все реакции с участием неметаллов являются окислительно-восстановительными.
Рассмотрим отношение неметаллов к воде, металлам, друг к другу, а также к оксидам, кислотам, основаниям и солям. Все неметаллы устойчивы к нагреванию, поэтому большинство их реакций проходит только при высоких температурах:
1. С водой при обычных условиях активно взаимодействует только фтор: F2 + H2O = 2HF + O 2O = O2; O2 + O = O3. Можно сказать, что вода горит во фторе. При этом образуется сложная смесь веществ, в том числе фториды кислорода OF2 и O2F2. Хлор и бром взаимодействуют с водой только частично: Cl2 + H2O ←→ HCl + HClO Растворы хлора Cl2 в воде называют хлорной водой. При пропускании водяного пара над нагретым углем образуется водяной газ: C + H2O = t o CO + H2.
2. С металлами взаимодействуют все неметаллы, кроме инертных газов. В результате образуются бинарные соединения: оксиды, гидриды, карбиды, нитриды, фосфиды, сульфиды, хлориды, бромиды, иодиды и др. Ca + H2 = CaH2 – гидрид кальция.
3. Друг с другом неметаллы реагируют только при нагревании (кроме фтора), образуя бинарные соединения разного типа:
- Оксиды: N2 + O2 ←→ 2NO –Q – оксид азота (II) Из неметаллов непосредственно с кислородом не реагируют только хлор, бром, иод. Их оксиды получают косвенным путем.
- Водородные соединения: H2 + S = H2S – сероводород.
4. С оксидами при обычных условиях неметаллы практически не реагируют. При нагревании происходят немногочисленные, но практически важные реакции. Например, восстановление металлов и неметаллов из оксидов: FeO + C = Fe + CO↑.
Рассмотрим общую характеристику неметаллов на примере галогенов

Фтор F2 и хлор Cl2 проявляют сходные физические свойства: это ядовитые газы с резким запахом, причем фтор имеет светло-желтый цвет, а хлор – желто-зеленый. Бром Br2 – тяжелая жидкость красно-бурого цвета. Хлор и бром частично растворимы в воде, их раствор называют хлорной и бромной водой.
Иод I2 – очень мало растворим в воде, лучше растворяется в спирте или других органических растворителях.
Галогены получают путем электролиза расплава или раствора NaCl или вытеснением их хлором. Галогены вытесняют друг друга из растворов их кислот: 2HBr + Cl2 = 2HCl + Br2.
Неметаллы – это химические элементы, для атомов которых характерна способность, принимать электроны до завершения внешнего слоя благодаря наличию, как правило, на внешнем электронном слое 4-х и более электронов и малому радиусу атомов по сравнению с атомами металлов.
Все элементы-неметаллы (кроме водорода) занимают в периодической системе химических элементов Д. И. Менделеева верхний правый угол, образуя треугольник, вершиной которого является фтор F, а основанием диагонали B-At.

Для неметаллов характерны высокие значения электроотрицательности, она изменяется в пределах от 2 до 4. неметаллы – это элементы главных подгрупп, преимущественно p-элементы, исключение составляет водород – s-элемент.
У атомов неметаллов преобладают окислительные свойства, то есть способность присоединять электроны.
В соответствии с численными значениями относительных электроотрицательностей окислительные способности неметаллов увеличиваются в следующем порядке:

Все неметаллы, кроме фтора, проявляют восстановительные свойства (способность отдавать электроны). Причем эти свойства постепенно возрастают от кислорода к кремнию:


Как видно из таблицы, неметаллические элементы в основном расположены в правой верхней части периодической системы.
В электронной оболочке атомов неметаллов на внешнем энергетическом уровне, как правило, содержится от 4до 8 электронов. Исключение составляют только водород H, у которого в электронной оболочке атома вообще только один электрон, гелий He с двумя электронами и бор B, у которого на наружнем энергетическом уровне имеется три электрона.
Радиусы атомов неметаллов меньше, чем у металлов того же периода, поэтому в силу близости положительно заряженного ядра атома, неметаллы хорошо удерживают свои валентные электроны (электроны внешнего энергетического уровня).

Характер изменения радиусов атомов химических элементов в периодах и в группах. Радиусы атомов неметаллов существенно меньше, чем радиусы атомов металлов, находящихся в том же периоде.
Главное отличительное свойство неметаллов — это их высокая электроотрицательность, т.е. способность в химических соединениях притягивать электроны.

Величины относительных электроотрицательностей (ОЭО) некоторых химических элементов (по Л. Полингу). ОЭО неметаллических химических элементов (выделены красным цветом) превосходит соответствующую величину металлических химических элементов.
Атомы неметаллов способны как принимать, так и отдавать электроны, а значит, химические вещества, содержащие такие атомы, в ходе превращений могут выступать как в роли окислителей, так и в роли восстановителей.
На внешнем электронном слое у атомов неметаллов находится различное число электронов: у атома водорода – один электрон (1s 1 ), у атома гелия – два электрона (1s 2 ), у атома бора – три элетрона (2s 2 2 p 1 ). Однако атомы большинства неметаллов, в отличие от атомов металлов, на внешнем электронном слое имеют большое число электронов – от 4 до 8; их электронные конфигурации изменяются от ns 2 np 2 у атомов элементов главной подгруппы IV группы до ns 2 np 6 у атомов инертных газов.
Положение неметаллов в периодической системе Д.И. Менделеева и электронные конфигурации внешнего электронного слоя их атомов

Из 118 известных на данный момент химических элементов 96 являются металлическими и только 22химических элемента относятся к неметаллическим.
Кислород и кремний составляют около 76 % (практически три четверти) от массы земной коры (O2 — 49,4 %, Si — 25,8 %).

Такие химические элементы, как углерод C, водород H, кислород O, азот N, фосфор P, и сера S составляют 98,5 % от массы растений и 97,6 % от массы тела человека.


В состав земной атмосферы входят как простые, так и сложные вещества, образованные элементами неметаллами.
В объёмных долях на азот N2 приходится 78 %, на кислород O2 — 21 %, а инертные газы составляют 0,96%от объёма воздуха. В состав земной атмосферы также постоянно входит углекислый газ CO2, доля которого (по разным оценкам) составляет около 0,04 % от состава чистого воздуха.
Следует иметь в виду, что в воздухе постоянно содержится водяной пар H2O и другие соединения неметаллов, доля которых не является постоянной.

Главный химический элемент Вселенной — это водород. Из него образованы Солнце и другие звёзды, газовые облака и т.д. И на нашей планете из каждых 100 атомов, 17 — это атомы водорода.
Простые вещества, образованные атомами неметаллов, построены с помощью ковалентных неполярных связей.
Два типа строения простых веществ неметаллов:
Молекулярное строение. При обычных условиях большинство таких веществ представляют собой газы (H2, N2, O2, F2, Cl2, O3) или твердые вещества (I2, P4, S8) и лишь бром (Br2) является жидкостью. Все эти вещества летучи, в твердом состоянии они легкоплавки, и способны к возгонке.
Атомное строение. Вещества образованы длинными цепями атомов (Cn, Bn, Sin, Sen, Ten) – имеют высокую твердость, высокие температуры кипения и плавления.
Многие элементы-неметаллы образуют несколько простых веществ – аллотропных модификаций.
Все газообразные вещества, жидкий бром, а также типичные ковалентные кристаллы представляют собой диэлектрики. Кристаллы непластичны, а любая деформация вызывает разрушение ковалентных связей. Большинство неметаллов не имеют металлического блеска.
Химические свойства
1. Окислительные свойства неметаллов
- взаимодействие с металлами:
2Na + S = Na2S
- взаимодействие с водородом (образуются летучие водородные соединения):
H2 + Cl2 = 2HCl
- любой неметалл выступает в роли окислителя в реакциях с теми неметаллами, которые имеют более низкое значение электроотрицательности:
2P + 3Cl2 = 2PCl3
- взаимодействие со сложными веществами:
CH4 + 2O2 = CO2 + 2H2O
- взаимодействие с кислородом (исключение – фтор):
4P + 5O2 = 2P2O5
- взаимодействие со сложными веществами-окислителями:
S + 6HNO3 = H2SO4 + 6NO2? + 2H2O.
При взаимодействии с неметаллами концентрированная серная кислота восстанавливается до SO2.



1. Какой объем хлороводорода может быть получен из 40 л хлора, если объемы газов измерены при одинаковых условиях?

2. Какой объем оксида углерода (IV) (н. у.) получится при разложении известняка массой 500 г, содержащего 20% примесей?


3. Назовите неметаллы, которые при обычных условиях являются газообразными веществами. Какой неметалл при обычных условиях находится в жидком состоянии.
5. Назовите все неметаллы, атомы которых имеют конфигурацию внешнего слоя: ns 2 np 5 , ns 2 np 3 .
6. Укажите, в каких из указанных ниже соединений атомы неметаллов имеют положительные степени окисления:

8. Напишите химическую формулу каждого из следующих веществ: а) фторида ксенона ( IV ); б) оксида азота ( I ), в) хлорида фосфора ( V ).
Неметаллы (неМе) в Периодической системе химических элементов располагаются в правом верхнем углу:

Перечислим все неметаллы:

У большинства неметаллов есть общие характеристики и свойства:
- Относительно небольшой радиус атома.
- Высокая электроотрицательность (значения, близкие к 3-4). Чем ближе к фтору элемент, то есть чем выше и правее расположен элемент, тем больше его электротрицательность.
- У неметаллов относительно электронов на внешнем энергетическом уровне (исключения — водород, бор, гелий). Как правило, у большинства неметаллов от 4 до 8 электронов на внешнем энергетическом уровне.
- Большинство неметаллов проявляют окислительные свойства. Окислительные свойства простых веществ зависят не только от положения в Периодической системе, но и от особенностей строения их молекул. Фтор, хлор или кислород в виде простых веществ — сильные окислители; мышьяк, селен, водород, углерод и кремний в виде простых веществ сильные восстановители и слабые окислители. А в целом почти все неметаллы могут проявлять как окислительные, так и восстановительные свойства в реакциях.
- Среди неметаллов есть газообразные вещества (H2, O2, N2, Cl2, F2), жидкие вещества (Br2) и твердые вещества (к примеру, S8, P4, I2).
- Для неметаллов характерны крайне низкие значения электро- и теплопроводности, у них отсутствуют такие свойства, как ковкость, пластичность.
Остановимся подробно на свойствах и характеристиках конкретных неметаллов.
+6C 1s 2 2s 2 2p 2
+14Si … 3s 2 3p 2
(3 неспаренных электрона)
- молекулярный азот — очень инертное вещество;
- реагирует с кислородом под действием электрического разряда, образуя оксид азота NO, реакция эндотермическая;
- реагирует с активными металлами при нагревании, образуя нитриды, с литием реагирует при комнатной температуре;
- не взаимодействует с кислотами, щелочами, водой;
- реагирует с водородом в жестких условиях с образованием аммиака.
+15Р … 3s 2 3p 3

Презентация по теме "Общая характеристика неметаллов" может быть использована как сопровождение вводного урока химии по неметаллам в 9 классе. В презентации отражены основные физические свойства неметаллов, приведены причины и примеры аллотропных модификаций.

ОБЩИЕ СВЕДЕНИЯ

Красный фосфор

- В состав земной атмосферы входят простые и сложные вещества, образованные элементами-неметаллами ( N 2 -75,5% , O 2 -23,2% , а также CO 2 ,H 2 O и др.)
- Водород – главный элемент Вселенной (Солнце и другие звёзды, газовые облака и т.д.) Из каждых 100 атомов на Земле 17 – это атомы водорода.
Элементы в неживой природе.

Нахождение в природе .
Самородные элементы
Азот и кислород, инертные газы в составе воздуха

Нахождение в природе
← Апатиты Р
Галит NaCl →
← FeS 2 пирит
Кварц SiO 2 →

Неметаллы - это химические элементы, которые могут проявлять свойства как окислителя ( принимают электроны), так и восстановителя (отдают электроны).
НеМ – элементы с высокой ОЭО (2 - 4)
Исключения : фтор – только окислитель,
инертные газы – могут только отдавать электроны.
Гелий, неон и аргон – соединений не образуют.

Соединения неметаллов.
SO 3 , SO 2 , CO 2 и другие.
H 2 SO 4 , H 2 SO 3 ,H 2 CO 3 и другие
Образуют летучие соединения с водородом HCl, NH 3 …

ПОЛОЖЕНИЕ в ПСХЭ
III А
VII А
14 Si
VIII А
33 As
34 Se
10 Ne
17 Cl
35 Br
52 Te
18 Ar
36 Kr
54 Xe
85 At
86 Rn

Агрегатное состояние
Газообразное
Жидкое
Не N 2 Н 2 Cl 2 O 2 O 3
Твёрдое
Br 2
I 2 P 4 C Si B S 8

Характеристики сравнения Атомы металлов Количество электронов на внешнем уровне Атомы неметаллов Радиус атома Электроотрицательность Способность отдавать и принимать электроны с целью завершения внешнего энергетического уровня По периоду – уменьшается, по группе - возрастает По периоду – возрастает, по группе - уменьшается Способны только отдавать электроны Более склонны принимать электроны, чем отдавать их " width="640"
Атомы неметаллов
Сравните строение электронных оболочек и атомные характеристики (радиус, электроотрицательность, способность отдавать и принимать электроны) металлов и неметаллов.
Характеристики сравнения
Атомы металлов
Количество электронов на внешнем уровне
Атомы неметаллов
Способность отдавать и принимать электроны с целью завершения внешнего энергетического уровня
По периоду – уменьшается, по группе - возрастает
По периоду – возрастает, по группе - уменьшается
Способны только отдавать электроны
Более склонны принимать электроны, чем отдавать их

Простые вещества - неметаллы строение
Определите вид химической связи в молекулах N 2 , O 2 , Cl 2 , составьте схемы её образования, укажите её особенности
Химическая связь – ковалентная неполярная:
Типы кристаллических решеток

Химические свойства неметаллов
- Преобладают окислительные свойства:
В соответствии с численными значениями относительной ЭО окислительные способности неметаллов увеличиваются в следующем порядке: Si B H 2 P C S I 2 N 2 Cl 2 O 2 F 2

Аллотропия
Причины аллотропии
Аллотропия состава
Аллотропия формы
ЭЛЕМЕНТЫ - IA,IIIA,IVA

ПНИКТОГЕНЫ -VA

ХАЛЬКОГЕНЫ - VIA

ГАЛОГЕНЫ - VIIA

ИНЕРТНЫЕ ГАЗЫ- VIIIA

Строение атомов НеМ
1. Элементы расположены в главных подгруппах III –VIII групп (А).
2. На последнем уровне 3 – 7(8) электронов.
3. Радиус атома уменьшается
4. Неметаллические свойства
В периоде – увеличиваются
В группе - уменьшаются

Строение атомов НеМ
- 5. Высокая электроотрицательность.
- 6. Принимают электроны и отдают.
- 7. НеМ → кислотный оксид→кислота
- 8. Летучие водородные соединения
(кислоты, основания и безразличные)

Строение неметаллов .
Простые вещества - неметаллы строение и физические свойства
Распределите вещества C, N 2 ,O 2 , Si, Br 2 ,I 2 на две группы на основании данных об агрегатных состояниях и температурах кипения, определите причину различия в свойствах:
O 2 , N 2 , Br 2 , I 2 C, Si
молекулярная крист. решётка атомная крист. решётка
Газообразные или легколетучие вещества с низкими температурами плавления
Твердые нелетучие вещества с высокими температурами плавления
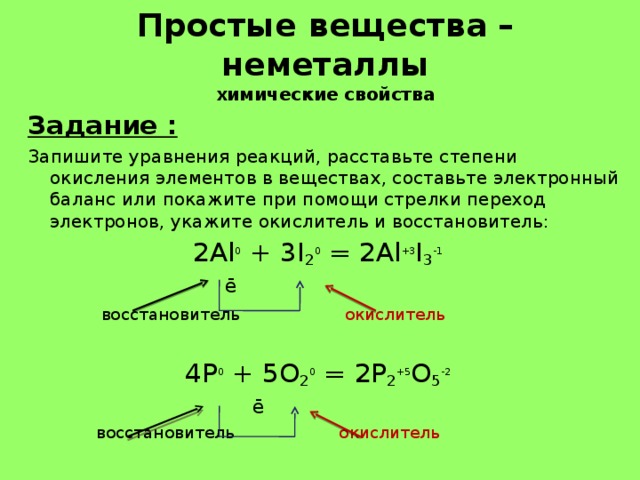
Простые вещества – неметаллы химические свойства
Запишите уравнения реакций, расставьте степени окисления элементов в веществах, составьте электронный баланс или покажите при помощи стрелки переход электронов, укажите окислитель и восстановитель:
2Al 0 + 3I 2 0 = 2Al +3 I 3 -1
4P 0 + 5O 2 0 = 2P 2 +5 O 5 -2

Подведём итоги
- Символы неМе расположены в периодической системе в главных подгруппах над диагональю B-At .
- На внешнем энергетическом уровне содержат от 4 до 8 электронов; имеют меньший радиус и более высокую электроотрицательность, чем атомы металлов.
- Простые вещества-неметаллы образованы при помощи ковалентной неполярной химической связи, могут иметь атомную или молекулярную кристаллическую решётку.
- В химических реакциях способны выступать как окислителями, так и восстановителями.
Кислород, водород – пример газообразных бесцветных неметаллов

Хлор (как и фтор) – окрашенные газообразные неметаллы.
При растворении хлора в воде получается хлорная вода

Бром – жидкость красно-бурого цвета
При растворении брома в воде получается бромная вода

При растворении брома в воде получается бромная вода

Большинство неметаллов имеют твёрдое агрегатное состояние
Сера – кристаллическое вещество жёлтого цвета
Красный фосфор
Углерод (уголь)

Неметаллы малорастворимы в воде
Сера не смачивается водой

Домашнее задание.
авторы Н.Е.Кузнецова и др.
§ 20,21,22 стр.58 № 1, 2, 3,4. Стр. 65 № 1
Написать уравнения реакций:
- Кислород + сера, кремний, фосфор, медь, алюминий,
- Водород + сера, кислород, хлор, калий
- Сера + фосфор, натрий, алюминий.
- Углерод + кремний, алюминий.
- Указать окислитель и восстановитель.

-75%
Читайте также:

