Как сделать нитробензол в домашних условиях
Добавил пользователь Владимир З. Обновлено: 05.10.2024
Нитробензол получают прямым нитрованием бензола. Наиболее вероятными примесями являются нитропроизводные циклических соединений, содержащихся в качестве примесей в бензоле. Чаще всего это - нитротолуол и нитротиофен. Некоторые плохо очищенные препараты могут характеризоваться свободной кислотностью.
Мак-Алпин и Смайс очищали чистый продажный нитробензол для электрохимических измерений путем пятикратной перекристаллизации, осушки пятиокисью фосфора и перегонки при пониженном давлении. В качестве критериев чистоты они использовали температуру замерзания и показатель преломления.
Целью большого числа работ являлось получение нитробензола, не содержащего нитротолуола, динитробензола и динитро-тиофена. Исчерпывающее исследование очистки нитробензола провели Коен и Бокхорст. Поступающий в продажу Реактив несколько раз подвергали дробной кристаллизации и фракционированной перегонке (при давлении 2 мм), затем сушили пятиокисью фосфора и, в заключение, снова подвергали дробной перекристаллизации в отсутствие влаги. Температура плавления 8 атмосфере сухого водорода составляла 5.76+0.01°. Этот препарат хранили в течение 5 месяцев в темноте в запаянном сосуде; за это время температура плавления изменилась менее чем на 0.01°.
Мессон несколько раз подвергал дробной кристаллизации свободный от тиофена бензол, а затем нитровал его и очищал. Температура плавления оказалась такой же, что и температура плавления препарата, полученного Коеном и Бокхорстом. Аллотропии не наблюдалось.
Сиджвик и Юбэнк, а также Дэви и Сиджвик Нитровали не содержащий тиофена бензол теоретическим количеством азотной кислоты в присутствии большого избытка серной кислоты. Температуру поддерживали ниже 40°, чтобы избежать образования динитросоединения. Полученный нитробензол перегоняли при пониженном давлении и подвергали дробной кристаллизации.
Согласно наблюдениям Гантча, нитробензол, полученный из чистого бензола и очищенный многократными фракционированием и перекристаллизацией, бесцветен. Загрязненный нитробензол быстро окрашивается при стоянии над пятиокисью фосфора, тогда как чистый препарат обычно остается в этих условиях бесцветным даже после стояния в течение нескольких месяцев.
Мейзенхеймер и Дорнер сушили продажный нитробензол хлористым кальцием и фракционировали его при пониженном давлении с целью использования для криоскопических измерений. Для каждой серии опытов, брали свежеперегнанный нитробензол. Роберте и Бюри очищали продажный реактив, подвергая его пять раз фракционированной перегонке и дробной кристаллизации. Среднюю фракцию от последней кристаллизации сохраняли над пятиокисью фосфора. Непосредственно перед использованием препарат перегоняли в вакууме в тщательно вымытый прибор для проведения криоскопических измерений, причем использовали только среднюю фракцию.
Смит, Фокинг и Барбер очищали нитробензол для измерений растворимости перегонкой в вакууме и осушкой над хлористым кальцием. В качестве критерия чистоты использовали показатель преломления.
Вильяме и Огг подвергали нитробензол многократной дробной кристаллизации, после чего фракционировали его. Температура кипения составляла 210.6 - 210.8°.
Бранд и Кранц нитровали тщательно очищенный бензол, отгоняли с водяным паром образующийся нитробензол, сушили его над хлористым кальцием, а затем перекристаллизовывали и перегоняли несколько раз при пониженном давлении; полученный препарат использовали для оптических измерений. Шайбе, Мей и Фишер получали нитробензол из несодержащего тиофена бензола, перегоняли его и перекристаллизовывали из этилового спирта для удаления динитросоединений.
Критерии чистоты. Розин приводит технические условия для выпускаемого в продажу чистого препарата нитробензола. Кислотность определяют встряхиванием 16 мл нитробензола с 50 мл воды в течение 1 мин., отделением водной фазы и добавлением в нее двух капель индикатора бромфено-ла синего. При титровании едким натром цвет раствора изменяется от желтого до синевато-лилового, причем на нейтрализацию должно расходоваться не более чем 0.5 мл 0.02 н. раствора едкого натра.
Пределы перегонки. 210-212°
Температура замерзания. не ниже 5°
Многие исследователи использовали в качестве критерия чистоты нитробензола температуру его замерзания, установленную Коеном и Бокхорстом.
Токсикология. Элкинс считает, что максимально допустимая концентрация нитробензола в воздухе составляет 0.0005%. Нитробензол является одним из наиболее токсичных ароматических растворителей. При неоднократном действии в весьма малых дозах он вызывает (так же как и бензол) сильнейшую анемию. Максимально допустимую концентрацию в настоящее время считают равной 0.0001%.
Данные взяты из справочника А.Вайсбергер, Э.Проскауэр, Дж.Риддик, Э.Тупс
Органические растворители.- М.:Издатинлит, 1958.



Нитросоединения жирного ряда могут быть получены при непосредственном действии азотной кислоты или окислов азота на предельные углеводороды. Прямое нитрование углеводородов жирного ряда и нафтеновых углеводородов изучено М. И. Коноваловым (реакция Коновалова). С. С. Наметкин объяснил механизм этой реакции и широко использовал ее для установления строения терпеновых углеводородов. Однако метод прямого нитрования мало пригоден для препаративных целей, так как он не дает возможности получить достаточно однородный продукт. Лучшие результаты получаются при действии азотистокислых солей на галоидопроизводные углеводородов, например:
В качестве побочного продукта при этом образуется некоторое количество сложного эфира азотистой кислоты C 2 H 5 -O-NO, который легко отделить от нитросоединения ввиду значительно более низкой температуры его кипения.
Нитросоединения ароматического ряда, напротив, легко получаются при непосредственном нитровании углеводородов и других ароматических соединений - фенолов, кислот и пр. В случае легко нитрующихся соединений реакция идет при применении разбавленной азотной кислоты; трудно вступающие в реакцию вещества нитруют смесью концентрированных азотной и серной кислот. Серная кислота связывает образующуюся при реакции воду и тем самым поддерживает необходимую для реакции концентрацию азотной кислоты. Непосредственное нитрование является единственным практически применяемым методом получения нитросоединений ароматического ряда.
Примером получения нитросоединений жирного ряда действием азотистокислых солей на галоидные производные может служить синтез нитрометана. В качестве исходного вещества берут монохлоруксусную кислоту, в которой хлор обладает значительной подвижностью. При взаимодействии натриевой соли хлоруксусной кислоты с азотнокислым натрием образуется натриевая соль нитроуксусной кислоты:
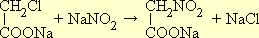
При нагревании нитроуксусная кислота легко декарбоксилируется (т. е. отщепляет CO 2 ), образуя нитрометан:
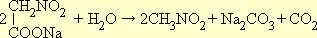
Реактивы:
Хлоруксусная кислота. 18,9 г (0,2 моля)
Азотистокислый натрий. 14 г (0,2 моля)
Едкий натр; хлористый кальций
К смеси указанного количества хлоруксусной кислоты и 20 г толченого льда прибавляют при помешивании 14 мл охлажденного во льду 40%-ного раствора едкого натра до щелочной реакции (по фенолфталеину). При нейтрализации температура смеси не должна подниматься выше 20°. Полученный раствор хлоруксуснокислого натрия приливают к раствору азотистокислого натрия в 18 мл воды, находящемся в перегонной колбе емкостью 200 мл. Колбу соединяют с холодильником и закрывают пробкой с термометром, шарик которого должен быть погружен в жидкость.
Смесь медленно нагревают до начала выделения пузырьков углекислого газа, что происходит при температуре около 80°. После этого прекращают нагревание, так как реакция продолжается самостоятельно, без подогрева извне. Если температура смеси начинает понижаться, то вновь осторожно подогревают до 85°. Когда реакция в основном закончится, реакционную смесь осторожно подогревают, доводя температуру ее к концу реакции до 110°. Нитрометан начинает перегоняться при температуре около 90°. При отгонке получают не менее 5 мл нитрометана и около 15 мл воды.
Темп. кип. чистого нитрометана 101,2°; уд. вес 1,1382; показатель преломления 1,3935.
Нитрометан является нейтральным соединением, но в присутствии щелочей изомеризуется в аци-форму, взаимодействующую со щелочью с образованием соли:
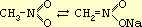
При подкислении раствора соль разлагается и выделившаяся в свободном виде аци-форма постепенно переходит в нейтральный нитрометан. Присутствие аци-формы нитрометана может быть обнаружено по характерному окрашиванию с хлорным железом.
Растворяют 0,5 мл нитрометана при нагревании в 1 мл 1 н. раствора едкого натра и прибавляют несколько капель раствора хлорного железа. По охлаждении в пробирку осторожно по каплям прибавляют разбавленный раствор соляной кислоты. Появляется кровавокрасное окрашивание.
Обязательным условием успешного протекания реакции является хорошее перемешивание реагирующих веществ.
Наряду с нитробензолом образуется небольшое количество динитробензола. Повышение температуры во время нитрования приводит к образованию значительных количеств динитропродукта.
Реактивы:
Бензол. 18 мл или 15,6 г (0,2 моля)
Азотная кислота уд. веса 1,4. 20 мл (0,28 моля)
Серная кислота конц. 25 мл (0,45 моля)
Углекислый натрий; хлористый кальций
В колбе емкостью 260 мл осторожно, при охлаждении, смешивают азотную кислоту с серной. К охлажденной до комнатной температуры смеси постепенно, небольшими порциями, прибавляют бензол, каждый раз хорошо перемешивая содержимое колбы и наблюдая за тем, чтобы температура смеси не превышала 50-60°. В случае необходимости колбу охлаждают водой. (Для уменьшения потерь бензола за счет испарения к колбе присоединяют воздушный холодильник.) Когда весь бензол прибавлен, колбу помещают на водяную баню, нагретую до 60°, и ведут реакцию при этой температуре в течение получаса, часто и энергично перемешивая жидкость.
Затем реакционную смесь переливают в литровую колбу, содержащую 300 мл воды, перемешивают жидкость, охлаждают и при помощи делительной воронки отделяют находящийся в нижнем слое нитробензол *1 . Его промывают в делительной воронке сначала разбавленным раствором углекислого натрия, а затем чистой водой.
Промытый нитробензол переливают в небольшую колбу и прибавляют прокаленный хлористый кальций. Колбу закрывают пробкой, в которую вставлена стеклянная трубка (в качестве обратного воздушного холодильника), и нагревают на водяной бане. Когда жидкость станет прозрачной, переливают нитробензол в перегонную колбу и перегоняют с воздушным холодильником. После отгонки небольшого количества непрореагировавшего бензола перегоняется нитробензол при температуре 204-207°. Отгонять продукт досуха не следует во избежание разложения остающегося в колбе динитробензола *2 .
Темп. кип. чистого нитробензола 210,9°; уд. вес 1,2055; показатель преломления 1,5532.
Согласно правилу замещения в бензольном ядре, вторая нитрогруппа вступает в мета-положение по отношению к первой:
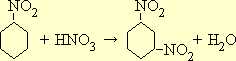
Так как замещение второго водородного атома бензольного ядра на нитрогруппу идет значительно труднее, чем замещение первого, то при получении динитробензола приходится создавать более жесткие условия нитрования (повышенная концентрация кислот, более высокая температура).
При реакции, кроме основного продукта м -динитробензола, получаются небольшие количества п -динитробензола (около 3%) и о -динитробензола (около 1%), которые можно удалить путем перекристаллизации препарата из спирта.
Реактивы:
Нитробензол. 12,3 г (0,1 моля)
Азотная кислота уд. веса 1,4. 10 мл (0,14 моля)
Серная кислота конц. 30 мл (0,55 моля)
Углекислый натрий; спирт
В колбу емкостью 200 мл вливают нитробензол и нагревают под тягой на кипящей водяной бане. К горячему нитробензолу при энергичном перемешивании небольшими порциями прибавляют нитрующую смесь. Температура реакционной смеси во время нитрования не должна подниматься выше 115°.
После внесения всего количества нитрующей смеси нагревание и перемешивание продолжают еще в течение 30-40 мин. Конец реакции устанавливают на основании следующей пробы: каплю раствора вносят в пробирку с водой; динитробензол должен при этом выпадать в виде бледножелтых кристаллов; если этого не происходит, нагревание необходимо продолжить.
По окончании реакции смесь охлаждают до 70° и при энергичном перемешивании ( под тягой ) выливают в 100 мл холодной воды. Сырой динитробензол выпадает в виде аморфной массы. По охлаждении кислый раствор декантацией сливают с осадка *1 , добавляют к последнему 50 мл воды и нагревают до кипения; динитробензол при этом плавится. По охлаждении воду сливают и повторяют ту же операцию, добавляя к воде углекислый натрий до резко щелочной реакции (по лакмусу). Охладив раствор, сливают воду через фильтр, а оставшийся на дне стакана динитробензол (в виде твердой лепешки) еще два раза плавят в чистой воде, беря каждый раз по 50 мл воды и сливая охлажденный раствор через тот же фильтр. Небольшое количество задержанных фильтром кристаллов промывают холодной водой, отжимают между листами фильтровальной бумаги, присоединяют к основной массе динитробензола, который вынимают из стакана, и высушивают на воздухе.
Полученный продукт плавится около 80°. Для получения вполне чистого м -динитробензола его перекристаллизовывают из спирта. Он образует бесцветные длинные иглы с темп. пл. 90°.
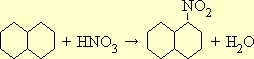
Реактивы:
Нафталин. 12,8 г (0,1 моля)
Азотная кислота уд. веса 1,4. 7,2 (0,1 моля)
Серная кислота конц. 13 мл (0,23 моля)
Метиловый спирт
Серную кислоту смешивают с 7 мл воды и с указанным количеством азотной кислоты. К смеси, нагретой до 50°, прибавляют тонко растертый нафталин и, поддерживая указанную температуру, ведут реакцию в течение 1 часа при постоянном перемешивании. (Целесообразно применить механическую мешалку.) Затем повышают температуру до 60° и в течение часа продолжают перемешивание смеси.
По охлаждении нитронафталин застывает в виде лепешки, плавающей на поверхности раствора. Кислую жидкость сливают, а сырой нитронафталин плавят в кипящей воде. По охлаждении воду сливают и повторяют эту операцию еще два раза. При такой обработке большая часть непрореагировавшего нафталина улетучивается с парами воды. Расплавленный продукт при энергичном перемешивании выливают в холодную воду, в которой он застывает в виде маленьких шариков. Осадок отфильтровывают, отжимают между листами фильтровальной бумаги и сушат на воздухе.
Полученный продукт не вполне чист и содержит небольшие количества динитронафталина и непрореагировавшего нафталина. Для получения чистого препарата его кристаллизуют из метилового спирта: он выпадает в виде желтых игл с темп. пл. 61,5°.
Фенол нитруется очень легко уже на холоду под действием разбавленной азотной кислоты. В соответствии с ориентирующим влиянием OH-группы как заместителя 1-го рода при этом получается о - и п -нитрофенол:
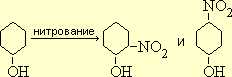
Разделение этих изомеров основано на том, что о -нитрофенол, в отличии от п -нитрофенола, перегоняется с водяным паром.
При нитровании фенола нужно избегать повышения температуры реакционной смеси во избежание образования ди- и тринитрофенола.
Реактивы:
Фенол. 28,2 г (0,3 моля)
Азотная кислота. 185 мл (0,6 моля)
Метиловый спирт; едкий натр; активный уголь; соляная кислота
К фенолу прибавляют 5 мл воды, нагревают до плавления, и смесь постепенно при перемешивании вносят в азотную кислоту. Колбу с азотной кислотой охлаждают водой, наблюдая за тем, чтобы температура реакционной смеси все время была ниже 20°. Смесь, принимающую темную окраску, оставляют стоять в течение нескольких часов в холодной воде, периодически взбалтывая.
По окончании реакции тщательно сливают кислоту, промывают несколько раз водой оставшуюся в колбе маслянистую, частично осмолившуюся массу и подвергают ее перегонке с водяным паром (прибор собирают, как показано на рис. 18). В приемник в виде желтого быстро кристаллизующегося масла переходит о -нитрофенол. Если о -нитрофенол начинает кристаллизоваться в холодильнике, то на некоторое время прекращают подачу в него воды; горячий конденсат расплавляет кристаллы о -нитрофенола, и он переходит в приемник.
Выпавший в приемнике о -нитрофенол отфильтровывают на воронке Бюхнера, отжимают между листами фильтровальной бумаги и высушивают на воздухе.
Если полученный продукт плавится при более низкой температуре, его перекристаллизовывают из метилового спирта.
Для выделения п -нитрофенола оставшуюся в колбе смолистую массу кипятят с 170 мл 10%-ного раствора едкого натра и небольшим количеством активного угля и фильтруют.
Еще горячий темный фильтрат упаривают до тех пор, пока капля раствора по охлаждении не будет застывать. Раствор охлаждают, выделившийся п -нитрофенолят отсасывают, промывают несколько раз небольшими порциями 10%-ного раствора едкого натра и хорошо отжимают на фильтре.
Полученную соль переносят в стакан и при нагревании разлагают 10%-ной соляной кислотой. Выделившийся нитрофенол по охлаждении застывает. Водный слой сливают и перекристаллизовывают нитрофенол из горячей 1-2%-ной соляной кислоты.
Свободный анилин при нитровании легко подвергается окислению и осмолению. Для предохранения аминогруппы от окисления анилин сначала подвергают ацетилированию. Полученный ацетанилид нитруется с образованием преимущественно п -нитроацетанилида:
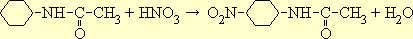
Если нитрование ведется при низкой температуре, то изомерный о -нитроацетанилид образуется лишь в весьма небольших количествах; повышенная же температура благоприятствует его образованию.
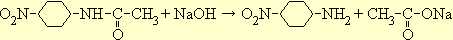
Реактивы:
Ацетанилид. 13,5 г (0,1 моля)
Азотная кислота уд. веса 1,38. 8 мл (0,11 моля)
Серная кислота конц.; углекислый натрий; спирт; едкий натр
Тонко измельченный сухой ацетанилид вносят в 30 мл концентрированной серной кислоты и перемешивают до тех пор, пока не получится вполне прозрачный раствор. Температура при этом не должна подниматься выше 25° во избежание омыления ацетанилида.
Раствор охлаждают до 0° в смеси льда и соли, и постепенно приливают смесь 8 мл азотной кислоты и 5 мл концентрированной серной кислоты. Температура во время нитрования не должна превышать 2-3° во избежание образования значительных количеств о -нитросоединения. После того как прибавлена вся кислота, продолжают перемешивание еще в течение получаса и смесь оставляют стоять на холоду в течение ночи.
На следующий день вливают раствор в смесь 35 мл воды и 35 г толченого льда; тотчас выпадает нитроацетанилид. Через полчаса осадок отфильтровывают, хорошо промывают водой, переносят в стакан с 50 мл воды, прибавляют углекислый натрий до щелочной реакции (по лакмусу) и нагревают до кипения. При этой обработке о -нитроацетанилид омыляется, а п -нитроацетанилид остается без изменения. Охлаждают раствор до 50°, отфильтровывают кристаллы п -нитроацетанилида, хорошо промывают водой и высушивают на воздухе.
Для получения п -нитроанилина сырой п -нитроацетанилид смешивают с 20 мл воды, приливают 12 мл 35%-ного раствора едкого натра и кипятят до тех пор, пока капля раствора, внесенная в 10%-ную соляную кислоту, не будет растворяться без осадка.
Обычно омыление заканчивается через 2,5-3 часа. Нужно следить, чтобы во время кипячения реакция все время оставалась щелочной. Смеси дают охладиться до 40°, отфильтровывают осадок, тщательно промывают холодной водой и высушивают.
*1 Остающийся в делительной воронке водный слой, содержащий серную и азотную кислоты (а также аналогичные ему растворы), нельзя непосредственно выливать в канализационную раковину; предварительно его необходимо нейтрализовать известковым молоком или известью.
Нитробензол — токсичное органическое вещество, имеющее миндальный запах. Формула C6H5NO2. Внешний вид — ярко-желтые кристаллы или маслянистая жидкость, нерастворимая в воде.
Содержание
Применение
Исходное сырьё в производстве анилина, ароматических азотсодержащих соединений (бензидин, хинолин, азобензол), растворитель эфиров целлюлозы, компонент полировальных составов для металлов. Применяется как растворитель и мягкий окислитель. В основном используется как полупродукт для производства анилина.
Получение
В промышленности нитробензол получают непрерывным нитрованием бензола смесью концентрированых H2SO4 и HNO3 с выходом 96—99 %.
В лабораторных условиях нитробензол получают нитрованием бензола смесью H2SO4 (1,84 г/см 3 ) и HNO3 (1,4 г/см 3 ) в соотношении 1:1 при 55—60 °C (45 мин). Выход целевого продукта достигает 80 %.
Химические свойства
Электрофильное замещение
В связи с сильным электроноакцепторным действием нитрогруппы реакции электрофильного замещения идут в мета-положение и скорость реакции ниже чем у бензола.
-
. Образуется смесь изомеров: 93 % м-динитробензола, 6,5 % о-динитробензола и 0,5 % п-динитробензола. .
- Галогенирование.
Восстановление
Наиболее важной реакцией ароматических нитросоединений является восстановление их до первичных аминов.
Эта реакция была открыта в 1842 году Н. Н. Зининым, который впервые восстановил нитробензол до анилина действием сульфида аммония. В настоящее время для восстановления нитрогруппы в аренах до аминогруппы в промышленных условиях применяется каталитическое гидрирование. В качестве катализатора используют медь на силикагеле в качестве носителя. Катализатор готовят нанесением карбоната меди из суспензии в растворе силиката натрия и последующим восстановлением водородом при нагревании. Выход анилина над этим катализатором составляет 98 %.
Иногда в промышленном гидрировании нитробензола до анилина в качестве катализатора используют никель в комбинации с оксидами ванадия и алюминия. Такой катализатор эффективен в интервале 250—300° и легко регенерируется при окислении воздухом. Выход анилина и других аминов составляет 97—98 %. Восстановление нитросоединений до аминов может сопровождаться гидрированием бензольного кольца. По этой причине для получения ароматических аминов избегают использовать в качестве катализаторов платину, палладий или никель Ренея.
В промышленности анилин получают каталитическим восстановлением нитробензола на медном или никелевом катализаторе, который вытеснил старинный способ восстановления нитробензола чугунными стружками в водном растворе хлорного железа и соляной кислоты.
Восстановление нитрогруппы до аминогруппы сульфидом и гидросульфидом натрия в настоящее время имеет значение только для частичного восстановления одной из двух нитрогрупп, например, в м-динитробензоле или 2,4-динитроанилине.
При ступенчатом восстановлении полинитросоединений с помощью сульфида натрия этот неорганический реагент превращается в тетрасульфид натрия, что сопровождается образованием щелочи.
Высокая щелочность среды приводит к образованию азокси- и азосоединений в качестве побочных продуктов. Для того чтобы избежать этого в качестве восстановителя следует использовать гидросульфид натрия, где щелочь не образуется.
Токсичность
Впитывается через кожу, оказывает сильное действие на ЦНС, нарушает обмен веществ, вызывает заболевания печени, окисляет гемоглобин в метгемоглобин
Существуют разные способы получения анилина. Сырьем служит вещество нитробензол, имеющее формулу C6H5NO2. Первоначально нитробензол подвергали прямому гидрированию с использованием катализаторов и высоких температур. Реакция идет следующим образом:
C6H5NO2 + 3H2 = C6H5NH2 + 2H2O.
Ее достоинство – простота и невысокая стоимость реагентов. Недостаток – низкий выход целевого продукта.
2
В 1842 году русский химик Николай Зинин экспериментальным путем нашел гораздо более эффективный способ превращения нитробензола в анилин. Он заключается в воздействии на нитробензол сульфидом аммония. Реакция протекает таким образом:
С6H5NO2 + 3(NH4)2S = C6H5NH2 + 6NH3 + 3S + 2H2O.
3
Можно получить анилин из нитробензола и путем восстановления порошком железа в присутствии водяного пара. Реакция протекает следующим образом:
Читайте также:

