Как сделать молекулярную массу
Обновлено: 05.07.2024
- Как вычислить молекулярную и молярную массы вещества?
- Моль, молярная масса
Как вычислить молекулярную и молярную массы вещества?
Для этого нужно сложить массы всех атомов в этой молекуле.
В молекуле воды Н2О 2 атома водорода и 1 атом кислорода. Атомная масса водорода = 1, а кислорода = 16. Поэтому молекулярная масса воды равна 1 + 1 + 16 = 18 атомных единиц массы, а молярная масса воды =18 г/моль.
В молекуле серной кислоты Н2SO4 2 атома водорода, 1 атом серы и 4 атома кислорода. Поэтому молекулярная масса этого вещества составит 1 2 + 32 + 4 16 = 98 а.е.м, а молярная масса - 98 г/моль.
В молекуле сульфата алюминия Al2(SO4)3 2 атома алюминия, 3 атома серы и 12 атомов кислорода. Молекулярная масса этого вещества равна 27 · 2 + 32 · 3 + 16 · 12 = 342 а.е.м., а молярная масса - 342г/моль.
Моль, молярная масса
Молярная масса - это отношение массы вещества к количеству вещества, т.е. М(х) = m(x)/n(x),
где М(х) - молярная масса вещества Х, m(x) – масса вещества Х, n(x) - количество вещества Х.
Единица СИ молярной массы - кг/моль,однако обычно используется единица г/моль. Единица массы - г, кг.
Единица СИ количества вещества - моль.
Моль - это такое количество вещества, в котором содержится 6,02·10 23 молекул этого вещества.
Любая задача по химии решается через количество вещества. Необходимо помнить основные формулы:
или общую формулу:
где V(x) – объем вещества Х(л), Vm - молярный объем газа при н.у. (22,4 л/моль), N - число частиц, NA - постоянная Авогадро (6,02·10 23 ).
Определите массу иодида натрия NaI количеством вещества 0,6 моль.
Молярная масса иодида натрия составляет:
M(NaI)= M(Na) + M(I) = 23 + 127 = 150 г / моль
Определяем массу NaI:
m(NaI) = n(NaI)·M(NaI) = 0,6 · 150 = 90 г.
Определите количество вещества атомного бора,содержащегося в тетраборате натрия Na2B4O7 массой 40,4 г.
Молярная масса тетрабората натрия составляет 202 г/моль.
Определяем количество вещества Na2B4O7:
Вспомним, что 1 моль молекулы тетрабората натрия содержит 2 моль атомов натрия, 4 моль атомов бора и 7 моль атомов кислорода (см. формулу тетрабората натрия).

1. Поместить в пробирку небольшое количество карбоната кальция или магния, прилить 2-3млраствора соляной кислоты.2. Провести наблюдение.3. Сделать выв … оды по работе. Написать словесные уравнения по проделанным реакциям.
7. Що называет быструю реакцию химич. Яки факторы влияют на скорость химических реакций. Как можно ускорить розчинення метала в кислоте, зміючи її кон … центрації?
СРОЧНО. Какое вещество образуется при взаимодействии 2-метил бутена с HCI .Напишите уравнение реакции.
Санитарная комиссия Н-ского района опубликовала данные, касающиеся концентрации различных ионов (мги) в воде местной реки. Сформулируйте свое мнение: … можно ли использовать речную воду в следующей ситуации? Заполните таблицу, исходя из этих данных, ответьте на вопросы.
Массы атомов и молекул очень малы, поэтому в качестве единицы измерения удобно выбрать массу одного из атомов и выражать массы остальных атомов относительно нее. Именно так и поступал основоположник атомной теории Дальтон, который составил таблицу атомных масс, приняв массу атома водорода за единицу.
До 1961 года в физике за атомную единицу массы (а.е.м. сокращенно) принимали 1/16 массы атома кислорода 16 О, а в химии – 1/16 средней атомной массы природного кислорода, который является смесью трех изотопов. Химическая единица массы была на 0,03% больше, чем физическая.
В настоящее время за в физике и химии принята единая система измерения. В качестве стандартной единицы атомной массы выбрана 1/12 часть массы атома углерода 12 С.
1 а.е.м. = 1/12 m( 12 С) = 1,66057×10 -27 кг = 1,66057×10 -24 г.
Относительная атомная и молекулярная масса элемента
Относительная атомная масса элемента (Ar) – это безразмерная величина, равная отношению средней массы атома элемента к 1/12 массы атома 12 С.
При расчете относительной атомной массы учитывается распространенность изотопов элементов в земной коре. Например, хлор имеет два изотопа 35 Сl (75,5%) и 37 Сl (24,5%).Относительная атомная масса хлора равна:
Ar(Cl) = (0,755×m( 35 Сl) + 0,245×m( 37 Сl)) / (1/12×m( 12 С) = 35,5.
Из определения относительной атомной массы следует, что средняя абсолютная масса атома равна относительной атомной массе, умноженной на а.е.м.:
m(Cl) = 35,5 ×1,66057×10 -24 = 5,89×10 -23 г.
Относительная молекулярная масса вещества (Mr) – это безразмерная величина, равная отношению массы молекулы вещества к 1/12 массы атома 12 С.
Относительная молекулярная масса молекулы равна сумме относительных атомных масс атомов, входящих в состав молекулы, например:
Абсолютная масса молекулы равна относительной молекулярной массе, умноженной на а.е.м.
Число атомов и молекул в обычных образцах веществ очень велико, поэтому при характеристике количества вещества используют специальную единицу измерения – моль.
Моль – это количество вещества, которое содержит столько же частиц (молекул, атомов, ионов, электронов), сколько атомов углерода содержится в 12 г изотопа 12 С.
Масса одного атома 12 С равна 12 а.е.м., поэтому число атомов в 12 г изотопа 12 С равно:
NA = 12 г / 12 × 1,66057×10 -24 г = 1/1,66057×10 -24 = 6,0221×10 -23 .
Таким образом, моль вещества содержит 6,0221×10 -23 частиц этого вещества.
Физическую величину NA называют постоянной Авогадро, она имеет размерность [NA] = моль -1 . Число 6,0221×10 -23 называют числом Авогадро.
Молярная масса вещества
Легко показать, что численные значения молярной массы М и относительной молекулярной массы Mr равны, однако первая величина имеет размерность [M] = г/моль, а вторая безразмерна:
Это означает, что если масса некоторой молекулы равна, например, 44 а.е.м., то масса одного моля молекул равна 44 г.
Постоянная Авогадро является коэффициентом пропорциональности, обеспечивающим переход от молекулярных отношений к молярным.
Молекулярная масса ( м ) масса данной молекулы: она измеряется в дальтон (Da или U). [1] [2] Различные молекулы одного и того же соединения могут иметь разные молекулярные массы, потому что они содержат разные изотопы элемента. Связанная величина относительной молекулярной массы, как определено ИЮПАК , представляет собой отношение массы молекулы к единой атомной единице массы (также известной как дальтон) и не имеет единицы измерения. Молекулярная масса и относительная молекулярная масса отличаются от молярной массы, но связаны с ней . Молярная масса определяется как масса данного вещества, деленная на количество вещества.и выражается в г / моль. Молярная масса обычно является более подходящей цифрой при работе с макроскопическими (взвешиваемыми) количествами вещества.
Определение молекулярной массы авторитетно является синонимом молекулярной массы; однако в обычной практике он также сильно варьируется, как и единицы, используемые вместе с ним. Многие распространенные подготовительные источники используют г / моль и эффективно определяют его как синоним молярной массы, в то время как более авторитетные источники используют Da или u и более точно согласовывают его определение с молекулярной массой. Даже когда молекулярный вес используется с единицами Da или u, он часто является средневзвешенным значением, аналогичным молярной массе, но с другими единицами измерения. В молекулярной биологии вес макромолекул называется их молекулярной массой и выражается в кДа, хотя численное значение часто является приблизительным и представляет среднее значение.
Молекулярная масса молекул малого и среднего размера, измеренная с помощью масс-спектрометрии, может использоваться для определения состава элементов в молекуле. Молекулярные массы макромолекул, таких как белки, также можно определить с помощью масс-спектрометрии; однако методы, основанные на вязкости и светорассеянии, также используются для определения молекулярной массы, когда кристаллографические или масс-спектрометрические данные недоступны.
СОДЕРЖАНИЕ
Атомные и молекулярные массы обычно выражаются в дальтонах, которые определяются относительно массы изотопа 12 C (углерода 12), которая по определению [4] равна 12 Да. Например, молярная масса и молекулярная масса метана , молекулярная формула которого CH 4 , рассчитываются соответственно следующим образом:
| Молярная масса или молекулярная масса CH 4 | |||
|---|---|---|---|
| Стандартный атомный вес | Число | Общая молярная масса (г / моль) или молекулярная масса (Да или г / моль) | |
| C | 12,011 | 1 | 12,011 |
| ЧАС | 1,008 | 4 | 4,032 |
| CH 4 | 16,043 | ||
| Молекулярная масса 12 C 1 H 4 | |||
| Масса нуклида | Число | Общая молекулярная масса (Da или u) | |
| 12 С | 12.00 | 1 | 12.00 |
| 1 ч | 1,007825 | 4 | 4,0313 |
| CH 4 | 16.0313 | ||
В приведенном выше примере стандартный атомный вес углерода составляет 12,011 г / моль, а не 12,00 г / моль. Это связано с тем, что природный углерод представляет собой смесь изотопов 12 C, 13 C и 14 C, которые имеют массы 12 Да, 13,003355 Да и 14,003242 Да соответственно. Более того, доля изотопов варьируется от образца к образцу, поэтому 12,011 г / моль - это среднее значение для разных мест на Земле. Напротив, существует меньше вариаций в природном водороде, поэтому стандартный атомный вес имеет меньшие вариации. Точность определения молярной массы ограничена.по стандартному атомному весу с наибольшей дисперсией, в данном примере - углерода. Эта неопределенность не то же самое, что неопределенность в молекулярной массе, которая отражает дисперсию (ошибку) в измерениях, а не естественную дисперсию содержания изотопов во всем мире. В масс-спектрометрии высокого разрешения массовые изотопомеры 12 C 1 H 4 и 13 C 1 H 4 наблюдаются как отдельные молекулы с молекулярными массами приблизительно 16,031 Да и 17,035 Да, соответственно. Интенсивность пиков масс-спектрометрии пропорциональна изотопному содержанию в молекулярных частицах. 12 C 2 H 1 H3 также можно наблюдать с молекулярной массой 17 Да.
В масс-спектрометрии молекулярная масса небольшой молекулы обычно указывается как моноизотопная масса , то есть масса молекулы, содержащей только наиболее распространенный изотоп каждого элемента. Обратите внимание, что это также незначительно отличается от молекулярной массы в том, что выбор изотопов определен и, таким образом, представляет собой единую удельную молекулярную массу из множества возможных. Массы, используемые для вычисления моноизотопной молекулярной массы, находятся в таблице изотопных масс и не встречаются в типичной периодической таблице. Средняя молекулярная масса часто используется для более крупных молекул, поскольку молекулы с большим количеством атомов вряд ли будут состоять исключительно из наиболее распространенного изотопа каждого элемента. Теоретическую среднюю молекулярную массу можно рассчитать, используя стандартные атомные веса.можно найти в типичной периодической таблице, поскольку, вероятно, существует статистическое распределение атомов, представляющих изотопы по всей молекуле. Однако средняя молекулярная масса образца обычно существенно отличается от этого, поскольку среднее значение для одного образца не совпадает со средним значением для многих географически распределенных образцов.
Молекулярная масса – одно из основных понятий в современной химии. Ее ввод стал возможным после научного обоснования утверждения Авогадро о том, что многие вещества состоят из мельчайших частиц – молекул, каждая из которых, в свою очередь, состоит из атомов. Этим суждением наука во многом обязана итальянскому химику Амадео Авогадро, который научно обосновал молекулярное строение веществ и подарил химии многие важнейшие понятия и законы.

Единицы масс элементов
Первоначально за базовую единицу атомной и молекулярной массы брали атом водорода как наиболее легкого из элементов во Вселенной. Но атомные массы в большинстве своем вычислялись но основе их кислородных соединений, поэтому было принято решение выбрать новый эталон для определения атомных масс. Атомную массу кислорода приняли равной 15, атомную массу самого легкого вещества на Земле, водорода, - 1. В 1961 году кислородная система определения веса была общепринятой, но создавала определенные неудобства.
В 1961 году была принята новая шкала относительных атомных масс, эталоном для которой стал изотоп углерода 12 С. Атомная единица массы (сокращенно а.е.м.) составляет 1/12 часть массы этого эталона. В настоящее время атомной массой называют массу атома, которая должна быть выражена в а.е.м.
Масса молекул
Масса молекула любого вещества равна сумме масс всех атомов, образующих данную молекулу. Самая легкая молекулярная масса газа у водорода, его соединение пишется как Н2 и имеет значение, приближенное к двум. Молекула воды состоит из атома кислорода и двух атомов водорода. Значит, ее молекулярная масса равна 15,994 + 2*1.0079=18.0152 а.е.м. Самые большие молекулярные массы имеют сложные органические соединения – белки и аминокислоты. Молекулярная масса структурной единицы белка колеблется от 600 до 10 6 и выше, в зависимости от количества пептидных цепей в этой макромолекулярной структуре.
Одновременно со стандартными единицами массы и объема в химии используется совершенно особая системная единица – моль.
Моль – это количество вещества, которое содержит столько структурных единиц (ионов, атомов, молекул, электронов), столько содержится в 12 граммах изотопа 12 С.
Молярная и молекулярная масса
Масса количества вещества в 1 моль измеряется в г/моль и называется молярной массой. Отношение между молекулярной и молярной массой можно записать в виде уравнения
ν = k × m/M, где к – коэффициент пропорциональности.
Нетрудно сказать, что для любых соотношений коэффициент пропорциональности будет равен единице. Действительно, изотоп углерода имеет относительную молекулярную массу 12 а.е.м, а, согласно определению, молярная масса этого вещества равна 12 г/моль. Отношение молекулярной массы к молярной равно 1. Отсюда можно сделать вывод, что молярная и молекулярная масса имеют одинаковые числовые значения.
Объемы газов
Как известно, все окружающие нас вещества могут пребывать в твердом, жидком или газообразном агрегатном состоянии. Для твердых тел наиболее распространенной базовой мерой является масса, для твердых и жидких – объем. Это связано с тем, что твердые тела сохраняют свою форму и конечные размеры, Жидкие и газообразные вещества конечных размеров не имеют. Особенность любого газа состоит в том, что между его структурными единицами – молекулами, атомами, ионами - расстояние во много раз больше, чем такие же расстояния в жидкостях или твердых телах. Например, один моль воды в нормальных условиях занимает объем 18 мл – приблизительно столько же вмещается в одну столовую ложку. Объем одного моля мелкокристаллической поваренной соли – 58,5 мл, а объем 1 моля сахара больше моля воды в 20 раз. Для газов места требуется еще больше. Один моль азота при нормальных условиях занимает объем, в 1240 раз больший, чем один моль воды.

Таким образом, объемы газообразных веществ существенно отличаются от объемов жидких и твердых. Это обусловлено разностью растояний между молекулами веществ в различных агрегатных состояниях.
Нормальные условия
Состояние любого газа сильно зависит от температуры и давления. Например, азот при температуре в 20 °С занимает объем в 24 литра, а при 100 °С при том же самом давлении - 30,6 литров. Химики учли такую зависимость, поэтому было принято решение сводить все операции и измерения с газообразными веществами к нормальным условиям. Во всем мире параметры нормальных условий одинаковы. Для газообразных химических веществ это:
- Температура в 0°С.
- Давление в 101,3 кПа.
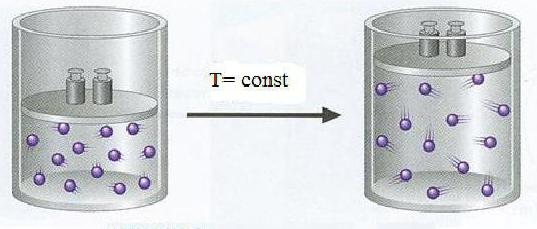
Для нормальных условий принято специальное сокращение – н.у. Иногда в задачах это обозначение не пишется, тогда следует внимательно перечитать условия задачи и привести заданные параметры газа к нормальным условиям.
Расчет объема 1 моля газа
В качестве примера несложно выполнить расчет одного моля любого газа, например азота. Для этого сначала нужно найти значение его относительной молекулярной массы:
Поскольку относительная молекулярная масса вещества численно равна молярной, то M(N2)=28 г/ моль.
Опытным путем выяснено, что при нормальных условиях плотность азота равна 1,25 г/литр.
Подставим это значение в стандартную формулу, известную со школьного курса физики, где:
- V — объем газа;
- m — масса газа;
- ρ — плотность газа.
Получим, что молярный объем азота при нормальных условиях
V(N2)= 25г/моль : 1,25 г/ литр =22,4 л/ моль.
Получается, что один моль азота занимает 22,4 литра.
Если выполнить такую операцию со всеми существующими газовыми веществам, можно прийти к удивительному выводу: объем любого газа при нормальных условиях равен 22,4 литра. Вне зависимости от того, о каком газе идет речь, какова его структура и физико-химические характеристики, один моль этого газа будет занимать объем 22,4 литра.

Молярный объем газа – одна из важнейших констант в химии. Эта постоянная позволяет решить многие химические задачи, связанные с измерением свойств газов при нормальных условиях.
Итоги
Молекулярная масса газообразных веществ важна для определения количества вещества. А если исследователь знает количество вещества того или иного газа, он может определить массу или объем такого газа. Для одной и той же порции газообразного вещества одновременно выполняются условия:
Если убрать постоянную ν, можно уравнять эти два выражения:
Так можно вычислить массу одной порции вещества и его объем, а также становится известной молекулярная масса исследуемого вещества. Применяя эту формулу, можно легко вычислить соотношение объем-масса. При приведении данной формулы к виду M= m Vm/V станет известна молярная масса искомого соединения. Для того чтобы вычислить это значение, достаточно узнать массу и объем исследуемого газа.
Следует помнить, что строгое соответствие реальной молекулярной массы вещества к той, что найдена по формуле, невозможно. Любой газ содержит массу примесей и добавок, которые вносят определенные изменения в его структуру и влияют на определение его массы. Но эти колебания вносят изменения в третью или четвертую цифру после запятой в найденном результате. Поэтому для школьных задач и экспериментов найденные результаты вполне правдоподобны.
Читайте также:

