Как сделать кристаллический йод
Добавил пользователь Владимир З. Обновлено: 28.09.2024
История
Иод был открыт в 1811 г. Куртуа в золе морских водорослей, а с 1815 г. Гей-Люссак стал рассматривать его как химический элемент.
Символ элемента J был заменен на I относительно недавно, в 50-х годах XX века.
Нахождение в природе
В большом количестве находится в виде иодидов в морской воде. Известен в природе также в свободной форме, в качестве минерала, но такие находки единичны, — в термальных источниках Везувия и на о. Вулькано (Италия). Запасы природных иодидов оцениваются в 15 млн тонн, 99% запасов находятся в Чили и Японии. В настоящее время в этих странах ведётся интенсивная добыча иода, например, чилийская Atacama Minerals производит свыше 720 тонн иода в год.
Сырьём для промышленного получения йода в России служат нефтяные буровые воды, тогда как в зарубежных странах, не обладающих нефтяными месторождениями, используются морские водоросли, а также маточные растворы чилийской (натриевой) селитры, что намного удорожает производство йода из такого сырья.
Физические свойства
Пары имеют характерный фиолетовый цвет, так же, как и растворы в неполярных органических растворителях, например в бензоле — в отличие от бурого раствора в полярном спирте. Иод при комнатной температуре представляет собой темно-фиолетовые кристаллы со слабым блеском. При нагревании при атмосферном давлении он сублимируется (возгоняется), превращаясь в пары фиолетового цвета; при охлаждении пары иода кристаллизуются, минуя жидкое состояние. Этим пользуются на практике для очистки иода от нелетучих примесей.
Химические свойства
Химически иод довольно активен, хотя и в меньшей степени, чем хлор и бром.
- С металлами иод при легком нагревании энергично взаимодействует, образуя иодиды:
- С водородом иод реагирует только при нагревании и не полностью, образуя йодистый водород:
- Элементный иод — окислитель, менее сильный, чем хлор и бром. Сероводород H2S , Na2S2O3 и другие восстановители восстанавливают его до иона I - :
- При растворении в воде иод частично реагирует с ней:
Применение
Медицина
Широко используется в альтернативной (неофициальной) медицине, однако его использование без назначения врача в основном мало обосновано, и нередко сопровождается различными рекламными заявлениями.
См. также
Производство аккумуляторов
Иод используется в качестве положительного электрода (окислителя) в литиево-иодных аккумуляторах для электромобилей.
Лазерный термоядерный синтез
Некоторые иодорганические соединения применяются для производства сверхмощных газовых лазеров на возбужденных атомах иода (исследования в области лазерного термоядерного синтеза и промышленность).
Радиоэлектронная промышленность
В последние годы резко повысился спрос на иод со стороны производителей жидкокристаллических дисплеев.
Динамика потребления иода
Мировое потребление иода в 2005 составило 25,5 тыс. тонн.
Важность для человека
Недостаток йода приводит к заболеваниям щитовидной железы (например, к базедовой болезни, кретинизму) Так же при небольшом недостатке йода отмечается усталость, головная боль, подавленное настроение, природная лень, слабеет память и интеллект, нервозность и раздражительность. Со временем появляется аритмия, повышается артериальное давление, падает уровень гемоглобина в крови.
Биологическая роль
Иод относится к микроэлементам и присутствует во всех живых организмах. Его содержание в растениях зависит от присутствия его соединений в почве и водах. Некоторые морские водоросли (морская капуста, или ламинария, фукус и другие) накапливают до 1% иода. Иод входит в скелетный белок губок и скелетопротеинов морских многощетинковых червей.
У животных и человека иод входит в состав так называемых тиреоидных гормонов, вырабатываемых щитовидной железой — тироксина и трииодтиронина, оказывающих многостороннее воздействие на рост, развитие и обмен веществ организма.
В организме человека (масса тела 70 кг) содержится 12-20 мг иода, суточная потребность в иоде составляет около 0,2 мг (200 мкг). Отсутствие или недостаток иода в рационе (что типично для некоторых местностей) приводит к заболеваниям (эндемический зоб, кретинизм, гипотиреоз). В связи с этим к поваренной соли, поступающей в продажу в местностях с естественным геохимическим дефицитом иода, с профилактической целью добавляют иодид калия, иодид натрия или иодат калия (иодированная соль).
Токсичность
Иод — токсичное вещество. Смертельная доза 2-3 г. Вызывает поражение почек и сердечно-сосудистой системы. При вдыхании паров йода появляется головная боль, кашель, насморк, может быть отёк лёгких. При попадании на слизистую оболочку глаз появляется слезотечение, боль в глазах и покраснение. При попадании внутрь появляется общая слабость, головная боль, рвота, понос, бурый налёт на языке, боли в сердце и учащение пульса. Через день воспаляются почки, появляется кровь в моче. Если не лечить через 2-3 дня могут отказать почки и наступить миокардит. Без лечения наступает летальный исход.
Периодическая система химических элементов Менделеева
Классификация хим. элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона/
198095, г.Санкт-Петербург, ул.Швецова, д.23, лит.Б, пом.7-Н, схема проезда
Способ получения кристаллического йода может быть использован для производства йода реактивных квалификаций.
Способ позволяет использовать в качестве сырья йодосодержащие растворы природного и техногенного происхождения с большим содержанием органических примесей. Способ гарантирует качество продукта реактивной квалификации и улучшения условий труда.
Сущность изобретения: получение йода реактивных квалификаций осуществляют в две стадии: на первой стадии йод-пасту, полученную из йодосодержащего сырья, сублимируют в потоке атмосферного воздуха в присутствии серной кислоты, пары йода и йодистоводородной кислоты, которые образуются, конденсируют и разделяют, йод, который сконденсировался, промывают водой, из йодистоводородной кислоты и промывных вод выделяют йод с получением йод-пасты; на второй стадии смесь промытого йода и йод-пасты сублимируют в потоке атмосферного воздуха в присутствии карбоната натрия.
Изобретение относится к способам получения кристаллического йода реактивных квалификаций и может быть использовано при производстве йода из йодсодержащего сырья с органическими примесями, массовая концентрация которых обусловлена как содержанием их в естественных водах, так и содержанием их в растворах техногенного происхождения.
Известен способ получения кристаллического йода реактивных квалификаций из йода-сырца, полученного из производственных концентратов с содержанием до 3,55% органических примесей [Гончаров А.И. и др. Влияние органических примесей в растворе на качество йода при кристаллизации. "Журнал прикладной химии" 1975, 48, 741 с.], путем плавки его под слоем серной кислоты при температуре 120-150°С, дробление остывшего плава, промывки водой для удаления серной кислоты и сушки [В.И. Ксензенко, Д.С. Стасиневич. Химия и технология брома, йода и их соединений. М., "Химия", 1995г., 357 с.]. Основные недостатки способа заключаются в больших потерях йода с отработанной серной кислотой и йодистоводородной кислотой, которая образуется в результате взаимодействия йода, органических примесей и серной кислоты, низком качестве готового продукта в результате наличия в нем сульфатов, невозможности получения йода реактивного из сырья с более высоким содержанием органических примесей и тяжелых условий труда вследствие прямого контакта персонала с йодом.
Известен также способ получения кристаллического йода реактивных квалификаций сублимацией йода-сырца [В.И. Ксензенко, Д.С.Стасиневич. Химия и технология брома, йода и их соединений. М., "Химия", 1995 г., 355-357]. Согласно этому способу йод выделяют из концентратов в виде кристаллов элементарного йода, отделяют от маточника с помощью центрифуги или нутч-фильтра в результате чего получают йод-пасту. Затем йод-пасту сушат нагретым воздухом или обезвоживают путем отжима воды на гидравлическом прессе. При этом получают йод-сырец, содержащий некоторое количество неорганических и органических примесей. Йод-сырец подвергают сублимации. Для связывания влаги и органических примесей йод-сырец смешивают с неорганическими реагентами, например, известью. Сублимацию йода проводят в специальных печах, куда загружают стальные кюветы или керамические тигли с йодом. Печи имеют газовый или электрический обогрев. Пары йода, выходящие из печи, конденсируют в холодильниках, изготовленных из керамических или асбоцементных труб, охлаждаемых воздухом. В печах поддерживают температуру выше температуры плавления йода (114-180°С). Процесс ведут так, чтобы температура паров йода была ниже температуры его плавления (113,6°С), в противном случае происходит налипание йода на стенки конденсатора, так как пары йода в этом случае не десублимируются, а конденсируются с образованием жидкого йода, который затем кристаллизуется в твердую массу. Удаление кристаллов йода из конденсатора проводят вручную с использованием специальных скребков или зубила с молотком.
Недостатком данного способа является необходимость предварительного обезвоживания йод-пасты, тяжелый ручной труд на стадиях обезвоживания и сублимации йода, низкое качество готового продукта. Для получения йода реактивного марки "ч" йод подвергают многократной сублимации.
Наиболее близким по технической сущности и результату, который достигается до предполагаемого изобретения является способ получения кристаллического йода реактивных квалификаций, предложенный авторами [см. заявку № 2004032106 от 23.03.2004, МПК 7 C01В 7/14], согласно которому полученную при выделены из йодных концентратов и отделенную от маточного раствора йод-пасту без предварительной сушки или отжима на прессе направляют на сублимацию. Обезвоживание йод-пасты производится за счет испарения воды на начальном этапе сублимации йода. Сублимация осуществляется при атмосферном давлении. Перед сублимацией в йод-пасту добавляют карбонат натрия в количестве, обеспечивающем рН конденсата воды не ниже 4,0. При нагревании йод-пасты начинается отвод воды и йода. Смесь паров воды и йода конденсируется на поверхности конденсатора, выполненного из эластичного материала (фторопластовая пленка или лакоткани на основе фторопласта и стекловолокна). Вода с поверхности конденсатора стекает, а кристаллический йод периодически стряхивают в приемник. Через отверстие в нижней части приемника вода вытекает и отделяется от йода. Полученный влажный йод используют при загрузке на следующую операцию сублимации.
Процесс сублимации обезвоженного йода проводят при температуре паров йода 114-184°С.
После того как отгонка воды закончится, а йод расплавится, в испаритель подают воздух. Часть воздуха барботируют через расплав йода для насыщения его парами йода. Другую часть воздуха подают в верхнюю часть испарителя. За счет разведения воздухом парциальное давление паров йода в йодовоздушной смеси перед десублимацией снижают до давления ниже давления насыщенных паров йода в тройной точке (87 мм рт.ст.), что обеспечивает получение высококачественных кристаллов готового продукта, которые легко снимаются с поверхности конденсатора. Десублимированный кристаллический йод собирают в приемник. По показателям качества йод отвечает требованиям, предъявляемым к йоду реактивному марки "ч".
При всей привлекательности указанного технологического процесса (упрощения и удешевления процесса, улучшения условий труда и качества готового продукта, сокращение потерь йода) существенным недостатком рассматриваемого способа является то, что сырьем для получения йода реактивной квалификации по этому способу может служить йод-паста с содержанием до 3,55% органических примесей. Задачей заявляемого способа, является расширение возможностей способа сублимационной очистки йода, в том числе, для очистки сырья с более высоким содержанием органических примесей.
Заявляемый способ характеризуется как известными признаками:
- выделение йода из растворов с получением йод-пасты;
так и новыми признаками:
- обезвоживание и сублимацию йод-пасты осуществляют в две стадии: на первой стадии йод-пасту сублимируют в потоке атмосферного воздуха в присутствии серной кислоты, пары йода и йодистоводородной кислоты, которые образуются, конденсируют и разделяют, йод, который сконденсировался, промывают водой, из йодистоводородной кислоты и промывных вод выделяют йод с получением йод-пасты; на второй стадии смесь промытого йода и йод-пасты сублимируют в потоке атмосферного воздуха в присутствии карбоната натрия.
Предложенный способ позволяет получать кристаллический йод реактивной квалификации из йод-пасты, полученной из йодосодержащих растворов с содержанием до 35% органических примесей.
Способ заключается в том что, из йодосодержащих растворов с большим содержанием органических примесей выделяют йод с получением йод-пасты, обезвоживание и сублимацию йод-пасты осуществляют в две стадии: на первой стадии йод-пасту сублимируют в потоке атмосферного воздуха в присутствии серной кислоты, пары йода и йодистоводородной кислоты, которые образуются, конденсируют и разделяют, йод, который сконденсировался, промывают водой, из йодистоводородной кислоты и промывных вод выделяют йод с получением йод-пасты; на второй стадии смесь промытого йода и йод-пасты сублимируют в потоке атмосферного воздуха в присутствии карбоната натрия согласно прототипа [см. заявку № 2004032106 от 23.03.2004г]. Для этого, на начальном этапе сублимации, за счет испарения воды и йода осуществляют обезвоживания йод-пасты. Перед сублимацией в йод-пасту добавляют карбонат натрия в количестве, обеспечивающем рН конденсата воды не ниже 4,0. Сублимацию обезвоженного йода осуществляют при температуре паров йода 114-184°С. Парциальное давление паров йода в йодовоздушной смеси перед десублимацией уменьшают за счет разведения воздухом до давления ниже давления насыщенных паров йода в тройной точке.
Полученный кристаллический йод по качеству соответствует требованиям, предъявленным к йоду реактивной квалификации.
Отличительным признаком заявляемого изобретения, от прототипа является то, что обезвоживание и сублимацию йод-пасты осуществляют в две стадии: на первой стадии йод-пасту сублимируют в потоке атмосферного воздуха в присутствии серной кислоты, пары йода и йодистоводородной кислоты, которые образуются, конденсируют и разделяют, йод, который сконденсировался, промывают водой, из йодистоводородной кислоты и промывных вод выделяют йод с получением йод-пасты; на второй стадии смесь промытого йода и йод-пасты сублимируют в потоке атмосферного воздуха в присутствии карбоната натрия.
Заявляемый способ осуществляют следующим образом.
Из йодосодержащих растворов с большим содержанием органических примесей выделяют йод с получением йод-пасты.
На первой стадии йод-пасту, содержащую до 35% органических примесей, загружают в сублиматор, который представляет собой эмалированную емкость с рубашкой. Рубашку заполняют высокотемпературным носителем с температурой кипения не ниже 250°С, который нагревают ТЭНами до температуры 150-200°С. Перед сублимацией, в герметически закрытый сублиматор дозируют концентрированную (не менее 92%) серную кислоту. Количество серной кислоты, которая добавляется, определяется содержанием органических примесей в йод-пасте и фазовым состоянием кубового остатка после сублимации и составляет 0,5-1,3 кг на 1 кг йод-пасты. После того как вся йод-паста расплавится, через расплав йода и серную кислоту барботируют часть атмосферного воздуха для насыщения его парами йода и удаления паров йодистоводородной кислоты, которая образуется при взаимодействии йода и серной кислоты с органическими примесями. Другую часть воздуха подают в верхнюю часть испарителя для разведения концентрации паров йода. За счет разведения воздухом парциальное давление паров йода в йодовоздушной смеси перед десублимации снижают до давления ниже давления насыщенных паров йода в тройной точке (87 мм.рт.ст.). Этот прием исключает образование жидкого йода, который может при конденсации паров кристаллизоваться в твердую массу и налипать на стенки конденсатора. Разбавленная смесь воздуха, паров воды, йода и йодистоводородной кислоты поступает в конденсатор, где йод десублимируется и его периодически встряхивают в приемник, вода и йодистоводородная кислота конденсируются и также стекают в приемник. Раствор йодистоводородной кислоты, который скондесировался, через нижний штуцер в приемнике отделяют от десублимированного кристаллического йода, йод кристаллический промывают водой, затем из раствора йодистоводородной кислоты и промывных вод выделяют йод с получением йод-пасты.
Кубовый остаток, представляющий собой жидкую суспензию органических веществ и серной кислоты, охлаждают до 50°С и удаляют из сублиматора.
На первой стадии сублимации осуществляется очистка йода от органических примесей основного характера за счет их реакции с серной кислотой. Продукты их взаимодействия остаются в кубовом остатке. Летучие органические примеси кислотного характера могут испаряться из сублиматора вместе с парами воды, йодистоводородной кислоты, йода и попадать в конденсатор, а также и в полупродукт на следующую стадию переработки. На второй стадии переработки смесь промытого йода и йод-пасты сублимируют в потоке атмосферного воздуха в присутствии карбоната натрия согласно прототипа [см. заявку № 2004032106 от 23.03.2004]. Обезвоживание йод-пасты производится за счет испарения воды на начальном этапе сублимации йода. Сублимация осуществляется при атмосферном давлении в испарителе, что представляет собой эмалированную емкость с рубашкой. Рубашку заполняют высокотемпературным теплоносителем с температурой кипения не ниже 250°С, который нагревают ТЭНами до температуры 150-200°С. Перед сублимацией в йод-пасту добавляют карбонат натрия в количестве, обеспечивающем рН конденсата воды не ниже 4,0. При нагревании йод-пасты начинается отгонка воды. Пары воды при этом насыщенны парами йода. Смесь паров воды и йода конденсируются на поверхности конденсатора, выполненного из эластичного материала (фторопластовая пленка или лакоткани на основе фторопласта и стекловолокна). Вода с поверхности конденсатора стекает, а кристаллический йод периодически встряхивают в приемник. Через отверстие в нижней части приемника вода вытекает и отделяется от йода. Полученный влажный йод используют при загрузке на следующую операцию сублимации.
Процесс сублимации обезвоженного йода проводят при температуре паров йода 114-184°С.
После того, как отгонка воды закончится, а йод расплавится, в испаритель подают воздух. Часть воздуха барботируют через расплав йода для насыщения его парами йода. Другую часть воздуха подают в верхнюю часть испарителя для концентрации паров йода. За счет разведения воздухом парциальное давление паров йода в йодовоздушной смеси перед десублимацией снижают до давления ниже давления насыщенных паров йода в тройной точке (87 мм.рт.ст.), что при конденсации паров предотвращает образование плава йода и обеспечивает получение высококачественных кристаллов готового продукта, которые легко снимаются с поверхности конденсатора. Десублимированный кристаллический йод собирают в приемник.
Продукт по качеству соответствует йоду кристаллическому реактивной квалификации.
На второй стадии сублимации очистка йода от органических примесей кислотного характера осуществляется за счет их взаимодействия с карбонатом натрия. Продукты их взаимодействия остаются в кубовом остатке.
Таким образом, заявляемый способ, который включает обезвоживание и сублимацию йод-пасты в две стадии: на первой стадии йод-пасту сублимируют в потоке атмосферного воздуха в присутствии серной кислоты, пары йода и йодистоводородной кислоты, которые образуются, конденсируют и разделяют, йод, что сконденсировался, промывают водой, из йодистоводородной кислоты и промывных вод выделяют йод с получением йод-пасты; на второй стадии смесь промытого йода и йод-пасты сублимируют в потоке атмосферного воздуха в присутствии карбоната натрия, позволяет получать йод кристаллический реактивной квалификации с йодосодержащих растворов с большим содержанием органических примесей.
Организация процесса по заявляемому способу позволяет снизить общие потери йода за счет последующей переработки йодистоводородной кислоты, которая образовалась в результате взаимодействия органических примесей с серной кислотой в присутствии йода, потому что в предлагаемом способе йодистоводородная кислота является полупродуктом в технологическом процессе, а не отходом производства.
Способ получения кристаллического йода из йодосодержащих растворов с большим содержанием органических примесей, включающий выделение йода с получением йод-пасты, обезвоживание и сублимацию йод-пасты, отличающийся тем, что обезвоживание и сублимацию йод-пасты осуществляют в две стадии: на первой стадии йод-пасту сублимируют в потоке атмосферного воздуха в присутствии серной кислоты, пары йода и йодистоводородной кислоты, которые образуются, конденсируют и разделяют, йод, который сконденсировался, промывают водой, из йодистоводородной кислоты и промывных вод выделяют йод с получением йод-пасты; на второй стадии смесь промытого йода и йод-пасты сублимируют в потоке атмосферного воздуха в присутствии карбоната натрия.
Химический элемент йод (обозначается как I) является самым тяжёлым из часто встречающихся галогенов и находится в 17 группе (VIIA) периодической системы Менделеева с атомным номером 53 и массой 126.9045. Он существует в виде блестящего пурпурно-чёрного неметаллического твёрдого вещества в стандартных условиях, которое плавится с образованием глубокой фиолетовой жидкости.
- История открытия
- Основная информация
- Физические свойства
- Химические свойства
- Наличие в природе
- Изотопы элемента
- Получение и нахождение
- Использование и применение
- Биологическая роль

История открытия

Йод был открыт в 1811 году французским химиком Бернаром Куртуа (1777—1838). Одна из первых его работ в начале 1800-х годов состояла в том, чтобы помочь своему отцу в изготовлении соединений натрия и калия (нитрат калия, KNO3) из морских водорослей.
Куртуа дал небольшое количество этого вещества Шарлю-Бернару Десормесу и Николя Клеману, которые провели систематическое расследование. В ноябре 1813 года они выставили йод в Императорском институте в Париже. То, что это действительно новый элемент, было доказано Джозефом Гей-Люссаком и подтверждено Хамфри Дэви, который отправил отчёт в Королевское учреждение в Лондоне, где ошибочно предположили, что он был первооткрывателем, и это убеждение сохранялось более 50 лет.
Основная информация
Йод является важным элементом, необходимым для жизни. Он наиболее известен своей ролью в выработке гормонов щитовидной железы у людей, а также у всех позвоночных. Дефицит йода может привести к серьёзным проблемам со здоровьем, включая зоб (увеличение щитовидной железы), умственную отсталость и кретинизм.
В качестве чистого элемента он представляет собой блестящий пурпурно-чёрный неметалл, твёрдый при стандартных условиях. Он легко переходит из твёрдого в газообразное состояние, минуя жидкую форму, и выделяет пурпурный пар. Хотя это технически неметалл, он обладает некоторыми металлическими качествами. Основными характеристиками элемента являются:

Физические свойства
Йод является одним из самых ярких и красивых элементов. Как твёрдое вещество, это тяжёлый, серовато-черный, металлический материал. Среди его основных физических свойств можно выделить:

- При нагревании не плавится. Вместо этого он испаряется. Сублимация — это процесс, при котором твёрдое вещество превращается непосредственно в газ без предварительного плавления. Образующийся пар йода имеет фиолетовый цвет и резкий запах. Если в эти пары помещается холодный объект, йод снова превращается в твёрдое вещество. Образует привлекательные, нежные металлические кристаллы.
- Растворяется в воде лишь незначительно. Но он растворяется во многих других жидкостях, образуя характерные пурпурные растворы.
- При нагревании в надлежащих условиях его можно заставить испаряться при 113,5°C и закипеть при 184 °C. Плотность элемента составляет 4,93 грамма на кубический сантиметр.
- Имеет умеренное давление паров при комнатной температуре, и в открытом сосуде медленно сгущается до глубоких фиолетовых паров, которые раздражают глаза, нос и горло (высококонцентрированный йод является ядовитым и может нанести серьёзный ущерб коже и тканям.) По этой причине йод лучше всего взвешивать в закупоренной бутылке. Для приготовления водного раствора флакон может содержать раствор йодида калия, что значительно снижает давление паров йода.
Химические свойства
Как и другие галогены, йод является активным элементом. Однако он менее активен, чем три галогена, стоящие над ним в периодической таблице. Основные химические свойства йода:


- Его наиболее распространёнными соединениями являются щелочные металлы, натрий и калий. Но он также образует соединения с другими элементами, в том числе с галогенами. Некоторыми примерами являются монобромид йода (IBr), монохлорид йода (ICl) и пентафторид йода (IF 5).
- Молекулярная решётка йода содержит дискретные двухатомные молекулы, которые также присутствуют в расплавленном и газообразном состояниях. Выше 700 °C диссоциация на атомы йода становится заметной.
- Молекула элемента может действовать, как кислота Льюиса в том смысле, что она сочетается с различными основаниями Льюиса. Взаимодействие, однако, слабое, и лишь немногие твёрдые комплексные соединения были выделены. Они легко обнаруживаются в растворе и называются комплексами с переносом заряда. Например, йод слабо растворяется в воде и даёт желтовато-коричневый раствор. Коричневые растворы также образуются со спиртом, эфиром, кетонами и другими соединениями, действующими, как основания Льюиса через атом кислорода.
- Даёт красный раствор в бензоле, который рассматривается, как результат другого типа комплекса с переносом заряда. В инертных растворителях, таких как четырёххлористый углерод или сероуглерод, получаются растворы фиолетового цвета, которые содержат несогласованные молекулы йода.
- Реагирует также с йодид-ионами, поскольку последние могут действовать, как основания Льюиса, и по этой причине растворимость элемента в воде значительно повышается в присутствии йодида. При добавлении йодида цезия кристаллический трийодид цезия может быть выделен из красновато-коричневого водного раствора.
- Образует синий комплекс с крахмалом, и этот цветовой тест используется для обнаружения небольших количеств йода.
- Это более слабый окислитель, чем бром, хлор или фтор.
- Легко соединяется с большинством металлов и некоторыми неметаллами с образованием йодидов. Например, серебро и алюминий легко превращаются в их соответствующие йодиды, а белый фосфор легко объединяется с йодом.
- Водный раствор йодистого водорода (HI), известный как йодистоводородная кислота, является сильной кислотой, которая используется для приготовления йодидов путём реакции с металлами или их оксидами, гидроксидами и карбонатами.
- Проявляет степень окисления +5 в умеренно сильной йодной кислоте (HIO 3), которая может быть легко обезвожена с образованием белого твёрдого пентоксида йода (I 2 O 5).
Наличие в природе
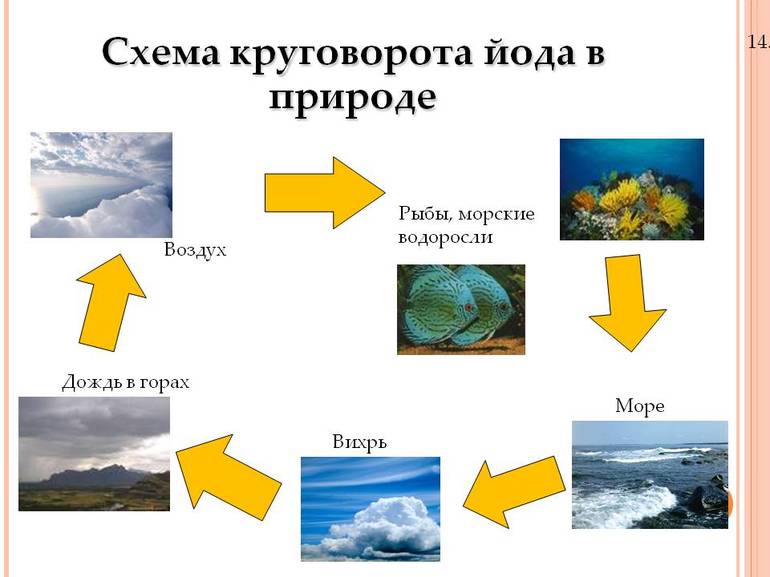
Йода не очень много в земной коре. По оценкам, его количество составляет от 0,3 до 0,5 частей на миллион. Он находится в нижней трети элементов, с точки зрения изобилия. Но, тем не менее, он более распространён, чем кадмий, серебро, ртуть и золото. Его содержание в морской воде ещё меньше — около 0,0003 частей на миллион.
Этот элемент, как правило, концентрируется в земной коре лишь в нескольких местах, когда-то покрытых океанами. За миллионы лет океаны испарились и оставили химические соединения, которые были растворены в них и сегодня существуют под землёй, как соляные копи.

Существует возможность собирать этот элемент из морской воды, солоноватой воды, рассола или морских водорослей. Морская вода имеет разные названия, в зависимости от количества растворенных в ней твёрдых веществ. Водоросли являются популярным источником йода, так как поглощают элементы из морской воды. Со временем они начинают иметь гораздо более высокую концентрацию йода, чем морская вода. Морскую водоросль собирают, сушат и сжигают для сбора вещества. Процесс мало чем отличается от того, который использовал Куртуа в 1811 году.
Изотопы элемента

Известен только один природный изотоп элемента — йод-127. Изотопы — это две или более формы элемента. Они отличаются друг от друга по их массовому числу. Число, написанное справа от названия элемента, является массовым числом. Оно представляет количество протонов плюс нейтронов в ядре атома элемента. Количество протонов определяет элемент, но количество нейтронов в атоме любого одного элемента может варьироваться. Каждая вариация является изотопом.
Примерно 30 радиоактивных изотопов йода были изготовлены искусственно. Это такие изотопы, которые распадаются на части и выделяют некоторую форму радиации. Они образуются, когда очень маленькие частицы обжигают атомы. Эти частицы прилипают к атомам и делают их радиоактивными.
Применение изотопов
Ряд изотопов йода имеет коммерческое использование. В медицинских целях они вводятся в организм пациента через рот, а затем проходят через тело в кровотоке. Когда они путешествуют, то излучают радиацию. Это излучение обнаруживается с помощью рентгеновской плёнки. Медицинский специалист может сказать, насколько хорошо организм функционирует, наблюдая диаграмму направленности. Изотопы йода используются и в следующих целях:

- Йод-123 — в исследованиях мозга, почек и щитовидной железы.
- Йод-125 — для исследования поджелудочной железы, кровотока, печени, поглощения минеральных веществ в костях и потери белков в организме.
- А йод-131 — при исследованиях печени, почек, кровотока, лёгких, мозга, поджелудочной железы.
Наиболее распространённым изотопом является йод-131. При попадании в организм он имеет тенденцию поступать непосредственно в щитовидную железу, а затем используется для выработки гормонов щитовидной железы.
Получение и нахождение

Этот элемент коммерчески производится из йодсодержащих рассолов. Природные рассолы или рассолы, извлечённые из нефтяных скважин, содержащие до 150 мг на литр (0,02 унции на галлон), обнаружены в Яве, Калифорнии и северной Италии. В число ведущих мировых производителей входят Чили, Япония, Китай, Россия и Азербайджан.
Примеси, такие как глина, песок и масло, удаляются фильтрацией, а раствор пропускается через поток диоксида серы, а затем через несколько контейнеров, в которых содержатся пучки медной проволоки. Образующийся йодид меди удаляют фильтрацией, промывают водой, сушат и тонко измельчают. Продукт нагревают с карбонатом калия, получая йодид калия, который затем окисляют до свободного элемента дихроматом и серной кислотой.
Использование и применение

Около 2/3 всего йода и его соединений используется в системах санитарии или в производстве различных антисептиков и лекарств. Вещество также используется для изготовления красителей, фотоплёнки и специального мыла. Он применяется в некоторых отраслях промышленности в качестве катализатора — вещества, используемого для ускорения или замедления химической реакции. Он не претерпевает никаких изменений во время реакции.
Элемент может оказывать как благоприятное, так и неблагоприятное воздействие на живые организмы. Он имеет тенденцию убивать бактерии и другие болезнетворные организмы. Это свойство вещества вызывает его использование в системах санитарии и в качестве антисептика — химического вещества, останавливающего рост микробов.
Настойка йода всегда была одним из самых популярных антисептических препаратов Её наносили на порезы и раны, чтобы предотвратить заражение. Сегодня она часто заменяется другими антисептиками.
Одной из причин того, что сегодня настойка используется реже, является то, что она также может вызвать проблемы. В более высоких дозах йод может раздражать или сжигать кожу. Он также может быть довольно ядовитым, если принимать его внутрь, поэтому важно использовать его согласно инструкции.
Другими важными областями применения йода являются:
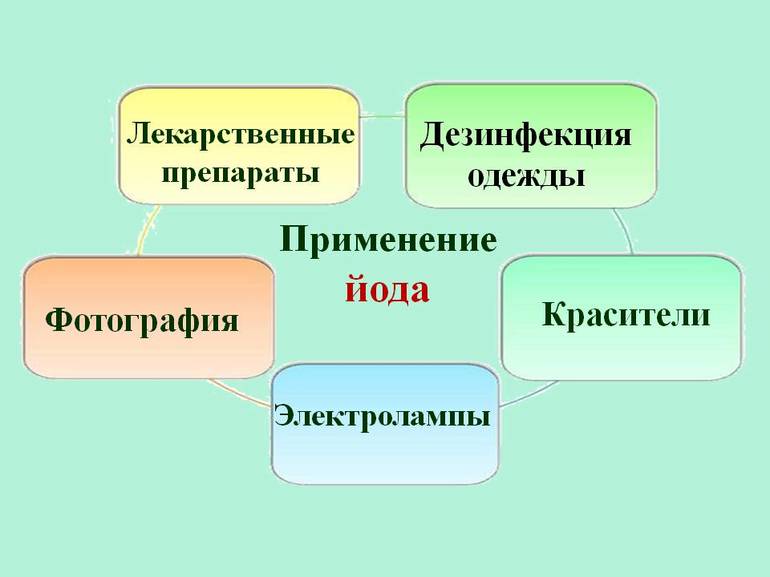
- Поскольку он преобразуется в тироксин в щитовидной железе, небольшое его количество имеет важное значение для организма, который содержит в среднем 14 мг (0,00049 унции) элемента. Тироксин — это гормон, необходимый для поддержания нормального обмена веществ во всех клетках организма. Он способен возбудить нервную систему, в особенности кору головного мозга и промежуточный мозг. Во многих местах питьевая вода содержит достаточно йода для этой цели.
- Элемент и его соединения широко используются в аналитической химии. Многие процедуры основаны на выделении или поглощении йода и его последующем титровании с тиосульфатом натрия (йодометрия). Ненасыщенность жиров (то есть количество двойных или тройных связей между атомами углерода) определяется добавлением свободного йода (йодного числа).
- Используется в фотографии, как йодид серебра и йодид калия.
- Йодид серебра также применяется для посадки облаков, чтобы вызвать дождь.
- Используется в производстве красителей.
Биологическая роль
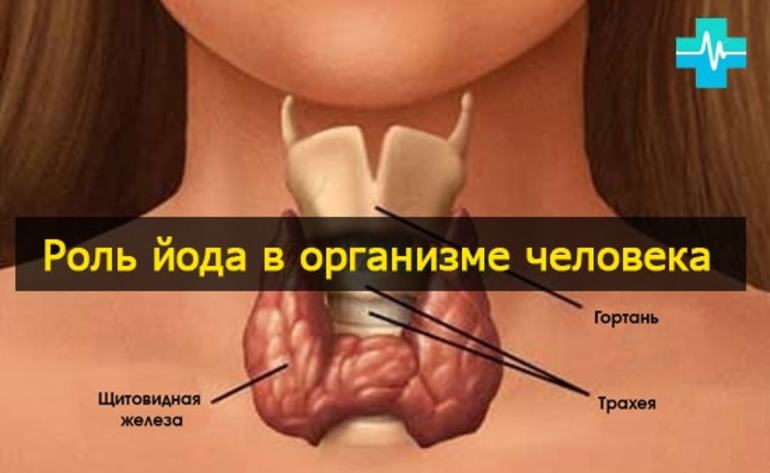
Йод является важным элементом для людей, которым требуется суточное его потребление в количестве около 0,1 мг. Максимальная безопасная для здоровья доза единовременного потребления — 0.5 г (500 мкг). Тело человека содержит до 20 миллиграмм этого элемента, главным образом в щитовидной железе, которая помогает регулировать рост и температуру тела.
Обычно люди получают достаточно йода из пищи, которую они едят. Дефицит же этого микроэлемента может вызвать опухоль щитовидной железы (известный, как зоб). Зоб вызывает большой комок в шее, поскольку щитовидная железа выходит из-под контроля. (Он может вырасти до размера виноградного плода.) Зоб пытается производить гормоны щитовидной железы, но он не получает достаточного количества йода из рациона человека, поэтому продолжает расширяться, пытаясь сделать свою работу.
Недостаток йода может вызвать и другие проблемы. Например, гормоны щитовидной железы необходимы для нормального развития мозга у нерожденного ребёнка и продолжения этого развития после рождения. Люди, которые не включают в свой рацион достаточного количества микроэлемента, не развиваются нормально.
Сегодня эксперты говорят, что низкий уровень йода является основной причиной умственной отсталости, глухоты, мутизма (неспособности говорить) и паралича. К менее серьёзным проблемам относятся сонливость, неуклюжесть и неспособность к обучению.

Количество йода в организме человека очень мало. Для определения его количества вес человека делится на 2 500 000. Полученное число и есть вес элемента в организме. Для нормальных людей эта сумма примерно равна размеру головки булавки, но эта крошечная точка может иметь большое значение для здоровья.

Но те, кто живет в развивающихся странах, могут не получать йодированной соли. Всемирная организация здравоохранения (ВОЗ) пытается найти способы обеспечения микроэлементом этих людей. По оценкам ВОЗ, 1,5 млрд человек живут в районах с низким уровнем йода. До 20 млн из этих людей могут иметь психические расстройства из-за его недостатка. ВОЗ начала программу по обеспечению будущего поколения в таких регионах этим микроэлементом, необходимым для нормального развития и функционирования.
Когда подняли вопрос о промокашках, я вспомнил, что за неимением фильтровальной бумаги, промокашка была незаменима при школьно-домашнем изготовлении йодистого азота.
Кстати, неплохо было бы поделиться опытом, какие еще "боеприпасы" делали школьники в прошлом. На сегодня я расскажу только про йодистый азот.
Кристаллический йод в аптеках, ясно дело, не продавался, приходилось в кабинете химии заимствовать. Но нам ли быть в печали! Спиртовый раствор йода работал не хуже, и даже лучше. Смешивались раствор йода и нашатырный спирт (пропорции сначала брали ампула на ампулу, потом поняли, что лучше всего капать одно в другое, и смотреть, идет ли реакция - такое беззвучное бурление, когда коричневая капля йода, падая в бесцветный раствор аммиака, превращается в темно-фиолетовые клубы и сгустки).
В результате происходившей реакции, образовывался осадок того самого NJ 3 , который надо было отфильтровать через промокашку и высушить на батарее. Только главное было - недосушивать до конца (если в школу нести собрался), т.к. вещество крайне неустойчивое и разлагается на составные части от малейшего прикосновения.
Из личных наблюдений - на такую промокашку с йодистым азотом села муха. Резкий хлопок, фиолетовое облачко из газообразного йода (опять же, кто не в курсе - йод на самом деле - это фиолетовые кристаллы. Или газ.), волокон промокашки, и мушиные ножки-крылышки в разные стороны. Взрыв, что характерно, без пламени, просто распад сухого вещества на газообразные йод и азот.
С кристаллическим конечно, было прикольнее - кучка кристаллов после взрыва рассыпАлась в разные стороны, и т.к. не все кристаллы в кучке были сухими на момент взрыва, то некоторые из них еще досыхали на полу и ждали своего часа. Потом под ногами долго еще щелкало.
Носили в школу в сыром виде (еще раз - когда просохнет, носить нельзя, взрывается). Для этого использовались жестяные коробочки из под монпансье (недавно упоминавшиеся тут). Очень классно было, когда мы разжились настоящей фильтровальной бумагой (круглой), которая как раз хорошо укладывалась в круглую коробочку.
Особый замысел был у нас - подложить на уроке сырой кружочек под ножки стула впереди сидящей девчонки. Ну вот нравилось ей на стуле качаться, на передних ножках. Грех был не воспользоваться. Она наклоняется, мой одноклассник Миша Р. ныряет под парту, я подаю боеприпас, он укладывает его туда, куда ножки должны опуститься. Вылазит. Ждем ("взрывчатка"-то сырая, т.е. должна высохнуть, прежде чем рвануть). Девчонка качается. Наконец, опускается назад, мы замираем ("Ща как даст. ") Ни фига. Заглядываем под парту - кошмар! - она ножки стула сдвинула, и они опустились мимо наших "мин". Миша идет на погружение под парту, поправлять положение. Только он не учитывает того, что промокашки-то уже не такие уж сырые. И вот он осторожненько-осторожненько подталкивает кружочки с йодистым азотом под ножки стула, и тут эта наша жертва опускается прямо на них. Грохот, весь класс смотрит на фиолетовый дымок, потом на появляющегося из под парты Мишку. Учительница истории не находит ничего лучшего, как спросить - "Миша, ты это нарочно?" Ответ был честный: "Да нет, это случайно получилось!" Ясно дело, случайно, кто ж знал, что эта дура опустит задние ножки стула в такой неудачный момент.
Интересно, что к теме коммьюнити это, пожалуй, подходит и тем, что происходило все это в 1979-ом году - как раз между 76-ым и 82-ым. .
Читайте также:

