Как сделать ковалентную связь
Добавил пользователь Евгений Кузнецов Обновлено: 05.10.2024
Ковалентная химическая связь образуется между атомами с близкими или равными значениями электроотрицательностей.
Предположим, что хлор и водород стремятся отнять друг у друга электроны и принять структуру ближайшего благородного газа. Но ни один из них не отдаст электрон другому, т.к. значения их электроотрицательностей близки.
Каким же способом они все таки соединяются? Все просто – они поделятся электронами друг с другом, образуется общая электронная пара.
При взаимодействии атомов с равными значениями электроотрицательности образуется ковалентная неполярная связь.
В этом случае общая электронная пара будет находится на одинаковом расстоянии от обоих атомов и в равной степени принадлежать обоим атомам. Такая связь не имеет полярности , т.е электронная плотность распределяется симметрично. Ковалентная неполярная связь реализуется, например, в простых веществах-неметаллах: H2, О2, N2, Cl2 и др. Связи могут быть как одинарными, так и двойными, тройными.
Механизм образования ковалентной неполярной связи
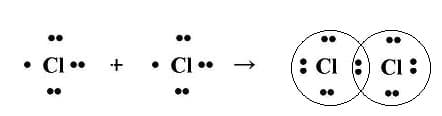
ковалентная неполярная связь
При взаимодействии атомов, с различными значениями электроотрицательностей образуется ковалентная полярная связь
Если электроотрицательности атомов различаются, то при их соединении электронная плотность распределяется между атомами неравномерно. Электронная пара смещается в сторону атома, имеющего большее значение электроотрицательности. Образуется ковалентная полярная связь (HCl, H2O, CO), кратность которой также может быть различной.
Механизм образования ковалентной полярной связи
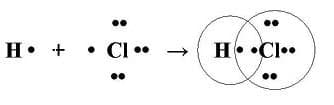
ковалентная полярная химическая связь
При образовании данного типа связи, более электроотрицательный атом приобретает частичный отрицательный заряд, а атом с меньшей электроотрицательностью – частичный положительный заряд (δ- и δ+). Образуется электрический диполь, в котором заряды, противоположные по знаку, расположены на неком расстоянии друг от друга. В качестве меры полярности связи используют дипольный момент:

Полярность соединения тем более выражена, чем больше дипольный момент. Молекулы будут иметь неполярный характер, если дипольный момент равен нулю.

Атомы большей части известных нам химических элементов не могут существовать индивидуально, они образуют разнообразные соединения посредством взаимодействия друг с другом. В атомном состоянии в природе находятся только благородные газы, такие как гелий, неон, аргон, криптон, ксенон, радон, это можно объяснить тем, что электронная оболочка у благородных газов устойчива. Атомы всех остальных, как простых, так и сложных веществ, соединены между собой при помощи химических связей.
Ковалентный тип химической связи начал изучать американский физико-химик Гилберт Ньютон Льюис в 1916 году. Он высказал предположение о том, что устойчивые внешние конфигурации молекул могут возникнуть в случае возникновения общей электронной пары.
Характеристики ковалентной связи
Существуют определённые характеристики ковалентной связи, которые способны оказывать влияние как на химические, так и на физические свойства самих веществ.
Направленность связи. Исходя из того, что атомные орбитали являются пространственно ориентированными, они перекрываются по определённым направлениям. В количественном виде направленность выражается валентными углами, которые расположены между направлениями химической связи.
Насыщаемость. В образовании ковалентной связи способны принимать участие ограниченное количество электронов на внешних оболочках.
Полярность является одним из основополагающих свойств ковалентной химической связи. Она возникает в случае неравномерного распределения электронной плотности между двумя атомами с различным значением электроотрицательности. По этому принципу ковалентная связь подразделяется на полярную и неполярную.
Ковалентная неполярная связь
Если электроны, принимающие участие в образовании связи, равнозначно удалены между связывающими атомами, это характеризует ковалентную неполярную связь. Именно эта связь реализуется во всех двухатомных молекулах, ядра которых одинаковы, например, Cl2, N2, F2, O2, обобществлённые электроны распределены равномерно между ними. Иногда данный тип связи можно встретить и в веществах, состоящих из различных элементов, но с практически одинаковыми значениями электроотрицательности, примером тому является фосфин PH3. Вещества с ковалентной неполярной связью обычно представлены в жидком и газообразном агрегатном состоянии, также среди них иногда встречаются низкоплавкие твёрдые вещества. Интересным исключением из этой закономерности является алмаз, температура плавления которого выше 3500⁰С. Это обуславливается тем, что алмаз является не совокупностью молекул, а сплошной решёткой, состоящей из атомов углерода с ковалентной связью между ними.
Ковалентная полярная связь
Ковалентная полярная связь возникает между атомами, которые различаются по своей природе и электроотрицательности, примерами таких соединений являются HF, NH3, CF4. Чем больше различия в электроотрицательности между атомами, тем выше значение полярности в соединении. Связывающие электроны при таком типе связи смещаются к более электроотрицательному атому, вследствие на нём возникает избыточный отрицательный заряд, соответственно, на другом атоме образуется результирующий положительный заряд. Если же значения электроотрицательности элементов сильно отличаются друг от друга, т.е. их разность высока, то мы имеем дело с ионной связью.
Механизмы образования ковалентной связи
Существует два механизма, по которым образуется ковалентная связь:
1) Обменный. В данном случае каждый из атомов в соединении отдаёт по одному электрону.
2) Донорно-акцепторный. Этот метод обусловливается тем, что один из атомов отдаёт электронную пару и при этом является донором, другой атом предоставляет свободную атомную орбиталь и является акцептором.
Еще по этой теме:

Серная кислота
Основные сведения о серной кислоте: свойства, получение, применение.

Как развивалось приложение все эти годы, и почему мы им так гордимся.
Азотная кислота
Статья содержит основную информацию об азотной кислоте: её свойства, получение и применение.

Диены
Основные сведения о диеновых углеводородах: номенклатура и изомерия, классификация, химические свойства, получение.
Правило Марковникова
Правило Марковникова: формулировка, механизм протекания реакций, исключения из правила.

Таблицы для ЕГЭ по химии
В статье представлены таблицы, необходимые при изучении химии и сдаче ЕГЭ.

Внеклассное мероприятие по химии
Идеи интересных внеклассных мероприятий по химии.

Формулы для решения задач по химии
Перечень основных формул, которые используются при решении школьных задач по химии.

Химические профессии
Обзор необычных профессий, связанных с химией.

ЕГЭ по химии 2019
Основная информация о ЕГЭ по химии 2019: структура экзамена, баллы, даты проведения.

Критерии оценивания ОГЭ по химии, баллы 2019
Подробно расскажем о баллах ОГЭ по химии 2019, методах и критериях оценивания заданий и переводе первичных баллов в школьную оценку.

Изменения ОГЭ по химии в 2019 году
Расскажем об изменениях, которые ждут школьников при сдаче ОГЭ по химии в 2019 году.

Подготовка к ОГЭ по химии
Несколько советов и рекомендаций, следуя которым подготовка к ОГЭ по химии будет проходить результативно.

Онлайн тесты по химии
Немного информации о проверке знаний с помощью тестов по химии в режиме онлайн.

Все об ОГЭ по химии в 2019
Основные сведения об ОГЭ по химии 2019: даты, время, баллы, материалы для подготовки.
Тест по химии 11 класс
Рассказываем о тестах по химии, используемых для проверки знаний в 11 классе.

Тест по химии 10 класс
Общие сведения о тестах по химии в 10 классе.
Тест по химии 9 класс
Рассказываем о тестах по химии, используемых для проверки знаний в 9 классе.
Тест по химии 8 класс
Рассказываем в общих чертах о тестах по химии в 8 классе
Ионная связь
Статья, содержащая в себе базовые понятие об ионном виде химической связи.
Водородная связь
Статья о водородном типе химической связи и его особенностях.
Подготовка к ЕГЭ по химии с нуля
Металлическая связь
Продолжаем серию статей про виды химической связи.

Шкала перевода баллов ЕГЭ по химии 2018
Отвечаем на вопросы о системе оценивания и переводе первичных баллов в тестовые.
Учимся на летних каникулах
Размышляем о том, как полезно провести время во время летнего отдыха на каникулах. (в статье есть подарок внимательным читателям)

Мой сын увлёкся химией, что делать?
Собрали ТОП-5 полезных материалов для старшеклассника.
Двенадцать сервисов для изучения химии, с которыми ты точно сдашь
Великолепная подборка полезных сайтов для самостоятельного изучения химии.
О правах и обязанностях в школе: почему необходимо сотрудничество учеников и учителей
Современный задачник по химии
материал о том, какие виды задачников по химии существуют и как среди них ориентироваться.
Выбираем репетитора по химии: инструкция
Или не выбираем
Научиться решать задачи по химии легко: следуем инструкции
Учимся решать задачи по химии к ОГЭ, ЕГЭ, инструкция от ХиШника
Изменения в ЕГЭ по химии 2018 года, новая демоверсия, спецификация, кодификаторы ЕГЭ
ФИПИ снова решил усложнить нам жизнь новыми требованиями к ЕГЭ. О том, почему изменения не всегда плохи, и как встретить их с достоинством.

Что такое лицензионный ключ и как происходит его активация в приложении

Современный урок химии по ФГОС
Для чего нужны стандарты, по которым происходит обучение химии в российских школах, и как приложение “ХиШник” поможет соответствовать этим стандартам?

ХиШник в школе: ИКТ на уроках химии
Как наше приложение поможет внедрить ИКТ в уроки
Ура! Новые планы ХиШника и подарочки
Подводим итоги 2017, планируем 2018 и, конечно же, дарим подарки!
Можно ли просматривать историю решения задач учениками в онлайн-режиме?
На прошлой неделе мы провели семинар в рамках масштабных ежегодных курсов повышения квалификации на базе СУНЦ НГУ (Новосибирск, Академгородок).
Как купить полный доступ к приложению?
Сегодня новый вопрос: что делать, если решать задачи в демо-версии приложения понравилось, как получить полный доступ? Отвечаем!

Спасибо!
от 01.01.2017 года
Настоящее пользовательское (лицензионное) соглашение (далее – "Соглашение") заключается между Обществом с ограниченной ответственностью "АЛЕКТА" (далее – "Лицензиар"), и Пользователем (физическим лицом, выступающем в роли конечного потребителя Продукта) совместно именуемые "Стороны".
Пожалуйста, внимательно ознакомьтесь с текстом настоящего Соглашения. Оно представляет собой публичную оферту и, после его принятия Вами, образует соглашение между Вами (Пользователем) и Лицензиаром о предмете и на условиях, изложенных в тексте Соглашения.
Принимая настоящее Соглашение, Вы соглашаетесь с положениями, принципами, а также соответствующими условиями лицензионного соглашения, изложенными ниже.
В основе метода валентных связей лежат следующие положения:
1. Ковалентная связь образуется двумя электронами с противоположно направленными спинами, причем эта электронная пара принадлежит двум атомам.
2. Ковалентная связь тем прочнее, чем в большей степени перекрываются электронные облака.
По механизму образования ковалентная связь разделяется на:
- обменную ковалентную связь;
- донорно-акцепторную ковалентную связь.
Обменная ковалентная связь возникает между атомами. Где каждый атом отдаёт по одному неспаренному электрону в общую электронную пару.
Донорно-акцепторная ковалентная связь заключается в том, что один атом (донор) отдаёт электронную пару, а другой атом (акцептор) предоставляет для этой пары свободную орбиталь.

Кроме одинарных связей, может образовываться двойная и тройная ковалентная связь.

Свойства ковалентной связи.
- насыщаемость;
- направленность;
- поляризуемость.
Насыщаемость – способность к образованию строго определённого количества ковалентных связей (от 1 до 6), которая определяет максимально возможную валентность элемента.
Направленность – стремление атомов к образованию наибольшей электронной плотности между ядрами.
Поляризуемость – смещение электронов под влиянием внешнего электрического поля.
- неполярная ковалентная связь т.е. электронное облако, образованное общей парой электронов, распределяется в пространстве симметрично относительно ядер обоих атомов (примеры: Cl2,N2).
- полярную ковалентную связь т.е. общее электронное облако смешено в сторону одного из атомов так, что возникает ассиметрия в распределении заряда (примеры: CO,H2O).

Электроотрицательность – это способность атомов оттягивать к себе общую электронную пару.
Ключевые слова конспекта: Ковалентная неполярная и полярная связь. Электроотрицательность. Кратность ковалентной связи. Обменный и донорно–акцепторный механизмы образования ковалентных связей. Полярность связи. Полярность молекулы. Молекулярные и атомные кристаллические решётки.
Все органические соединения (их более 100 миллионов!) построены за счёт ковалентной химической связи. Однако и неорганических соединений с ионной связью меньше, чем с ковалентной.
Теорию ковалентной связи в 1916 г. предложил американский химик Гилберт Льюис. Он объяснил, как возникает химическая связь в двухатомных молекулах водорода Н2, азота N2, кислорода O2, галогенов (F2, Сl2, Вг2, I2).
Вспомним механизм образования некоторых двухатомных молекул на примере водорода и хлора.
В структурных формулах общая электронная пара обозначается чёрточкой.
Условно этот процесс можно представить следующим образом. При сближении двух атомов водорода происходит перекрывание их сферических s-орбиталей до тех пор, пока сила отталкивания ядер не будет равна силе притяжения между ядром одного атома и электроном другого. Место взаимопроникновения орбиталей называется электронной плотностью. Это область пространства, где сосредоточен повышенный отрицательный заряд.
Атомы в молекулах водорода и хлора образовали одну общую электронную пару. Такая ковалентная связь называется простой или одинарной.
Посчитайте: в молекуле азота каждый атом распоряжается восьмью электронами. Два атома азота в молекуле N2 связаны уже не одинарной, а тройной связью. Очевидно, что такая связь гораздо прочнее. Это и объясняет очень низкую реакционную способность азота.
Следовательно, по числу общих электронных пар, связывающих атомы в молекулы, т. е. по кратности, различают одинарную, двойную и тройную связи.
В рассмотренных примерах ковалентные связи образовывались между одинаковыми атомами, т. е. атомами одного элемента. Понятно, что эти два атома равноправны по отношению к общим электронным парам, которые симметрично располагаются между ядрами двух атомов. Такая химическая связь называется ковалентной неполярной.
Ковалентная связь может образоваться между двумя атомами, которые в соответствии с положением в периодической системе обладают различными неметаллическими свойствами. Усиление неметаллических свойств проявляется в стремлении атома оттянуть общую электронную пару к себе.
Понятно, что между атомами с одинаковой электроотрицательностыо (атомами одного химического элемента-неметалла) образуется ковалентная неполярная связь.
В результате полярности связи Н—Сl молекула хлороводорода представляет собой частицу с двумя противоположно заряженными полюсами — диполь.
Несмотря на то, что в молекуле метана каждая из связей С—Н полярна, она не является диполем. Причина в том, что молекула метана имеет форму правильного тетраэдра, а потому полярность всех связей взаимно компенсируется.
Следовательно, полярность молекулы определяется двумя факторами: полярностью связей в молекуле и её геометрией.
В рассмотренных примерах при образовании полярных и неполярных молекул был реализован обменный механизм возникновения ковалентной связи: каждый из участвующих атомов предоставлял другому на паритетных началах свои непарные электроны, образуя таким образом общие (поделённые) электронные пары. Однако имеется ещё один механизм образования ковалентной связи — донорно-акцепторный.
Рассмотрим его на примере строения катиона аммония NH4 + .
В результате образования ковалентных связей возникают молекулы. Такая связь преобладает в химических соединениях и значит все они имеют молекулярное строение. Это почти 100 млн органических соединений, большинство веществ, которые при обычных условиях представляют собой газы и жидкости, а также некоторые твёрдые вещества, например ромбическая сера, белый фосфор.
Ковалентная связь определяет два типа решёток: молекулярные и атомные.
В узлах кристаллической решётки вещества молекулярного строения находятся молекулы этого вещества, поэтому кристаллическая решётка такого типа называется молекулярной.
Атомы в молекулах таких веществ связаны достаточно прочными ковалентными связями, а вот между молекулами связи значительно более слабые (вандерваальсовы силы). Разрушить молекулярную кристаллическую решётку нетрудно, поэтому соединения такого строения обычно легкоплавкие, летучие, часто обладают запахом.
Ковалентные связи могут приводить к образованию веществ не только молекулярного, но и атомного строения, т. е. с атомными кристаллическими решётками. В узлах таких кристаллических решёток располагаются отдельные атомы, связанные между собой очень прочными ковалентными связями. Атомная кристаллическая решётка характерна для некоторых простых веществ, например, модификаций бора, кремния, углерода. Если каждый углеродный атом в решётке находится в центре тетраэдра и окружён четырьмя другими атомами углерода, с которыми связан ковалентными неполярными связями, образуется кристаллическая решётка алмаза.
Это свойство используется для изготовления абразивных (от фр. abrasif — шлифовальный) инструментов, которые предназначены для шлифования, полирования, бурения металлов, керамических материалов, горных пород и т. д. Отшлифованные алмазы — бриллианты — используются в ювелирном деле.
Однако атомы углерода в кристаллической решётке могут располагаться слоями, образуя правильные шестиугольники наподобие пчелиных сот. Между атомами углерода соседних слоёв расстояние больше, чем в слоях, поэтому и связи менее прочные. Такую решётку имеет графит.
Это приводит к тому, что графит, в отличие от алмаза, электропроводен и мягок, но обладает высокой тугоплавкостью. Его используют для изготовления электродов и замедлителей нейтронов в ядерных реакторах. При высоких температурах и давлении из графита получают технические алмазы. Способность оставлять след на бумаге — свойство, на котором основано применение карандашей.
Гораздо более характерны атомные кристаллические решётки для сложных веществ. К ним относятся минералы, основу которых составляют оксид алюминия (наждак, корунд, рубин, сапфир) и оксид кремния(IV) (кварц, кремнезём, горный хрусталь).

В первый раз ковалентность была открыта в 1916 г. химиком из Америки Дж. Льюисом, и прошло некоторое время, пока сформировалась гипотеза, а потом её смогли обобществить, и она была доказана опытным путём.
Концепции и немного истории

Химики узнали, что это за прецедент, при котором выявили: электроотрицательность неметаллов довольно велика, и при содействии 2-х физических атомов притягивание электронов может быть сложной задачей и даже неосуществимой, поскольку они в 2-х атомах соединяются, и между ними случается ковалентность атомов.
Типы ковалентной связи

Характеристика ковалентности — это действие, которое случается в веществах с неметаллическими качествами. Выявляется она при совместном участии атомных электронов в различных элементах. Схема образования ковалентной полярной связи — взаимодействующие атомы имеют различный способ электроотрицательности, а открытые электроны не принадлежат тождественно 2 атомам.
Большую часть времени электроны приближаются к первому атому, чем ко второму.
Случаем ковалентности полярной могут быть взаимодействия, которые выявляются в молекуле хлористого водорода, где раскрытые электроны в ответе за ковалентность и ближе к атому хлора, чем водород.
И дело в том, что электроотрицательный показатель у первого вещества выше, чем у второго. Хорошим примером ковалентной полярной связи будет вода.
Эти одинарные химические взаимодействия происходят из-за появления накопительных молекулярных частей электронов, которые являются общими для двух взаимодействующих частей. Появление электронных пар связано с перекрытием орбиталей. Такие типы взаимодействий в химии происходят между частями обоих элементов.
Вещества со строением такой структуры:
- газы;
- вода;
- алкоголь;
- углеводы;
- белковая пища;
- кислотная органика.
Ковалентность появляется методом открытия пар электронов в несложных субстанциях или же сложных соединениях. Чтобы квалифицировать природу кристаллической химической связи, надо взглянуть на атомную составляющую частиц, находящихся в формуле.
Взаимодействия описанного типа образуются лишь только между веществами, в которых доминируют неметаллические качества. В случае если слияние имеет атомы похожих или же различных неметаллов, то взаимодействия между ними считаются ковалентными.
Полюсное взаимодействие
Когда в соединении совместно есть металл и неметалл, выявляется, что элементы образуют ионное соединение. Ковалентная полярность связывает решётку атомов всевозможных неметаллов друг с другом.
Это бывают атомы:
- хлора и водорода;
- фосфора и кислорода;
- аммиака.

Есть другое определение таких веществ. Это говорит о том, что кратная цепь возникает между неметаллами с разными показателями электроотрицательного появления. В 2-х случаях возможно выделить многообразие атомов, где была замечена эта связь.
Выставленные соединения в нормальных критериях наличествуют в водянистом или же газообразном агрегатном состоянии. Формулы Дж. Льюиса могут помочь понять устройство и насыщаемость связывания атомных ядер.
Действие получения ковалентности для атомов с разными значениями электроотрицательности объединяется к образованию совместной плотности электрического состояния. Как правило, он сдвинут к составляющей, что содержит самую возвышенную степень электроотрицательности.
По причине возникающего смещения всей пары в направленности вещества с большим числом электроотрицательности в нём отчасти появляется негативный заряд. Вследствие этого, появляется слияние с 2-мя по-разному заряженными полюсами. Нередко при формировании полярных отношений применяется акцепторный или же донорно-акцепторный механизм.
Путь образования ковалентных связей:
- Акцепторный (обмена). Любой атом выделяет 1 неспаренный электрон.
- Донорно-акцепторный ковалентный тип. Один атом (донор) гарантирует электрическую пару, а акцептор орбиталь для неё.
Устройство образования ковалентных связей описывается как конфигурация взаимодействия, свойственная не для всех полярных соединений. Примерами считаются вещества органического и неорганического происхождения.
Неполярная структура

Неполярная ковалентность связывает составляющие с неметаллическими качествами, что точно так же равно электроотрицательному значению. Другими словами, элементы с неполярностью предполагают собой соединения, состоящие из различных чисел похожих неметаллов. Формула вещества с ковалентной неполярной связью: N2.
Примером ковалентной неполярной связи считаются вещества простой структуры: О2, N2, Cl2. Составление этого типа взаимодействия и других неметаллических частей включает экстремальные электроны.
Валентность относится к количеству электронов, важных для окончания обычной наружной оболочки. Атом имеет возможность предоставить или же получить негативно заряженные частички.
Эта работа относится к уровню двухэлектронных или же двухцентровых цепей. В этом случае пара электронов занимает общую долю между 2-мя орбиталями. В структурных формулах пара электронов записывается в виде части по горизонтали.
Каждая связь демонстрирует количество общих пар электронов в молекуле. Потребуется затратить наибольшее число энергии для разрушения с помощью этой связи, вследствие чего эти вещества станут одними из самых мощных по шкале крепости.
По донорно-акцепторному механизму неполярные части буквально не связаны. Ковалентная неполярная связь представляет собой структуру, образующуюся совместными электронными парами. Эти пары в равной степени принадлежат 2 атомам.
Однообразие ковалентных неполярных и полярных связей заключается в возникновении абсолютной электрической плотности. Лишь только в ином случае приобретённые электрические совместные части в равной степени принадлежат 2 атомам, занимающим центральное состояние. В итоге выборочные положительные и отрицательные заряды не образуются, что значит полученные цепочки считаются неполярными.

Неполярность приводит к образованию совместной пары, в итоге конечная степень атома будет законченной. Качества этих веществ, имеющих определённые структуры, выделяются от тех, что с металлическими или же ионными взаимодействиями.
В обменном процессе ковалентности между атомами любой из них представляет собой один неспаренный электрон, образующий электрическую ковалентность. В этом случае они могут иметь обратные заряды.
Случаем подобной ковалентной связи могут быть взаимодействия, которые видятся в молекуле водорода. Когда атомы вещества намереваются совместно действовать, их электрические части попадают друг в друга.
В итоге плотность между ядрами возрастает, они сами притягиваются, а энергия системы миниатюризируется. Впрочем, в случае если ядра делаются очень близкими, они начинают отталкиваться, и, таким образом, между ними появляется подходящее расстояние.
Что касается донорно-акцепторного вида ковалентности, то это случается, когда 1 из частиц, донор, предположит собственную электрическую пару для связи, а 2-я, акцептор, считается свободной орбиталью.
Квалифицирование ковалентности

Смысл ковалентной неполярной связи такой — это взаимодействие, которое появляется между похожими атомами. В молекулах с неполярной ковалентностью совместные пары электронов находятся на равных расстояниях от атомных ядер.
К примеру, в молекуле воздуха атомы имеют 8 электрических конфигураций, в то время как они имеют 4 совместные электрические пары. Препараты с неполярной ковалентностью, как правило, предполагают собой газы, воду или же сравнительно низколегированные твёрдые вещества.
Чтобы верно квалифицировать ковалентную полярную и неполярную связь, достаточно понять свойство и формулу молекул, в случае, если они состоят из атомов различных составляющих, взаимодействие будет полярным, а если из 1-го, то станет неполярным. Ещё надо знать, что неполярные связи в целом могут встречаться лишь только между неметаллами, и это связано с механизмом ковалентных взаимодействий.
Полярная и неполярная связи: ионные металлические химические соединения молекул, как отличить от ковалентной или определить их типы

Электроотрицательность неметаллов довольно велика, так что при химическом взаимодействии двух атомов неметаллов полный перенос электронов от одного к другому (как в случае ионной связи) невозможен. В этом случае для выполнения правила октета необходимо объединение электронов.
Неполярная ковалентная связь
В качестве примера обсудим взаимодействие атомов водорода и хлора:
- H 1s1 — один электрон
- Cl 1s2 2s2 2p6 3s2 3p5— семь электронов на внешнем уровне
Каждому из двух атомов недостает по одному электрону для того, чтобы иметь завершенную внешнюю электронную оболочку. И каждый из атомов выделяет „в общее пользование” по одному электрону. Тем самым правило октета оказывается выполненным. :
Образование ковалентной связи
Обобществленные электроны принадлежат теперь обоим атомам. Атом водорода имеет два электрона (свой собственный и обобществленный электрон атома хлора), а атом хлора — восемь электронов (свои плюс обобществленный электрон атома водорода).
Эти два обобществленных электрона образуют ковалентную связь между атомами водорода и хлора. Образовавшаяся при связывании двух атомов частица называется молекулой.
Образование ковалентной неполярной связи
Благодаря спариванию и обобществлению двух электронов удается выполнить правило октета для обоих атомов.
Помимо одинарных связей может образовываться двойная или тройная ковалентная связь, как, например, в молекулах кислорода О2 или азота N2. Атомы азота имеют по пять валентных электронов, следовательно, для завершения оболочки требуется еще по три электрона. Это достигается обобществлением трех пар электронов.
Ковалентные соединения — обычно газы, жидкости или сравнительно низкоплавкие твердые вещества. Одним из редких исключений является алмаз, который плавится выше 3 500 °С. Это объясняется строением алмаза, который представляет собой сплошную решетку ковалентно связанных атомов углерода, а не совокупность отдельных молекул.
Фактически любой кристалл алмаза, независимо от его размера, представляет собой одну огромную молекулу. Ковалентная связь возникает при объединении электронов двух атомов неметаллов. Возникшая при этом структура называется молекулой.
Полярная ковалентная связь
В большинстве случаев два ковалентно связанных атома имеют разную электроотрицательность и обобществленные электроны не принадлежат двум атомам в равной степени. Большую часть времени они находятся ближе к одному атому, чем к другому.
В молекуле хлороводорода, например, электроны, образующие ковалентную связь, располагаются ближе к атому хлора, поскольку его электроотрицательность выше, чем у водорода. Однако разница в способности притягивать электроны не столь велика, чтобы произошел полный перенос электрона с атома водорода на атом хлора.
Поэтому связь между атомами водорода и хлора можно рассматривать как нечто среднее между ионной связью (полный перенос электрона) и неполярной ковалентной связью (симметричное расположение пары электронов между двумя атомами). Частичный заряд на атомах обозначается греческой буквой δ.
Такая связь называется полярной ковалентной связью, а о молекуле хлороводорода говорят, что она полярна, т. е. имеет положительно заряженный конец (атом водорода) и отрицательно заряженный конец (атом хлора).
Обменный и донорно-акцепторный механизм образования ковалентной связи
- Обменный механизм. Каждый атом дает по одному неспаренному электрону в общую электронную пару.
- Донорно-акцепторный механизм. Один атом (донор) предоставляет электронную пару, а другой атом (акцептор) предоставляет для этой пары свободную орбиталь.
Ковалентная связь – полярная и неполярная: что это такое и какова формула вещества
Свойства
Что такое ковалентная полярная и неполярная связь? Если новое соединение образуется таким образом, то происходит обобществление электронных пар. Обычно такие вещества имеют молекулярное строение: Н2, О3, HCl, HF, CH4.
Есть и немолекулярные вещества, в которых атомы связаны таким образом. Это так называемые атомные кристаллы: алмаз, диоксид кремния, карбид кремния. В них каждая частица связана с четырьмя другими, в результате получается очень прочный кристалл. Кристаллы с молекулярной структурой обычно не отличаются высокой прочностью.

Свойства такого способа образования соединений:
- кратность,
- направленность,
- степень полярности,
- поляризуемость,
- сопряжение.
Кратность — это количество поделенных электронных пар. Их может быть от одной до трех. У кислорода до заполнения оболочки двух электронов не хватает, поэтому она будет двойной. У азота в молекуле N2 она тройная.
Поляризуемость — возможность образования ковалентной полярной связи и неполярной. При этом она может быть более или менее полярна, ближе к ионной или наоборот — в этом заключается свойство степени полярности.
Направленность означает, что атомы стремятся соединиться таким образом, чтобы между ними осталась как можно большая электронная плотность. О направленности имеет смысл говорить тогда, когда соединяются p или d-орбитали. S-орбитали сферически симметричны, для них все направления равноценны.
В двойном или тройном случае p-орбитали образуют одну σ-связь, а остальные будут типа π. Сопряжение — это чередование простых и кратных, делающее молекулу более стабильной. Такое свойство характерно для сложных органических соединений.

Полярность
Важно! Как определить, вещества с неполярной ковалентной или полярной связью перед нами? Это очень просто: первая всегда возникает между одинаковыми атомами, а вторая — между разными, имеющими неодинаковую электроотрицательность.
Примеры ковалентной неполярной связи — простые вещества:
- водород Н2,
- азот N2,
- кислород О2,
- хлор Cl2.
Схема образования ковалентной неполярной связи показывает, что с помощью объединения электронной пары атомы стремятся дополнить внешнюю оболочку до 8 или 2 электронов. Например, фтору не хватает одного электрона до восьмиэлектронной оболочки. После образования поделенной электронной пары она заполнится.
Распространенная формула вещества с ковалентной неполярной связью — двухатомная молекула.

Полярно обычно связываются только элементы-неметаллы

В этом случае молекулу образуют разные элементы, но разница в электроотрицательности не так велика, чтобы электрон полностью перешел от одного атома к другому, как в веществах ионного строения.
Схемы образования ковалентной структуры этого типа показывают, что электронная плотность смещается к более электроотрицательному атому, то есть поделенная электронная пара находится к одному из них ближе, чем ко второму.
Части молекулы приобретают заряд, который обозначается греческой буквой дельта. В хлороводороде, например, хлор становится заряжен более отрицательно, а водород — более положительно. Заряд будет частичный, а не целый, как у ионов.
Важно! Не следует путать полярность связи и полярность молекулы. В метане СН4, например, атомы связаны полярно, а сама молекула неполярна.
Механизм образования
Образование новых веществ может проходить по обменному или донорно-акцепторному механизму.При этом объединяются атомные орбитали. Возникает одна или несколько молекулярных орбиталей.
Они отличаются тем, что охватывают оба атома. Как и на атомной, на ней может находиться не более двух электронов, причем их спины тоже должны быть разнонаправленными. Как определить, какой механизм задействован? Это можно сделать по числу электронов на внешних орбиталях.
Обменный
В этом случае электронная пара на молекулярной орбитали образуется из двух неспаренных электронов, каждый из которых принадлежит своему атому. Каждый из них стремится заполнить свою внешнюю электронную оболочку, сделать ее устойчивой восьми- или двухэлектронной. Так обычно образуются вещества с неполярной структурой.
Для примера рассмотрим соляную кислоту HCl. У водорода на внешнем уровне один электрон. У хлора — семь. Нарисовав схемы образования ковалентной структуры для него, увидим, что для заполнения внешней оболочки каждому из них не хватает по одному электрону. Поделив между собой электронную пару, они смогут завершить внешнюю оболочку.
По такому же принципу образуются и двухатомные молекулы простых веществ, например, водорода, кислорода, хлора, азота и других неметаллов.
Читайте также:

