Как сделать карбонат кальция
Обновлено: 03.07.2024
Структурная формула
- Латинское название: Calcii carbonas
- Код АТХ: A02AC01, A12AA04
- Химическая формула: CaCO3
- Код CAS: 471-34-1
Химическое название
Химические свойства
Кальция Карбонат, что это такое? Это неорганическое хим. соединение, соль, образованная Ca и угольной кислотой. Химическая формула Карбоната Кальция: CaCO3. В природе вещество можно обнаружить в кальците, ватерите, арагоните, мраморе, известняке, обычном меле, яичной скорлупе. Это достаточно распространенный минерал, в соответствии с химической формулой имеет три полиморфные модификации.
По внешнему виду – белые кристаллы без запаха или мелкий порошок. Вещество не растворяется в воде, спирте, растворимо в разбавленной азотной и соляной кислоте (при этом выделяется углекислый газ). Согласно Википедии, молярная масса вещества = 100,1 грамм на моль.
Углекислый кальций изготавливают из минералов, в основном мрамора. В лабораторных условиях соединение можно получить с помощью реакции кальцинации оксида Ca, в итоге образуется гидроксид Ca, через который проводят СО2 и осаждается карбонат. Для химических свойств характерна реакция разложения Карбоната Кальция, при которой под действием высокой температуры, вещ-во расщепляется на негашеную известь и углекислый газ. Также для химического соединения характерна реакция с водой и СО2, с образованием гидрокарбоната Ca.
- для производства краски, пластмассы, бытовой химии и резины;
- в качестве пищевого красителя Е170;
- при производстве мела для письма на доске, пластмассы;
- в побелке для деревьев, потолков и в садоводстве;
- в пищевой и бумажной промышленности;
- при производстве бумаги (отбеливатель, раскислитель, наполнитель);
- в качестве источника кальция при производстве посуды, стекловолокна, изделий из стекла;
- в медицине.
Фармакологическое действие
Противоязвенное, восполняющее дефицит кальция, антацидное.
Фармакодинамика и фармакокинетика
При попадании средства в пищеварительный тракт происходит нейтрализация соляной кислоты, снижается кислотность желудочного сока в целом. Эффект от применения Карбоната Кальция наступает достаточно быстро, однако при прекращении действия может возникнуть обратное действие, секреция желудочного сока усиливается. Вещество нормализует уровень электролитов, угнетает активность остеокластов, замедляет процессы разрушения костной ткани.
Показания к применению
Углекислый кальций назначают:
- при заболеваниях пищеварительного тракта при гиперацидности желудочного сока (гастриты, язва желудка, острый дуоденит, симптоматическая язва любого происхождения, эрозия ЖКТ, изжога, рефлюкс-эзофагит);
- пациентам с остеопорозом, в том числе во время постменопаузы;
- при кариесе и рахите в детском возрасте;
- пациентам с остеомаляцией и тетанией; , во время кормления грудью;
- в период интенсивного роста ребенка;
- при гипокальциемии после длительного лечения ГК, при почечной остеодистрофии, гипопаратиреозе, замедленном всасывании кальция;
- в составе комплексного лечения аллергии.
Противопоказания
Побочные действия
Карбонат Кальция может спровоцировать развитие аллергических реакций, диспепсии (газообразование, боли, диарея, запор), вторичного усиления желудочной секреции, гиперкальциемии, алкалоза.
Карбонат Кальция, инструкция по применению (Способ и дозировка)
Индивидуальный режим дозирования. В качестве антацида углекислый кальций назначают в дозировке от 500 мг до 1 грамма. При профилактике остеопороза применяют до 1,2 грамм в сутки.
Для детей дозировку корректируют. Назначают 300-600 мг вещества в день.
Передозировка
При передозировке может возникнуть гиперкациемия (прием более 2 грамм в сутки). Симптомы: общая слабость, головные боли, анорексия, отсутствие аппетита, рвота, запоры, чувство жажды, вялость, полиурия, болезненные ощущения в суставах и мышцах, сбои сердечного ритма, заболевания почек.
Показано промыть желудок, дать пострадавшему энтеросорбенты, проводить симптоматическое лечение.
Взаимодействие
Сочетанный прием средства с тетрациклиновыми антибиотиками может привести к снижению их эффективности и плазменной концентрации.
При сочетании препарата с тиазидными диуретиками выше риск развития метаболического алкалоза и гиперкальциемии.
Карбонат Кальция замедляет процессы абсорбции других лекарств.
При сочетании средства с левотироксином, оно снижает эффект от приема анаболика.
Особые указания
При продолжительном лечении средством рекомендуют контролировать плазменную концентрацию кальция.
При приеме больших доз препарата и больших количеств молочной продукции может развиться гиперкальциемия и молочно-щелочной синдром.
Нельзя применять лекарство в таблетированной форме для лечения рахита, кариеса и остеопороза в качестве антацида.
Детям
Для детей нужно скорректировать дозировку.
При беременности и лактации
Вещество часто назначают беременным женщинам и кормящим мамам.
Препараты, в которых содержится (Аналоги)
Торговые названия средства: Кальция карбонат, Витакальцин, Аддитива кальций, Скоралайт, УПСАВИТ Кальций. В комбинации с магния карбонатом: Тамс, Ренни, Рамни, Эндрюс антацид. В сочетании с колекальциферолом средство входит в состав следующих лекарств: Идеос, Ревиталь Кальций Д3, Кальций-Д3 Никомед, Натекаль Д3, Компливит кальций Д3. С магния гидроксидом: Гастрик, Витрум Маг. Комплексные средства: Альфадол-Са, Витрум Бьюти Люкс, Витрум Остеомаг, Гевискон, Кальцемин и так далее.
Отзывы
Вещество часто назначают для лечения дефицита кальция детям и взрослым пациентам, это хорошее средство от изжоги. Лекарство хорошо переносится, его добавляют в состав различных препаратов, разной ценовой категории. Пациенты отмечают высокую эффективность и отсутствие побочных реакции при использовании любых препаратов на его основе.
Цена Карбоната Кальция, где купить
Купить Кальция Карбонат пищевой на развес можно по цене 250 рублей за кг. Стоимость таблеток Ренни составляет порядка 150 рублей за 12 таблеток.

Автор-составитель: Марина Степанюк - провизор, медицинский журналист Специальность: Провизор подробнее
Опыт работы: С 2003 по 2013 г. – работала на должностях провизора и заведующего аптечным киоском. Награждена грамотами и знаками отличия за многолетний и добросовестный труд. Статьи на медицинскую тематику публиковались в местных изданиях (газеты) и на различных Интернет-порталах.
Обратите внимание!
Информация о действующих веществах на сайте является справочно-обобщающей, собранной из общедоступных источников и не может служить основанием для принятия решения об использовании данных веществ в курсе лечения. Перед применением вещества Карбонат Кальция обязательно проконсультируйтесь с лечащим врачом.
Комментарии
Синэстрол
Диета при молочнице во время беременности
Занамивир
Отзывы на Амписид
инструкция по применению Бупропиона
Похудеть после родов
Цена Триамцинолона
Тардиферон-Гино
Другие действующие вещества
Гопантеновая кислота
Прамирацетам
Нелфинавир
Цистеин
Статьи по теме
Цена Осталона
Химические свойства Гидроксида Алюминия
Инструкция по применению Ацетазоламида
Дисфункция яичников репродуктивного периода
Последние комментарии
Ирина: Купила в обычной аптеке, цена средняя, у меня было 789 за упаковку. Хороший источник .
Разиля: Сильная депрессия,практически перестала спать, в голову приходили всякие мысли, выписали .
Юлия: "Людмила 13 декабря 2018, 12:47 Отличный препарат,но какое время его можно принимать и с .
Владимир Михайлович: Моё заболевание клинической смертью началось 04.10.2015 г. в десять часов вечера, дома .




Все представленные на сайте материалы предназначены исключительно для образовательных целей и не предназначены для медицинских консультаций, диагностики или лечения. Администрация сайта, редакторы и авторы статей не несут ответственности за любые последствия и убытки, которые могут возникнуть при использовании материалов сайта.
Похоже на гипермаркет, где желающему купить пачку макарон предлагается стенд с двумя сотнями наименований, не правда ли? Вот только цена ошибки при выборе в случае с добавкой несоизмеримо выше.
Разобраться в многообразии того, что предлагается Вам на просторах сети, а главное — понять, что есть правда, а что — лукавство (назовем это так) в рекламировании и описании различных добавок[1], и призвана серия статей, которую мы начинаем публиковать.
Итак, отправимся вместе в увлекательное путешествие по просторам заблуждений относительно меловых добавок, и вместе попробуем найти то зерно истины, которое поможет нам правильно понимать, какую добавку и в каком случае нам стоит применять, а какую — нет.
Карбонат кальция: мел или мрамор?
Таким образом, мрамор это по сути своей и есть мел. Но есть и отличия. Отличаются мел и мрамор, прежде всего, внешним видом:

Цвет различен, потому что и в мраморе, и в меле зачастую есть окрашивающие примеси. Сам по себе кальцит — основная составляющая и мела, и мрамора — имеет белый цвет. А ведь известно, что примеси увеличивают абразивные свойства мела. Так, абразивность примеси доломита — порядка 4,5 по Моосу, а кварца — и вовсе 7, против 3 у непосредственно кальцита. А часто придающий мрамору рыжеватый оттенок оксид железа Fe2O3 и вовсе ускоряет окислительные процессы в полимере и ускоряет распад готовых мешков, биг-бэгов или пленок от солнечного света.
Вывод: Добавка на основе мела наносит относительно меньшее абразивное воздействие на оборудование при одинаковой твердости.
Карбонат кальция: природный или химически осажденный?
Ca(OH)2 + CO2 → CaCO3↓ + H2O
Также существуют способы получения химически осажденного карбоната кальция обработкой дистиллерной жидкости раствором карбоната натрия в присутствии бикарбоната натрия, чистого или в сочетании с динатриевыми солями сульфокарбоновых кислот. Тогда в меле увеличивается содержание хлоридов, от которых избавляются вводом алкисульфатов первичных спиртов или ортофосфата карбамида[7].
Разумеется, так происходит не везде в мире, и наверняка существуют более чистые способы получения карбоната кальция из других кальцийсодержащих веществ. Но какой способ был применен именно при изготовлении конкретной предлагаемой меловой добавки, сразу не очевидно: не все примеси явно видны при осмотре. Только хорошо оснащенная лаборатория сможет сказать Вам правду об этом с высокой степенью вероятности. Поэтому, когда Вам предлагают добавку, усиленно рекламируя химическую осажденность мела, стоит поинтересоваться, каким именно способом был осажден этот мел.
Вывод: химическое осаждение — не панацея.
В действительности важно то, какие вещества были использованы при производстве мела химическим способом. А еще лучше, если сам же производитель меловой добавки обладает и собственным меловым заводом, или же использует мел такого всемирно известного и авторитетного производителя, как Omya.
Размер частиц: какая цифра важнее?
Когда речь заходит о размере частиц карбоната кальция, на основе которого создана добавка, то логично предположить, что чем меньше заявляется размер частиц мела, тем лучше и дороже должна быть добавка. Для покупателей зачастую оказывается сюрпризом, что добавка, размер частиц которой заявлен даже в нанометрах (нм), в производстве не показывает никаких преимуществ по сравнению с добавками, размер частиц которых измеряется в микронах (мкм; например, 0,8–1,2 мкм, как в некоторых марках добавок A-Len). Попробуем разобраться, почему это так.
Размер D50 — это размер ячейки, в которую при сепарации проходит 50% частиц карбоната кальция. Если D50=1,2 мкм, то это значит, что 50% частиц мела провалились сквозь сито с ячейкой 1,2 мкм. Следовательно, их размер не может превышать 1,2 мкм: более крупные частицы остались сверху сита.
Размер D98 или 97 — это размер ячейки, в которую при сепарации проходит 98% (или 97%) частиц карбоната кальция. Если D98=5 мкм, то это значит, что 98% частиц мела провалились сквозь сито с ячейкой 5 мкм. Следовательно, их размер не может превышать 5 мкм по тому же принципу, что описан выше. И только 2% частиц могут быть крупнее 5 мкм.
Вывод: Надо ориентироваться в качестве меловой добавки не только по заявляемым размерам частиц, которые у всех поставщиков — D50, а по D98 илиD97. Следует особенно иметь в виду, что при одинаковой величине показателя D50 две различные добавки могут иметь разные показатели D97. Например, у двух марок D50 равен 1,2 мкм, а вот D97 у одной добавки может быть 12 мкм, а у другой — 5 мкм. Уж как сепарировали. И обязательно проверяйте ответы поставщика на практике, чтобы не переплачивать за нанометры.
Поверхностная обработка мела: нужна ли она?
Естественно, что чем дольше мы сможем эксплуатировать шнек без замены, тем выгоднее для нас, а значит — мы должны минимизировать естественный износ металла. Но при этом еще и заработать, ведь переработка полимеров — это не самоцель, а инструмент извлечения прибыли.
Поэтому через очень недолгое время с того момента, как весь мир приступил к наполнению пластмасс карбонатом кальция, и была разработана технология поверхностной обработки мела, призванной снизить или вообще исключить его абразивное воздействие. Это широко афишируемая всеми производителями наполнителей обработка мела стеаратами или стеариновой кислотой.
Прежде всего, давайте зададимся вопросом: какие именно качества придает мелу обработка стеариновой кислотой, или так называемая гидрофобизация?
Это даст нам ответ на вопрос, должна ли содержаться в составе мела стеариновая кислота как отдельный элемент, или она должна полностью раствориться в добавке, стать неотъемлемой частью самого мела, и как отдельный элемент не выделяться?
Стандартно реакция обработки карбоната кальция стеариновой кислотой (последняя имеет форму мелких кристаллов, этакий белый порошок) выглядит в развернутом виде следующим образом:

Результатом реакции является стеарат кальция:


То есть это не должно быть банальное смешивание сухих компонентов при неправильной температуре и без учета особенностей обрабатываемых материалов, как это приходилось видеть на некоторых производствах меловых добавок (а за время работы с добавками их приходилось посещать десятками).
Что нам дала правильная обработка стеариновой кислотой? Во-первых, мел и полимер прекрасно связались вместе, или, как говорят еще, компатибилизировались. Во-вторых, частицы мела оказались обволокнуты совершенно неабразивным стеаратом, и уже ничего Вам не поцарапают.
В таком случае не создается необходимых условий для реакции всего объема стеариновой кислоты с карбонатом кальция (температура другая, водяного пара нет, зато кроме мела и кислоты есть другие составляющие, а самого мела меньше, так что труднее точно ввести нужный процент активного вещества). В результате поверхность молекулы карбоната кальция покрывается стеаратом неравномерно, и часть карбоната кальция оказывается не связанной. Соответственно, при переработке эти несвязанные частицы мела активно мигрируют к поверхности. Расплав становится негомогенным, т.е. неравномерным, а частицы мела усиленно царапают металлические поверхности.
Если же зайти еще дальше в попытках сэкономить и засыпать в компаундер чистый стеарат кальция вместе с мелом? Стеарат кальция в таком виде не прореагирует с карбонатом кальция. Он останется как самостоятельное вещество, и, не обладая таким сродством с полимером, как стеариновая кислота, станет просто выпотевать на поверхность. Эффекта — ноль, в активе — нагар на голове и пленка с меловыми агломерациями.
Стеарат цинка: для чего он нужен?
В связи с ранее рассмотренным вопросом правильной обработки мела стеариновой кислотой может возникнуть еще один вопрос, который хотелось бы вывести в отдельный раздел.
Известно, что есть вещество, более эффективное, чем стеариновая кислота и стеарат кальция в качестве гидрофобизатора, термостабилизатора и смазывающего вещества. Речь идет о стеарате цинка:
или, в рациональном виде:
Zn(C18H35O2)2, либо [СН3(СН2)16COO]2Zn
Стеарат цинка получается при взаимодействии цинка со стеариновой кислотой и представляет собой белый или желтоватый слегка маслянистый порошок. Он традиционно используется в качестве смазывающего агента, а также для улучшения прилипания порошков, термостабилизацией различных полимеров и улучшения однородности смесей в целлюлозно-бумажном производстве.
Сразу может возникнуть идея: если стеарат цинка эффективнее стеарата кальция почему бы не смешать стеарат цинка с необработанным стеариновой кислотой карбонатом кальция прямо при изготовлении добавки? Другими словами, нельзя ли в целях удешевления заменить процесс гидрофобизации мела стеариновой кислотой на простой ввод стеарата цинка?
Как показывает практика, так не получается. Причина в том, что именно стеариновая кислота обладает необходимой кислотной карбоксильной группой, которая только и может реагировать с поверхностью частиц мела с образованием внешнего слоя стеарата кальция. Обратим внимание на то, что для качественной гидрофобизации мела природа связи гидрофобизатора с карбонатом кальция должна быть именно химической, а не физической — последняя легко разрушаема. Только качественная стеариновая кислота может создать наиболее прочную связь — химическую — с частицами карбоната кальция, и только правильные условия проведения реакции помогут создать равномерное покрытие всех частиц мела.
Но и без стеарата цинка в производстве действительно качественной добавки не обойтись. Как уже было отмечено выше, стеарат цинка — прекрасный термостабилизатор и лубрикант. А вот самое интересное состоит в том, что, находясь в одном расплаве со стеаратом кальция, они усиливают действие друг друга. Кроме того, стеарат цинка еще более легкоплавкий, чем стеарат кальция, а значит — в большем объеме выносится на поверхность расплава и служит дополнительной и очень значимой защитой Вашей шнековой пары от абразивного воздействия наполнителей, красителей, антислипов-антиблоков и других добавок.
Полимерное связующее: какой полимер лучше?
Существует категория пользователей добавок, представители которой уверены: если они работают с ПНД, то и меловая добавка, которую они используют, обязательно должна быть на основе ПНД. А если их основное сырье — ПВД, то и добавку следует вводить в него только на ПВД. И без вариантов.
Давайте посмотрим, действительно ли выбор добавки так однозначно зависит от используемого основного сырья?
Большая часть меловых добавок делается на основе полиэтилена. Начнем с него.
Как известно, полиэтилен — это синтетический термопластичный неполярный полимер, принадлежащий к классу полиолефинов. Продукт полимеризации этилена. В общем виде реакция полимеризации этилена выглядит так:

Получается, что химически молекула полиэтилена выглядит в общем виде вот так:
— СН2 — СН2 — СН2 — СН2 — СН2 — СН2 — СН2 —
Однако у разных видов полиэтилена вид цепочки немного различается. Вот как выглядит молекула полиэтилена высокого давления (ПВД), он же — полиэтилен низкой плотности (ПЭНП)[10]:
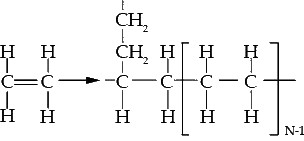
Такое строение дает следующую структуру молекулы ПВД[11]:

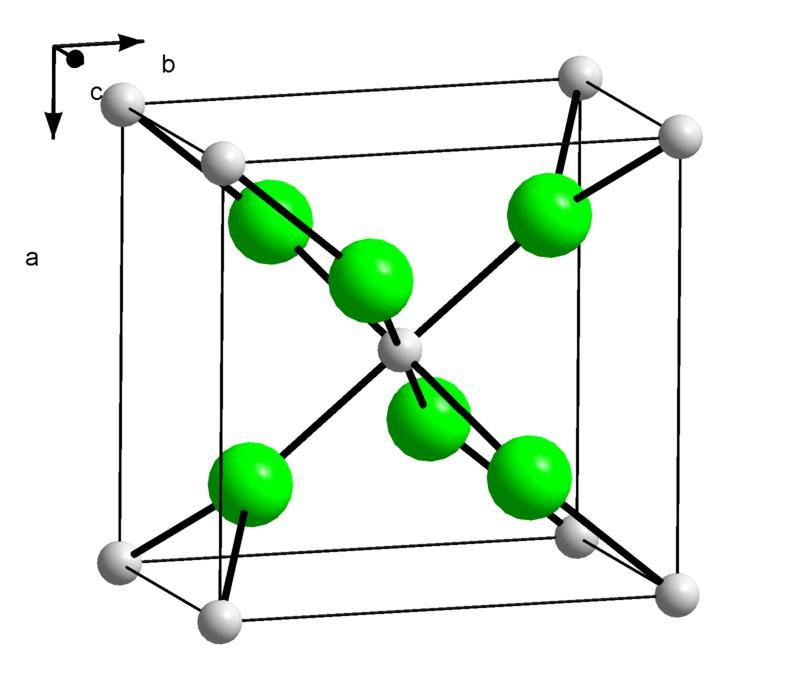
А теперь давайте сравним ее с молекулярной решеткой полиэтилена низкого давления (ПНД), он же полиэтилен высокой плотности (ПЭВП)[12]:


Что нам показывают эти картинки? В чем отличие?
Чтобы это понять, вспомним, что в науке о полимерах существует такое понятие, как кристалличность и аморфность. В любом полиэтилене имеются зоны (области), где молекулярные цепочки относительно ровные и расположены более упорядоченно относительно друг друга. Примерно как мы это наблюдаем в структуре ПНД. Эти области называются кристаллитами. Вокруг кристаллитов же наблюдается рыхлая аморфная структура. Хорошо демонстрирует такое интересное свойство молекул полиэтилена следующий рисунок[13]:

Что будет, если, например, ввести в ПНД добавку, которая также создана на основе ПНД? И так очень кристалличный полимер — ПНД — станет еще более жестким. В определенный момент, совпадающий с повышением процента ввода меловой добавки на основе ПНД (по опыту — начиная с 15%) начнется охрупчение полимера и резкое падение прочности. Внешне Вы увидите учащение обрывов рукава, а при испытаниях на разрыв пленка будет слабо тянуться и резко, как струна, рваться. Как говорится, такой пакет нам не нужен.
Логично было бы предположить, что в таком случае можно выполнить добавку на основе ПВД. Его аморфная структура могла бы послужить повышению эластичности пленки из ПНД. Но здесь мы вновь натыкаемся на препятствие: температура плавления ПНД выше, чем ПВД. Если ПНД плавится при 125–132°С, то ПВД — всего лишь при 103–110°С[15]. Получается, при переработке ПНД добавка на основе ПВД будет деструктировать раньше, и это налагает очень нежелательные лимиты на регулирование температур переработки. К тому же ПВД и ПНД практически не смешиваются между собой.
Вот сделать добавку на основе ПВД и в ПВД же ее вводить — можно. Но такая добавка будет иметь крайне узкий диапазон применения. А ведь нас всех интересует такой продукт, который мы могли бы вводить на всех экструдерах, и на ПВД, и на ПНД, чтобы в производственном процессе не возникало путаницы и не создавались условия для совершения ошибок оператором экструдера или ТПА.
Как же создать такую добавку, чтобы она подходила и для ПНД (не повышала степень кристалличности, а, наоборот, увеличивала эластичность, при этом не деструктировала слишком рано с созданием нагара на голове), и для ПВД (плавилась при достаточно низких температурах, не усиливала аморфность структуры)?
Далеко ходить оказалось не нужно. Есть такой чудесный материал, который в России еще пока не всеми оценен по достоинству. Это линейный полиэтилен — ЛПВД, он же ЛПЭНП, он же LLDPE. Он является мягким и эластичным материалом, плотность которого находится в диапазоне 0,915 — 0,925 г/см3. Выделяется устойчивостью к разрывам, проколам и ударам. А также ему характерны низкая плотность и высокая эластичность. Из ЛПВД производят пленку минимальной толщины[16].
Молекулярная структура ЛПВД такова[17]:

Как видите, структура достаточно разветвленная, сочетающая в себе зоны кристаллитов и аморфные области. Степень кристалличности —75-85%[18], т.е. ближе к ПНД. Структура похожа на ПВД, но ответвления короче, чем у ПВД. Этот полиэтилен имеет более высокую температуру размягчения и плавления, чем ПВД — 118°С, лучшие эксплуатационные свойства при низких и высоких температурах, более высокую химическую стойкость, в 2–3 раза более высокие стойкость к раздиру и проколу, прочностьи относительное удлинение при разрыве, устойчивость к растрескиванию, ударную вязкость. Прочность при растяжении ниже, чем у ПНД, но опять-таки выше, чем у ПВД. Отлично смешивается и с ПНД и с ПВД.
Для полипропилена добавка на основе ЛПВД также подойдет, но несколько ограниченно: при повышении процента ввода (более 10% в экструзию мешков, например) прочность на разрыв готового изделия является более низкой по сравнению с результатами использования с полипропиленом меловой добавки на основе полипропилена.
Вывод: добавка, созданная на основе ЛПВД, будет оптимально сочетаться как с ПНД, так и с ПВД, и может быть использована как на тех экструдерах, на которых изготавливается пленка из ПНД, так и на тех машинах, где выдувается ПВД-пленка. Однако применение с полипропиленом такой добавки ограничено падением прочности на разрыв готового изделия при повышении нормы ее ввода.
Полимерное связующее: можно ли обойтись без воска?
Получается, если Вы хотите иметь при переработке нормальные сдвиговые напряжения и контролируемую вязкость расплава, если Вам требуется сделать свое производство энергоэффективным, а производительность — достаточно высокой, то Вам не обойтись без полиэтиленового воска.
Полимерное связующее: что вместо воска и чем это грозит?
Итак, представьте, что Вы делаете меловую добавку и беспрестанно думаете: как удешевить ее и снять побольше маржи с каждой тонны? Кроме необработанного мела, не очень первичного полиэтилена или полипропилена, засыпанной прямо в бункер порошковой стеариновой кислоты (авось мел сам как-нибудь гидрофобизируется), Ваш взор падает на полиэтиленовый воск. Который, как мы уже рассмотрели, является либо продуктом последующей переработки полиэтилена, либо олигомером, специально получаемым в реакторе по методу Фишера-Тропша, и потому не может стоить дешевле полиэтилена и полипропилена. Можно найти дешевый воск, который получают деполимеризацией уже переработанного, вторичного полимера — содержащий огромное количество примесей (эти вещи при такой переработке проконтролировать невозможно). А можно пойти еще дальше и попытаться в качестве внутренней смазки использовать и вовсе другие химические вещества.
По внешнему виду добавки Вы никак не поймете, какой олигомер был в нее введен. Критерий истины — практика. Сравните несколько меловых добавок при высокой норме ввода — скажем, при 35–40%. Прочность и внешний вид готового изделия скажут Вам о том, какого качества воск, и воск ли вообще, был применен в составе добавки, гораздо лучше рекламных проспектов и интернет-обещаний.
Внешний вид гранулы: жуется или крошится?
Ясно, что если в некой добавке 70–75% мела, то полимера (полиэтилен/полипропилен + воск) там на 5–15% больше, чем в той, где мела 80–85%. Полимер стоит в 10–12 раз дороже мела, и его цена составляет бóльшую часть себестоимости готовой добавки. Значит, добавка, в которой мела 70–75%, должна стоить ощутимо дороже своих 80-процентных аналогов.
Проведенное в нашей хорошо оснащенной лаборатории исследование состава подобной добавки показало фактическое содержание мела 82%. Как же тогда возможно такое: добавка не крошится, а мела в ней много?
А на самом деле практика показывает еще, что добавка, которая хорошо крошится, но при этом фактически имеет 77–81% наполнения мелом, гораздо лучше распределяется в полимере — она сразу раскрашивается, и ей не нужно дополнительное время в шнеке, чтобы распасться. Особенно, если шнек короткий (отношение диаметра к длине менее 28/1) и не смесевой (не барьерный).
Вывод: внешний вид — не главное. Главное — результат. Не так важно, как добавка жуется; важно то, сколько Вы сможете ее максимально ввести, а значит — сколько денег Вы заработаете.
Итак, подведем итоги. Данной статьей мы попытались помочь Вам определиться в многообразной вселенной меловых добавок российского рынка. Напомним, мы вместе выяснили, что:
Сертификат и скидка на обучение каждому участнику

XVIII городская конференция "Юность Архангельска"
Направление: химия
Исследовательская работа
Многоликий карбонат кальция
Тимеровой Кариной Радиковной
Научный руководитель – учитель муниципального бюджетного общеобразовательного учреждения муниципального образования "Город Архангельск" "Средняя школа № 51 имени Ф.А. Абрамова"
Епишева Надежда Владимировна
Глава 1 Формы карбоната кальция в природе ………………………………………. 4
Глава 2 Получение карбоната кальция в лаборатории и его свойства……………… 5
Глава 3 Взаимопревращения карбоната и гидрокарбоната кальция в природе.
Образование сталактитов и сталагмитов…………………………………….. 5
Глава 4 Карбонат кальция – строительный материал………………………………. 6
Глава 6 Прочее применение карбоната кальция человеком…………………………. 8
Это вещество активно используют при создании бумаги, продуктов питания, лекарств, пластмассы, красок, резины, бытовой химии, памятников. В виде карбоната кальция мел используется для написания на досках [8].
Гипотеза : карбонат кальция - многоликое по внешнему виду вещество с разнообразными областями применения в человеческой деятельности. Найдём ли мы подтверждение этому?
Цель исследования заключается в детальном изучении свойств карбоната кальция, его формах в природе, применении человеком.
Для реализации поставленной цели необходимо решить следующие задачи:
- изучить литературные источники по данной теме;
- совершить экскурсию в экспозиционный зал минералов геологических фондов;
- собрать коллекцию различных природных форм карбоната кальция;
- провести лабораторные опыты, демонстрирующие получение и химические свойства карбоната кальция;
- совершить экскурсию в пещеры Голубино; рассмотреть сталактиты и сталагмиты, объяснить причину их образования;
- провести эксперименты со школьным мелом, выявить его состав и степень безопасности применения в школе;
- проанализировать состав некоторых пищевых продуктов на наличие пищевого красителя Е 170;
- совершить экскурсию в аптеку, чтобы узнать, часто ли людьми применяются препараты, содержащие карбонат кальция;
- собрать коллекцию предметов домашнего обихода с использованием карбоната кальция.
В ходе исследования применены следующие методы и приёмы : работа с литературными источниками, экскурсии, беседы со специалистами, химический эксперимент, сбор коллекций . Объект исследования – карбонат кальция. Предмет исследования – разнообразие форм карбоната кальция в природе, его свойства и применение жизни человека.
Основная часть
Формы карбоната кальция в природе
Карбонат кальция (углекислый кальций) — неорганическое химическое соединение , соль угольной кислоты и кальция . Химическая формула — CaCO 3 .
Карбонат кальция является распространенным минералом. В природе встречаются три полиморфные модификации (минералы с одинаковым химическим составом, но с различной кристаллической структурой): кальцит , арагонит и фатерит (ватерит).
Некоторые горные породы (известняк, мел, мрамор, травертин и другие известковые туфы ) практически полностью состоят из карбоната кальция с некоторыми примесями. Кальцит является стабильным полиморфом карбоната кальция и встречается в самом разнообразном геологическом окружении: в осадочных, метаморфических и магматических горных породах. Около 10 % всех осадочных пород составляют известняки, сложенные преимущественно кальцитовыми остатками раковин морских организмов. Арагонит является вторым по устойчивости полиморфом CaCO 3 и в основном образуется в раковинах моллюсков и скелетах некоторых других организмов. Также арагонит может образовываться и в неорганических процессах, например в карстовых пещерах или гидротермальных источниках. Фатерит является наименее стабильной разновидностью этого карбоната, и очень быстро превращается в воде либо в кальцит, либо в арагонит. В природе встречается относительно редко, когда его кристаллическая структура стабилизирована теми или иными примесями [8].
Получение карбоната кальция в лаборатории и его свойства
При пропускании через известковую воду углекислого газа наблюдается помутнение в результате образования нерастворимого карбоната кальция.
При нагревании жёсткой воды, содержащей растворимый гидрокарбонат кальция, образуется нерастворимый карбонат кальция. Так устраняется временная жёсткость воды.
Реакция обмена карбонатов с другими солями
Карбонат кальция - твёрдые белые кристаллы, нерастворимые в воде, нетоксичны. Молярная масса – 100 г/моль. Плотность кальцита – 2,74 г/моль, арагонита – 2,83 г/моль.
При нагревании разлагается:
В водном растворе в присутствии оксида углерода ( IV ) превращаются в гидрокарбонаты:
Мы получили в лаборатории карбонат кальция и провели качественную реакцию на него – взаимодействие с кислотой (прил. 3).
Взаимопревращения карбоната и гидрокарбоната кальция в природе.
Образование сталактитов и сталагмитов.
Со сводов пещер капает жёсткая вода. Это и преобразованные в каменных породах осадки, которые просочились с поверхности земли, и собственный пещерный конденсат.
На поверхности камня проходит обратная реакция. Растворённый в воде гидрокарбонат кальция снова превращается в карбонат, отдавая углекислый газ.
Мы посетили Голубинский провал (Пинежский район, Архангельская область) и обнаружили сталактиты и сталагмиты, но они были ледяные, а не из карбоната кальция. В Северных пещерах трудно найти карбонатные образования (прил.3).
Карбонат кальция – строительный материал.
Природный карбонат кальция - это древнейший строительный отделочный камень, главные отличия которого - это долговечность, исключительные декоративные и экологические качества, чистота цвета, однородность структуры, простота обработки и монтажа, эффективная теплоизоляция, доступная стоимость. Природный фасадный камень - это, возможно, единственный строительный материал, который может называться вечным, по праву считается символом прочности и надежности.
Мрамор - это камень, который применяется для изготовления изделий для интерьера и для отделки зданий. Широкая цветовая гамма делает мрамор универсальным для оформления интерьера. Разнообразные оттенки мрамора возникают благодаря содержанию в большем или меньшем количестве окислов различных металлов и графита. А прожилки, представляющие собой трещины, заполненные природными цементами, образуют на камне неповторимый рисунок [3].
Мы обнаружили в интернете рекламные объявления различных фирм в г. Архангельске, предлагающих услуги по отделке мрамором лестниц, дорожек, каминов, столешниц, подоконников. На левом берегу Двины, рядом с остановкой ЛДК-4 установлен памятник павшим в боях за честь и независимость нашей Родины в 1941-1945 годах. Он представляет собой бетонную фигуру солдата, стоящего на пьедестале обитым мрамором (прил.3).
Кроме того, ш патлевки, различные герметики — все они содержат карбонат кальция в значительных количествах.
Школьный мел
Школьный мел состоит на 40 % из карбоната кальция и на 60 % из гипса (чаще всего) или любого другого связующего вещества (клей ПВА, крахмал) плюс небольшое количество карбоната магния, оксидов металлов, незначительных примесей кварца, ископаемых морских организмов (радиолярии, фораминиферы) [4].
Впервые я услышала о карбонате кальция на уроках химии, когда речь зашла о меле.
Мел бывает разный по своим качествам: мягкий, твёрдый, блёклый, яркий, сильно крошится, плотный. Конечно, он не является ядовитым, но влияет ли мел на состояние здоровья человека, ведь так часто мы им пользуемся в школе? Действие мела на организм обусловлено индивидуальными особенностями каждого человека. Как и любая пыль, меловая пыль также накапливается в дыхательных путях, вызывая раздражения. Отсюда кашель, першение в горле, чихание. Пострадать может и чувствительная кожа. Руки от мела могут чесаться, кожа сохнуть. Поедание мела - это пристрастие людей с пониженным содержанием железа. Такой феномен часто наблюдается у беременных женщин и детей.
- во время работы с мелом чаще мыть руки со смягчающим туалетным мылом;
- после каждого урока желательно смазывать руки увлажняющим кремом для рук;
- стирать мел с доски только влажной тряпкой - так меловой пыли гораздо меньше;
- промывать тряпку для стирания мела с доски как можно чаще, чтобы она была чистой.
Современный мел есть нельзя, т.к. он содержит различные добавки. Так считают большинство учителей. Действительно, в меле может быть клей. Детей, желающих полакомиться мелом, в настоящее время практически нет. Не всех учителей устраивает мел, которым они пользуются в школе. Они отмечают, что мел крошится, ломается, много меловой пыли (прил. 2).
Мы провели анализ качественного состава школьного мела. В наличии – карбонат кальция, сульфат кальция, крахмал. Это те, компоненты, которые мы смогли обнаружить в меле с помощью качественных реакций.
Са SO 4 + BaCl 2 = Са Cl 2 + BaSO 4 (мел (фильтрат) + хлорид бария, наблюдается белый осадок)
Мел (настой) + йод синее окрашивание, что говорит о наличии крахмала (прил.3).
Прочее применение карбоната кальция человеком.
Карбонат кальция используется в качестве пищевой добавки Е 170 . Эта безопасная пищевая добавка природного происхождения используется как пищевой краситель, разрыхлитель и регулятор кислотности. Кроме того, он предотвращает комкование и слёживание. Для пищевой промышленности его извлекают из мрамора. Это белый порошок без вкуса и запаха. Е 170 используют в составе детского питания, продуктов с содержанием какао, шоколада, твёрдых и плавленых сыров, молочных продуктов и прочее [7].
Для самых различных целей карбонат кальция используется в быту: для побелки потолков, покраски стволов деревьев, для подщелачивания почвы в садоводстве.
Очищенный от посторонних примесей, карбонат кальция широко используется в бумажной и пищевой промышленности , при производстве пластмасс, красок, резины, продукции бытовой химии. Производители бумаги используют карбонат кальция одновременно в качестве отбеливателя, наполнителя (заменяя им дорогостоящие волокна и красители), а также раскислителя. Производители стеклянной посуды, бутылок, стекловолокна используют карбонат кальция в огромных количествах в качестве источника кальция — одного из основных элементов, необходимых для производства стекла. Производители пластмассы — одни из основных потребителей карбоната кальция (более 50 % всего потребления). Используемый в качестве наполнителя и красителя, карбонат кальция необходим при производстве поливинилхлорида (PVC), полиэфирных волокон (кримплен, лавсан, и т. п.). Изделия из данных видов пластмасс распространены повсеместно — это трубы, сантехника, кафельная плитка, черепица, линолеум, ковровые покрытия . Широко используется при производстве продукции личной гигиены (например, зубной пасты).
Мы собрали коллекцию продукции, в составе которой имеется карбонат кальция.
В ходе работы выполнен следующий объём работ и получены результаты:
- изучили литературные источники по данной теме, которая оказалась очень широкой, поэтому общий кругозор значительно повысился;
- совершили экскурсию в экспозиционный зал минералов геологических фондов;
- собрали коллекцию различных природных форм карбоната кальция;
- провели лабораторные опыты, демонстрирующие получение и химические свойства карбоната кальция;
- совершили экскурсию в пещеры Голубино; рассмотрели сталактиты и сталагмиты, объяснили причину их образования, но лишь один из них, возможно, являлся карбонатным;
- провели эксперименты со школьным мелом, выявили его состав (большой процент карбоната кальция) и степень безопасности применения в школе;
- проанализировали состав некоторых пищевых продуктов на наличие пищевого красителя Е 170 – встречается в продуктах довольно редко;
- совершили экскурсию в аптеку, чтобы узнать, часто ли людьми применяются препараты, содержащие карбонат кальция (препараты очень востребованы);
- собрали коллекцию предметов домашнего обихода с использованием карбоната кальция.
Итак, цель достигнута. Мы детально изучили свойства карбоната кальция, его формы в природе, применение человеком. Гипотеза подтвердилась. Карбонат кальция - действительно, пожалуй, самое многоликое вещество на нашей планете. Минералы с карбонатом кальция слагают многокилометровые слои на тысячекилометровых пространствах континентов, целые горные системы. Из этого же вещества коралловые полипы создали одно из самых грандиозных сооружений на Земле - Большой Барьерный риф, протянувшийся на 2000 км вдоль побережья Австралии. Кальцит - это причудливый и таинственный мир пещер, белокаменное сияние древнейших городов мира и не подвластные тысячелетиям египетские пирамиды, мраморные колонны античных храмов и многоцветная облицовка станций метро [6]. И обычный школьный мелок – это тоже карбонат кальция. Благодаря тому, что карбонат кальция неядовитое вещество, человек нашёл ему очень широкое применение. Это мы тоже показали в работе.
Работа заинтересовала меня. В дальнейшем планируем работать в рамках этой темы по более узким вопросам.
Библиографический список
Габриелян О.С. Химия. 9 класс: учеб. для общеобрзоват. учреждений/ О.С. Габриелян. – М.: Дрофа, 2009. – 222 с. ISBN 5-7107-9290- X
Очень часто люди путают хлорид кальция и карбонат кальция. Из этой статьи вы узнаете не только о различиях, но и о каждом из этих элементов отдельно. Материал будет полезен и для тех, кто заинтересован в химии, и просто для любознательных людей. Статья даст возможность понять, что химия – это очень важная наука!
Основные и связанные понятия
Несмотря на то, что хлорид кальция и карбонат кальция в химии принадлежат к совершенно разным группам, находятся в прямой зависимости друг от друга.
Вам будет интересно: Музыкальный колледж в Вологде: адрес, время работы, преподаватели и условия приема
С помощью хлорида кальция можно получить и его карбонат. Теперь стоит разобрать отдельно каждое из этих веществ. О них необходимо знать для того, чтобы не попасть в неловкое положение, ведь знания по химии необходимы каждому, хотя бы на минимальном уровне.
Хлорид кальция
Хлорид кальция – это кальциевая соль соляной кислоты. При нормальных условиях существует в виде белых или прозрачных кристаллов. Легко растворяется в спирте и в воде. Содержание кальция в данном хлориде составляет 27 %. Данный хлорид имеет очень широкое распространение в медицине, так как кальций является неотъемлемой частью организма. Еще одно назначение этого вещества – консервирование продуктов. Именно хлорид кальция является солью, которая входит в состав многих консервантов и помогает храниться продуктам дольше.
Хлорид кальция с карбонатом калия в объединении образуют карбонат кальция, о котором и пойдет речь в следующем пункте. Эта реакция является одним из важнейших химических свойств данного вещества.
Карбонат кальция
Карбонат кальция (или, как его иногда называют в химии, углекислый кальций) – это соль угольной кислоты и кальция. Одним из самых простых и надежных способов его получения уже был описан выше, однако есть и еще несколько. Также он встречается и в естественной природе в виде мрамора и мела, которые далеко не редко встречаются нам.
Данное вещество также очень широко используется в медицине. Часто его применяют в качестве консервирующего вещества.
Еще одна стезя, в которой оно применяется – сельское хозяйство. Карбонат кальция служит неплохим удобрением для почвы и используется в самых разных наполнителях.
Заключение
В завершение хотелось бы отметить, что нельзя недооценивать роль, пусть даже на первый взгляд маловажных, веществ. Каждое из них несет какую-либо пользу, либо же, напротив, – вред. На примере хлорида и карбоната кальция можно понять, что химия – это не такая уж далекая от жизни человека наука, как считают многие!
Читайте также:

