Как сделать изомеры алкенов
Обновлено: 04.07.2024
Алкены – это ненасыщенные органические соединения, которые состоят из углерода и водородных атомов, по крайней мере с одной двойной связью в углеродной цепи. Рассмотрим строение алкенов и особенности образования двойной связи.
Общая молекулярная формула нециклических алкенов — CnH2n, циклических алкенов — CnH2n-2 где n равняется любому целому числу, больше единицы. Полярность молекулы алкена, за счет наличия двойной связи выше, по сравнению с алканами. В алкенах одна s-орбиталь и 2 р-орбитали атома углерода при двойной связи, находятся в состоянии sp 2 -гибридизации. Еще одна р-орбиталь – негибридизованная.

Орбитали гибридизованного атома С располагаются под углом 120 о относительно друг друга, образуя плоский треугольник.
Рассмотрим образование молекулы алкена на примере этилена СН2=СН2.
Молекула этилена образуется при соединении двух sp 2 -гибридизованных атомов углерода и 4 атомов водорода.

Длина двойных связей составляют 0,133 нм, что меньше длины одинарных связей – 0,154 нм.
Две связи в составе двойной отличаются по типу и силе:
- сигма (σ) связь – образуется при осевом соединении sp 2 -гибридизованных орбиталей и является сильной связью
- пи (π) связь – образуется при боковом наложении негибридизованных p – орбиталей. По сравнению с σ связью является более слабой.
Изомерия и номенклатура алкенов
Для алкенов характерна изомерия структурная (изомерия углеродного скелета, положения кратных связей и заместителей, межклассовая) и геометрическая (цис-, транс-, Z-, E-). Подробно о каждом виде изомерии изложено в разделе Изомерия органических соединений.
Названия алкенов строят согласно рациональной номенклатуре или номенклатуре ИЮПАК. Также для некоторых алкенов приняты тривиальные названия, например, этилен (этен), изопропилен (2-метилпропен) и др. Правила построения названия по номенклатуре ИЮПАК представлены в разделе Номенклатура алкенов.
Когда мы говорили об алканах , упоминалась насыщенная связь. У алкенов эта связь ненасыщенная, двойная связь — этим определяются все свойства алкенов . Эта связь видоизмененных (= гибридизированных) орбиталей:
Sp² — гибридизация
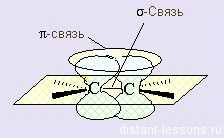
Получается, что по двойной связи молекула имеет плоскость . Радикалы при двойной связи будут располагаться по обе стороны от этой плоскости.
Общая формула алкенов:
n = числу атомов углерода.
Номенклатура алкенов строится из двух частей .
- в качестве основной цепи выбирается та, в которой находится двойная связь, не зависимо от ее размера,
- нумерация идет с того конца, к которому ближе двойная связь
- после окончания -ен ставится номер атома, после которого идет двойная связь.
Соответственно, существует 3 вида изомерии алкенов:
- Структурная
- Пространственная
- Межклассовая
Структурная изомерия алкенов: ну, во первых, можно по цепи двигать двойную связь — изомерия положения двойной связи:
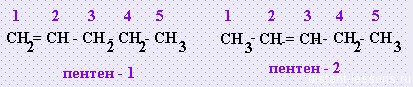
во-вторых, изомерия положения радикалов:
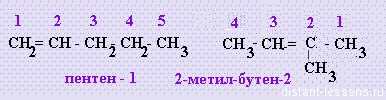
Пространственная изомерия: это положение одинаковых радикалов при двойной связи либо по одну, либо по разные стороны от плоскости двойной связи: цис- \транс-изомерия :

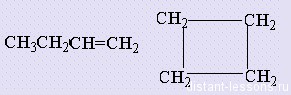
Межклассовая изомерия алкенов: по общей формуле — СnH2n алкены изомерны циклоалканам.
Химические свойства алкенов:

Двойная ненасыщенная связь обуславливает такие свойства алкенов, как реакции присоединения — π- связь разрывается и образуется одинарная — алкены превращаются в алканы .
- Реакции присоединения:
- СH2=CH-CH3 + H2 → CH3-CH2-CH3
- CH2=CH-CH3 + Br2 → CH2Br-CHBr-CH3 — качественная реакция на алкены — обесцвечивание бромной воды.
- Присоединение по правилу Марковникову:
водород присоединяется к наиболее гидрогенезированному (= к тому, у которого больше водородов) атому углерода при двойной связи:
- В нейтральной (или слабощелочной среде:
СH2=CH2 → CH2(OH) — CH2(OH) — схематичное уравнение
3СH2=CH2 + 2KMnO4 + 4H2O = 3C2H4(OH)2 + 2MnO2 + 2KOH — полное уравнение - В кислой среде — идет разрыв двойной связи:
R-СH=CH-R → 2R-COOH — схематичное уравнение - полное сгорание: С2H4 + 3O2 = 2CO2 + 2H2O
Алкены получают двумя способами:
- Гидрирование алкинов: C2H2 + H2 = C2H4
- из производных алканов: дегидрирование, дегалогенирование, дегидрогалогенирование и т.д.
- в ЕГЭ это вопрос А13 и А14— Строение и свойства углеводородов
- в ГИА (ОГЭ) это B2— Первоначальные сведения об органических веществах: предельных и непредельных углеводородах
Здравствуйте!Небольшая опечатка в таблице получения алкенов — Алканы-де-…де-…
Здравствуйте, можете помочь со следующими заданиями:
1) Классификация этиленовых углеводородов( не представляю, что там может быть. Может какие из них являются газами, жидкостями и твердыми вещесвами)
2) Уравнение реакции гидробромирования пентена-2( вопрос в том, куда будет присоединяться водород, а куда бром, и почему. Я знаю, что есть правило Морковникова, но здесь оба атома углерода одинаково гидрогенизированы)
3) Написать формулЫ и названия дигалогенпроизводных из которых при взаимодействии с цинком получается 4-этил-2-метилпентен-1( эти формулы будут отличаться только галогенами, или же может быть какое-то отличие в строении? И все-ли галогены могут тут присутствовать?)
Доброго времени суток!
1) по классификации — можно ответить про изомеры -на сайте есть по этому вопросу информация
2) Пентен-2: СH3-CH=CH-CH2-CH3 — водород может пойти как ко второму атому С, так и к 3. Суть в том, что на практике всегда образуется смесь изомеров.
3) 4-этил-2-метилпентен-1: СH2=С(CH3)-СH2-СH(C2H5)-СH3 будет образовываться из СH2Cl-CCl(CH3)-СH2-СH(C2H5)-СH3 , можно дибромпроизводное взять, разницы нет.
Сертификат и скидка на обучение каждому участнику

Химия 10 класс Учитель Федорова О.В.
Урок № 6 Дата
Тема урока: Электронное и пространственное строение алкенов. Гомология и изомерия алкенов. Свойства, получение и применение алкенов.
Цель урока: рассмотреть электронное и пространственное строение алкенов, гомологический ряд алкенов, на примере этилена показать новый вид изомерии, формировать навыки учащихся в составлении формул алкенов, умении называть вещества, изучить области применения ацетилена.
Задачи урока:
Образовательные:
- подвести учащихся к пониманию, осознанию электронной природы химической связи в алкенах.
Развивающие:
- развить абстрактное мышление, познавательную активность, умение работать с таблицами, анализировать, делать выводы, умение выделить главное.
Воспитательные:
- воспитать уверенность к себе, самостоятельность, аккуратность, внимательность, культуру труда, любовь к выбранной профессии.
Планируемые результаты
- знать э лектронное и пространственное строение алкенов, гомологи и изомеры алкенов, номенклатуру алкенов;
- сформировать умение составлять структурные формулы органических соединений, используя алгоритм построения, устанавливать причинно-следственные связи между составом, строением и применением веществ.
- формирование умений управлять своей учебной деятельностью, подготовка к осознанию выбора дальнейшей образовательной траектории
Метапредметные:
Коммуникативные:
- формулировать собственное мнение и позицию, задавать вопросы.
Регулятивные:
- отработать навыки пользования номенклатурой IUPAC применительно к алкенам;
- продолжить развитие умения планировать и регулировать свою деятельность, самостоятельно планировать пути достижения цели.
Познавательные:
- умение определять понятия, устанавливать аналогии, строить логические заключения и делать выводы.
Тип урока: урок изучения нового материала
I Организационный момент
II Актуализация опорных знаний учащихся
1. Первый представитель ряда алканов называется:
а) бутан; б) пропан; в) октан; г) метан.
2. Общая формула алканов:
а ) С n H2 n ; б ) С n H2 n +2 ; в ) С n H2 n –2 ; г ) С n Hn .
3. Атомы углерода в алканах находятся в состоянии:
а) sр -гибридизации;
б) pр -гибридизации;
в) sр 3 -гибридизации;
4. Валентный угол в алканах равен:
а) 109°28'; б) 180°; в) 90°; г) 270°.
5. Молекула метана имеет строение:
а) октаэдрическое; б) плоскостное;
в) тетраэдрическое; г) гексагональное.
6. Связи в молекуле алканов:
а) двойные; б) тройные;
в) полуторные; г) одинарные.
7. Вещество СН 3 –СН(CH 3 )– СH(CH 3 )–СН 3 называется:
а) 2,3,4-триметилоктан; б) н -гексан;
в) 2,3-диметилбутан; г) 3,4-диметилпентан.
8 . Для алканов характерна изомерия:
а) положения кратной связи;
б) углеродного скелета;
г) положения функциональной группы
9. Реакция 2СН 3 I + 2Na = 2NaI + C 2 Н 6 носит имя:
а) Н.Н.Зинина; б) А.М.Бутлерова;
в) Ш.А.Вюрца; г) Д.И.Менделеева.
10. Взаимодействие метана с хлором – это реакция:
а) разложения; б) соединения;
в) обмена; г) замещения.
Критерии оценивания: каждый правильный ответ – 0.5 балла.
III Мотивация учебной деятельности
Изучая классификацию углеводородов, мы выяснили, что кроме предельных углеводородов, существуют непредельные. Как вы считаете, какова цель нашего урока?
IV Изложение нового материала
1. Строение алкенов
Этиленовые углеводороды (алкены) – это углеводороды, в молекулах которых атомы углерода связаны между собой одной двойной связью.
Общая формула алкенов CnH 2 n .
Первый представитель гомологического ряда алкенов – этилен.
Молекулярная формула – C 2 H 4 .
Структурная и электронная формулы этилена имеют вид:
Атомы углерода при двойной связи находятся в состоянии sp 2 -гибридизации. Двойная связь состоит из σ-связи, образованной sp 2 -гибридными орбиталями, и π-связи, возникающей за счет перекрывания p-орбиталей. Три σ-связи атома углерода направлены к вершинам треугольника с атомом С в центре, угол между связями 120 о .
Молекула этилена плоская, а электронная плотность π-связи расположена над и под этой плоскостью. В других алкенах плоским является фрагмент, который непосредственно примыкает к двойной связи. В углеродных соединениях π-связь значительно слабее, чем σ-связь. Под воздействием реагентов π-связь легко разрывается. Шаростержневые модели молекул этена и пропена отражают их пространственное строение.
Рис. 1. Строение этилена
Рис. 2. Модель молекулы пропилена
Рис. 2. Модель молекулы этилена
Валентный угол - 120°
Длина (- С = С -) связи – 0,134 нм
2. Номенклатура и изомерия
По систематической номенклатуре названия этиленовых углеводородов производят заменой суффикса -ан в соответствующих алканах на суффикс -ен (алкан — алкен, этан — этен, пропан — пропен и т.д.), общее название углеводородов данного ряда алкены, но за этиленом и пропиленом сохранились старые названия.
Структурная изомерия алкенов
1. Изомерия углеродного скелета (начиная с С4Н8):
2. Изомерия положения двойной связи (начиная с С4Н8):
3. Межклассовая изомерия с циклоалканами, начиная с С3Н6:
Пространственная изомерия алкенов
Вращение атомов вокруг двойной связи невозможно без ее разрыва. Это обусловлено особенностями строения p-связи (p-электронное облако сосредоточено над и под плоскостью молекулы). Вследствие жесткой закрепленности атомов поворотная изомерия относительно двойной связи не проявляется. Но становится возможной цис-транс-изомерия.
Алкены, имеющие у каждого из двух атомов углерода при двойной связи различные заместители, могут существовать в виде двух пространственных изомеров, отличающихся расположением заместителей относительно плоскости p-связи.
Так, в молекуле бутена-2 СН3–СН=СН–СН3 группы СН3 могут находиться либо по одну сторону от двойной связи в цис -изомере, либо по разные стороны в транс-изомере.

,
Алгоритм составления названий изомеров алкенов
1.Номеруем самую длинную цепь с того конца, где ближе двойная связь
2.Называем радикалы, начиная с простейшего, указываем их число и местоположение.
3.Называем самую длинную цепь.
4.Указываем месторасположение двойной связи цифрой в конце названия через дефис.
3. Физические свойства
Этилен, пропилен и бутен – газы. Алкены, содержащие от 5 до 18 атомов С в молекуле, – жидкости. Если атомов в молекуле алкена больше 19 – это твердые вещества. Алкены бесцветны, нерастворимы в воде и легче ее, обладают характерным резким запахом. Этилен образуется в фруктах, регулируя процесс их созревания. К классу алкенов принадлежат феромоны некоторых насекомых.
4. Химические свойства
1. Реакции присоединения
Для алкенов характерны реакции присоединения по двойной связи С = С, при которых протекает разрыв пи-связи в молекуле алкена.
1.1. Гидрирование
Алкены реагируют с водородом при нагревании и под давлением в присутствии металлических катализаторов (Ni, Pt, Pd и др.).
Например, при гидрировании бутена-2 образуется бутан.

Реакц ия протекает обратимо. Для смещения равновесия в сторону образования бутана используют повышенное давление.
1.2. Галогенирование алкенов
Присоединение галогенов к алкенам происходит даже при комнатной температуре в растворе (растворители — вода, CCl 4 ).
При взаимодействии с алкенами красно-бурый раствор брома в воде (бромная вода) обесцвечивается. Это качественная реакция на двойную связь.
Например, при бромировании пропилена образуется 1,2-дибромпропан, а при хлорировании — 1,2-дихлорпропан.


Реакции протекают в присутствии полярных растворителей по ионному (электрофильному) механизму.
1.3. Гидрогалогенирование алкенов
Алкены присоединяют галогеноводороды. Реакция идет по механизму электрофильного присоединения с образованием галогенопроизводного алкана.
Например, при взаимодействии этилена с бромоводородом образуется бромэтан.

При присоединении полярных молекул к несимметричным алкенам образуется смесь изомеров. При этом выполняется правило Марковникова.
Правило Марковникова: при присоединении полярных молекул типа НХ к несимметричным алкенам водород преимущественно присоединяется к наиболее гидрогенизированному атому углерода при двойной связи.
Например, при присоединении хлороводорода HCl к пропилену атом водорода преимущественно присоединяется к атому углерода группы СН 2 =, поэтому преимущественно образуется 2-хлорпропан.

1.4. Гидратация
Гидратация (присоединение воды) алкенов протекает в присутствии минеральных кислот. При присоединении воды к алкенам образуются спирты.
Например, при взаимодействии этилена с водой образуется этиловый спирт.

Гидратация алкенов также протекает по ионному (электрофильному) механизму.
Для несимметричных алкенов реакция идёт преимущественно по правилу Марковникова.
Например, при взаимодействии пропилена с водой образуется преимущественно пропанол-2.

1.5. Полимеризация
Полимеризация — это процесс многократного соединения молекул низкомолекулярного вещества (мономера) друг с другом с образованием высокомолекулярного вещества (полимера).
nM → M n (M – это молекула мономера)
Например, при полимеризации этилена образуется полиэтилен, а при полимеризации пропилена — полипропилен.


2. Окисление алкенов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
2.1. Горение алкенов
Этилен горит ярким оранжеватым пламенем, в то время как этан — голубым. Это происходит потому, что массовая доля углерода в алкенах несколько выше, чем в алканах с тем же числом атомов углерода.
2.2. Каталитическое окисление
Каталитическое окисление протекает под действием катализатора.
Взаимодействие этилена с кислородом в присутствии солей палладия протекает с образовани ем этаналя (уксусного альдегида)

Взаимодействие этилена с кислородом в присутствии серебра протекает с образованием эпоксида (оксида этилена)

2.3. Мягкое окисление
Мягкое окисление протекает при низкой температуре в присутствии перманганата калия. При этом раствор перманганата обесцвечивается.
В молекуле алкена разрывается только π-связь и окисляется каждый атом углерода при двойной связи.
При этом образуются двухатомные спирты (диолы).

Например , этилен реагирует с водным раствором перманганата калия при низкой температуре с образованием этиленгликоля (этандиол-1,2)
5. Получение алкенов
1.Крекинг алканов
Основным промышленным источником получения первых четырех членов ряда алкенов (этилена, пропилена, бутиленов и пентиленов) являются газы крекинга и пиролиза нефтепродуктов, а также газы коксования угля (этилен, пропилен). Газы крекинга и пиролиза нефтепродуктов содержат от 15 до 30% олефинов. Так, крекинг бутана при 600°С приводит к смеси водорода, метана, этана и олефинов – этилена, пропилена, псевдобутилена (бутена-2) с соотношением олефинов ≈ 3,5 : 5 : 1,5 соответственно.
2. Дегидрирование алканов:
3. Гидрирование алкинов :
Получение в лаборатории
1. Дегидратация* спиртов:
*Правило А. М. Зайцева:
Отрыв атома водорода происходит от наименее гидрогенизированного атома углерода.
6. Применение (сам. работа обучающихся с учебником стр.53)
V Закрепление
1.Выполните тестовые задания на стр. 48, 54
V I Домашнее задание
§ 10, 11, выполнить упр.5, стр.48
VII Рефлексия

Данный видеоурок основывается на изучении гомологического ряда, общей формулы, электронного и пространственного строения, номенклатуры ИЮПАК, тривиальных названий и изомерии алкенов.

В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Алкены: гомологический ряд, номенклатура и изомерия"
Алкены – это углеводороды, которые содержат в составе молекул одну двойную С = С-связь.
Алкены довольно широко распространены в природе. Например, этилен является фитогормоном, который ускоряет созревание плодов. Насекомые выделяют феромоны, которые также являются алкенами. Натуральные экстракты растений содержат алкены в качестве основного компонента. В небольшом количестве этилен содержится в природном газе и в попутных газах.
Рассморим ещё 2 представителя алкенов. Это (R) – лимонен и альфа-пинен. Название (R) – лимонен говорит о том, что это алкен и здесь есть двойная связь. Это вещество пахнет апельсинами и придаёт апельсинам их запах. Другое вещество – альфа-пинен – тоже алкен и является основным компонентом скипидара, который используют как растворитель для масляных красок. Некоторые думают, что у скипидара неприятный запах, но это не так.

Первым представителем алкенов является этен, или этилен. Вторым алкеном является пропен, или пропилен, третьим – бутен, четвёртым – пентен. Эти углеводороды образуют гомологический ряд, в котором каждый последующий член ряда отличается на одну или несколько групп – СН2.
Алкены содержат в своей молекуле меньшее число водородных атомов, чем соответствующие им алканы (с тем же числом углеродных атомов), поэтому такие углеводороды называют непредельными или ненасыщенными. Поэтому, состав этих углеводородов выражается общей формулой CnH2n. Буква n, как и в случае алканов, показывает число атомов углерода, которое входит в состав углеводорода.
Если рассмотреть строение алкенов, то можно увидеть двойную связь между атомами углерода. При образовании этой двойной связи обобществляются две пары электронов от соседних атомов углерода. Одна пара электронов образует σ-связь, другая связь – π-связь – образуется за счёт перекрывания р-облаков по обе стороны от оси, которая соединяет центры атомов.
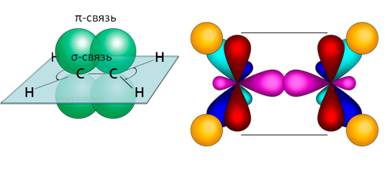
По своей природе π-связь резко отличается от σ-связи: π-связь менее прочная вследствие перекрывания электронных облаков вне плоскости молекулы. Под действием реагентов π-связь легко разрывается.
Установлено, что молекула этилена имеет плоскостное строение, валентные углы связей равны 120 °. Длина С = С-связи равна 0,134 нм. Такое плоскостное строение двойной связи характерно и для других алкенов. Молекула этилена симметрична; ядра всех атомов расположены в одной плоскости и валентные углы близки к 120°; расстояние между центрами атомов C равно 0,134 нм. У алкенов отсутствует вращение относительно двойной углерод-углеродной связи.

Название алкенов образуется с заменой суффикса -ан в названии соответствующего насыщенного углеводорода на суффикс -ен. Так, название этан заменяется на этен, а пропан – на пропен. Если в составе алкена более трёх атомов углерода, то в названии обязательно указывается положение двойной связи. Например, алкен, содержащий четыре атома углерода называется бутен, но в конце следует указать цифрой положение двойной связи. В первом случае двойная связь отходит от первого атома углерода, поэтому этот алкен называется бутен-1, у второго алкена двойная связь отходит от второго атома углерода, поэтому он называется бутен-2.
Нумерацию углеродной цепи у алкенов определяет двойная связь, при этом атом углерода около двойной связи должен получить наименьший номер.
Например, CCl3 – CH2 – CH = CH – CH3 называется 5,5,5-трихлорпентен-2, но не 1,1,1-трихлорпентен-3. Ещё одно правило: главная цепь должна содержать двойную связь, хотя может быть и не самой длинной. Например, данный углеводород называется 2-этилгексен-2, но не 3-метилгептен-3.
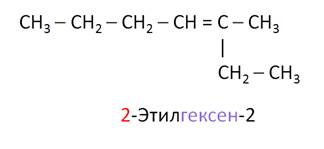
Таким образом, при названии алкенов в качестве главной цепи нужно выбрать самую длинную углеродную цепь, которая содержит двойную связь и наибольшее число заместителей. Атомы углерода нумеруют с того конца, где ближе двойная связь. После этого указывают цифрами атомы углерода, от которого отходят заместители. Далее записывают название углеводорода, заменяя суффикс -ан на -ен. В конце названия указывают атом углерода, от которого отходит двойная связь.
Назовём следующий углеводород.

Выбираем самую длинную цепь, которая содержит двойную связь и наибольшее число заместителей. В нашем случае два заместителя: метил и этил. В главной цепи 6 атомов углерода, значит, алкен называется гексен и от третьего атома углерода отходит двойная связь, значит название будет 4-метил-3-этилгексен-3.
Непредельные (алкеновые) радикалы называют тривиальными названиями или по систематической номенклатуре. Так, радикал с двумя атомами углерода и двойной связью между ними называется винил, или этенил, с тремя атомами углерода и двойной связью – аллил.
Для алкенов характерно несколько видов структурной изомерии: изомерия углеродного скелета и изомерия положения двойной связи. Изомерия положения двойной связи начинается с бутена. Так, для бутена характерна изомерия углеродного скелета. Его изомером в данном случае будет 2-метилпропен. Если рассмотреть изомерию положения двойной связи, то для бутена будет характерно два изомера: бутен-1 и бутен-2.
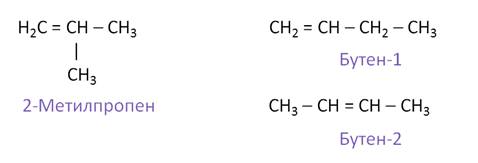
Кроме того, для алкенов характерна ещё и межклассовая изомерия с циклоалканами. Так, межклассовым изомером бутена будет циклобутан, который имеет такую же молекулярную формулу С4Н8.

Для алкенов характерна ещё и пространственная изомерия – стереоизомерия. Пространственные изомеры имеют только те алкены, которые содержат разные атомы или группы атомов у каждого атома углерода при двойной связи.
Сравним два алкена. У первого алкена у одного атома углерода при двойной связи разные атомы: Н и Cl, у второго атома углерода тоже разные. У второго же алкена при двойной связи у первого атома углерода два одинаковых атома, у второго – два разных. Потому первый алкен имеет пространственные изомеры, а второй – нет.

Если рассмотреть физические свойства алкенов, то можно заметить, что температура кипения и плавления алкенов увеличивается с увеличением относительной молекулярной массы. Этен, пропен и бутен – газы, алкены, содержащие от С5 – С17 – жидкости, алкены, содержащие 18 и более атомов углерода – твёрдые вещества. Алкены не растворяются в воде, они легче воды, алкены растворимы в органических растворителях (бензин, бензол и другие.)
Так, этилен (этен) – бесцветный газ с очень слабым сладковатым запахом, немного легче воздуха, малорастворим в воде.
Таким образом, общая формула алкенов CnH2n. Алкены содержат одну С = С-связь. Двойная связь образована σ-связью и π-связью. Молекула этилена имеет плоскостное строение. Название алкенов образуется с заменой суффикса -ан на суффикс -ен. Для алкенов характерна структурная и пространственная изомерия.
Читайте также:

