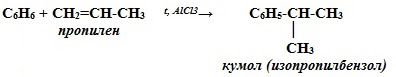
Как сделать из ch3cl c2h6
Добавил пользователь Владимир З. Обновлено: 05.10.2024
Справочник содержит названия веществ и описания химических формул (в т.ч. структурные формулы и скелетные формулы).
1. Бензилхлорид
2. 1,1-дихлорэтан
Русский: 1,1-дихлорэтан (IUPAC) [Wiki] ; English: 1,1-DCA ; 1,1-Dichloroethane (IUPAC) [Wiki] ; CFC-150a ; EINECS:215-077-8 ; Ethane, 1,1-dichloro- (CAS) ; ethylidene chloride ; ethylidene dichloride ;
3. Пентахлорэтан
Русский: 1,1,1,2,2-пентахлорэтан (IUPAC) ; Пентахлорэтан ; Хладон-125 ; хладагент R-120 ; English: 1,1,1,2,2-pentachloroethane (IUPAC) ; Ethane pentachloride ; Ethane, 1,1,1,2,2-pentachloro- ; Ethane, pentachloro- (CAS) ; PENTACHLORAETHAN ; Pentachlorethan ; Pentachloroethane ; Pentalin ; pentacloroetano ;
4. 1,2-дихлорэтан
Русский: 1,2-дихлорэтан (IUPAC) [Wiki] ; сим-дихлорэтан ; этилендихлорид ; English: 1,2-Bichloroethane ; 1,2-Dichloroethane (IUPAC) [Wiki] ; 1,2-Ethylene dichloride ; Brocide ; DCE ; Dichlor-Mulsion ; Dichloroethane, 1,2- ; Dutch liquid ; Dutch liquid, Dutch oil ; EDC ; EDC (halocarbon) ; Ethane dichloride ; Ethylene dichloride ; Freon 150 ; Glycol dichloride ; α,β-Dichloroethane ;
5. Хлораль
Русский: Хлораль [Wiki] ; трихлорацетальдегид ; трихлоруксусный альдегид (IUPAC) ; English: 2,2,2-trichloroacetaldehyde (IUPAC) ; Acetaldehyde, trichloro- (CAS) ; Anhydrous chloral ; Chloral [Wiki] ; Grasex ; Trichloroethanal ;
6. Ацетохлор
Русский: Ацетохлор ; English: 2-chloro-N-(ethoxymethyl)-N-(2-ethyl-6-methylphenyl)acetamide ; 2-chloro-N-ethoxymethyl-6'-ethylacet-o-toluidide (IUPAC) ; Acenit ; Acetochlor [Wiki] ; Erunit ; Harness ; Nevirex ; top hand ;
7. Этиленхлоргидрин
Русский: 2-хлорэтанол ; Этиленхлоргидрин ; English: 2-Chloro-1-ethanol ; 2-Chloroethanol (IUPAC) ; 2-Chloroethyl alcohol ; 2-Hydroxyethyl chloride ; 2-Monochloroethanol[ ; Chloroethanol ; Ethanol, 2-chloro- (CAS) ; Ethylchlorhydrin ; Ethylene chlorohydrin ; Glycol chlorohydrin ; Glycol monochlorohydrin ; β-Chloroethanol ; β-Hydroxyethyl chloride ; δ-Chloroethanol ;
8. Дихлоруксусная кислота
Русский: Дихлоруксусная кислота ; English: 2,2-Dichloroacetic acid ; Acetic acid, dichloro- (CAS) ; DCA ; Dichloroacetic acid (IUPAC) ; Dichloroethanoic acid ;
9. Гексахлоран
Русский: Гексахлоран ; гексахлорциклогексан ; English: Cyclohexane, 1,2,3,4,5,6-hexachloro- (CAS) ; Hexachlorocyclohexane ;
10. метазахлор
Русский: метазахлор ; English: 2-chloro-N-(2,6-dimethylphenyl)-N-(1H-pyrazol-1-ylmethyl)acetamide (CAS) ; 2-chloro-N-(2,6-dimethylphenyl)-N-(pyrazol-1-ylmethyl)acetamide (IUPAC) ; 2-chloro-N-(pyrazol-1-ylmethyl)acet-2',6'-xylidide (IUPAC) ; metazachlor ;
11. 1-хлорпропан
Русский: 1-хлорпропан ; English: 1-chloropropane (IUPAC) ; 1-propyl chloride ; Propane, 1-chloro- (CAS) ; chloromethylethane ; n-Propyl chloride ; propyl chloride ;
12. 2-хлорпропан
Русский: 2-хлорпропан ; изопропил хлористый ; English: 2-chloropropane (IUPAC) ; 2-propyl chloride ; Isoprid ; Isopropyl chloride [Wiki] ; Isopropylchloride ; Narcosop ; Propane, 2-chloro- (CAS) ; chlorodimethylmethane ; sec-propyl chloride ;
13. 1-Хлорбутан
Русский: 1-Хлорбутан ; English: 1-Chlorobutane (IUPAC) ; Butane, 1-chloro- (CAS) ; Butyl chloride ; N-Butyl chloride ; N-Propylcarbinyl chloride ; NBC wormer ; Sure Shot ;
14. 2-Хлорбутан
Русский: 2-Хлорбутан ; втор-бутилхлорид ; метилэтилхлорметан ; English: (±)-2-Chlorobutane ; 1-Methylpropyl chloride ; 2-Chloro-butane ; 2-Chlorobutane (IUPAC) [Wiki] ; BRN 1718770 ; Butane, 2-chloro- (CAS) ; EINECS:201-151-7 ; sec-Butyl chloride ;
15. Хлорметан
Русский: Хлорметан (IUPAC) ; метилхлорид ; монохлорметан ; фреон 40 ; English: Artic ; Chloromethane (IUPAC) ; Freon 40 ; Methane, chloro- (CAS) ; Methyl chloride ; Monochloromethane ; R 40 ; UN 1063 ;
16. Дихлорметан
Русский: ДХМ ; Дихлорметан (IUPAC) ; метилен хлористый ; хлористый метилен ; English: DCM ; Di-clo ; Dichloromethane (IUPAC) ; Freon 30 ; MDC ; Methane dichloride ; Methane, dichloro- (CAS) ; Methylene bichloride ; Narkotil ; R-30 ; Solaesthin ; Solmethine ; UN 1593 ; methylene chloride ; methylene dichloride ;
17. Хлороформ
Русский: Хлороформ [Wiki] ; метилтрихлорид ; трихлорметан ; хладон 20 ; English: Chloroform (IUPAC) [Wiki] ; Formyl trichloride ; Freon 20 ; Methane trichloride ; Methane, trichloro- (CAS) ; Methenyl trichloride ; Methyl trichloride ; R-20 ; TCM ; Trichloroform ; Trichloromethane ; UN 1888 ;
18. Тетрахлорметан
Русский: Тетрахлорметан (IUPAC) [Wiki] ; Хлорид углерода(IV) ; перхлорметан ; углерод четыреххлористый ; углеродтетрахлорид ; фреон-10 ; четырёххлористый углерод ; English: Benziform ; Benzinoform ; Carbon chloride ; Carbon tet ; Carbon tetrachloride [Wiki] ; Freon 10 ; Halon 104 ; Methane tetrachloride ; Methane, tetrachloro- (CAS) ; Perchloromethane ; Tetrachloromethane (IUPAC) ; Tetraform ; Tetrasol ;
1) Вычислить объём углекислого газа, выделившегося при сливании растворов, содержащих 5,3 гр карбоната натрия и 7,3 гр соляной кислоты. 2) Вычислить массовую долю поваренной соли в растворе, приготовленном из 40 гр соли и 160 гр воды.
Рассчитайте массу алюминия, необходимого для получения 130 г хрома из его оксида cr203 алюмотермическим способом
Определить количество оксида железа 3 необходимиго для получения чистого железа количеством 112 г путём алюминотермии и составить дано
Рассчитайте объем водорода, выделившегося при взаимодействии 30 г цинка с 200 мл 20%-ного раствора соляной кислоты
К раствору содержащему 27 г хлорида меди, добавили железные опилки. Какая масса меди выделилась в результате этой реакции?
Определи объем воздуха (кислорода 21%), необходимый для сжигания этилового спирта объемом 500 мл (плотность=0,8 г/мл) и массовой долей C2H5OH 92%
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH - | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | - | - | Н | Н | Н | |
| F - | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | - | Н | Р | Р |
| Cl - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | - | - | - | Н | - | - | Н | - | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS - | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | - | Н | ? | Н | Н | ? | М | М | - | Н | ? | ? |
| HSO3 - | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | - | Н | Р | Р |
| HSO4 - | Р | Р | Р | Р | Р | Р | Р | Р | - | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | - | Р |
| NO2 - | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | - | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO - | Р | Р | Р | Р | Р | Р | Р | Р | Р | - | Р | Р | - | Р | Р | Р | Р | Р | Р | Р | - | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые (
Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую:
Скопируйте эту ссылку, чтобы разместить результат запроса " " на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки - помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация - такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. ХИМИЯ – это область чудес, в ней скрыто счастье человечества, величайшие завоевания разума будут сделаны именно в этой области.(М. ГОРЬКИЙ) Таблица
|