Как сделать из бутана гексан
Добавил пользователь Morpheus Обновлено: 04.10.2024
– это предельный углеводород, содержащий четыре атома углерода в углеродной цепи. Бесцветный газ без вкуса и запаха, нерастворим в воде и не смешивается с ней.
Все алканы — вещества, схожие по физическим и химическим свойствам, и отличающиеся на одну или несколько групп –СН2– друг от друга. Такие вещества называются гомологами, а ряд веществ, являющихся гомологами, называют гомологическим рядом.
Самый первый представитель гомологического ряда алканов – метан CH4. , или Н–СH2–H.
Продолжить гомологический ряд можно, последовательно добавляя группу –СН2– в углеводородную цепь алкана.
| Название алкана | Формула алкана |
| Метан | CH4 |
| Этан | C2H6 |
| Пропан | C3H8 |
| Бутан | C4H10 |
| Пентан | C5H12 |
| Гексан | C6H14 |
| Гептан | C7H16 |
| Октан | C8H18 |
| Нонан | C9H20 |
| Декан | C10H22 |
Общая формула гомологического ряда алканов CnH2n+2.
Первые четыре члена гомологического ряда алканов – газы, C5–C17 – жидкости, начиная с C18 – твердые вещества.
В молекулах алканов встречаются химические связи C–H и С–С.
Связь C–H ковалентная слабополярная, связь С–С – ковалентная неполярная. Это одинарные σ-связи. Атомы углерода в алканах образуют по четыре σ-связи. Следовательно, гибридизация атомов углерода в молекулах алканов – sp3:
При образовании связи С–С происходит перекрывание sp3-гибридных орбиталей атомов углерода:
При образовании связи С–H происходит перекрывание sp3-гибридной орбитали атома углерода и s-орбитали атома водорода:
Четыре sp3-гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным.
Поэтому четыре гибридные орбитали углерода в алканах направлены в пространстве под углом 109о 28′ друг к другу:
Это соответствует тетраэдрическому строению.
| Например, в молекуле бутана C4H10 атомы водорода располагаются в пространстве в вершинах тетраэдров, центрами которых являются атомы углерода. При этом углеродный скелет имеет зигзагообразное строение. |

Структурная изомерия
Для бутана характерна структурная изомерия – изомерия углеродного скелета.
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Изомеры углеродного скелета отличаются строением углеродного скелета.
| Например. Для н-бутана (алкана с линейной цепью) существует изомер с разветвленным углеродным скелетом – изобутан |
| Бутан | Изобутан |
Для бутана не характерна пространственная изомерия.
– предельный углеводород, поэтому он не может вступать в реакции присоединения.
Для бутана характерны реакции:
- разложения,
- замещения,
- окисления.
Разрыв слабо-полярных связей С – Н протекает только по гомолитическому механизму с образованием свободных радикалов.
Поэтому для бутана характерны радикальные реакции.
Бутан устойчив к действию сильных окислителей (KMnO4, K2Cr2O7 и др.), не реагирует с концентрированными кислотами, щелочами, бромной водой.
Химические свойства бутана:
Бутан трудно вступает в химические реакции. В обычных условиях не реагирует с концентрированными кислотами, расплавленными и концентрированными щелочами, щелочными металлами, галогенами (кроме фтора), перманганатом калия и дихроматом калия в кислой среде.
Химические свойства бутана аналогичны свойствам других представителей ряда алканов. Поэтому для него характерны следующие химические реакции:
- 1. каталитическое дегидрирование бутана:
CH3-CH2-CH2-CH3 → CH2=CH-CH2-CH3 + H2 (kat = Pt, Ni, Al2O3, Cr2O3, повышенная to).
CH3-CH2-CH2-CH3 + Br2 → CH3-CHBr-CH2-CH3 + HBr (hv или повышенная to);
CH3-CH2-CH2-CH3 + I2 → CH3-CHI-CH2-CH3 + HI (hv или повышенная to).
Реакция носит цепной характер. Молекула брома или йода под действием света распадается на радикалы, затем они атакуют молекулы бутана, отрывая у них атом водорода, в результате этого образуется свободный бутил CH3-CH·-CH3, который сталкиваются с молекулами брома (йода), разрушая их и образуя новые радикалы йода или брома:
Br2 → Br·+ Br· (hv); – инициирование реакции галогенирования;
CH3-CH2-CH2-CH3 + Br· → CH3-CH·-CH2-CH3 + HBr; – рост цепи реакции галогенирования;
CH3-CH·-CH2-CH3 + Br → CH3-CHBr-CH2-CH3 + Br·;
CH3-CH·-CH2-CH3 + Br· → CH3-CHBr-CH2-CH3; – обрыв цепи реакции галогенирования.
Галогенирование — это одна из реакций замещения. В первую очередь галогенируется наименее гидрированый атом углерода (третичный атом, затем вторичный, первичные атомы галогенируются в последнюю очередь). Галогенирование бутана проходит поэтапно – за один этап замещается не более одного атома водорода.
CH3-CH2-CH2-CH3 + Br2 → CH3-CHBr-CH2-CH3 + HBr (hv или повышенная to);
CH3-CHBr-CH2-CH3 + Br2 → CH3-CBr2-CH2-CH3 + HBr (hv или повышенная to);
Галогенирование будет происходить и далее, пока не будут замещены все атомы водорода.
См. нитрование этана.
При избытке кислорода:
2C4H10 + 13O2 → 8CO2 + 10H2O.
При нехватке кислорода вместо углекислого газа (СО2) получается оксид углерода (СО), при еще меньшем количестве кислорода выделяется мелкодисперсный углерод сажа (в различном виде, в т.ч. в виде графена, фуллерена и пр.) либо их смесь.
C4H10 + SO2 + Cl2 → C4H9-SO2Cl + … (hv).
2C4H10 + 2SO2 + О2 → 2C4H9-SO2ОН (повышенная to).
Реакции замещения
В молекулах алканов связи С–Н более доступны для атаки другими частицами, чем менее прочные связи С–С.
1.1. Галогенирование
Бутан реагирует с хлором и бромом на свету или при нагревании.
При хлорировании бутана образуется смесь хлорпроизводных.
CH3-CH2-CH2-CH3 + Cl2 → CH3-CH2-CHCl-CH3 + HCl
Бромирование протекает более медленно и избирательно.
| Избирательность бромирования: сначала замещается атом водорода у третичного атома углерода, затем атом водорода у вторичного атома углерода, и только затем первичный атом. С третичный–Н > С вторичный–Н > С первичный–Н |
| Например, при бромировании пропана преимущественно образуется 2-бромбутан: CH3-CH2-CH2-CH3 + Br2 → CH3-CH2-CHBr-CH3 + HBr |
Хлорбутан может взаимодействовать с хлором и дальше с образованием дихлорбутана, трихлорбутана, тетрахлорбутана и т.д.
1.2. Нитрование бутана
Бутан взаимодействует с разбавленной азотной кислотой по радикальному механизму, при нагревании и под давлением. Атом водорода в бутане замещается на нитрогруппу NO2.
| Например. При нитровании бутана образуется преимущественно 2-нитробутана: |
CH3-CH2-CH2-CH3 + HNO3 → CH3-CH2-CHNO2-CH3 + H2O



Бутан, формула, газ, характеристики:
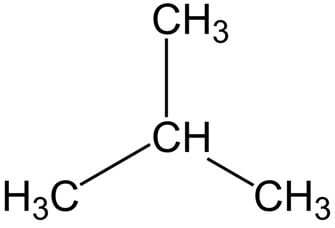
Рациональная формула н-бутана CH3-CH2-CH2-CH3, изобутана CH(CH3)3.
Строение молекулы н-бутана:
Строение молекулы изобутана:
Бутан – бесцветный газ, без вкуса, со специфическим характерным запахом.
В природе содержится в природном газе, добываемом из газовых и газоконденсатных месторождений, в попутном нефтяном газе. Для выделения из природного и попутного нефтяного газа производят их очистку и сепарацию газа.
Образуется также при крекинге нефтепродуктов., в т.ч. сланцевой нефти.
Также содержится в сланцевом газе и сжиженном газе (сжиженном природном газе).
Пожаро- и взрывоопасен.
Мало растворяется в воде и других полярных растворителях. Зато растворяется в некоторых неполярных органических веществах (метанол, ацетон, бензол, тетрахлорметан, диэтиловый эфир и другие).
Малотоксичен, но оказывает вредное воздействие на человека – на нервную систему (отравление, рвота, возможен летальный исход), обладает наркотическими свойствами, может вызвать удушье и сердечную аритмию, вызывает дисфункцию лёгочно-дыхательного аппарата. Класс опасности четвертый.
Дегидрирование бутана
Дегидрирование – это реакция отщепления атомов водорода.
В качестве катализаторов дегидрирования используют никель Ni, платину Pt, палладий Pd, оксиды хрома (III), железа (III), цинка и др.
При дегидрировании алканов, содержащих от 2 до 4 атомов углерода в молекуле, разрываются связи С–Н у соседних атомов углерода и образуются двойные и тройные связи.
| Например, при дегидрировании бутана преимущественно образуются бутен-2 (бутилен) или бутин-2. |
При дегидрировании бутана под действием металлических катализаторов образуется смесь продуктов. Преимущественно образуется бутен-2:
Если бутан нагревать в присутствии оксида хрома (III), преимущественно образуется бутадиен-1,3:
Физические свойства бутана:
| Наименование параметра: | Значение: |
| Цвет | без цвета |
| Запах | специфический характерный запах |
| Вкус | без вкуса |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | газ |
| Плотность (состояние вещества – жидкость, при 0 °C), кг/м3 | 601,2 |
| Плотность (состояние вещества – газ, при 0 °C), кг/м3 | 2,672 |
| Температура плавления н-бутана, °C | -138,4 |
| Температура плавления изобутана, °C | -159,6 |
| Температура кипения н-бутана, °C | -0,5 |
| Температура кипения изобутана, °C | -11,7 |
| Температура самовоспламенения, °C | 372 |
| Критическая температура*, °C | 152,01 |
| Критическое давление, МПа | 3,797 |
| Критический удельный объём, м3/кг | 228 |
| Взрывоопасные концентрации смеси газа с воздухом, % объёмных | от 1,4 до 9,3 |
| Удельная теплота сгорания, МДж/кг | 45,8 |
| Молярная масса, г/моль | 58,12 |
* при температуре выше критической температуры газ невозможно сконденсировать ни при каком давлении.
Окисление бутана
– слабополярное соединение, поэтому при обычных условиях он не окисляется даже сильными окислителями (перманганат калия, хромат или дихромат калия и др.).
3.1. Полное окисление – горение
Бутан горит с образованием углекислого газа и воды. Реакция горения пропана сопровождается выделением большого количества теплоты.
2C4H10 + 13O2 → 8CO2 + 10H2O + Q
Уравнение сгорания алканов в общем виде:
CnH2n+2 + (3n+1)/2O2 → nCO2 + (n+1)H2O + Q
При горении бутана в недостатке кислорода может образоваться угарный газ СО или сажа С.
3.2. Каталитическое окисление
- Каталитическое окисление бутана – промышленный способ получения уксусной кислоты:
Бутан, получение, свойства, химические реакции.
Бутан, C4H10 – органическое вещество класса алканов. В природе содержится в природном газе, добываемом из газовых и газоконденсатных месторождений, в попутном нефтяном газе. Образуется также при крекинге нефтепродуктов.
Бутан, формула, газ, характеристики
Физические свойства бутана
Химические свойства бутана
Химические реакции – уравнения получения бутана
Применение и использование бутана
Декарбоксилирование солей карбоновых кислот (реакция Дюма)
Реакция Дюма — это взаимодействие солей карбоновых кислот с щелочами при сплавлении.
R–COONa + NaOH →R–H + Na2CO3
Декарбоксилирование — это отщепление (элиминирование) молекулы углекислого газа из карбоксильной группы (-COOH) или органической кислоты или карбоксилатной группы (-COOMe) соли органической кислоты.
При взаимодействии пентаноата натрия с гидроксидом натрия при сплавлении образуются бутан и карбонат натрия:
CH3–CH2–CH2–CH2–COONa + NaOH → CH3–CH2–CH2–CH3 + Na2CO3
Получение бутана. Химические реакции – уравнения получения бутана:
Так как бутан в достаточном количестве содержится в природном газе, попутном нефтяном газе и выделяется при крекинге нефтепродуктов, его не получают искусственно. Его выделяют при очистке и сепарации из природного газа, ПНГ и нефти при перегонке.
Бутан в лабораторных условиях получается в результате следующих химических реакций:
- 1. гидрирования непредельных углеводородов, например, бутена:
CH3-CH2-CH=CH2 + H2 → CH3-CH2-CH2-CH3 (kat = Ni, Pt или Pd, повышенная to).
C4H9I + HI → C4H10 + I2 (повышенная to);
C4H9Br + H2 → C4H10 + HBr.
- 3. взаимодействия галогеналканов с металлическим щелочным металлом, например, натрием (реакция Вюрца):
2C2H5Br + 2Na → CH3-CH2-CH2-CH3 + 2NaBr;
2C2H5Cl + 2Na → CH3-CH2-CH2-CH3 + 2NaCl.
Суть данной реакции в том, что две молекулы галогеналкана связываются в одну, реагируя с щелочным металлом.
- 4. щелочного плавления солей одноосновных органических кислот:
C4H9-COOH + NaOH → C4H10 + Na2CO3 (повышенная to);
C4H9-COONa + NaOH → C4H10 + NaHCO3.
Основная статья: C4H10
| Распространенное имя | бутан нормальныйнеразветвленный бутанн -бутан | изобутани -бутан |
| Название ИЮПАК | бутан | метилпропан |
| Молекулярная диаграмма | ||
| Схема скелета |
Вращение вокруг центральной С-С связи производит два различных конформаций ( транс
и
гош
) для
п
изобутан. [9]
Применение и использование бутана:
– в качестве топлива в смеси с пропаном в быту для приготовления пищи, транспортных средствах, в отопительных приборах и т.п.;
– н-бутан используется как сырьё в химической и нефтехимической промышленности для получения бутилена, 1,3-бутадиена, компонентов бензинов с высоким октановым числом, для производства других химических веществ;
– в пищевой промышленности как пищевая добавка E943a и E943b (изобутан), последний используется в качестве пропеллента;
Мы приступаем к новому разделу - органической химии. Совершенно необязательно (и даже преступно по отношению к собственному времени!) знать наизусть, зубрить свойства органических веществ.
По мере изучения вы поймете, что свойства вещества определяются его строением, и научитесь легко предсказывать ход реакций ;)
- Атомы в молекуле соединены в определенной последовательности, в соответствии с их валентностью. Порядок связи атомов отражает химическое строение.
- Зная свойства веществ, можно установить их химическое строение, и наоборот, зная строение вещества можно сделать вывод о его свойствах.
- Атомы или группы атомов оказывают взаимное влияние друг на друга непосредственно или через другие атомы
- Свойства вещества зависят от количественного и качественного состава, а также от химического строения молекулы

Алканы (парафины) - насыщенные углеводороды, имеющие линейное или разветвленное строение, содержащие только простые связи. Относятся к алифатическим углеводородам, так как не содержат ароматических связей.
Алканы являются насыщенными соединениями - содержат максимально возможное число атомов водорода. Общая формула их гомологического ряда - CnH2n+2.
Номенклатура алканов
Номенклатура (от лат. nomen - имя + calare - созывать) - совокупность названий индивидуальных химических веществ, а также правила составления этих названий. Названия у алканов формируются путем добавления суффикса "ан": метан, этан, пропан, бутан и т.д.
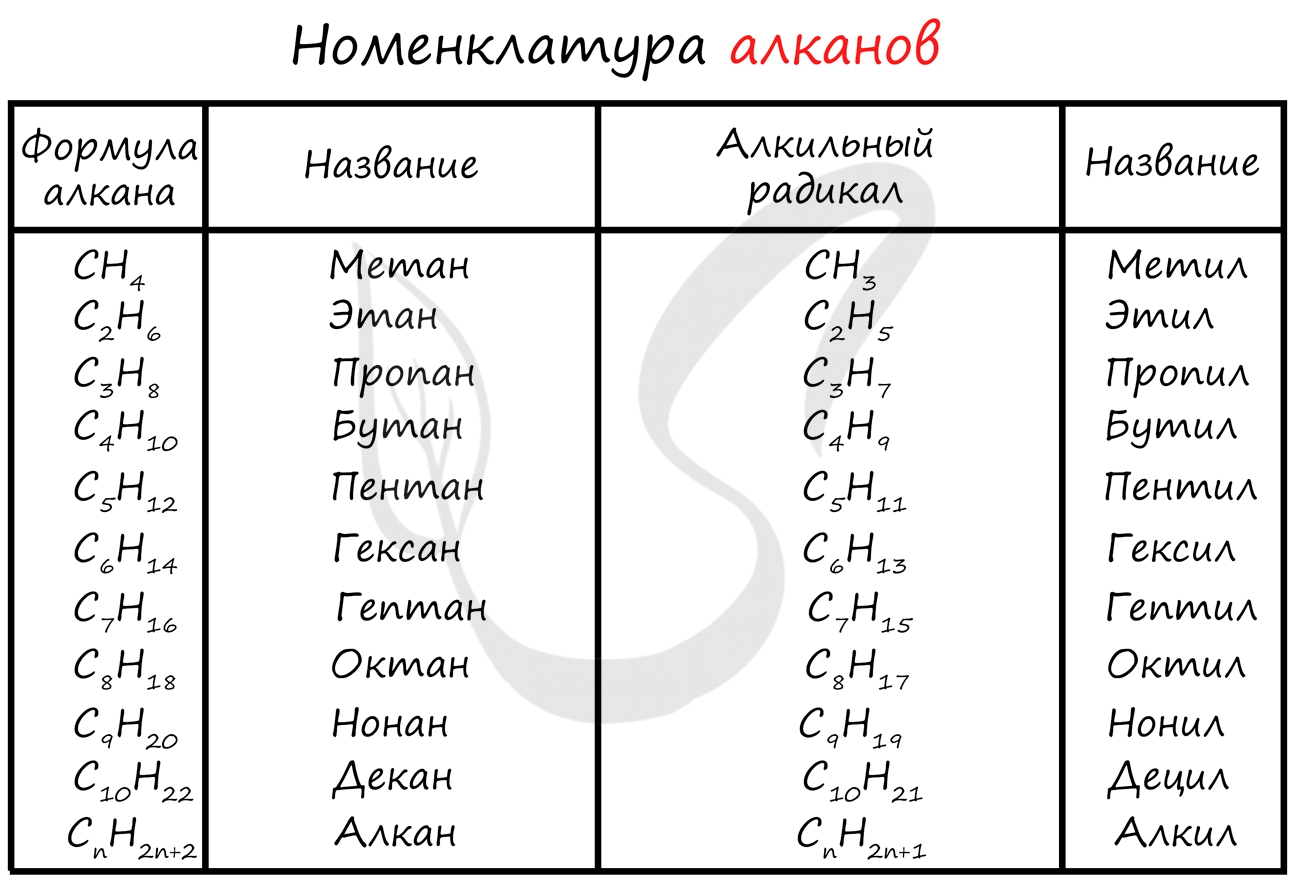
Гомологами называют вещества, сходные по строению и свойствам, отличающиеся на одну или более групп CH2
Перечисленные выше алканы, являются по отношению друг к другу гомологами, то есть составляют один гомологический ряд (греч. homólogos - соответственный).
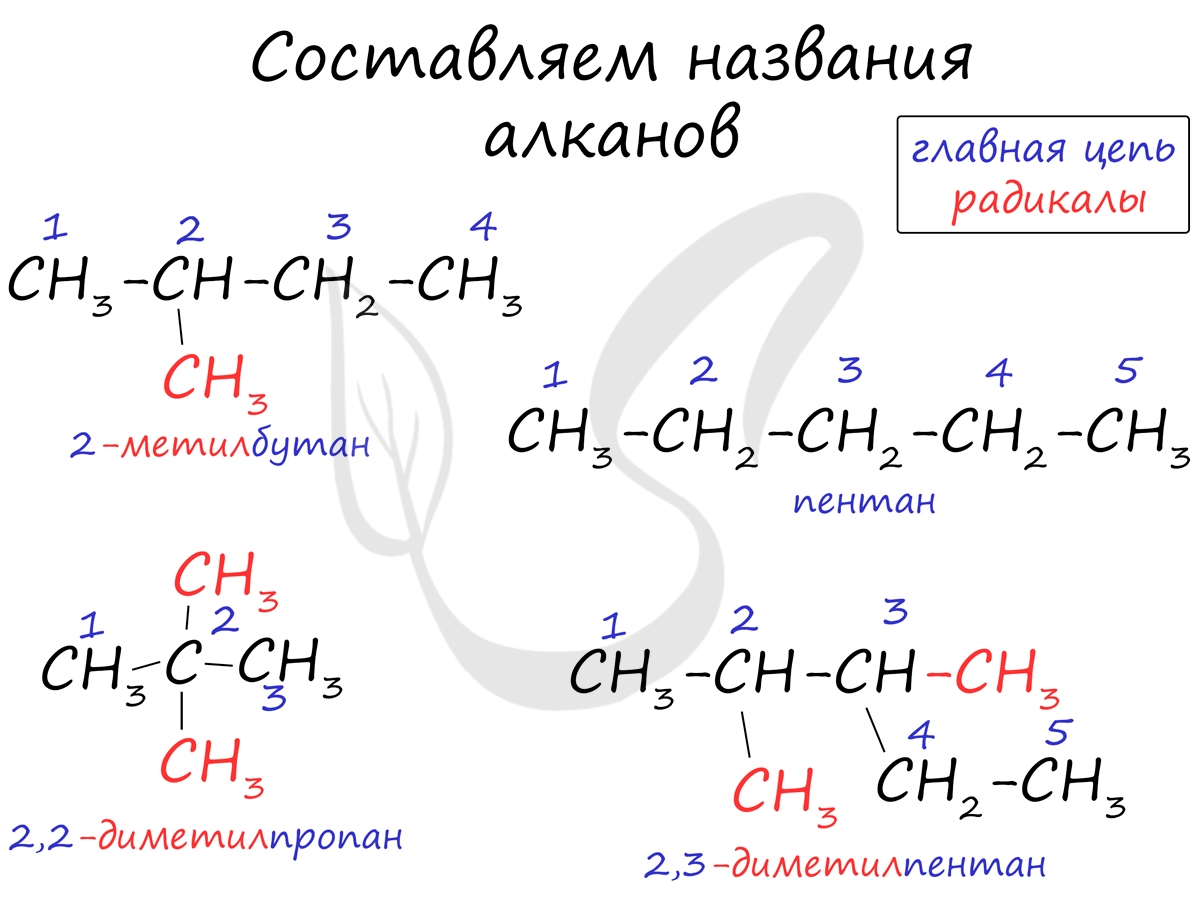
Названия алканов формируются по нескольким правилам. Если вы знаете их, можете пропустить этот пункт, однако я должен познакомить читателя с ними. Итак, алгоритм составления названий следующий:
- В структурной формуле вещества необходимо выбрать самую длинную (пусть и изогнутую на рисунке!) цепь атомов углерода
- Атомы выбранной цепи нумеруют, начиная с того конца, к которому ближе разветвление (радикал)
- В начале название перечисляют радикалы и другие заместители с указанием номеров атомов углерода, с которыми они связаны. Если в молекуле имеется несколько одинаковых радикалов, то цифрой указывают нахождение каждого из них в главной цепи и перед их названием соответственно ставят частицы ди-, три-, тетра- и т.д.
- Основой названия служит наименование предельного углеводорода с тем же количеством атомов углерода, что и в главной цепи
Внимательно изучите составленные для различных веществ названия ниже.
В углеводородной цепочке различают несколько типов атомов углерода, в зависимости от того, с каким числом других атомов углерода соединен данный атом. Различают первичные, вторичные, третичные и четвертичные атомы углерода.

Изомерами (греч. isomeros - составленный из равных частей) называют вещества, имеющие одну молекулярную формулу, но отличающиеся по строению (структурная изомерия) или расположению атомов в пространстве (пространственная изомерия).
Изомерия бывает структурной (межклассовая, углеродного скелета, положения функциональной группы или связи) и пространственной (геометрической, оптической). По мере изучения классов органических веществ вы узнаете о всех этих видах.
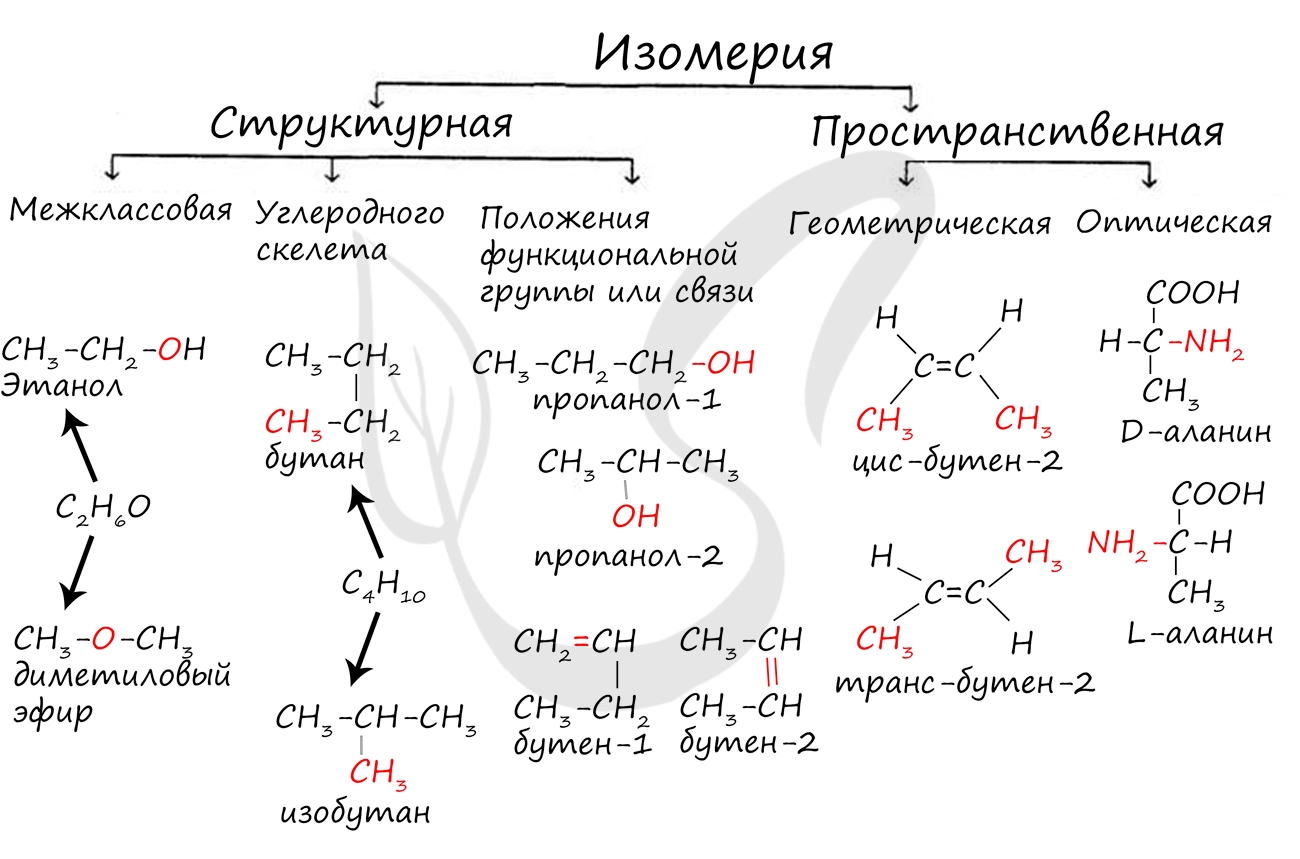
В молекулах алканов отсутствуют функциональные группы, кратные связи. Для алканов возможна изомерия только углеродного скелета. Так у пентана C5H12 существует 3 структурных изомера.

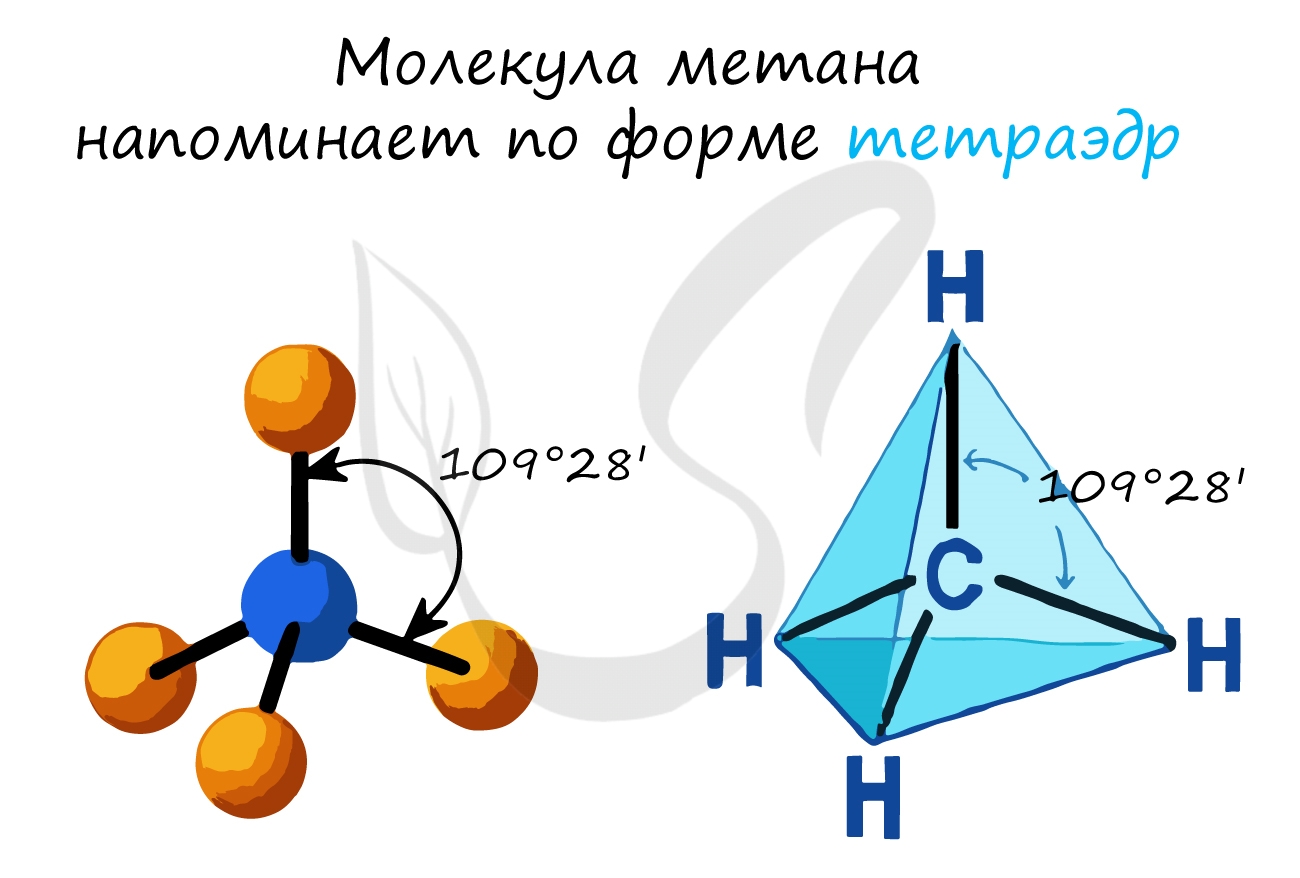
- В молекулах алканов присутствуют одиночные сигма-связи (σ-связи), длина которых составляет 0,154 нм
- Тип гибридизации атомов углерода - sp 3
- Валентный угол (между химическими связями) составляет 109°28'
Природный газ и нефть
Алканы входят в состав природного газа: метан 80-97%, этан 0.5-4%, пропан 0.2-1.5% , бутан 0.1-1%, пентан 0-1%. Состав нефти нельзя выразить одной формулой, он непостоянен и зависит от месторождения.
В состав нефти входят алканы с длинными углеродными цепочками, например: C8H18, C12H26. Путем крекинга из нефти получают алканы.

Получение алканов
В ходе крекинга нефти получается один алкан и один алкен.
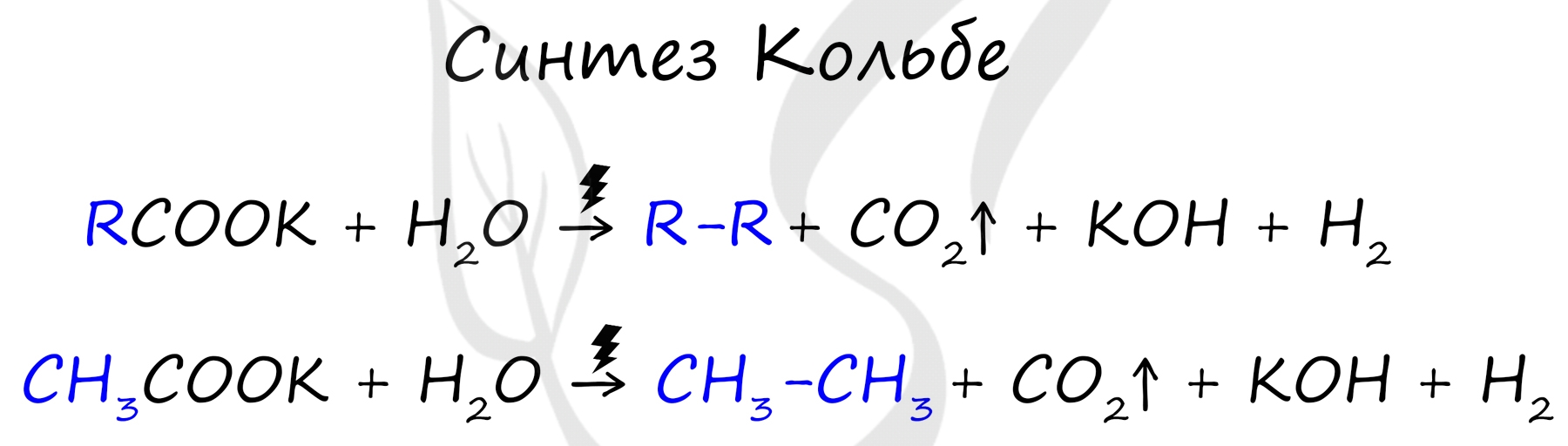
Данный синтез заключается в сплавлении соли карбоновой кислоты с щелочью, в результате образуется алкан.

Эта реакция заключается во взаимодействии галогеналкана с металлическим натрием, калием или литием. В результате происходит удвоение углеводородного радикала, рост цепи осуществляется зеркально: в том месте, где находился атом галогена.
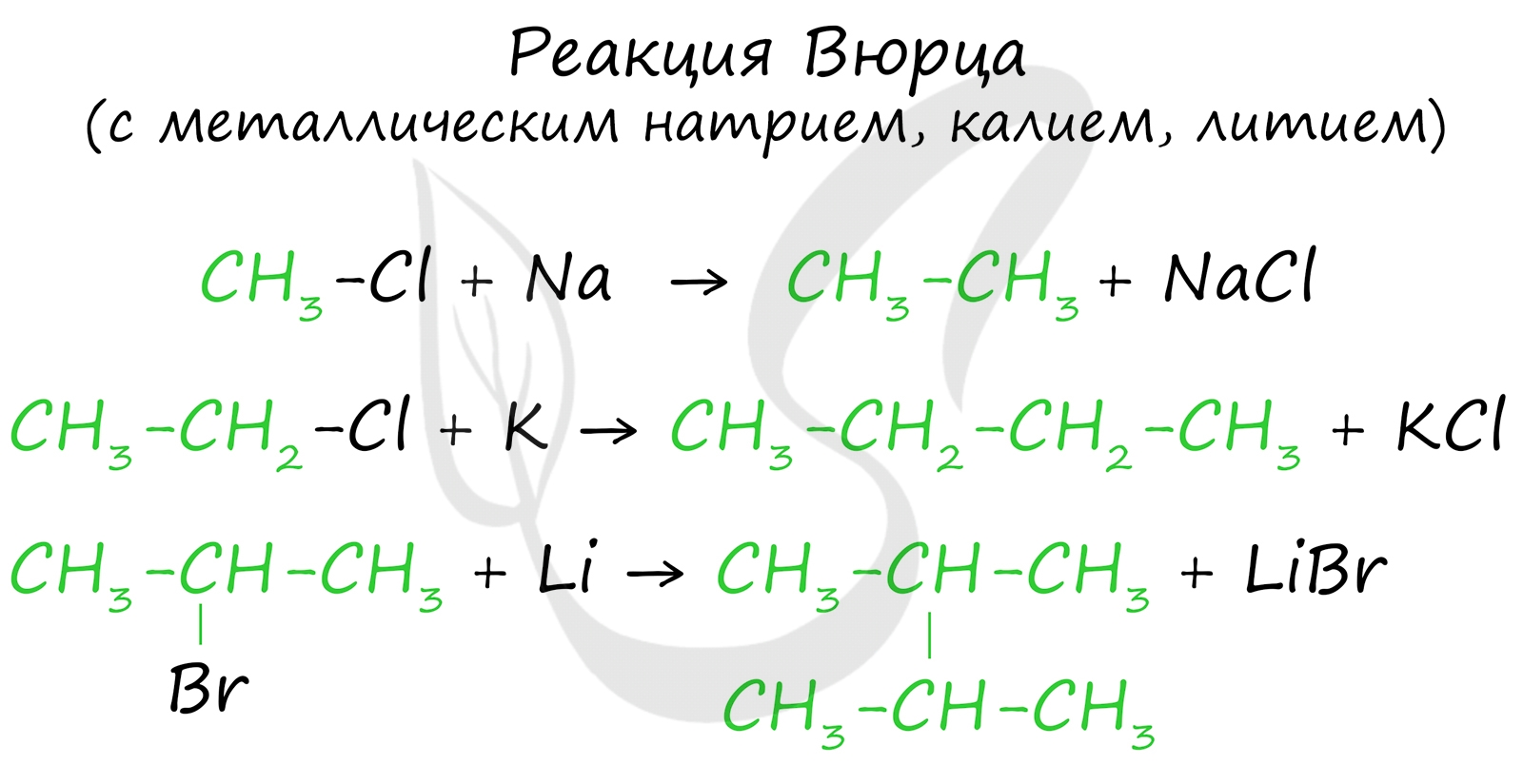
В ходе синтеза Гриньяра с помощью реактива Гриньяра (алкилмагнийгалогенида) получают различные органические соединения, в том числе несимметричные (в отличие от реакции Вюрца).
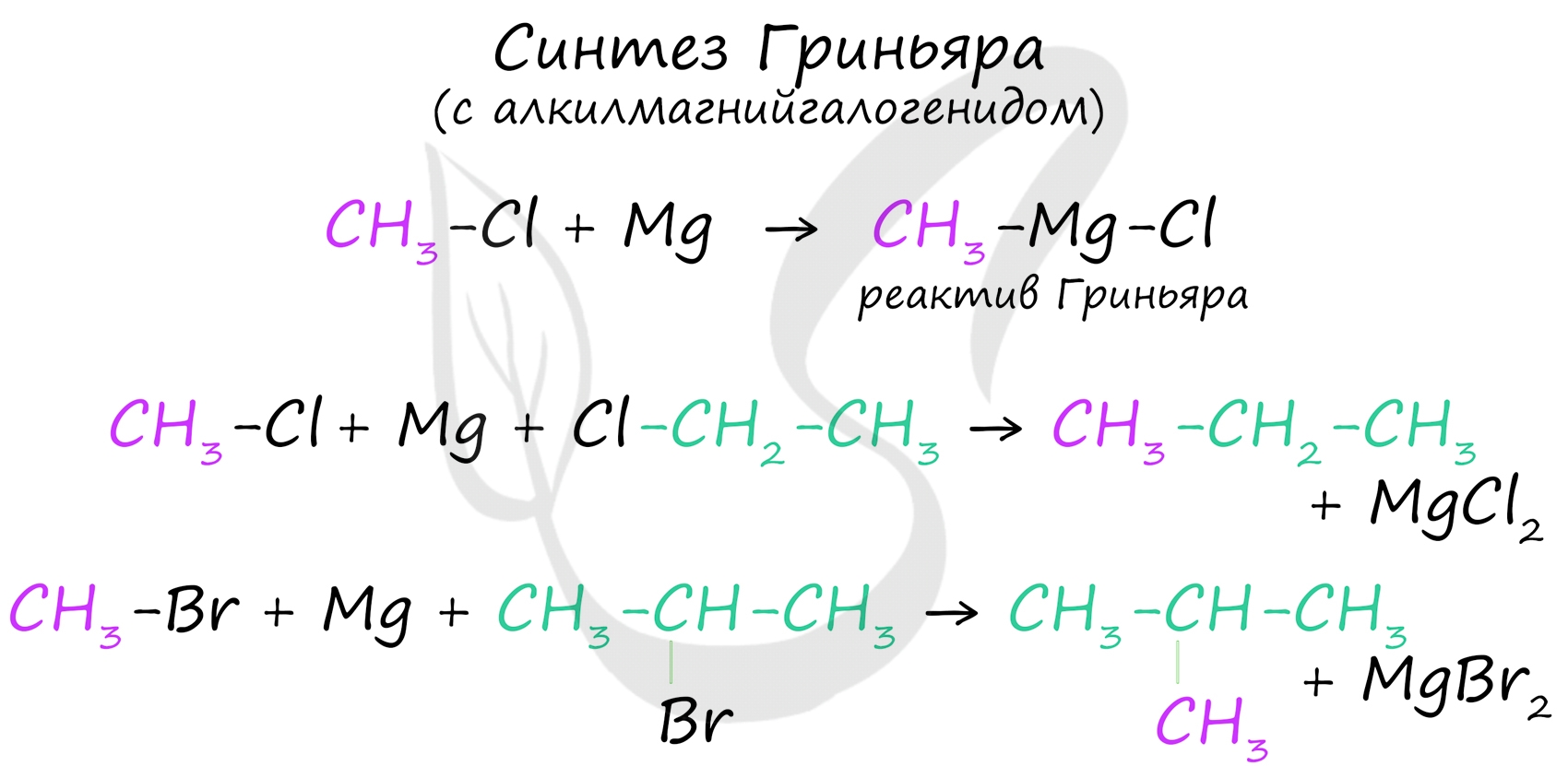
На схеме выше мы сначала получили реактив Гриньяра, а потом использовали его для синтеза. Однако можно записать получение реактива Гриньяра и сам синтез в одну реакцию, как показано на примерах ниже.

В результате электролиза солей карбоновых кислот может происходить образование алканов.
В результате разложения карбида алюминия образуется метан и гидроксид алюминия.
Химические свойства алканов
Атом галогена замещает атом водорода в молекуле алкана. Запомните, что легче всего идет замещение у третичного атома углерода, чуть труднее - у вторичного и значительно труднее - у первичного.

Реакции с хлором на свету происходят по свободнорадикальному механизму. На свету молекула хлора распадается на свободные радикалы, которые и осуществляют атаку на молекулу углеводорода.

Реакция Коновалова заключается в нитровании алифатических (а также ароматических) соединений разбавленной азотной кислотой. Реакция идет при повышенном давлении, по свободнорадикальному механизму.
Для удобства и более глубокого понимания, азотную кислоту - HNO3 - можно представить как HO-NO2.

Все органические вещества, в их числе алканы, сгорают с образованием углекислого газа и воды.
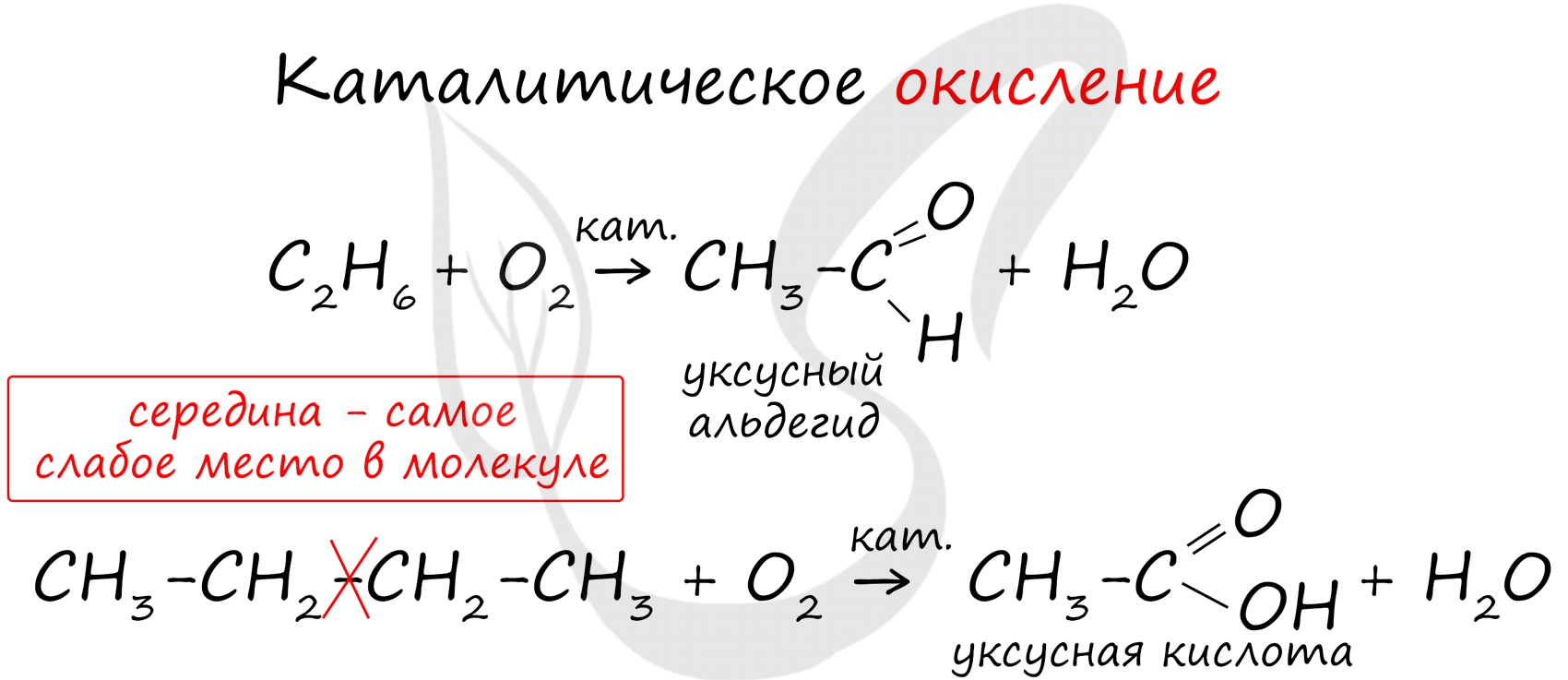
В ходе каталитического, управляемого окисления, возможна остановка на стадии спирта, альдегида, кислоты.
Пиролиз (греч. πῦρ - огонь + λύσις - разложение) - термическое разложение неорганических и органических соединений. Принципиальное отличие пиролиза от горения - в отсутствии кислорода.
В реакциях, по итогам которых образуются изомеры, используется характерный катализатор AlCl3.

Вам уже известно, что в результате крекинга образуется один алкан и один алкен. Это не только способ получения алканов, но и их химическое свойство.
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.

Гексан — органическое вещество, линейный насыщенный углеводород с химической формулой C6H14. Относится к классу алканов, иначе парафинов, алифатических углеводородов. Данный тип химических соединений характеризуется насыщенностью атомами водорода (их в молекуле максимально возможное количество) и простыми связями. Атом углерода соединен с четырьмя атомами водорода как верхний узел в тетраэдре. Между собой атомы углерода соединены неполярной связью. Оба типа связи С—С и С—Н отличаются достаточной прочностью, что обеспечивает низкую химическую активность гексана. По расположению структуры атомов углерода в пространстве у гексана различают пять изомеров.
При создании определенных условий давления и температуры гексан взаимодействует со слабым раствором азотной кислоты, вступает в реакции галогенирования, сульфохлорирования. Окисляется кислородом с получением гидропероксида; горит с выделением большого количества тепла. Окислением в присутствии катализаторов можно получить спирт, альдегид, карбоновую кислоту. Методом риформинга в присутствии катализатора из гексана получают его изомеры и бензол.
Гексан представляет собой прозрачную подвижную летучую жидкость, с несильным запахом. Жидкось огнеопасна и взрывоопасна. Не растворяется в воде, но хорошо смешивается с органическими растворителями: хлороформом, этанолом, метанолом, ацетоном, диэтиловым эфиром.
Получение
Гексан получают из бензиновых фракций первой перегонки нефти и конденсатов сопутствующих газов.
Изомеры гексана выделяют из бензинов, полученных алкилированием или каталитическим крекингом; гидрокрекингом из газойлей (тяжелых фракций нефти), а также из гудронов после удаления твердых составляющих.
Опасность гексана
Гексан оказывает раздражающее воздействие на кожу; при внутреннем потреблении повреждает легкие; при вдыхании действует как наркотическое вещество, вызывая сонливость, головокружение, поражение периферической нервной системы и онемение ног, угнетение ЦНС. Пары гексана вызывают раздражение слизистой глаз.
При регулярном вдыхании паров гексана возникает хроническое отравление, приводящее к серьезным заболеваниям нервной системы, которые проявляются понижением чувствительности ног, быстрой утомляемостью, снижением мышечного тонуса, головными болями и даже параличом конечностей.
Гексан огне- и взрывоопасен. Работать с ним допускается только в помещениях с хорошей вентиляцией или в вытяжном шкафу, с соблюдением правил пожарной безопасности, с использованием всех средств защиты, включая противогазы с автономным запасом воздуха.
Транспортировка гексана должна производиться в герметичной таре со специальной информационной маркировкой, отдельно от легковоспламеняющихся веществ. Хранение — в помещении с вентиляцией, защищенном от света, сухом и прохладном.
Применение
— Нейтральный растворитель лакокрасочных материалов, клеев для мебели и обуви, адгезивов.
— Производство бензина и добавок к бензину (изомеров гексана) для улучшения его свойств.
— Сырье для производства бензола, синтетических резин, полиолефинов.
— В химической индустрии для фракционной очистки веществ.
— В качестве промышленного средства для обезжиривания и очистки.
— Для экстракционной очистки растительных масел в пищепроме.
— В лабораторной практике — для анализа качества воды, лекарственных средств, продуктов питания, продуктов нефтепереработки. Используется в сложных и точных исследованиях (флюориметрия, УФ-спектроскопия, газохроматография). Неполярный растворитель в химических реакциях.
— В качестве индикаторной жидкости в термометрах с диапазоном минусовых значений.
— Гексан отличный растворитель парафиновых пробок при добыче нефти.
— В электронной, шинной промышленности.
Спасайте! Я в написании уравнений не бум-бум(( Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения.
Конечно же спасу)
а) Из метана при сильном нагревании можно получить ацетилен:
В присутствии катализатора ацетилен превращается в бензол (реакция тримеризации):
Бензол реагирует с хлором в присутствии хлорида железа, при этом образуется хлорбензол:
При сильном нагревании карбоната кальция с углеродом образуется карбид кальция:
При действии на карбид кальция воды получается ацетилен:
При гидрировании ацетилена в присутствии катализатора образуется этилен:
В результате присоединения к этилену хлороводорода образуется хлорэтан:
Бутен из хлорэтана можно получить в две стадии. Хлорэтан реагирует с натрием, при этом получается бутан (реакция Вюрца):
При дегидрировании бутана образуется смесь бутена-1 и бутена-2:
в) Этан из метана можно получить в две стадии. При хлорировании метана на свету образуется хлорметан:
При взаимодействии хлорметана с натрием образуется этан (реакция Вюрца):
Пропан из этана также можно получить в две стадии. При хлорировании этана образуется хлорэтан:
При реакции хлорэтана с хлорметаном в присутствии натрия образуется пропан:
Из пропана в две стадии можно получить гексан. При хлорировании пропана образуется смесь изомеров - 1-хлорпропана и 2-хлорпропана. Изомеры имеют разные температуры кипения и их можно разделить перегонкой.
При взаимодействии 1-хлорпропана с натрием образуется гексан:
При дегидрировании гексана можно получить циклогексан:
Циклогексан можно далее дегидрировать в бензол:
При взаимодействии бензола с азотной кислотой в присутствии концентрированной серной кислоты образуется нитробензол (реакция нитрования):
Гексан, C6H14 – органическое вещество класса алканов. В природе содержится в природном газе, добываемом из газовых и газоконденсатных месторождений, в попутном нефтяном газе, в нефти.
Гексан, формула, характеристики:
Гексан – органическое вещество класса алканов, состоящий из шести атомов углерода и четырнадцати атомов водорода.
Химическая формула гексана C6H14. Имеет пять изомеров: н-гексан, 2-метилпентан (изогексан), 3-метилпентан, 2,3-диметилбутан (диизопропил) и 2,2-диметилбутан (неогексан). Изомеры гексана различаются между собой по своим физическим м.
Строение молекулы н-гексана:

Строение молекулы 2-метилпентана (изогексана):

Строение молекулы 3-метилпентана:

Строение молекулы 2,3-диметилбутана (диизопропила):

Строение молекулы 2,2-диметилбутана (неогексана):

Все изомеры гексана – бесцветная жидкость со слабым запахом, который напоминает дихлорэтан.
В природе содержится в природном газе, добываемом из газовых и газоконденсатных месторождений, в попутном нефтяном газе, в нефти (в значительных количествах). Также содержится в сланцевой нефти, сланцевом газе и сжиженном газе (сжиженном природном газе).
Пожаро- и взрывоопасен.
Мало растворяется в воде. Растворяется в органических веществах (ацетон, бензол, хлороформ, диэтиловый эфир и другие).
Токсичен. Гексан обладает сильным наркотическим действием. Класс опасности четвертый.
Физические гексана:
| Наименование параметра: | Значение: |
| Цвет | без цвета |
| Запах | слабый запахом, который напоминает дихлорэтан |
| Вкус | без вкуса |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | жидкость |
| Плотность н-гексана (при 20 °C и атмосферном давлении 1 атм.), кг/м 3 | 654,8 |
| Плотность н-гексана (при 0 °C и атмосферном давлении 1 атм.), кг/м 3 | 677,4 |
| Температура плавления н-гексана, °C | -95,3 |
| Температура плавления 2-метилпентана (изогексана), °C | -153,7 |
| Температура плавления 3-метилпентана, °C | -118 |
| Температура плавления 2,3-диметилбутана (диизопропила), °C | -128,5 |
| Температура плавления 2,2-диметилбутана (неогексана), °C | -99,9 |
| Температура кипения н-гексана, °C | 68,7 |
| Температура кипения 2-метилпентана (изогексана), °C | 60,3 |
| Температура кипения 3-метилпентана, °C | 63,3 |
| Температура кипения 2,3-диметилбутана (диизопропила), °C | 58 |
| Температура кипения 2,2-диметилбутана (неогексана), °C | 49,73 |
| Температура самовоспламенения н-гексана, °C | 233 |
| Температура вспышки н-гексана, °C | -23 |
| Критическая температура н-гексана, °C | 234,7 |
| Критическое давление н-гексана, МПа | 3,032 |
| Взрывоопасные концентрации смеси газа н-гексана с воздухом, % объёмных | от 1,24 до 7,5 |
| Удельная теплота сгорания н-гексана, МДж/кг | 45,105 |
| Молярная масса, г/моль | 86,17848 |
Химические гексана:
Химические гексана аналогичны м других представителей ряда алканов. Поэтому для него характерны аналогичные химические реакции.
Читайте также:

