Как сделать формулу валентности
Добавил пользователь Alex Обновлено: 05.10.2024
Химические формулы веществ составляются на основе знания качественного и количественного состава вещества. Веществ существует гигантское количество, естественно запомнить все формулы невозможно. Это и не нужно! Важно знать определенную закономерность, согласно которой атомы способны соединяться друг с другом с образованием новых химических соединений. Такая способность называется валентностью.
Валентность – свойство атомов элементов присоединять определенное число атомов других элементов Рассмотрим модели молекул некоторых веществ, таких, как вода, метан и углекислый газ.
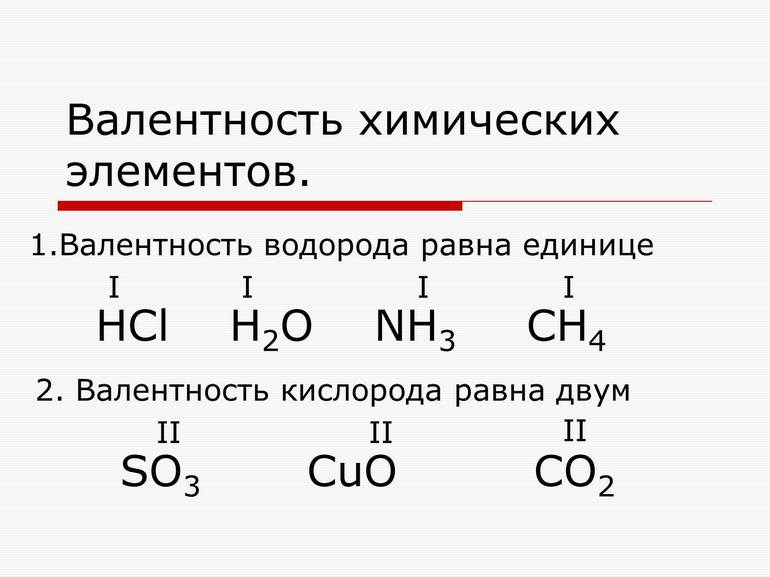
Видно, что в молекуле воды атом кислорода присоединяет два атома водорода. Следовательно, его валентность равна двум. В молекуле метана атом углерода присоединяет четыре атома водорода, его валентность в данном веществе равна четырем. Валентность водорода в обоих случаях равна одному.
Такую же валентность углерод проявляет и в углекислом газе, но в отличие от метана, атом углерода присоединяет два атома кислорода, так как валентность кислорода равна двум. Существуют элементы, валентность которых не меняется в соединениях. О таких элементах говорят, что они обладают постоянной валентностью. Если же валентность элемента может быть различной – это элементы с переменной валентностью. Валентность некоторых химических элементов приведена в таблице 2. Валентность принято обозначать римскими числами. Таблица 2. Валентность некоторых химических элементов
| Символ элемента | Валентность | Символ элемента | Валентность |
| H, Li, Na, K, F, Ag | I | C, Si, Sn, Pb | II, IV |
| Be, Mg, Ca, Ba, Zn, O | II | N | I, II, III, IV |
| Al, B | III | P, As, Sb | III, V |
| S | II, IV, VI | Cl | I, II,III, IV,V, VII |
| Br, I | I, III, V | Ti | II, III, IV |
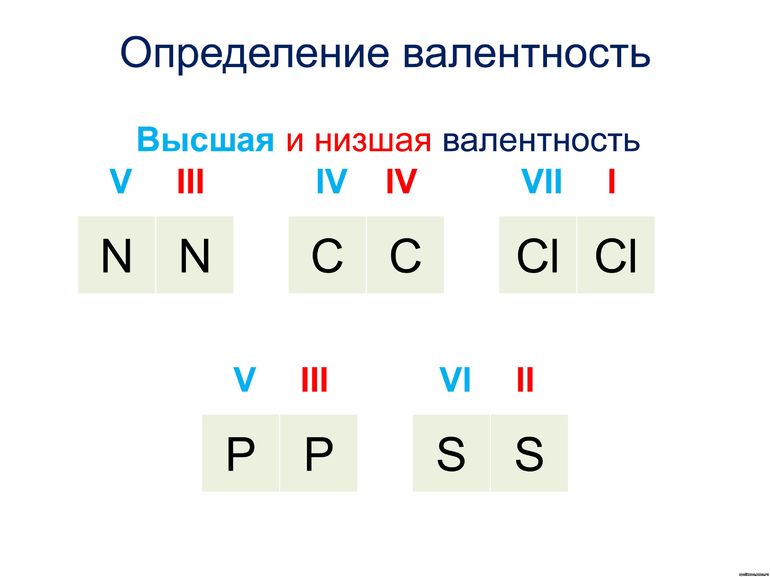
Стоит отметить, что высшая валентность элемента численно совпадает с порядковым номером группы Периодической Системы, в которой он находится. Например, углерод находиться в IV группе, его высшая валентность равна IV. Исключение составляют три элемента:
- азот – находится в V группе, но его высшая валентность IV;
- кислород – находится в VI группе, но его высшая валентность II;
- фтор – находится в VII группе, но его высшая валентность – I.
Исходя из того, что все элементы расположены в восьми группах Периодической Системы, валентность может принимать значения от I до VIII.
Составление формул веществ при помощи валентности
Для составления формул веществ при помощи валентности воспользуемся определенным алгоритмом:
- P O
- V II
- P O
- 10
- V II
- P O
Определение валентности по формуле вещества
Чтобы определить валентность элементов по формуле вещества, необходим обратный порядок действий. Рассмотрим его также при помощи алгоритма:
При изучении данного параграфа были рассмотрены сложные вещества, в состав которых входят только два вида атомов химических элементов. Формулы более сложных веществ составляются иначе.
Бинарные соединения – соединения, в состав которых входит два вида атомов элементов
Для определения порядка последовательности соединения атомов используют структурные (графические) формулы веществ. В таких формулах валентности элементов обозначают валентными штрихами (черточками). Например, молекулу воды можно изобразить как
Графическая формула изображает только порядок соединения атомов, но не структуру молекул. В пространстве такие молекулы могут выглядеть иначе. Так, молекула воды имеет угловую структурную формулу:




Определение валентности элементов по формулам их соединений. Составление химических формул по валентности Определение валентности элементов по формулам их соединений
- Определение валентности элемента по формуле соединения. Составление химических формул по валентности определение валентности элементов по химическим формулам соединений. Знать формулу вещества, состоящего из 2 элементов, и 1 скобка римской цифры указывает на валентность этого элемента. Вы можете определить их 1 валентность, валентность другогоэлемента.
- Например, если формула дана о оксиде меди CuO, то валентность меди можно определить следующим образом: валентность кислорода равна 2,1 атома, имеет 1 атом меди, поэтому валентность меди также равна 2. Определить валентность с помощью химической формулы, содержащей не 1.
Например, чтобы определить валентность железа оксида железа fe203, мы утверждаем: валентность кислорода равна 2.Но так как эта молекула содержит 3 атома кислорода, то общее число валентностей всех 3 атомов кислорода равно 6(2 * 3).Эти 6 валентностей попадают под 2 железа atoms. As в результате на каждый атом железа приходится 3 единицы валентности (6: 2).
- Приведенный выше пример позволяет вывести простое правило. Число единиц валентности всех атомов одного элемента должно быть равно числу единиц валентности всех атомов другого элемента. Эти соображения позволяют использовать следующие схемы при определении валентности элемента с помощью формул: 1.Напишите химическую формулу вещества и обратите внимание на валентность известных элементов. н я н н н н н ЦУО Н2Ѕ Fe203 С03 2.
При определении валентности элемента по формуле необходимо обратить внимание на следующие моменты: Людмила Фирмаль
2) Значение валентности не превышает 8. 3) Некоторые химические элементы имеют переменную валентность. Получение химических формул путем Valence. To составляя химическую формулу, нужно знать валентность элементов, образующих это соединение. Валентности наиболее важных элементов приведены в таблице 3. Таблица 3.Валентность атомов некоторых элементов в соединении
Примеры формул валентных элементных оксигенатов Е / 1 II и III Эл и Н II к II и III II и IV, III и V II, в III и VI ч., IV и VI элементы, постоянное бесплодное н. н, К. ли о,, мг, Са ва, ЗН Л1, переменной валентности КР ФК, со, Ni СН, ПБ п з пр добыча Н20, Na20 ГГО, САО, AI2O3 tnost размере 20,ЦУО Фео, Fe2Os СНО, Sn02 РН3,Р2О5 Кро, Cr203h2s, Сг203, ЅО2, ѕо3 При создании химической формулы используйте следующую схему: 1.
При создании химической формулы для элемента с переменной валентностью, рядом с названием вещества, напишите в скобках цифру, указывающую валентность этого элемента в данном соединении. Например, оксид меди (II) — это CuO, оксид. * Ди(я) — размере 20, хлорида железа (II) — Компьютерная FeCl2,хлорида железа (III) — fecl3 обеспечивает. Упражнение 5-8 (стр. 29).Решите задачу I и 2(стр. 29).
Если вам потребуется заказать решение по химии вы всегда можете написать мне в whatsapp.





















































Образовательный сайт для студентов и школьников
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института
Сертификат и скидка на обучение каждому участнику

Урок № класс 8 дата
Предмет Химия
Тип урока: усвоения новых знаний
Тема урока: Валентность химических элементов. Составление химических формул по валентности
Предметные: сформировать у учащихся умение составлять бинарные соединения по валентности, уметь разъяснять последовательность действий при составлении химических формул по валентности.
Коммуникативные: развивать память, смекалку, мышление, самостоятельность продолжить развитие представлений о строении вещества, применять ранее полученные знания.
Личностные: способствовать воспитанию интереса к предмету, к результату своего труда, осуществлять самоконтроль, взаимоконтроль; оценивать свои достижения на уроке.
Организационный этап
Организация. Раскрытие общей цели урока и плана его проведения.
Этап подготовки учащихся к активному и сознательному усвоению нового материала
1. Как называется закономерность, по которой соединяются элементы между собой в формуле? (валентность).
2. Дайте определение валентности.
(Валентность – это свойство атома химического элемента присоединять или замещать определенно число атомов другого химического элемента)
3. Как обозначается валентность? (Валентность обозначается римскими цифрами)
4. Какие виды валентности вы знаете? (постоянная и переменная)
5. Чему равна валентность водорода? кислорода? ( I , II )
6. Какое правило вы должны знать при определении валентности атомов элементов в соединениях? (Правило определения валентности. При определении валентности элемента по формуле бинарного соединения следует учитывать, что число единиц валентности всех атомов одного элемента должно быть равно числу единиц валентности всех атомов другого элемента)
7. Что значит бинарное соединение (вещество, состоящее из двух химических элементов)
8. Докажите, что сера в соединениях SO 2 и SO 3 имеет различную валентность
9. Определите валентность элементов в бинарных соединениях: СО2 NH 3 Cr 2 O 3 HBr NO 2
Этап усвоения новых знаний
Вы научились определять валентность элементов в бинарных соединениях. Согласно Закону постоянства состава веществ, формулы определенных соединений постоянны. Например формулы углекислого газа СО2, формула поваренной соли NaCl . Мы научимся составлять формулы бинарных соединений согласно их валентности
Работа с учебником. стр 59 рассмотрим порядок действий.
Повторить НОК. Найдите наименьшее общее кратное числе 2 и 3 (6) , 2 и 4 (4) , 3 и 6 (6) , 1 и 1(1), 2 и 2 (2), 8 и 12 (24)
Пример составления K 2 O показывает учитель, учащиеся знакомятся с алгоритмом составления формулы.
Учащиеся у доски составляют формулы AlCl 3 Al 2 O 3 , NaI Li 2 S ZnCl 2
Cu 2 O CuO FeCl 2 FeCl 3 найти отличия в названиях формул, какое правило используется (читаем учебник стр 59)
Динамическая пауза
"Бумер" Вытянуть руки перед собой, мышцы напряжены, мысленно представить, что руки вытягиваются, становятся длинными. Опустить и расслабить руки.
"Соедини лопатки " Руки опущены вдоль туловища. Отвести плечи назад, пытаясь соединить лопатки, зафиксировать в таком положении 5-7 с. Расслабить плечевой пояс -10 с.
Этап проверки понимания учащимися нового материала
Составьте формулы бинарных соединений с кислородом: натрия (I), углерода (II), кремния (IV), магния (II), бора (III), хлора (VII) марганца (IV).
Учитель проверяет выполнение работы, каждому ученику предлагается помощь или объяснение
Этап закрепления нового материала
Повторение основных понятий.
Самостоятельная работа. Кто быстрее и по всем правилам химического искусства испечет химическую слойку.
1 вариант 2 вариант
1 слой: азот (V) кислород азот (III) кислород
2 слой формула ______ ______
3 слой относительная
молекулярная масса ______ ______
4 слой массовая доля
кислорода ______ ______
Ответ ( N 2 O 5 Mr ( N 2 O 5 ) = 108 w (O) = 80:108 = 0,74 или 74%)
Рефлексия учебной деятельности
Мне было трудно…
Этап информации учащихся о домашнем задании, инструктаж по его выполнению

Новые вопросы в Химия
1. Определите плотность паров воды по водороду. 2. Как можно определить элементный состав воды? 3. При разложении воды образуется 8 г водорода. Скольк … о кислоро- да выделяется при этом? 4. Какой объем ВOДорода Кислорода, нормальных условиях, необходим для образования 7,2 г воды? 5. Расскажите о физических свойствах воды. 6. Какими химическими свойствами обладает вода? 7. Напишите уравнения реакций взаимодействия с водой следую- щих веществ: KO, BaO, P,0, SO, Ca, К. 8. В аодных бассейнах (озерах, морях и океанах) вода движется в вертикальном направлении. Почему? Объясните ответ на основе аномальных свойств воды. 29
РЕШИТЕ ПОЖАЛУЙСТА. ДАЮ 20 БАЛЛОВ. Закончить уравнения ревкций, подписать продукты. KOH+CO2=. Co+O2= CO2(овр).
Сколько Килограммов металлического натрия можно получить электролизом расплава 234 кг хлорида натрия ?
Рассчитайте молярную массу вещества, если известно, что количество вещества равно 1,46 моль, а масса вещества 71,7 г. Ответ округляется до ближайшего … целого числа!
В школе на уроках химии рассказывается о подробном строении элементов, атомов. Существует понятие валентности химических элементов, имеющее смысл для веществ молекулярной природы. Показатель бывает постоянный и переменный, изменяющийся в зависимости от соединений. Мерной единицей является число связей, образующих мелкие частицы с остальными атомами или их группами.
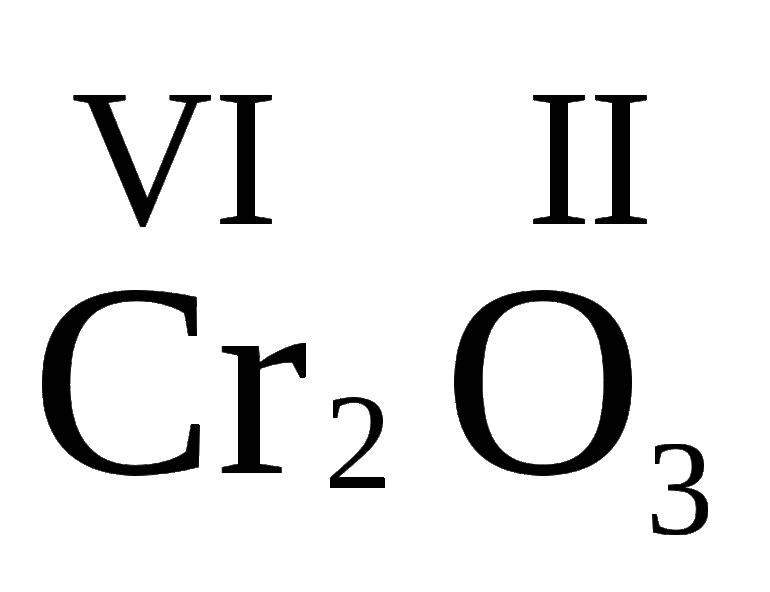
Общая характеристика
Валентность представляет способность атомов создавать химические соединения, добавлять другие атомы. С давних времен известны исторические данные о молекулярной, атомной структуре веществ.
Необходимость и основные понятия
Определение в переводе характеризует силу, создание. Главное суждение введено до открытия строения атома. Природа химических соединений заключается в делении между собой пары частиц на валентные электроны.
Число обобществленных связей, которыми атом соединяется с другими элементами, называется валентностью. В учет не берется полярность связей, поэтому показатель не имеет знака и не равен 0. В химических сочетаниях атомные частицы находятся в числовом соотношении.
Соединения водорода H с разными микрочастицами:
- Хлороводород (HCl).
- Вода (H2O).
- Аммиак (NH3).
- Метан (CH4).
Атом Cl (хлора) связан с одним А. водорода, О2 (кислорода) — с двумя, азота (N)-с тремя, а углерода — с 4 атомными частицами. В молекуле углекислого газа СО2 частица Н связана с двумя атомами кислорода.
А. соединяются по-разному с другими элементами. Такая способность выражается численной характеристикой.
Обозначение валентности:
- HCl (I I).
- H2O (I II).
- HN3 (III I).
- CH4 (IV I).
Образование химических связей атома любого элемента соответствует количеству соединившихся мелких частиц водорода. В молекуле хлороводорода валентность Cl равна 1, а в молекуле воды у атома кислорода — двум. В структурной составляющей метана В. углерода равна 4. Условно в химии обозначают единицы валентности римскими цифрами I-Х.
Историческая справка и взгляды ученых
Скудные знания о строении молекулярных и атомных частицах 19 века не позволяли объяснить причины, по которым атомы образуют связи с другими элементами. Валентность как основной принцип химии изучается до сих пор.

Мнения, научные работы доказаны в 1860 г. немецким деятелем Ф. Кекуле. По его мнению, углерод является из четырех основным, в самом простейшем его соединении частиц (метане) образуются связи с 4 атомами Н.
В Советском союзе информацию о строении веществ систематизировал А. Бутлеров. Последующее развитие связей получило введение периодической теории Д. Менделеева. Он подтвердил, что валентность Э. в соединениях и прочие свойства обусловлены занятым положением в периодической системе.
Главным преимуществом теории В. является возможность наглядного изображения молекулярного строения. Первые модели возникли в середине 19 века, а позже использовались структурные формулы в виде окружности с химическим знаком. Между обозначений атомов черточкой выделяется связь, а число линий соответствует В.
Основная классификация
Элементы распределяются с постоянной и переменной валентностью. Углерод соединяется с различными атомами кислорода, поэтому имеет переменную валентность. Многие элементы имеют неустойчивую величину.
| Валентность | |||
| Постоянная | Переменная | ||
| Элемент | В | Элемент | В |
| H (Водород) | I | I (Йод) | I |
| Li (Литий) | S (Сера) | II, IV, VI | |
| Na (Натрий) | N (Азот) | I-V | |
| K (Калий) | F | II, III | |
| F (Фтор) | Cu | I, II | |
| Al (Алюминий), B, Р | III, V | C, Si | II, IV |
| O (Кислород), Mg (Магний), Ca (Кальций), Ba (Барий), Zn (Цинк) | II | Cl, Br, I | I, III, V, VII |
Водород образует связь не с каждым элементом, а кислородные соединения имеются почти у всех. В таких сочетаниях атомы О2 проявляют двукратную валентность.
Ковалентная связь осуществляется из-за образования общих электронных пар. Когда между 2 атомными структурами (А) существует совместная электронная пара, она называется одинарной, при наличии двух — двойной, трех — тройной.
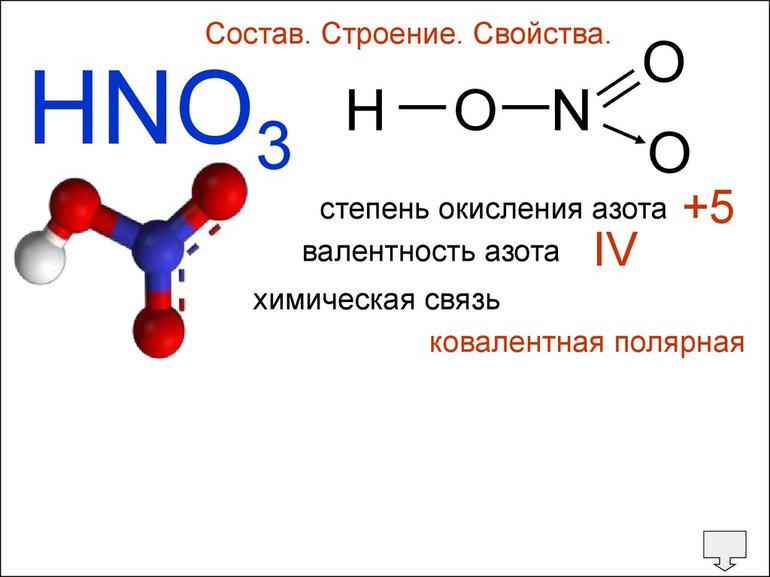
Валентность азота N в связи NH3 составляет III, поскольку один атом Н связан с тремя частицами N. Валентность углерода в метане (СН4), по тому же принципу будет 4 (IV).
Валентность хлора в молекуле хлороводорода равна единице, индекс не применяется. Одному атому H соответствует 1 атом Cl. Если образованная химическая связь углерода © в метане равна 4, валентность Н — всегда 1. Рядом с Н ставится индекс 4, а формула метана выглядит следующим образом: CH4.
Постоянной одной В. остается H, K, F. Двухвалентные — кислород, магний, кальций, цинк, а трехвалентные — алюминий. Валентность брома, железа, меди, хлора или прочих элементов модифицируется, когда они формируют различные соединения.
Йод представлен в таблице 53 по счету. Присутствие одного неспаренного электрона говорит о способности проявлять низшую В., равную единице в соединениях. Зная валентность, можно легко составить формулы соединений.
Определение по формуле
Если под рукой нет таблицы Менделеева, то существует возможность установления В. элемента с помощью несложных расчетов. Для примера выбирается формула оксида марганца — Mn2O7.
Кислород двухвалентный, а для определения марганца В. кислорода умножают на число атомов газа в сочетании 2*7, получается 14. Это число делится на количество мелких атомных частиц Mn:14/2 = 7. В полученном соединении валентность составляет VII.
Индексы в молекулярных веществах отображают число А., входящих в состав. Получив формулу вещества, в котором известна В. одного элемента, можно определить В. другого. В веществе, состоящем из молекул число В. обоих элементов равно. Используется минимальное общее кратное для определения неизвестной В.

Например, в образовании формулы связи оксида железа Fe2O3 участвуют пара атомов Fe с валентностью III и три атома O с двойной валентностью. Минимальным общим кратным будет 6.
Для правильной формулировки записи оксида фосфора учитывается В кислорода (II) и фосфора (V). Наименьшее общее кратное для Р и О получается десять. Обозначение записывается Р2О5.
Понимая и зная свойства элементов, проявляющих в разных сочетаниях, можно находить валентность по внешнему параметру соединений. Оксиды меди (купрум) имеют красный (Cu2O) и черный (CuО) цвет. Гидроксиды меди будут желтыми (CuОН) и синими (Cu (ОН)2).
Чтобы составить формулу бинарных соединений элементов, достаточно определить валентность. Если требуется записать формулу кислородного соединения хлора (ClO), в котором валентность Cl равна 7, соблюдают последовательность:
- Записывают символы элементов и валентность. Это VII II ClO.
- Найти меньшее кратное валентностей двух элементов. VII*II, получается 14.
- Делят наименьшее кратное на В. каждого элемента, находят значение индексов. 14/2 = 7, 14/7 = 2.
Записывают индексы возле знаков элементов. Получается Cl2O7.
Труды Менделеева
Согласно электронной теории, В. атома определяется из числа непарных электронов (Э)., участвующих в формировании пар с Э. других атомов. Понятие В. связано с созданием закона Менделеева.
Теория электронов
Атомы представляют положительную основу (ядро), вокруг которой расположены отрицательно заряженные электроны. Наружная оболочка последних бывает недостроенной, а завершенная структура устойчивее, она включает восемь электронов.

Создание связи за счет общих пар электронов приводит к благоприятному состоянию атомов.
Максимальная В. — это величина Э. во внешней оболочке атома. Химические связи составляют Э., находящиеся на наружной оболочке атома. Изучив таблицу Менделеева, можно определить, что положение веществ в периодической системе и его В. взаимосвязаны.
Валентность:
- Высшая. Соответствует порядковому № группы.
- Низшая. От числа вида по табличным данным отнимают номер интересующего элемента.
Основанием для образования соединений является прием электронов.
Виды электронов:
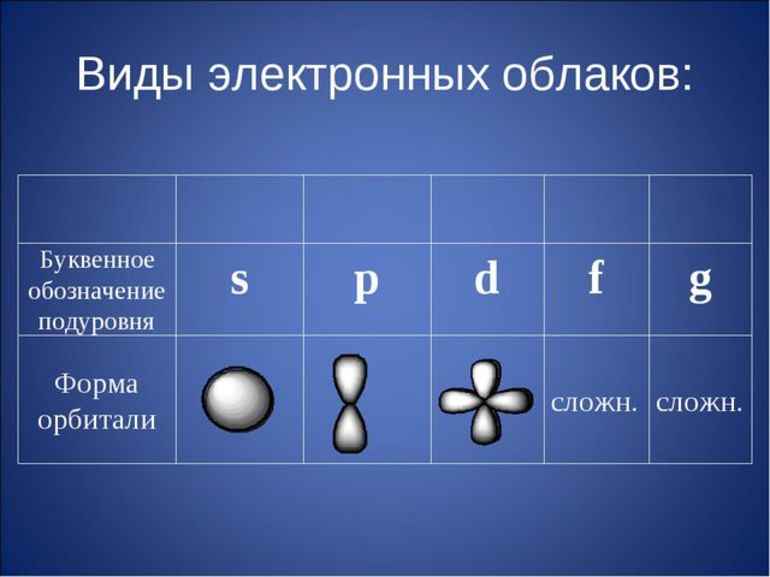
- Спаренные. Расположены на одной орбитали.
- Неспаренные. Это 1 электрон на орбитали.
Когда атом отрицательно заряжен частицами без пары для взаимодействия, то они образуются в таком количестве, сколько имеется неспаренных электронов.
В молекулярной структуре водорода и серы H2S последнее вещество приобретает двойную валентность (-), потому что каждый атом участвует в образовании 2 электропар. Знак черточка или тире указывает на притяжение пары к более отрицательному элементу. У менее отрицательного к валентности добавляют знак плюс.
Распределение свойств
В периодической таблице указаны все 118 химических элементов (водород, литий, бор, натрий, магний, кальций, ванадий, уран и другие).
Химические и физические свойства каждого вещества похожи с предшествующим ему в таблице элементом. Закономерность проявляется у всех, кроме нескольких первых, потому что они не включают перед собой элементов, аналогичных по атомному объему.
Валентность металлов:
| Элемент | В |
| Серебро | I-III |
| Ртуть | I-II |
| Золото | I-III |
| Никель | I- IV |
| Мышьяк | -III, II, III, V |
| Свинец | II-IV |
| Кобальт | II-IV |
| Олово | II, IV |
В периодической таблице элементы классифицированы, упорядочены с учетом атомного числа, электронной конфигурации и повторяющихся химических свойств. Ряды называются периодами, а столбцы — группами. В самой первой таблице содержалось не более шестидесяти элементов, теперь продолжительность списка увеличили до 118 элементов. Систематизированы не только химические вещества, но и их свойства.
Достаточно ученому-химику взглянуть на таблицу, и он сможет ответить на разные экзаменационные, научные вопросы.
Говоря о степени окисления, предполагают, что атом в веществе ионной природы имеет заряд, и если валентность нейтральная, то уровень окисления будет нулевым, положительным или отрицательным. Узнать информацию можно из таблицы Менделеева.
Для атома одного и того же Э., в зависимости от элементов, с которыми он сформирует химическое соединение, В. и стадия окисления совпадают (Н2О, СН4) и различаются (Н2О2, HNO3). Само понятие валентности ученые-химики не используют по Менделеевской таблице.
Читайте также:

