Свинцовый аккумулятор своими руками
Обновлено: 07.07.2024
Спанч-боб писал(а): В любом случае - полезно уметь делать аккумуляторы своими руками.
(поташный, газовый аккумулятор. )
Причём в стационарных условиях их можно сделать огромных размеров.
Предлагаю обсудить тему:
Как изготовить самодельный аккумулятор электрической энергии?
Вопросы
- Какие виды аккумуляторов возможно сделать самому на "коленке"?
- Какие материалы/кислоты/щелочи стоит запасти?
- Какая есть литература по этому вопросу?
- Есть ли аккумуляторы которые можно хранить без ущерба для ресурса? Например сухозаряженный
В последнее время, чтобы аналог чего-то массово выпускающегося собрать, обычно нужно купить материалов на сумму несколько большую чем стоит готовое изделие. При этом знания и инструмент для обработки и сборки в цену считаем что не входят. "Цена в партии от 1000 штук" и т.п. имеют значение. Поэтому я бы отделил вопрос "знать и уметь" от непосредственно "Какие материалы/кислоты/щелочи стоит запасти".
Проще и ДЕШЕВЛЕ запасти уже ГОТОВЫЕ аккумуляторы.Сухозаряженные свинцово-кислотные,щелочные или никельбметаллгидрид Санйо Энелуп(хранятся в заряженном состоянии до 5 лет).
jim hokins писал(а): Проще и ДЕШЕВЛЕ запасти уже ГОТОВЫЕ аккумуляторы.Сухозаряженные свинцово-кислотные,щелочные или никельбметаллгидрид Санйо Энелуп(хранятся в заряженном состоянии до 5 лет).
Это понятно, я о том же писал, но знать из какого говна и каких палок можно слепить что-то годное - тоже дорогого может стоить. Опять же, где как не в палате найдешь ссылку на книжку 37-го года?
Проще и ДЕШЕВЛЕ запасти уже ГОТОВЫЕ аккумуляторы.Сухозаряженные свинцово-кислотные,щелочные или никельбметаллгидрид Санйо Энелуп(хранятся в заряженном состоянии до 5 лет).
Санйо Энелуп запасено.
Вот сколько лет могут хранится сухозаряженные свинцово-кислотные аккумуляторы?
А по теме, скажем так, для общего развития, чтобы знать и уметь
Кстати где-то видел информацию по кустарному изготовлению гелевых аккумуляторов из обычных свинцовых.
Lev007 писал(а): Кстати где-то видел информацию по кустарному изготовлению гелевых аккумуляторов из обычных свинцовых.
Звучит интересно но представляется сомнительным. Какие сопли (гель) не залей через пробочки, все равно осыпанию намазных пластин они не помешают.
jim hokins писал(а): Современый ширпотреб,-не в курсе.Бывают прям из магаза никудышние,о каком хранении может идти речь?
Современный ширпотреб хитрая помесь технологий, которые шагнули на 30-50 лет вперед, и не отстававшей в развитии экономности капиталистов, дополненной азиатской хитростью. Неизвестно что в данном конкретном экземпляре изделия окажется важнее.
Гелезируются свинцокислые заливкой обычного водного кремнекислого натрия - строительного жидкого стекла чтобы подешевле и большими банками продавалось. Конечно это череповато внесением грязи и сокращением ресурса еще больше, а доставать химически чистую гелезирующую химию имхо мало кто будет.
Смысл гелезации заливных - использование в разных пространственных положениях чтобы обходиться без проливания электролита. Иногда это важно.
Сухие приличные могут храниться как минимум единицы лет - но надо закрывать герметично и исходно сильно высушить. Намного дольше и лучше хранятся никелевые - и новые и бу. Обычно их малоимущие в текущей северной папуасии на месте бывшего совка успешно пользуют даже после десятков лет валяния на помойках, а перед этим их еще регулярно могли промывать жижей из грязных канав и заливать техническими грязными электролитами. Проржавевшие до дыр стальные корпуса восстанавливаются например обтягиванием нагретой пластиковой бутылкой сообразного размера или заливкой расплавом битума в облегающую корпус ржавой банки пластиковую бутылку.
Книжки из начала совка были важны и пригодны в фазе разгорания вспышки техноцивилизации.
А сейчас фаза завершения - тута имеются в доступности наработанные недавно прошедшей техноцивилизацией большое количество артефактов - и по электрохимическим устройствам. Теперь имхо важнее учиться как из отходов собирать действующие акб например. Из выброшеных на помойку свинцокислых еще удается выплавить много свинца для изготовления поверхностных пластин. Где-то должны быть большие запасы хотя бы технической серной кислоты чтобы сделать электролит.
Для никелевых акб важны умения ремонтировать ламельные конструкции для устранения коротких замыканий и перекорпусения из прогнивших стальных банок из просравшей полимеры империи зла в доступные пластиковые емкости поступающие на свалки после выключения железного занавеса. Да хоть в деревянные кадки пропарафиненые с пригнанными плотно крышками.
Смысл примерно как и про патроны - в 18хх годах патронов еще было меньше населения, а щас их уже по слухам больше и после чистящего писца возможно запасов уже изготовленых акб останется также больше чем населения которым они еще нужны.
Теперь имхо важнее учиться как из отходов собирать действующие акб например. Из выброшеных на помойку свинцокислых еще удается выплавить много свинца для изготовления поверхностных пластин.
поддерживаю.
уже есть емкость, есть свинцовые пластины.
нужно лишь все это почистить и залить.
раньше так и восстанавливали АКБ.
вопрос: зачем ТС хочет изготавливать АКБ?
текущие умрут лет через 5-10, да и не умрут. а потеряют емкость в большистве. С учетом того, что мощные потребители эл-ва умрут еще раньше, то остатка хватит надолго.
Тут уж либо технология восстановится и запустят завод АКБ, либо они не будут нужны.
Ну при попытке использования автомобильных свинцокислых в автономной системе им уже может сильно поплохеть через 2..3 цикла и пару недель при нарушении режима заряда. Так что 5 лет это экстремально оптимистичное время для случая использования стартерных свинцокислых с намазными пластинами.
А у вариантов с поверхностными пластинами удельная емкость по массе и обьему в десятки раз хуже текущих автоакб стартерных. Так что даже для батарейки скромной емкости надо будет свинцу собирать и транспортировать много.
Делал такой,работает.
лучше(намного дольше даёт напругу)самодельная батарейка:
цинк+медь+раствор поваренной соли и медного купароса.
Во время ВОВ восстановление стартерных АКБ (по факту - изготовление новых) производилось в войсках, вероятно на уровне ОРВБ дивизии - АРЗ армии (фронта).
Отливались новые решетки, активная масса (ЕМНИП Pb + PbO) размалывалась в мельницах и наносилась на решетки. Формовались пластины. Понятно, что срок службы таких АКБ был мизерным, но, вероятно, был организован сбор неисправных.
А из необычных химических источников тока недавно видел следующий: к выводам светодиода подпаяны проволочки из разноименных металлов и воткнуты в какой-то фрукт. Кислый сок - в достаточной степени электролит. Вот не знаю, правда или нет.
Nikola_spb писал(а): из необычных химических источников тока недавно видел следующий: к выводам светодиода подпаяны проволочки из разноименных металлов и воткнуты в какой-то фрукт. Кислый сок - в достаточной степени электролит. Вот не знаю, правда или нет.
Lev007 писал(а): - Какие виды аккумуляторов возможно сделать самому на "коленке"?
- Какие материалы/кислоты/щелочи стоит запасти?
- Какая есть литература по этому вопросу?
Всегда можно получить постоянное напряжение для питания небольших электронных устройств, если знать, как сделать аккумулятор своими руками. Аккумуляторы отличаются от батареек обратимостью своих химических реакций. Это значит, что они не только вырабатывают электрический ток и со временем разряжаются, а также обладают способностью восстанавливаться. Для этого нужно выполнить заряд, пропуская через аккумулятор ток от внешнего источника.

Как сделать аккумулятор своими руками
Химический источник тока (двухполюсник), способный после разряда восстанавливаться, можно выполнить своими руками. Любой химический источник тока, имеющий периодический режим работы (разряд – заряд), состоит из следующих основных элементов:
- электроды: анод и катод;
- электролит;
- разделительные пластины (сепараторы);
- корпус;
- контактные клеммы (выводы).
В качестве анода и катода используются различные пары химических элементов. Анод имеет отрицательный заряд – восстановитель, катод положительный заряд – окислитель.
Оба электрода погружены в электролит. Это водные растворы солей и кислот, проводящие электричество. Когда происходит разряд аккумулятора (двухполюсника) на нагрузку, анод окисляется и вырабатывает электроны, которые через электролит движутся к катоду. На катоде происходит процесс восстановления окислителя.
Важно! При работе на нагрузку ток через двухполюсник течёт от минуса к плюсу, при зарядке от постороннего источника тока (ИТ) – от плюса к минусу.
Для создания одной банки простейшего аккумулятора из меди и цинка понадобятся следующие детали:
- медная проволока длиной 100 мм;
- оцинкованная пластина размерами 25 * 50 мм;
- прокладка – вырезанная из москитной полиэтиленовой сетки полоска;
- электролит – соляной раствор;
- корпус из непрозрачного материала – герметичный стаканчик из-под кофе с крышкой.
Необходимо, чтобы ёмкость для аккумулятора была непрозрачной.
Сборка элемента производится в следующей последовательности:
- медная проволока скручивается спиралью, для увеличения площади рабочей поверхности к верхнему концу припаивается отвод;
- оцинкованная пластина также скручивается по окружности, к верхней части пластины припаивается отвод;
- в крышке баночки делается два отверстия для выводов: в центре – для медной проволоки и ближе к краю – для вывода цинкового электрода;
- медную спираль располагают по центру, вокруг неё размещают цинковую трубку, между ними вставляют изолирующую прокладку;
- заливают электролит: солёную воду (1л воды на 5 ст. л. соли) или уксус 15%;
- неплотно прикрывают крышку, предварительно продев в неё выводы.
К полученной банке подключают источник тока для зарядки самодельного аккумулятора. При этом нельзя плотно закрывать крышку. Или для выхода газов при заряде в ней проделывается множество мелких отверстий (кроме отверстий для выводов). У самодельного элемента плюс – на медном электроде, минус – на цинковом.
Внимание! Чем меньше расстояние между элементами меди и цинка, и чем больше площадь поверхности электродов, тем большее напряжение выдаст подобная аккумуляторная ячейка.
В идеале такой элемент вырабатывает 0,7 вольта. Недостаток такой АКБ заключается в высоком внутреннем сопротивлении и быстром саморазряде.
Как сделать мощный аккумулятор своими руками
Для того чтобы самодельный аккумулятор выдавал на выходе более 3,6 В постоянного тока, нужно собирать самодельные банки в последовательно соединённую батарею. Можно единичные элементы помещать в общий корпус.

Качественные системы зарядки Li-ion 18650
Литий-ионные источники электричества этого типа широко эксплуатируются с различными устройствами. Для их продолжительной работы необходима постоянная подзарядка. При заряде напряжение на элементе достигает значения 4,2 В, после чего снижается до 2-3 В. При глубоких разрядах (ниже 3 В) срок службы Li-ion 18650 значительно сокращается.

Существуют специальные зарядные устройства для подобных аккумуляторов, но их можно сделать самостоятельно, используя схему.
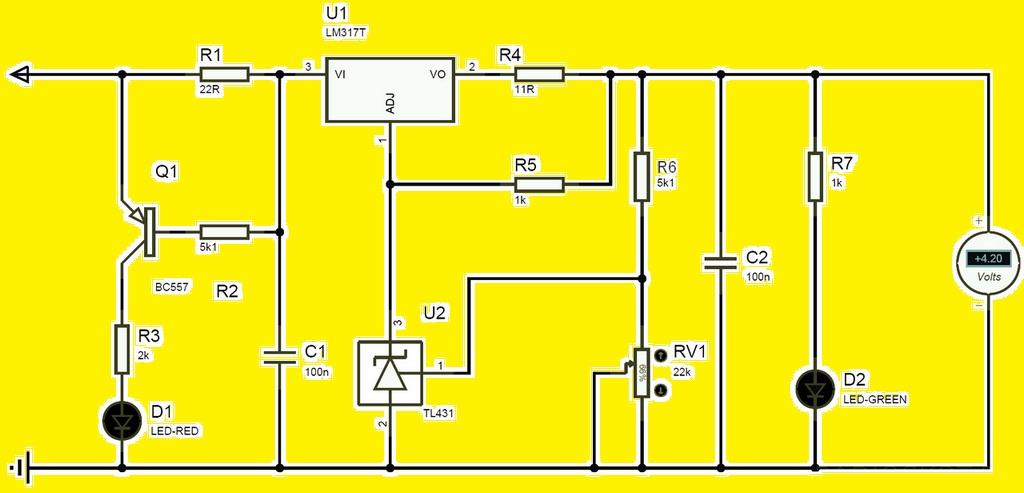
Регулировка тока осуществляется подбором резистора R4 на первоначальное значение тока зарядки. Он зависит от емкости аккумулятора. Например, если ёмкость батареи 3000 мА/ч, то ток зарядки равен 2-3 А.
Заводские системы контроля заряда самостоятельно делают регулировку этого параметра в рамках всего времени заряда.
Самодельная батарейка из подручных средств
Как можно сделать аккумуляторы, используя электролит и электроды, рассмотрено выше. Теперь о том, как быстро собрать источник тока однократного действия. Батарейка – это гальванический источник электричества, который не имеет способности восстанавливаться.
Способ первый: батарейка из лимона
Мякоть лимона содержит лимонную кислоту, она послужит электролитом. В качестве электрода выступают оцинкованный гвоздик и отрезок медной проволоки. Они втыкаются в лимон на расстоянии 50-100 мм друг от друга. Реакция окисления запускает движение электрического тока.

Способ второй: банка с электролитом
Литровую стеклянную банку используют в качестве ёмкости. В качестве электродов берутся цинковая и медная пластины. К пластинам прикрепляются провода, сами они опускаются в банку с электролитом. Им служит 20% раствор серной кислоты. Также можно использовать хлористый аммоний (нашатырь). На 100 мл воды берут 50 г. порошка. Уровень электролита не достигает края банки на 15-20 мм.
Осторожно! Работа с серной кислотой при приготовлении электролита подразумевает добавление воды в кислоту, а не наоборот. При приготовлении раствора необходимо использовать стеклянную посуду и стеклянную или деревянную палочку для перемешивания.
Способ третий: медные монеты
Принцип использования медного катода и алюминиевого анода рассмотрен в этом способе. Процесс изготовления источника тока следующий:
- по форме медных монет одного размера (медный пятак) вырезают кружочки из алюминиевой фольги и плотного картона (обложка старой книги);
- монеты очищаются путём погружения в уксус, им же пропитываются и кружочки картона;
- картон вставляется между монетой и кружком фольги, которые служат катодом и анодом.
Собранная таким образом батарея будет работать до тех пор, пока не высохнет электролит, пропитавший картонные кружки.

Способ четвертый: батарейка в пивной банке
Сам корпус пивной банки (алюминиевый) служит анодом (минус), в качестве катода используют графит. При изготовлении выполняются следующие шаги:
Способ пятый: батарейка из картошки
Это вариант использования химической реакции окисления между медными и оцинкованными полосками, в качестве электролита используется мякоть картофеля.
Внимание! Полученные напряжения таких источников настолько малы, что подобные конструкции могут служить лишь в качестве опытов для изучения происхождения электричества.

Способ шестой: графитовый стержень

Несмотря на всё разнообразие способов и видов самодельных источников тока, все они работают, благодаря электролитическим процессам и химическим реакциям окисления. Правильно подобранные пары элементов для анода и катода, а также использование подходящего электролитического раствора дают реальные результаты. Можно сделать аккумулятор своими руками для питания гаджетов и малогабаритных устройств.
Видео
Мужик переплавил пластины и сам собрал свинцовый аккумулятор:
https://electrotransport.ru/ussr/index.php?topic=52527.216
"гоняю их в зад перёд. 2 в паралели, 100 и 200 А. розряжаю компом или теликом бывает лампочками. Умудрился от АКБ этих закипятить чашку чая гдето 450 гр. температура воды была нуливая. кипятильник 500 ватт. напруга просела до полного кипения 10.8 в. зато радости было полные штаны"
"Ёмкость растёт потихоньку. По ходу ещё долго будет рости, наверно до следующей осени."
"радует то что не здря промучался целое лето"
"Собери весь этот хлам, переплавь как я. Сделай нормальную форму для отливки решоток и будет тебе счастье. А про магазинские ЗАБУДЬ. Они негодные"
----
Многие спорят: существует единое мировое правительство или нет?
По таким косвенным признакам понятно, что оно существует. Хотя контролирует не всё подряд, но некоторые направления развития контролирует очень жёстко (на уровне "если пойдёшь туда, мы тебя убьём").
И ценообразование на этом рынке искусственное. Как может банка панцирного свинцового аккумулятора стоить дороже жёсткого компьютерного диска? Этот диск - сложнейшее изделие точной механики, а в аккумуляторе ничего сложного нет, вон кулибины легко собирают его на коленке.
Помогал я на днях сыну с уроками. По химии тема была — электролиз.
И раз уж мой сайт и Ютуб-канал посвящены различным Самоделкам, решено было собрать самодельный источник постоянного тока.
Для эксперимента мне понадобилось:
— 9 поллитровых банок
— мультиметр и смартфон
В нашем эксперименте, в качестве электродов будут участвовать 3 металла : медь, алюминий, цинк (оцинкованная сталь).
Одним из электродов в каждой банке будет медь, вторым — либо алюминий, либо цинк.
В качестве электролита используем соляной раствор. На 9 банок ушло 1 кг. соли.
Медный электрод соединил с алюминиевым. Конечно… такой контакт недолговечен, но он мне и нужен-то только на время эксперимента!
В качестве цинковых электродов, использован оцинкованный профиль для гипсокартона.
Внутри банки, электроды не должны соприкасаться. Поэтому медную мочалку я отделил пластиковой проставкой, вырезанной из ПЭТ-бутылки.
Там где алюминиевые электроды — обернул алюминий туалетной бумагой.
Непосредственного контакта не будет, а для электролита бумага не будет препятствием!
Залил приготовленный соляной раствор в банки. В эксперименте участвуют 6 банок с электродами из меди и алюминия и…
… и 3 банки с электродами из меди и цинка. Итого — 9 банок.
Целью эксперимента будет — зарядка смартфона. Для этого я изготовил переходник, о котором можно посмотреть здесь .
Измеряем суммарное напряжение, которое образовали 9 банок.
Как видим: 5,15 Вольт.
А теперь посмотрим какое напряжение в одной банке между медью и алюминием.
Медь с цинком показали немного большее напряжение: 0,6В
Некоторые зрители выразили мнение, что это связано с тем, что оцинкованные электроды имеют большую площадь. Я с этим не согласен. Большая площадь будет влиять на величину тока, но не на величину напряжения.
По таблице приведённой выше, разность потенциалов между медью и алюминием должна быть выше, по факту же получается наоборот. Скорее всего это связано с наличием оксидной плёнки, образовавшейся на поверхности алюминия. А вы как думаете?
Ну да ладно эту теорию…
Давайте посмотрим что получилось в реальности. Наверняка всех интересует, какой ток может дать эта сборка.
Подключаю к переходнику свой старенький смартфон и… О чудо. Зарядка пошла.
Оставляю схему в покое на полчаса…
Тут же, я подключил свой рабочий смартфон (который кстати, на тот момент был практически разряжен) и через 1 час я обнаружил, что смартфон зарядился на 42%. Ёмкость батареи — 2000мАч.
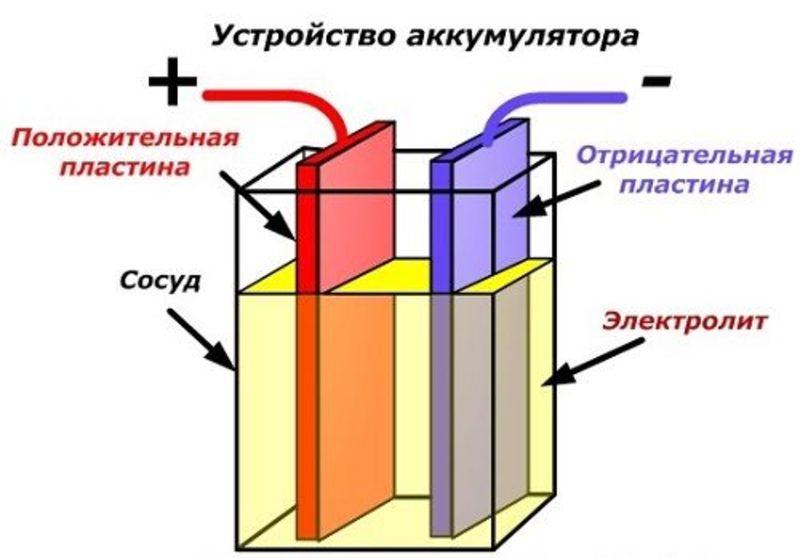
Аккумулятор – это накопитель энергии, который обычно работает на принципе обратимости химической реакции. Устроен простейший аккумулятор просто, впервые его идею опробовал на практике Риттер в 1803 году, это был столбик из 50-ти медных пластин, проложенных влажной плотной тканью.

Самодельный пакет пластин
Как сделать аккумулятор своими руками? Собрать из медных пластин? Есть более простые методы создания накопителя электроэнергии из подручных средств. Можно сделать как кислотный самодельный аккумулятор, так и устройство щелочного типа.
Кислота и свинец
Наиболее проста в устройстве свинцово-кислотная конструкция для накопления электроэнергии. Для её сборки требуются:
- устойчивая ёмкость, с возможностью её плотного закрытия крышкой;
- электролит – раствор аккумуляторной кислоты и дистиллированной воды;
- свинцовая пластина – можно использовать сплющенный кусок свинца с кабельной изоляции или приобретённый в охотничьем или рыболовном магазине;
- два металлических штыря – электроды, которые необходимо вбить вертикально в свинцовые пластины.
Далее приведем сам процесс изготовления этого устройства. Пластины свинца одеваются на металлические штыри, с небольшим расстоянием между ними. После чего конструкцию погружают в ёмкость с залитым электролитом. Свинец должен полностью находиться под раствором. Контактные концы штырей проводят через крышку ёмкости и надёжно фиксируют на ней. К концам электродов можно подключить потребитель электроэнергии. Ёмкость устанавливают на устойчивой поверхности, после чего заряжают устройство. Усложнив конструкцию, свернув свинцовые пластины в рулон и, соответственно, увеличив их площадь, при малом объёме можно добиться неплохих показателей такого устройства. По этому же принципу делают рулоны в современных гелевых накопителях энергии.

Пластины, подготовленные к погружению в банку
Важно! При работе с самодельными электронакопителями соблюдайте правила безопасности: кислота, использованная в электролите, – довольно агрессивное вещество.
Соль, уголь и графит
Для этого устройства не нужна кислота, так как используется щелочная реакция. Как сделать аккумулятор этого типа? Основой накопителя энергии этого типа служит ёмкость с электролитом в виде раствора воды и хлорида натрия – поваренной соли. Для его создания требуются:
- графитовые стержни, с металлическим колпачком для припаивания контакта;
- активированный или древесный уголь, истолчённый в крошку;
- тканевые мешки для размещения угольного порошка;
- ёмкость для электролита с плотной крышкой для фиксации концов электрода.
В качестве электродов служит графитовый стержень в плотной угольной обкладке. Графит можно использовать из пришедших в негодность батареек, а уголь – древесный или активированный, из противогазных фильтров. Для создания плотной обкладки уголь можно поместить в водопроницаемый мешок, после чего вставить внутрь графитовый стержень, а ткань мешка обмотать нитью или проводом с изоляционным покрытием.
Для увеличения показателей этого рода конструкции можно создать батарею из нескольких электродов, размещённых в одной ёмкости.

Важно! Накопительная ёмкость и напряжение на контактах самодельных устройств для накопления электроэнергии сравнительно невелики, но в то же время их вполне хватает для подключения маломощного источника света или других целей. Батарея из нескольких электродов имеет более высокие показатели, но они более громоздкие.
Лимоны и апельсины в качестве ёмкости для электричества
Лимонный сок, кислоту или её раствор можно использовать и отдельно. Для этого достаточно залить их в банку небольшого размера и установить там медный и стальной электрод. Напряжение природного накопителя электроэнергии невелико, но, тем не менее, его хватит для источника освещения малой мощности.
Даже при отсутствии накопителя энергии фабричного производства можно легко сделать аккумулятор своими руками. Для его создания требуются лишь знания основ физики и химии, а также наличие под руками кислоты или щелочи любого типа. В качестве электродов можно использовать практически любые металлы, которые есть в наличии, но наилучший вариант – это использование сталей с большим содержанием железа, а также меди и её сплавов.
Видео
Читайте также:

