Сульфат ртути как сделать
Добавил пользователь Skiper Обновлено: 19.09.2024
Выпуск 11, 1940 г.
ПОГЛОЩЕНИЕ ПАРОВ РТУТИ ОКИСЛАМИ МЕТАЛЛОВ И СОЛЯМИ
В. А. Пьянков и Ж. Л. Лоевский
Донецкий институт гигиены труда
Нашими предыдущими исследованиями было установлено, что одним из наиболее активных сорбентов для очистки воздуха от паров ртути является йодированный уголь. При достаточно большой динамической активности к парам ртути у данного сорбента имеется один весьма существенный недостаток - малый коэффициент использования йода. Вот почему нами были приняты дальнейшие исследования по изысканию и изучению новых сорбентов.
При этих исследованиях имелось в виду применить сорбенты не только для индивидуальной защиты от паров ртути, но и для очистки отходящих газов, загрязненных парами ртути. К этой последней группе сорбентов при наличии у них достаточно большой динамической активности к парам ртути должно было быть предъявлено основное требование — низкая стоимость, принимая во внимание необходимость очистки большого количества газов.
Установка, на которой производилось испытание динамической активности сорбентов, представлена на рис. 1.

В дозирующую трубку А наливалось определенное количество очищенной металлической ртути. В термостате, где поддерживалась температура с точностью до 0.1º, над ртутью пропускался с определенной скоростью воздух. При встряхивании ртути перед каждым опытом для разрушения оксидной пленки скорость испарения в течение нескольких суток оставалась постоянной при одной и той же температуре, скорости струи воздуха и давлении. Поступающий в дозирующую трубку воздух предварительно очищался пропусканием через слой ваты и активированного угля.
Из дозирующей трубки воздух с парами ртути поступал в динамическую трубку Т, в которой на стеклянной продырявленной перегородке помещался слой сорбента. Динамическая трубка помещалась в водяную ванну, в которой температура поддерживалась с точностью до 1º. Пары ртути, прошедшие через сорбент, задерживались в спирали С с кристаллом йода, и количество ртути определялось фотоколориметрически в виде золя сульфата ртути. Скорость тока воздуха измерялась реометром. Моностат и водяной манометр, применявшиеся для регулирования скорости движения воздуха и давления, не изображены на чертеже.
Очистка воздуха от ртути была исследована с использованием следующих сорбентов: 1) из окислов - окись меди, окись ртути, окись серебра, трехокись кобальта, двуокись свинца, продажная и активная двуокись марганца; 2) из солей - калийная селитра, бертолетова соль, бихромат калия, перманганат калия и хлорная известь.
Наибольшую динамическую активность в поглощении ртутных паров обнаружили окись серебра, активная двуокись марганца и двуокись свинца. Значительно меньшую активность обнаружили хлорная известь, продажная и активная двуокись марганца, желтая окись ртути и перманганат калия. Динамическая активность остальных сорбентов при очистке от ртути в условиях наших опытов оказалась равной нулю или близкой к нему.
Первыми были исследованы окись серебра, двуокись свинца и активная двуокись марганца. Несколько слов об их приготовлении.
Окись серебра получалась обычным путем - взаимодействием нитрата серебра со щелочью, приготовленной из металлического натрия. Двуокись свинца получалась окислением ацетата свинца хлорной известью. Активная двуокись марганца получилась путем окисления сульфата закиси марганца перманганатом калия в водном растворе в течение нескольких часов при температуре 60º. После стояния в течение 3 дней в теплом месте реакция заканчивалась, и отфильтрованная двуокись марганца высушивалась в течение 4 час. в сушильном шкафу при 110º, а затем в вакуум-эксикаторе над фосфорным ангидридом в течение 3 суток.
Поскольку ориентировочные опыты по очистке от ртути показали большую динамическую активность данных сорбентов к ртутным парам, были подобраны для опытов такие условия, при которых время защитного действия должно было свестись к минимуму. Минимальное количество сорбентов с величиной зерна 1.5-2 мм загружалось в динамическую трубку 1.5 см в диаметре слоем длиной в 1 см. Скорость воздуха 2.5 л на 1 см 2 сечения слоя сорбента. Концентрации паров ртути были близки к насыщению при температуре 20º, в среднем 14 — 15 мг на 1 м 3 .
Для сравнения при тех же условиях была испытана динамическая активность йодированного угля с содержанием йода 15% к весу угля. Данные опыты приведены в табл. 1 и 2.
Активная MnO2, вес 0.84 г
Продолжи- тельность работы сорбента,
шейся ртути, в мг
Продолжи- тельность работы сорбента,
шейся ртути, в мг
Йодированный уголь, вес 0.56 г, вес йода 0.084 г
Продолжи- тельность работы сорбента,
шейся ртути, в мг
Продолжи- тельность работы сорбента,
шейся ртути, в мг
Наибольшую динамическую активность к парам ртути при одинаковой длине слоя сорбента, равной 1 см, дает окись серебра и наименьшую — йодированный уголь. Если принять время защитного действия 15% йодированного угля равным 1, то для окиси серебра мы получим 14, для активной двуокиси марганца — 8 и для двуокиси свинца — 4. Нужно, однако, отметить, что при очистке воздуха от ртутных паров степень использования статической емкости сорбентов К является наибольшей для йодированного угля — 10% и наименьшей для двуокиси свинца — 0.6%. Емкость рассчитывалась по соответствующим реакциям данных сорбентов с ртутными парами, причем для реакции MnO2 с ртутью принимали образование Hg2MnO2, как это установлено Алексеевским. Аналогичную реакцию мы принимали и для PbO2.
Считаем уместным привести здесь для сравнения данные, полученные Алексеевским по сорбции паров ртути различными веществами. При стоянии сорбентов в эксикаторе над ртутью было адсорбировано ртути в течение 5 лет (в %): гопкалитом—7.2, активной двуокисью марганца — 41.8, окисью кобальта—1.65 и цинковой пылью— 0.017;
Таким образом, активная двуокись марганца по данным опытам является необычайно активным сорбентом паров ртути.
Какой же окончательный вывод может быть сделан в отношении выбора сорбента для противортутных респираторов? Казалось бы, что наилучшим сорбентом является окись серебра. К сожалению, этот сорбент является слишком дорогим и, очевидно, его можно рекомендовать только в отдельных случаях и при условии полной регенерации, что не представляет никаких затруднений. Окись серебра может служить незаменимым сорбентом для очистки выхлопных газов во всевозможных лабораторных приборах и аппаратах, работающих с ртутью.
В отношении экономичности значительные преимущества имеются за активной двуокисью марганца. Но у него имеется один недостаток по сравнению с остальными тремя сорбентами — это недостаточная прочность зерна. Очевидно, распыления его в противогазе можно избежать при условии нанесения на соответствующий трегер, обладающий достаточной механической прочностью.
При использовании окиси серебра или активной двуокиси марганца в противортутных респираторах нет необходимости брать большую длину слоя сорбента. Совершенно достаточным можно считать слой в 1 см при величине зерна 2 мм. При обычных нормальных размерах респираторных коробок для очистки от ртути воздуха в них будет загружаться около 60 г окиси серебра или около 30 г двуокиси марганца. При максимальной скорости вдыхаемого воздуха 2.5 л на 1 см 2 сечения слоя сорбента (обычно эта величина бывает в несколько раз меньше) на 60 г окиси серебра должно связываться до появления проскока до 3 г ртути и на 30 г активной двуокиси марганца до 1.5 г.
Исходя из оптимальных концентраций паров ртути в воздухе 2 мг на 1 м 3 , и скорости вдыхания воздуха 1 м 3 в час, одной зарядки окиси серебра должно хватить на 750 час., а двуокиси марганца на 300—400 час.
Следующими нами были испытаны продажная двуокись марганца, желтая окись ртути, перманганат калия и хлорная известь. Последняя была предварительно спрессована и програнулирована. Для того чтобы получить для данных сорбентов достаточное время защитного действия, необходимо было брать или очень большую длину слоя сорбента или очень малую скорость воздуха. Мы считали более целесообразным взять условия для опытов, близкие к тем, что были взяты в предыдущих опытах, и для характеристики сорбентов проследить за изменением проскока паров ртути в зависимости от длины слоя сорбента. Средние концентрации паров ртути при этом были 9 мг на 1 м 3 и скорость воздуха 1.5 л на 1 см 2 сечения слоя сорбента. Величина зерна 1.5-2 мм. Каждый опыт продолжался 20 мин., в течение которых испарялось 0.65 мг ртути. Данные опытов представлены кривыми, изображенными на рис. 2.

Таким образом, из данных 4 сорбентов при очистке от ртути наибольшую активность обнаруживает хлорная известь, дальше идет продажная двуокись марганца, а окись ртути и перманганат калия обнаруживают пониженную активность.
Хлорную известь при ее сравнительной низкой стоимости можно применять для чистки отходящих из печей и из рабочих помещений газов, загрязненных парами ртути. Нужно отметить, что продукт реакции взаимодействия паров ртути с известью — каломель (как показал анализ) осаждается не на поверхности сорбента как во всех других случаях, а на поверхности динамической трубки, тотчас за слоем сорбента. Очевидно, в данном случае происходит гомогенная реакция между парами ртути и хлором, который выделяется из хлорной извести при воздействии углекислого газа воздуха. Подтверждением тому, что продукт реакции — каломель - не осаждается на поверхности сорбента, является тот факт, что активность хлорной извести к парам ртути во времени изменяется очень медленно в отличие от других сорбентов Очевидно, благодаря этому степень использования статической емкости сорбента будет большая и в конечном счете будет определяться уравнением реакция ртути с активным хлором.
Показателем того, что реакция ртути идет со свободным хлором, который выделяется из хлорной извести за счет углекислого газа воздуха, является тот факт, что при повышении концентрации этого газа в воздухе динамическая активность хлорной извести к парам ртути возрастает. При добавлении к воздуху 0.02 % углекислого газа пары ртути задерживались полностью слоем хлорной извести в 1 см, в то время как при тех же условиях при обычном составе воздуха наблюдался проскок ртути до 15%. При добавлении 0.1 % углекислого газа полностью задерживал пары ртути слой хлорной извести в 0.5 см.
Если при очистке вентилируемого воздуха углекислого газа, содержащегося в нем, будет недостаточно, то можно добавлять к воздуху небольшое количество дымовых газов. Большой избыток последних нежелателен во избежание непроизводительного расхода хлорной извести и связанного с этим загрязнения воздуха хлором.
В газах, отходящих из печей на металлургическом ртутном заводе, в смеси с парами ртути находится более чем достаточное количество сернистого газа для выделения нужного количества хлора из хлорной извести. Чтобы убедиться в том, что сернистый газ будет оказывать на хлорную известь влияние, аналогичное углекислому газу, нами были проведены следующие опыты. По пути движения воздуха с парами ртути ставилась лодочка с 0.1 г хлорной извести, а перед ней присоединялась бюретка для дозирования сернистого газа. Концентрация паров ртути 6 м на 1м 3 и скорость движения воздуха 1.5 л на 1 см 2 сечения трубки, в которой помещалась хлорная известь. Данные опытов приведены в табл. 3.
ХИМИЧЕСКАЯ ОПАСНОСТЬ:
Вещество разлагается под влиянием света и при разогреве до 450°C с образованием очень токсичных паров ртути и оксидов серы. Водный раствор является кислотой средней силы. Реагирует с галидами водорода.
НОРМАТИВЫ ДЛЯ РАБОЧЕЙ ЗОНЫ:
TLV (предельная пороговая концентрация, США) (как Hg): ppm; 0.025 мг/м^3 (кожа, A4) (ACGIH 1999).
Вещество может всасываться в организм при вдыхании аэрозоля, через кожу и через рот.
РИСК ПРИ ВДЫХАНИИ:
Испарение при 20°C незначительно, однако, может быстро достигаться опасная концентрация частиц в воздухе при распылении
ВЛИЯНИЕ КРАТКОВРЕМЕННОГО ВОЗДЕЙСТВИЯ:
Вещество оказывает разъедающее действие на глаза, кожу и дыхательные пути. Разъедающее действие при проглатывании. Вещество может оказывать действие на желудочно-кишечный тракт и почки, приводя к повреждению тканей и поражению почек. Показано медицинское наблюдение.
Вряд ли нужно говорить о том, что ртуть – металл своеобразный . Это очевидно хотя бы потому, что ртуть – единственный металл, находящийся в жидком состоянии в условиях, которые мы называем нормальными. Именно это свойство, вернее сочетание свойств металла и жидкости (самой тяжелой жидкости – в 13,6 раза тяжелее воды), определило положение элемента №80 в нашей жизни.
В России ртуть и ее соединения в медицине стали применяться со времен профессора А.И. Венчикова. Легенда 30-х годов, русский ученый Венчиков Анатолий Иванович знал как победить старость и тяжелые недуги. Он не пытался убить вирус или клетку, он посылал в клетки те микроэлементы, которые нужны для противостояния болезни.
Ученый-целитель лечил бруцеллез, энцефалит, туберкулез, желтуху, рак и др. болезни. Знахари в те годы, как впрочем и сейчас, были не чести. Но Анатолий Иванович был доктор наук, профессор, заведовал кафедрой медицинского института. Больные верили ему и ехали со всего света.
В парфюмерии и косметике ртуть и ее соединения стали применяться намного раньше. Мать самого известного Рюриковича Елена Глинская, правившая вместо малолетнего сына, скоропостижно скончалась в разгар весьма непопулярных среди бояр реформ, и на её рыжих волосах и тех частях одежды с которыми они соприкасались, обнаружили немало соединений ртути. Столь же много солей этого популярного среди отравителей металла нашли и на волосах, и на саване, и в гробнице первой жены Ивана Грозного Анастасии Романовны, умершей в 1560 году. Она принадлежала к многочисленному и возвысившемуся в результате её замужества боярскому роду Захарьиных и потому была бельмом на глазу у прочих боярских семей.
Обстоятельства жизни и смерти этих цариц вкупе с наличием ртути на волосах позволили ученым сделать вывод, что обе царицы были отравлены. Но можно ли утверждать это с абсолютной уверенностью? Сернистая ртуть HgS (или киноварь), известная с древнейших времен красная краска, не только использовалась в старину в качестве румян, но и входила в состав красителей для волос. Анализируя состав румян химики выяснили, что человеческий пот делает киноварь весьма опасной для здоровья.
В те далекие времена сулему (дихлорид ртути HgCl2) – один из самых злых ядов, использовали для приготовления жидкостей, смягчающих кожу, мышьяк принимали малыми дозами для того, чтобы приучить к нему организм и тем самым предотвратить отравление, мышьяковистый ангидрид употребляли, чтобы сделать цвет кожи более живым, чтобы тело выглядело пышущим здоровьем, а цинк мог попасть в организм из цинковых белил. Но ещё более опасными были средства для выведения веснушек - в состав препарата входили эмульсия из горького миндаля и сулема.
Злые языки утверждают, что и Моцарт не был отравлен Сальери, а сам отравился ртутью, неудачно пытаясь лечиться от сифилиса.
В наши дни отечественная фармацевтическая промышленность выпускает следующие препараты ртути:
* Ртути дихлорид (сулема) – для лечения стригущего и плоского красного лишая (наружное разведение и мазь).
* Ртути оксицианид – для глазных ванночек при конъюнктивите. * Мазь ртутная серая – для втирания в кожу при паразитарных заболеваниях и иногда для лечения больных сифилисом.
* Ртути амидохлорид – применяется при заболеваниях кожи.
* Мазь ртути белая – для удаления веснушек.
* Ртути окись желтая – назначают в глазной практике при блефаритах, кератитах, конъюнктивитах, а также при кожных заболеваниях (сикозе, себорее).
* Ртути монохлорид (каломель) – применяют наружно в виде мази при заболеваниях роговицы, при бленнорее, используются также для предохранения от заражения венерическими заболеваниями (местно).
Дихлорид ртути или сулема – главная составляющая часть лекарства при терапевтическом лечении рака головного мозга: в крайних случаях необходимо прибегать к крайним средствам.
Дихлорид ртути от позднелабинского sublimatum – сулема HgCl2 (буквально – высоко поднятое, вознесенное, то есть добытое возгонкой) – бесцветные кристаллы ромбической формы. Плотность сулемы 5,44 г/см3, температура плавления 277 0 С, температура кипения 304°С. Растворима в холодной воде (1:18,5), легко растворима в кипящей воде (1:3) и спирте (1:4), растворима в эфире, ацетоне, легко возгоняется. Водные растворы имеют кислую реакцию.
Сулема – сильный яд. Смертельная доза сулемы – 0,5 г.
Получают растворением ртути в концентрированной серной кислоте с последующим нагреванием сухого сульфата ртути с хлоридом натрия или прямым хлорированием ртути при нагревании.
Применяют для получения других солей ртути, как дезинфицирующие средства в медицине, в фармацевтической промышленности, для протравливания семян, пропитки дерева и др. Сулему используют в качестве катализатора в органическом синтезе.
В настоящее время соли ртути используются только в гомеопатии в разведении 10 в минус 6 степени.
Ранее применялись водные растворы сулемы 0,1-0,2% концентрации (1:1000 – 2:1000) для дезинфекции белья, одежды, предметов ухода за больными, для дезинфекции помещений и др.
Сулема выпускается в порошке и таблетках (по 0,5 и 1 г.), состоящих из равных частей дихлорида ртути и хлорида натрия. Таблетки окрашиваются 1% раствором эозина в розовый или красно-розовый цвет и дают опалесцирующий раствор такого же цвета. Таблетки предназначаются только для наружного применения (для приготовления растворов).
Сулема – лучшее средство при таких тяжелых опухолях, как рак головного мозга, рак предстательной железы, рак мочевого пузыря, рак гортани и полости рта, саркома кости, наружные новообразования, а также рак желудка, рак пищевода и рак кишечника.
В первом случае достаточно растворить 0,5 г. сулемы в 1000 мл. дистиллированной воды и принимать разведение по одной столовой ложке, три раза в день за час до еды в 50 мл. воды. Этот рецепт рекомендуется при опухолях головного мозга. Выходить на максимальную дозу надо постепенно, начиная с чайной ложки на 50 мл. воды и далее по самочувствию.
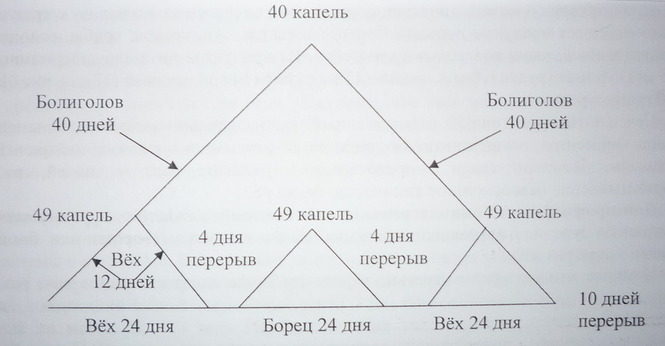
При метастических поражениях и опухолях головного мозга, сулема принимается одновременно с антимитотическими ядами таких ядовитых растений, как вёх ядовитый, болиголов крапчатый и борец белоустый. Используются не настойки, а вытяжки из этих растений. Применяя метод перколяции, строго соблюдая сроки сбора растений, вытяжки оптимальной концентрации готовятся из только что заготовленного сырья.
Механизм противоопухолевого действия цикутоксина, кониина и аконитина, объясняется их способностью блокировать митоз клеток на стадии метафазы, в самом начале кариокинеза (деления ядра клетки).
Схема лечения вытяжками трав.
Применение вытяжек из этих трав при метастатических поражениях головного мозга целесообразно независимо от локализации и вида опухоли.
Рекомендации по приему лекарственных трав следующие:
2. Вытяжка вёха ядовитого – УТРОМ и ВЕЧЕРОМ за 30 мин до еды в 50 мл. воды по следующей схеме:
Если разбился градусник, то действовать нужно немедленно. Ртуть - тяжёлый металл, а признаки отравления могут проявиться далеко не сразу. Представляем шесть главных "нельзя" и восемь важных "надо", если дома случилось ЧП.
Ртутные термометры считаются более точными, чем электронные, да и доверяют им многие охотнее. Если градусник разбился, то это настоящее происшествие, ведь пары ртути способны задерживаться и накапливаться в организме. Если концентрация высокая, то вредное вещество проникает даже в кожу.
Острое отравление ртутью может проявиться через несколько часов. Человек почувствует слабость, потеряет аппетит, его начнут мучить головные боли. Другие симптомы - боль при глотании, ощущение металла во рту, слюнотечение, рвота и тошнота, нередко - озноб, кашель, одышка, повышенная температура.
Чтобы избежать этого, нужно запомнить шесть главных "нельзя", если разбился градусник.
- Не трогать шарики ртути голыми руками.
- Не подметать осколки градусника и его содержимое веником.
- Не собирать пылесосом.
- Ни в коем случае не выбрасывать ртуть и осколки в мусорное ведро и не смывать в унитаз.
- Не использовать стандартную бытовую химию для мытья помещения, где разбился предмет.
- Вещи после устранения ЧП нельзя стирать в стиральной машине.
Но что делать, если разбился градусник?
- Надо срочно удалить из комнаты детей и домашних животных.
- Необходимо взять маску, смочить ткань водой и надеть на лицо. На ноги - бахилы (в крайнем случае пакеты, закреплённые резинками). На руки - резиновые перчатки.
- В стеклянной банке развести марганцовку, чтобы потом помыть полы в комнате.
- Шарики ртути собрать в отдельный контейнер.
- Нужно для сбора металла использовать кисточку (сгодится любая: для рисования, для макияжа). Смести с её помощью ртуть на лист бумаги, бросить всё в контейнер (и кисточку тоже, она больше непригодна для использования). Скотчем или лейкопластырем пройтись по всем поверхностям в комнате, чтобы собрать малейшие частицы, которые могли остаться. Тоже сложить отрезки клейкой ленты контейнер.
- Помыть полы раствором марганцовки. Если её нет, можно заменить раствором кальцинированной соды.
- Открыть окна и проветрить комнату.
- Крайне важно контейнер отнести в любой пункт МЧС.
Подписывайтесь на канал "Царьград" в Яндекс.Дзен
и первыми узнавайте о главных новостях и важнейших событиях дня.

Многие до сих пор не доверяют электронным градусникам и отдают предпочтение ртутным. Но ведь при определенных условиях они могут быть опасны для людей.
О последствиях разбитого термометра, воздействии ртути на организм и о том, как правильно избавиться от металла, рассказал доцент химического факультета ВГУ Юрий Ковыгин.
Об отравлениях и разбитом градуснике
Юрий Ковыгин: В градуснике порядка двух граммов ртути. Этого хватит, чтобы при правильном использовании отравить около 20 человек. Но сама по себе ртуть не так страшна, как её малюют.
Ртуть – это металл, который реагирует не со всеми веществами. Если вы съедите градусник, то, скорее всего, проблемы будут не от ртути: больше неудобств доставит стекло. В желудке содержится соляная кислота, с которой ртуть не реагирует. Из-за ртути, возможно, будет сильное местное раздражение, боли в животе, которые потом пройдут.
Жидкий металл сам по себе мало опасен: ему не попасть глубоко в ткани. Плохо, если вы вдыхаете пары ртути: они поражают лёгкие. Чрезвычайно опасны соединения ртути, особенно растворимые и летучие. Ртуть активно взаимодействует с серой в составе белков и связывает многие ферменты организма, чем нарушает клеточный обмен. Попадая в организм, она ломает многие биохимические процессы.
Хроническое отравление, помимо прочего, приводит к нарушениям центральной нервной системы. Любимый кэрролловский герой – Безумный Шляпник – типичный пример: шляпники поражались соединениями ртути при изготовлении фетра.
- Забытый в квартире шарик ртути может навредить человеку?
- Температура кипения у ртути – 357 градусов, и при комнатной температуре она испаряется очень слабо.
Если вы живете в квартире, в которой просто лежит шарик ртути под шкафом, то она, конечно, постепенно будет попадать в организм. Но и выводится из организма ртуть гораздо лучше, чем, например, свинец.
В нашем организме есть некоторое количество ртути. При увеличении нормы ртуть выводится почками. Токсическая доза ртути для человека – полмиллиграмма. С объёмом ртути меньше этой дозы организм справится без серьёзных проблем. Но если в организм будет попадать большее количество этого вещества, то тело не будет успевать от него избавляться и острое отравление перерастёт в хроническое.
При комнатной температуре из большой капли ртуть испаряется медленно. Но если вы разобьёте градусник и начнете его подметать или пылесосить, то один шарик вы разделите на множество. Тогда опасность возрастёт многократно. Во-первых, испарение пойдёт активнее. А во-вторых, через некоторое время на её поверхность попадут бактерии, способные переводить этот металл в летучие соединения, такие как метилртуть. Такое соединение легче и в большем количестве попадает в организм. Оно может вызвать болезнь Минаматы (синдром, вызываемый отравлением органическими соединениями ртути– ред.). Органические соединения ртути испаряются, впитываются через кожу, попадают и в лёгкие и во все органы тела.

- Что делать, если разбился градусник?
Если очень страшно, то после сбора видимых шариков, можно химически связать оставшуюся на полу ртуть марганцовкой. Но нужно иметь в виду, что раствор нужен концентрированный: образно говоря, на стакан воды – стакан марганцовки. Скорее всего, этот раствор испортит любое покрытие. На местах, куда он попадёт, останутся чёрные пятна.
Вообще, всем должны заниматься специалисты. Поэтому лучше всего вызвать команду демеркуризации из СЭС.
Переходим на электронные градусники
- Нужно ли помещать шарики ртути в воду?
- Да, до передачи собранной ртути специализированным службам, есть смысл хранить её под слоем воды. Так она будет меньше испаряться. Хотя, просто герметично заткнутый пузырёк для хранения ничуть не хуже.
- Почему нельзя выбрасывать ртуть в канализацию?
- Потому что она попадёт в водоём, где на дне содержится ещё больше бактерий, чем в вашей квартире. Бактерии, как уже сказано, переводят её в органические производные. Ртуть попадает в природные воды, в подземные, в рыбу и другие организмы.
- А если градусник разбить в постели – это опаснее?
- У ртути очень большое поверхностное натяжение – она не растекается, а сразу собирается в шарики, которые стремятся слиться друг с другом. Поэтому ртуть не впитывается в ткани. Собрать её так же легко, как и с гладкого покрытия. Но, если вы пропустили ртуть через мешок пылесоса, тогда она раздробится на микроскопические шарики, которые могут спрятаться в волокнах.
- Можно ли стирать вещи, которые соприкасались с ртутью?
- В воде ртуть проще раздробить. Если в вещах осталась ртуть, то при стирке она раздробится и прилипнет к барабану стиральной машинки изнутри, после чего превратится в амальгаму и останется там навсегда. Но, как уже говорилось, в ткани ртуть не впитывается, в машинку её можно засунуть разве что специально.

- Правда ли, что много ртути присутствует в рыбе и морепродуктах?
- Морские организмы накапливают этот металл, потому что естественное содержание ртути в воде довольно велико. Если превышен некоторый порог, если в рыбу попадает столько ртути, что она не может от неё избавиться, то ртуть накапливается во всех её частях.
- На ваш взгляд, каким лучше пользоваться термометром: электронным или ртутным?
- Хорошие электронные термометры, конечно, точнее, безопаснее, менее уязвимы. Но те, которые мы покупаем в аптеке, нередко бывают плохого качества, поэтому на них столько жалоб.
И есть смысл избавить себя и от ртути в доме, и от лишнего стресса. В конце концов, на дворе 21-й век! Поэтому переход на более технологичные электронные термометры неизбежен.
Читайте также:
- Чистка матраса в домашних условиях своими руками
- Смеситель из зеркала как сделать
- Самосвальный кузов своими руками на японский грузовик
- Чем склеить нарощенный ноготь
- Как сделать шулюм из утки дикой