Модель молекулы серной кислоты своими руками
Обновлено: 07.07.2024
Научиться создавать пространственные модели молекул с помощью специальных конструкторов или из подручных материалов.
Оборудование и материалы
- Специальные химические конструкторы.
- Любые конструкторы, которые можно приспособить для выполнения исследования.
- Материалы для изготовления моделей атомов и связей между ними.
- Бумага и ручка (цветные карандаши).
Обоснование
С использованием платформы ГлобалЛаб мы сможем создать удобную для просмотра коллекцию моделей молекул.
Протокол проведения исследования
- Выберите вещество, молекулярное строение которого вы собираетесь моделировать.
- Уточните название вещества.
- Запишите состав молекулы выбранного вами вещества в виде химической формулы. Сделайте фотографию (скан) записи, чтобы затем загрузить её в анкету проекта.
- Определите, к каким веществам относится выбранное вами вещество: к органическим или неорганическим.
- Подберите материалы и создайте модель вашей молекулы, передающую её пространственную структуру. Вы можете использовать специальные химические конструкторы, в состав которых входят шарики-атомы и палочки, моделирующие связи между ними. Вы можете использовать любые другие конструкторы, материалы для творчества, например, слепить атомы из пластилина или сделать их в виде небольших клубочков ниток. Вы можете даже собрать съедобную молекулу из фруктов или ягод!
- Сфотографируйте все этапы изготовления модели молекулы, а затем сделайте фотографии готовой модели с нескольких точек съёмки, чтобы хорошо было видно её пространственное строение.
- Заполните анкету проекта и опишите процесс изготовления модели. Таким образом вы примете участие в базовом варианте проекта.
- Если вы уже изучаете химию или просто интересуетесь ею, возможно, вы захотите ответить на дополнительные вопросы (более сложные).
- Посчитайте относительную молекулярную массу выбранного вами вещества.
- Нарисуйте структурную формулу молекулы выбранного вами вещества, сделайте фотографию или скан рисунка, чтобы разместить их в анкете проекта.
- Выясните величину валентного угла в молекуле.
- Определите тип химической связи.
- Выясните, какова гибридизация орбиталей.
- Определите геометрическую конфигурацию молекулы.
- Напишите, как вы определили с помощью метода валентных связей тип гибридизации молекулы и её геометрическую структуру по методу Гиллеспи.
- Заполните анкету полностью, включая необязательные вопросы, если вы выполняете более сложную версию проекта.
- Участвуйте в обсуждении результатов проекта.
Техника безопасности
Соблюдайте требования безопасности при работе с различными материалами и инструментами.
Серная кислота H2SO4 – это сильная кислота, двухосновная, прочная и нелетучая. При обычных условиях серная кислота – тяжелая маслянистая жидкость, хорошо растворимая в воде.
Растворение серной кислоты в воде сопровождается выделением значительного количества кислоты. Поэтому по правилам безопасности в лаборатории при смешивании серной кислоты и воды мы добавляем серную кислоту в воду небольшими порциями при постоянном перемешивании.

Валентность серы в серной кислоте равна VI.
Способы получения
1. Серную кислоту в промышленности производят из серы, сульфидов металлов, сероводорода и др. Один из вариантов — производство серной кислоты из пирита FeS2.
Основные стадии получения серной кислоты :
- Сжигание или обжиг серосодержащего сырья в кислороде с получением сернистого газа.
- Очистка полученного газа от примесей.
- Окисление сернистого газа в серный ангидрид.
- Взаимодействие серного ангидрида с водой.


Рассмотрим основные аппараты, используемые при производстве серной кислоты из пирита (контактный метод):
В контактном аппарате производится окисление сернистого газа до серного ангидрида. Процесс является обратимым. Поэтому необходимо выбрать оптимальные условия протекания прямой реакции (получения SO3):
- температура: оптимальной температурой для протекания прямой реакции с максимальным выходом SO3 является температура 400-500 о С. Для того чтобы увеличить скорость реакции при столь низкой температуре в реакцию вводят катализатор – оксид ванадия (V) V2O5.
- давление: прямая реакция протекает с уменьшением объемов газов. Для смещения равновесия вправо процесс проводят при повышенном давлении.
Однако, если для поглощения оксида серы использовать воду, то образуется серная кислота в виде тумана, состоящего из мельчайших капелек серной кислоты. Для того, чтобы не образовывался сернокислотный туман, используют 98%-ную концентрированную серную кислоту. Оксид серы очень хорошо растворяется в такой кислоте, образуя олеум: H2SO4·nSO3.
Общие научные принципы химического производства:
- Непрерывность.
- Противоток
- Катализ
- Увеличение площади соприкосновения реагирующих веществ.
- Теплообмен
- Рациональное использование сырья
Химические свойства
Серная кислота – это сильная двухосновная кислота .
1. Серная кислота практически полностью диссоциирует в разбавленном в растворе по первой ступени:
По второй ступени серная кислота диссоциирует частично, ведет себя, как кислота средней силы:
HSO4 – ⇄ H + + SO4 2–
2. Серная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Например , серная кислота взаимодействует с оксидом магния:
Еще пример : при взаимодействии серной кислоты с гидроксидом калия образуются сульфаты или гидросульфаты:
Серная кислота взаимодействует с амфотерным гидроксидом алюминия:
3. Серная кислота вытесняет более слабые из солей в растворе (карбонаты, сульфиды и др.). Также серная кислота вытесняет летучие кислоты из их солей (кроме солей HBr и HI).
Например , серная кислота взаимодействует с гидрокарбонатом натрия:
Или с силикатом натрия:
Концентрированная серная кислота реагирует с твердым нитратом натрия. При этом менее летучая серная кислота вытесняет азотную кислоту:
Аналогично – концентрированная серная кислота вытесняет хлороводород из твердых хлоридов, например , хлорида натрия:
4. Т акже серная кислота вступает в обменные реакции с солями.
Например , серная кислота взаимодействует с хлоридом бария:
5. Разбавленная серная кислота взаимодействует с металлами, которые расположены в ряду активности металлов до водорода. При этом образуются соль и водород.
Например , серная кислота реагирует с железом. При этом образуется сульфат железа (II):
Серная кислота взаимодействует с аммиаком с образованием солей аммония:
Концентрированная серная кислота является сильным окислителем . При этом она обычно восстанавливается до сернистого газа SO2. С активными металлами может восстанавливаться до серы S, или сероводорода Н2S.
Железо Fe, алюминий Al, хром Cr пассивируются концентрированной серной кислотой на холоде. При нагревании реакция возможна.
При взаимодействии с неактивными металлами концентрированная серная кислота восстанавливается до сернистого газа:
При взаимодействии с щелочноземельными металлами и магнием концентрированная серная кислота восстанавливается до серы:
При взаимодействии с щелочными металлами и цинком концентрированная серная кислота восстанавливается до сероводорода:
6. Качественная реакция на сульфат-ионы – взаимодействие с растворимыми солями бария. При этом образуется белый кристаллический осадок сульфата бария:
BaCl2 + Na2SO4 → BaSO4 ↓ + 2NaCl
Видеоопыт взаимодействия хлорида бария и сульфата натрия в растворе (качественная реакция на сульфат-ион) можно посмотреть здесь.
7. Окислительные свойства концентрированной серной кислоты проявляются и при взаимодействии с неметаллами.
Например , концентрированная серная кислота окисляет фосфор, углерод, серу. При этом серная кислота восстанавливается до оксида серы (IV):
Уже при комнатной температуре концентрированная серная кислота окисляет галогеноводороды и сероводород:

Метилэтилкетон

Линолевая кислота

Муравьиная кислота

Муравьиная кислота

Муравьиная кислота

Уксусная кислота

Уксусная кислота

Олеиновая кислота

Этиленгликоль

Бензилбензоат

Метилфенилацетат

Изоамилизовалерат

Изоамилацетат

Изобутилэтанат

Изобутилформиат

Пентилсалицилат

Этилизовалерат
Водородная связь
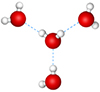
Между молекулами воды
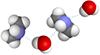
Между молекулами диметиламина и воды
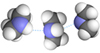
Между молекулами диметиламина
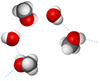
Между молекулами спирта и воды
Между молекулами спирта

Как говорит само название- медный купорос , который можно легко сделать в домашних условиях, то легко догадаться, что в его состав входит медь и серная кислота . От себя могу добавить, что кроме них в этом химическом соединении на каждую молекулу этого вещества присутствует 5 молекул воды, наличие которых дает сульфату меди, а именно так называется купорос лишенный химической влаги, такой красивый синий цвет. Слово купорос пришло к нам их древности, когда серная кислота называлась купоросное масло и все ее соли назывались купоросами. Соответственно если из серной кислоты и меди можно сделать медный купорос-то наверняка можно и поступить обратно-из сульфата меди можно получить раствор серной кислоты и металлическую медь и как это сделать я сейчас расскажу.
В своем рассказе, который я ориентирую на пользователя со школьным образованием, я простыми словами буду повествовать как можно это вещество разделить на 2 исходных составляющих и при этом получится медный порошок и раствор серной кислоты плотность которого зависит от факторов про которые я скажу позже.

Получать H2SO4 мы будем из водного раствора сульфата меди и ее концентрация будет зависеть от количества добавленной вами при растворении воды и веса синего порошка при помощи электролиза постоянным током. Все это звучит очень серьезно, но она самом деле мы просто будем пропускать через получившийся при раствор купороса в воде ток, который нам даст обычное зарядное устройство для аккумуляторов. Получать кислоту мы будем в пластиковой, керамической или стеклянной емкости, металлическую использовать нельзя.
Для начала соберем конструкцию по принципу показанному на рисунке, а в качестве электродов будем использовать графитные электроды от обычных батареек, которые нужно обернуть пару раз любой тонкой синтетической тканью и закрепить ее рыболовной леской. Для не опытного человека так нужно сделать для обоих электродов, чтобы не путаться в анодах / катодах, чтобы уменьшить их разрушение при электролизе. После этого делаем электролит - раствор медного купороса в воде, рассчитанный на получение 100 граммов серной кислоты, для чего нужно в воде растворить 250 грамм CuSO4.
Количество воды тут не играет большой роли но ориентируйтесь примерно на пол литра воды. К блоку питания можно подсоединить регулировку напряжения, поскольку при прохождении тока электролит будет греться и сила тока увеличится, что может привести к сгоранию блока питания.

При включении напряжения, через электроды и раствор пойдет напряжение и на одном электроде станет появляться порошок красного цвета, это выделяется медь, а на другом пузырьки будут появляться редко-значит процесс получения серной кислоты пошел. Со временем на электроде накопится много меди и нужно будет ее убрать, после чего снова включить ток. Раствор со временем будет бледнеть и в конечном результате он станет белым, а медь перестанет выделяться- значит ваша работа закончена и раствор медного купороса превратился в серную кислоту , которую можно слить и использовать по назначению. Если концентрация ее слабая для ваших потребностей-удалите лишнюю воду методом выпаривания.
Информация
Посетители, находящиеся в группе Гости, не могут оставлять комментарии к данной публикации.
Читайте также:

