Как сделать электронное строение серы
Добавил пользователь Алексей Ф. Обновлено: 19.09.2024
Сера является одним из распространенных химических элементов на нашей планете, который в прошлые эпохи сыграл важную роль в возникновении жизни. В настоящее время ее роль также остается важной не только для биологических процессов, протекающих в живых организмах, но и для развития индустрии и технологий. В статье приведены электронная формула серы, ее физические и химические свойства, а также влияние элемента на здоровье и окружающую среду.

Характеристики вещества
В периодической системе Д. И. Менделеева сера находится в третьем периоде и занимает клетку с номером 16. Эта цифра содержит полную информацию об электронной формуле элемента. Так, в ядре одного атома серы содержится 16 протонов. Количество нейтронов в большинстве случаев также составляет 16, однако, существую также другие стабильные изотопы, например, S33, S34 или S36. Где число указывает на атомную массу ядра. Изотоп S32 в образцах серы составляет 95%, 4% приходятся на стабильный изотоп S34.
Расположение в периодической таблице химических элементов позволяет записать электронную формулу рассматриваемого вещества. Поскольку сера находится в третьем периоде и VI группе, то ее атомы имеют три типа электронных уровней. Эти уровни обозначают латинскими символами, для серы это следующие:

Электронная формула обычно записывается так: S = [Ne] 3s2 3p4. То есть один атом S имеет внутреннюю электронную оболочку такую же, как у благородного газа неона. Внешняя оболочка содержит 6 электронов, из них 2 находятся на 3s уровне и полностью его заполняют, 4 расположены на трех 3p уровнях.
Записанная формула содержит ответ на вопрос о возможных степенях валентности. Поскольку 2 электрона на 3p уровнях не спарены, то оба они могут участвовать в образовании химических связей, то есть сера в этом случае будет проявлять валентность II. Если один из двух спаренных электронов 3p уровня перейдет на 3d, то рассматриваемый элемент будет проявлять валентность IV. Наконец, если удастся перебросить один электрон с уровня 3s на 3d, тогда получится шестивалентная сера.
Физические свойства

Рассматриваемый элемент относится к классу неметаллов, имеет желтый или оранжевый цвет, является мягким (по шкале Мооса относительная твердость равна 2), хрупким. Характерный запах серы знаком многим, в комбинации с водородом образуется газ H2S, который известен как неприятный запах тухлого яйца. Элемент способен окисляться до газообразного диоксида SO2. Этот процесс сопровождается горением с пламенем синего цвета. В воде растворимость S практически равна нулю. Средняя плотность твердой серы составляет 1,96 г/см3, то есть она практически в два раза плотнее жидкой воды.
Если вещество имеет одинаковый состав, но разное пространственное (графическое) строение, то говорят о наличии аллотропных модификаций. Сера их имеет несколько, причем их свойства и структура до конца еще не изучены в настоящее время. Особенностью этого элемента является то, что у него аллотропия наблюдается не только в твердом, но также в жидком и в газообразном агрегатных состояниях.
Твердая форма
Твердая сера представлена двумя стабильными кристаллическими решетками. Это следующие решетки:
- орторомбическая, или альфа-S;
- моноклинная, или бета-S.
Формула ромбической серы S8, она стабильна при температурах ниже 96 0C, если ее нагреть выше этого значения, то она плавно перестроится в моноклинную кристаллическую решетку бета-S. Разница в пространственном расположении атомов S в этих решетках приводит к тому, что некоторые их физические свойства начинают различаться. Например, орторомбическая сера является более пластичной при механических деформациях, чем моноклинная.
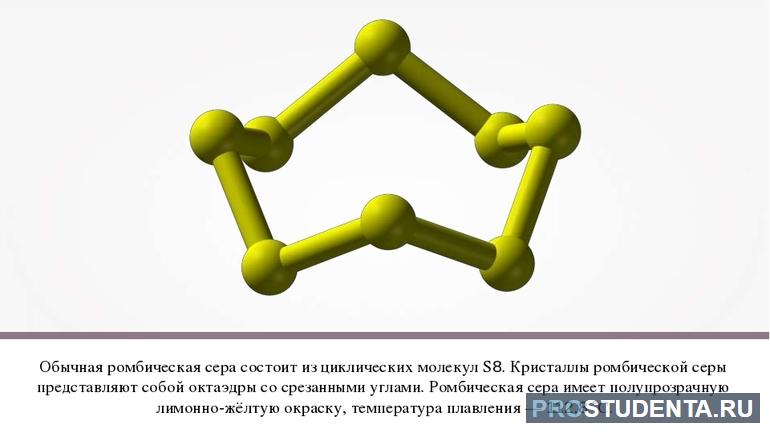
Отметим, что обе решетки имеют структурную одну и ту же единицу — это молекула S8, то есть 8 атомов S объединенных в замкнутую фигуру, которая представляет собой многоугольник в трех измерениях.
Аллотропия жидкости
Жидкая сера обладает удивительными физическими свойствами. Плавится моноклинная решетка при температуре 115 0C. Процесс плавления на атомном уровне заключается в разрушении устойчивых связей между кольцами S8 в твердой структуре. Расплав, структурной единицей в котором является молекула S8, обладает низкой вязкостью и высокой текучестью, он имеет желто-оранжевый цвет.

Дальнейший нагрев жидкой серы приводит к значительному уменьшению ее текучести и увеличению вязкости. При этом цвет вещества изменяется от оранжево-желтого к коричнево-красному. Эту трансформацию наука объясняет изменением молекулярной структуры. При увеличении температуры до 200 0C кольца S8 начинают разрушаться из-за воздействия температурного фактора. Разомкнутые остатки колец образуют длинные цепочки-молекулы, содержащие сотни и даже тысячи атомов S. Эти цепочки являются причиной снижения вязкости жидкости и появлению анизотропии в ее свойствах.
Если высокотемпературную жидкую серу резко охладить, например, вылить ее в холодную воду, то она перейдет в твердое состояние, основной характеристикой которого будет высокая пластичность. В отличие от стабильной и хрупкой альфа-S пластическая сера является метастабильным веществом, поэтому с течением времени при комнатной температуре из нее начинают выделяться орторомбические кристаллики.
Газообразное состояние
Проявляет свои удивительные свойства сера и в газообразном виде. Дело в том, что точка кипения ее находится при температуре 445 0C. Образующийся при этом газ имеет зеленый цвет и состоит из восьми атомных колец S8.
Дальнейшее увеличение температуры до 780 0C приводит к термическому разрушению этих колец и образованию диатомного газа S2, имеющего уже фиолетовый, а не зеленый цвет. Когда температура достигает значения 1800 0C, то уже никакой сложной структуры не наблюдается в газе. Он состоит исключительно из простых атомов серы и не имеет цвета.
Сера как химический элемент
Электронное атомное строение однозначно определяет химические свойства серы. Поскольку она может проявлять валентности II, IV и VI, то в своих соединениях она способна выступать как в роли окислителя, так и в роли восстановителя.
Примером окислительных реакций является образование сульфидов металлов, например, FeS или ZnS. Многие ученые считают, что на заре зарождения жизни на Земле именно окисление металлов серой сыграло главную роль в развитии живых организмов. Этот факт подтверждается рядом археологических находок в древних геологических пластах.

К восстановительным реакциям относительно серы можно назвать взаимодействия с такими сильными окислителями, как кислород или азот. При взаимодействии с O сера окисляется с образованием серного газа SO2. Он является основным компонентом в вулканических выбросах. Большой процент этого газа также содержится в выхлопах автомобилей при сгорании бензина и дизельного топлива. Если SO2 растворить в воде, то получается одна из самых сильных кислот — H2SO4, которая хорошо известна любителям не только химии, но и автомобилей, поскольку она является основным компонентом электролита в аккумуляторных батареях.
С азотом сера вступает в реакцию при определенных условиях с образованием соединения (SN)x. Оно представляет собой полимер, который впервые был получен в 1975 году. Особенностью этого нитрида является то, что он проявляет свойства металла, хотя состоит из двух неметаллических элементов.
Применение в индустрии
Сера используется во множестве индустриальных процессов и в конечных продуктах. Некоторые из них приводятся в списке:

Отрицательное влияние на здоровье
Несмотря на то что сера является одним из важных элементов для живых существ на Земле (она содержится в яйцах, масле чеснока, горчице, протеинах и др.), использование ее соединений должно осуществляться с соблюдением техники безопасности и максимально осторожно. Практически все соединения этого элемента являются токсичными для человека и животных. В общем случае выделяют следующие негативные эффекты от воздействия серных соединений:
- влияние на нервную систему и поведение;
- нарушение кровяного тока;
- вред для сердца;
- негативное воздействие на органы зрения и слуха;
- вред для иммунной системы;
- нарушения в работе кишечника и желудка;
- повреждение печени и почек;
- нарушения в работе гормонов
- отрицательное воздействие на кожу, легкие.
Например, при вдыхании паров, содержащих соединения с серой, происходит настолько сильное раздражение альвеол легких, что возникает обильное кровотечение. Это может привести к удушью и летальному исходу.

Другой пример — это кислотные дожди, которые раздражают зрение, кожные покровы и дыхательную систему животных. Причиной их возникновения является серный газ SO2, который в большом количестве выбрасывается в атмосферу в результате деятельности человека.
Сера S – элемент № 16, 3–й период, VIA группа (халькогены). Электронная конфигурация атома серы в стационарном состоянии 1s 2 2s 2 2p 6 3s 2 3p 4 :


Электронная формула атома серы:
Валентные возможности серы: II – в стационарном состоянии, IV (3s 2 3p 3 3d 1 ) и VI (3s 1 3p 3 3d 2 ) – в возбуждённом состоянии атома.
Наиболее характерными для серы являются следующие степени окисления:
0 – в простых веществах (ромбическая, пластическая сера);
–2 – в сероводороде Н2S и сульфидах (FeS, Na2S);
+4 – в оксиде серы (IV) SO2, сернистой кислоте Н2SO3 и её солях – сульфитах (K2SO3);
+6 – в оксиде серы (VI) S03, серной кислоте Н2SO4 и её солях – сульфатах (K2SO4).
Реже сера проявляет степени окисления:
–1 – в дисульфидах, например FeS2;
+1 – S2C12 – дихлорид дисеры или дихлорид серы (I);
+2 – SC12 – дихлорид серы или хлорид серы (II).
Высшим оксидом серы является оксид серы (VI) SO3 (серный ангидрид), его характер – кислотный. Высшим гидроксидом серы является серная кислота Н2SO4 – сильный электролит, нелетучая, стабильная двухосновная кислота. Водородным соединением серы является сероводород Н2S (газ при обычных условиях), его водный раствор – сероводородная кислота, двухосновная, слабый электролит.
Сера – простое вещество
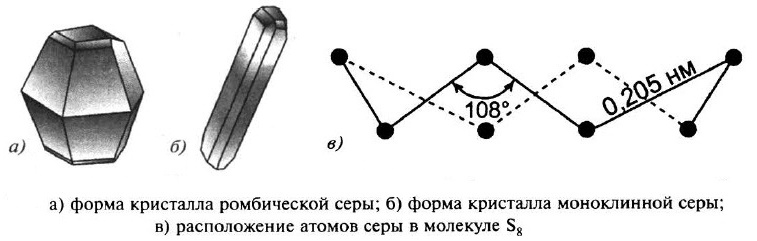
Наиболее прочны молекулы серы S8, имеющие форму короны.
Сeрa образует несколько аллотропных модификаций: ромбическая сера и моноклинная сера. Кристаллическая решётка в обоих случаях молекулярная, в узлах решётки – молекулы S8.
При выливании расплава серы в холодную воду образуется пластичная масса – пластическая сeрa, не имеющая кристаллического строения. Её макромолекулы образованы линейными цепями Sn. При хранении пластическая сера становится хрупкой, изменяет окраску и переходит в ромбическую модификацию.
Если медленно нагреть ромбические кристаллы выше 96 °С, то они превращаются в моноклинную модификацию. В обеих модификациях молекулы серы находятся в форме восьмичленных колец, но упакованы они по–разному. Переход ромбической серы в моноклинную при 96 °С является обратимым. При нагревании до 112 °С сера плавится, а составляющие кристаллическую решётку восьмичленные кольца разрываются, образуя молекулы с открытой цепью.
При обычных условиях сера – твёрдое кристаллическое вещество; кристаллы жёлтого цвета, хрупкие, лёгкие (р ≈ 2 г/см 3 ), легкоплавкие (t 0 пл ≈ 113°С для ромбической серы).
Для серы характерна окислительно-восстановительная двойственность: по отношению к металлам и водороду сера выступает в роли окислителя.

С водородом сера взаимодействует при нагревании с образованием сероводорода:

При обычных условиях серa взаимодействует со ртутью:
Сера используется для производства серной кислоты, в реакции вулканизации каучука, для производства инсектицидов, в косметической промышленности.
Читайте также:

