Как сделать углерод
Обновлено: 01.07.2024
У Углерод является химическим элементом таблицы Менделеева с атомным номером 6 и условным обозначением C. Углерод является неметаллическим веществом с 4 свободными электронами 14-ой группы периодической таблицы.
Как был открыт углерод
Такой химический элемент как углерод был известен людям еще с доисторических времен. Вероятно, он является самым древним химическим элементом, который известен людям. Этот элемент был известен доисторическим людям в форме золы и древесного угля. Об известности алмазов судить сложно, но есть вероятность того, что он был известен в Китае приблизительно в 2500 году до нашей эры. Есть сведения, что получение чистого углерода было уже во времена Римской империи. Его производство было такое же как и сейчас: нагревали дрова в пирамиде покрытой глиной, удалив воздух.
В 1722 году Рене Антуан Фершо де Реомюр продемонстрировал то, что железо превратилось в сталь в результате поглощения какого-то вещества, которое на сегодняшний день известно как углерод. Антуан Лавуазье в свою очередь доказал, что алмаз является одной из форм углерода в 1772 году. Он сжег образцы угля и алмаза у обнаружил, что ни один не образует воды и оба выпускают одинаковое количество углекислого газа.
Где и как добывают углерод

Углерод как химический элемент содержится в природе исключительно в виде соединений. Основными экономически важными углеродными соединениями являются графит и алмаз.
Распространенность графита в природе достаточно велика. Основнымти странами, которые приуспели в добыче графита являются Китай, Индия, Бразилия и Северная Корея. Графит обычно обнаруживается в связи с кварцем, слюдой полевыми штапами в песчаниках и известняках в виде жил и линз толщиной в 1 метр. На сегодняшний день классификация графита дробится на три части: аморфный, чешуйчатый и кусковой. Аморфный графит является самым распространенным, но с самым низким качеством и самым дешевым. Этот вид графита используется для изделий с низкой стоимостью. Крупные залежи аморфного гранита имеются в Китае, Европе, Мексике и США.
Чешуйчатый графит является более редким и более качественным по сравнению с аморфным. Его извлекают из горных попод в виде пластин. Чешуйчатый графит, обычно, раза в 4 дороже чем аморфный. Основные месторождения этой разновидности находятся в Австрии, Бразилии, Канаде, Китае, Германии и на острове Мадагаскар.
Кусковой графит является самым ценным, самым редким и качественным видом природного графита. Он был найден в жилах интрузивных контактов в твердых породах. Единственное место в мире, где его добывают является Шри-Ланка.
Еще одним экономически важным углеродным соединением является алмаз. Он является редким и очень ценным аллотропом углерода. Алмазы добываются из алмазной руды, но в самой руде не каждый камень является алмазом. Россия является лидером по производству алмазов, как драгоценных камней, в мире. К сведению один карат, а он равняется 0.2 грамма, оценивается приблизительно в 90$ США.
Распространенность углерода

Углерод является довольно распространенным химическим элементом. Если говорить про вселенский масштаб, то можно отметить, что он занимает почетное 4 место в распространенности по массе. Его опережают только водород, гелий и кислород. Что же касается земной коры, он занимает 15 место в списке самых распространенных элементов. Если брать человеческий организм, как масштаб распространенности, то углерод занимает второе место после кислорода и составляет около 18%. Как уже говорилось выше, углерод на нашей планете не встречается в свободной форме. Он встречается в природе в виде различных соединений, причем этих соединений огромное множество. Углерод является неотъемлемой частью жизни на Зелмле. Основными формами углеродосодержащих элементов являются твердые аллотропы, известняки, доломиты и углекислый газ. Большая часть углеродосодержащих элементов приходится на месторождение угля, нефти, торфа и природного газа.
Применение углерода

Углерод необходим для всех известных живых систем, и без него жизнь, как мы знаем, не могла бы существовать. Разнообразие его применения наверное самое большое из всех элементов таблицы Менделеева. Основное экономическое использование углерода, кроме продовольствия и древесины, приходится на природные углеводороды. К ним относится ископаемое топливо, природный газ и нефть. Углерод входит в состав почти всех повседневных вещей жизнедеятельности человека. К примеру все пластмассовые и металлические изделия, а так же шерсть, кашемир, шелк и многое другое. Сажа входит состав красок для печатных устройств. Углерод содержится во многих медицинских препаратах, самый яркий пример активированный уголь. Углерод является составной частью всех резиновых изделий. Кокс используется для превращения руды в железо, а обогащение углеродом делает из железа сталь. Поэтому все металлические предметы содержат атомы углерода. В ядерной промышленности углерод используется как замедлитель нейтронов, или изотоп углерода как топливо.
Интересные факты

Важная область практического применения новейших открытий в области физики, химии и даже астрономии — создание и исследование новых материалов с необычными, подчас уникальными свойствами. О том, в каких направлениях ведутся эти работы и чего уже сумели добиться ученые, мы расскажем в серии статей, созданных в партнерстве с Уральским федеральным университетом. Первый наш текст посвящен необычным материалам, которые можно получить из самого обычного вещества — углерода.
Наша статья посвящена многообразным обличьям этого элемента: оказывается, только из его атомов можно построить десятки различных материалов — от графита до алмаза, от карбина до фуллеренов и нанотрубок. Хотя все они состоят из абсолютно одинаковых атомов углерода, их свойства радикально отличаются — а главную роль в этом играет расположение атомов в материале.
Графит
Чаще всего в природе чистый углерод можно встретить в форме графита — мягкого черного материала, легко расслаивающегося и словно скользкого на ощупь. Многие могут вспомнить, что из графита делаются грифели карандашей — но это не всегда верно. Часто грифель делают из композита графитовой крошки и клея, но встречаются и полностью графитовые карандаши. Интересно, но на карандаши уходит больше одной двадцатой всей мировой добычи естественного графита.
Чем необычен графит? В первую очередь, он хорошо проводит электрический ток — хотя сам углерод и не похож на другие металлы. Если взять пластинку графита, то окажется, что вдоль ее плоскости проводимость примерно в сто раз больше, чем в поперечном направлении. Это напрямую связано с тем, как организованы атомы углерода в материале.
Отдельные слои соединяются между собой благодаря ван-дер-ваальсовым силам — они гораздо слабее, чем обычная химическая связь, но достаточны для того, чтобы кристалл графита не расслаивался самопроизвольно. Такое несоответствие приводит к тому, что электронам гораздо сложнее перемещаться перпендикулярно плоскостям — электрическое сопротивление возрастает в 100 раз.
Благодаря своей электропроводности, а также возможности встраивать атомы других элементов между слоями, графит применяется в качестве анодов литий-ионных аккумуляторов и других источников тока. Электроды из графита необходимы для производства металлического алюминия — и даже в троллейбусах используются графитовые скользящие контакты токосъемников.
Кроме того, графит — диамагнетик, причем обладающий одной из самых высоких восприимчивостей на единицу массы. Это означает, что если поместить кусочек графита в магнитное поле, то он всячески будет пытаться вытолкнуть это поле из себя — вплоть до того, что графит может левитировать над достаточно сильным магнитом.
И последнее важное свойство графита — невероятная тугоплавкость. Самым тугоплавким веществом на сегодняшний день считается один из карбидов гафния с температурой плавления около 4000 градусов Цельсия. Однако если попытаться расплавить графит, то при давлениях около ста атмосфер он сохранит твердость вплоть до 4800 градусов Цельсия (при атмосферном давлении графит сублимирует — испаряется, минуя жидкую фазу). Благодаря этому материалы на основе графита используют, например, в корпусах ракетных сопел.
Алмаз
Многие материалы под давлением начинают менять свою атомарную структуру — происходит фазовый переход. Графит в этом смысле ничем не отличается от других материалов. При давлениях в сто тысяч атмосфер и температуре в 1–2 тысячи градусов Цельсия слои углерода начинают сближаться между собой, между ними возникают химические связи, а когда-то гладкие плоскости становятся гофрированными. Образуется алмаз, одна из самых красивых форм углерода.
Свойства алмаза радикально отличаются от свойств графита — это твердый прозрачный материал. Его чрезвычайно сложно поцарапать (обладатель 10-ки по шкале твердости Мооса, это максимум твердости). При этом электропроводность алмаза и графита отличается в квинтиллион раз (это число с 18 нулями).
углерод в природе это может быть найдено в алмазах, нефти и граффити, среди многих других сценариев. Этот химический элемент занимает шестое место в периодической таблице и находится в горизонтальном ряду или периоде 2 и столбце 14. Он неметаллический и четырехвалентный; то есть вы можете установить 4 химические связи общих электронов или ковалентных связей.
Углерод - это элемент с наибольшим изобилием в земной коре. Это изобилие, его уникальное разнообразие в образовании органических соединений и его исключительная способность образовывать макромолекулы или полимеры при температурах, обычно встречающихся на Земле, делают его общим элементом всех известных форм жизни.

Углерод существует в природе как химический элемент без объединения в форме графита и алмаза. Тем не менее, по большей части он объединяется с образованием химических соединений углерода, таких как карбонат кальция (CaCO).3) и другие соединения в нефти и природном газе.
- 1 Где находится углерод и в какой форме?
- 1.1 Кристаллические формы
- 1.2 Аморфные формы
- 1.3 Нефть, природный газ и битум
- 2.1 Химический символ
- 2.2 Атомный номер
- 2.3 Физическое состояние
- 2,4 Цвет
- 2.5 Атомная масса
- 2.6 Точка плавления
- 2.7 Точка кипения
- 2.8 Плотность
- 2.9 Растворимость
- 2.10 Электронная конфигурация
- 2.11 Количество электронов во внешнем или валентном слое
- 2.12 Емкость канала
- 2.13 Катенасьон
- 3.1 Фотосинтез
- 3.2 Дыхание и разложение
- 3.3 Геологические процессы
- 3.4 Вмешательство человеческой деятельности
- 4.1 Нефть и природный газ
- 4.2 Графит
- 4.3 Алмаз
- 4.4 Антрацит
- 4.5 каменный уголь
- 4.6 лигнит
- 4.7 Торф
Где находится углерод и в какой форме?
Помимо того, что он является химическим компонентом, общим для всех форм жизни, углерод в природе присутствует в трех кристаллических формах: алмаз, графит и фуллерен..
Есть также несколько аморфных минеральных форм угля (антрацит, лигнит, уголь, торф), жидких форм (разновидности масел) и соды (природный газ)..
Кристаллические формы
В кристаллических формах атомы углерода объединяются, образуя упорядоченные структуры с геометрическим пространственным расположением.
графит
Это мягкий сплошной черный цвет с блеском или металлическим блеском теплостойким (огнеупорным). Его кристаллическая структура представляет собой атомы углерода, соединенные в гексагональные кольца, которые, в свою очередь, соединяются вместе, образуя листы.
Месторождения графита редки и были обнаружены в Китае, Индии, Бразилии, Северной Корее и Канаде..
бриллиант
Это очень твердое твердое вещество, прозрачное для прохождения света и намного более плотное, чем графит: значение плотности алмаза эквивалентно почти в два раза больше, чем у графита.
Атомы углерода в алмазе соединяются в тетраэдрической геометрии. Аналогично, алмаз сформирован из графита, подвергнутого условиям очень высоких температур и давлений (3000 ° С и 100 000 атм).
Большая часть алмазов находится на глубине от 140 до 190 км в мантии. Через глубокие извержения вулканов магма может переносить их на расстояния, близкие к поверхности.
Алмазные месторождения имеются в Африке (Намибия, Гана, Демократическая Республика Конго, Сьерра-Леоне и Южная Африка), Америке (Бразилия, Колумбия, Венесуэла, Гайана, Перу), Океании (Австралия) и Азии (Индия)..
![]()
фуллерены
Это молекулярные формы углерода, которые образуют кластеры из 60 и 70 атомов углерода в почти сферических молекулах, похожих на футбольные мячи.
Есть также фуллерены, меньшие, чем 20 атомов углерода. Некоторые формы фуллеренов включают углеродные нанотрубки и углеродные волокна.
![]()
Аморфные формы
В аморфных формах атомы углерода не объединяются, образуя упорядоченную и правильную кристаллическую структуру. Вместо этого они даже содержат примеси от других элементов.
антрацит
Это самый старый метаморфический минеральный уголь (который происходит от модификации горных пород под воздействием температуры, давления или химического воздействия жидкостей), поскольку его образование относится к первичной или палеозойской эре, каменноугольному периоду..
Антрацит - это аморфная форма углерода, в которой содержание этого элемента выше: от 86 до 95%. Серо-черный и металлический глянец, тяжелый и компактный.
Как правило, антрацит находится в зонах геологической деформации и составляет приблизительно 1% мировых запасов угля..
Географически он встречается в Канаде, США, Южной Африке, Франции, Великобритании, Германии, России, Китае, Австралии и Колумбии..
![]()
Каменный уголь
Это минеральный уголь, осадочная порода органического происхождения, образование которой относится к эпохам палеозоя и мезозоя. Содержание углерода составляет от 75 до 85%..
Это черный, он характеризуется непрозрачностью и имеет матовый и жирный вид, так как он содержит большое количество битумных веществ. Образуется при сжатии лигнита в палеозойскую эру, в каменноугольный и пермский периоды..
Это самая распространенная форма угля на планете. В Соединенных Штатах, Великобритании, Германии, России и Китае имеются крупные месторождения угля..
бурый уголь
Это ископаемый минеральный уголь, образовавшийся в третичном возрасте из торфа при сжатии (высокие давления). Он имеет более низкое содержание углерода, чем уголь, от 70 до 80%.
Это немного компактный материал, рассыпчатый (характеристика, которая отличает его от других углеродных минералов), коричневый или черный. Его текстура похожа на древесину, а содержание углерода колеблется от 60 до 75%..
Это топливо с легким воспламенением, с низкой теплотворной способностью и более низким содержанием воды, чем торф.
В Германии, России, Чехии, Италии (в регионах Венето, Тоскана, Умбрия) и Сардинии имеются важные шахты с бурым углем. В Испании месторождения лигнита находятся в Астурии, Андорре, Сарагосе и Ла-Корунья.
торф
Это материал органического происхождения, образование которого происходит из четвертичной эры, гораздо более поздней, чем предыдущие угли..
Это коричневато-желтый цвет и выглядит как губчатая масса низкой плотности, в которой вы можете увидеть остатки растений от того места, где они произошли.
В отличие от перечисленных выше углей, торф не происходит в результате процессов карбонизации древесного материала или дерева, а образуется в результате скопления растений - в основном трав и мхов - в болотистых районах в результате процесса карбонизации, который еще не завершен..
Торф имеет высокое содержание воды; по этой причине требует использования сушки и уплотнения перед использованием.
Имеет низкое содержание углерода (всего 55%); следовательно, он имеет низкую энергетическую ценность. Когда он подвергается сгоранию, его остаток золы в изобилии и выделяет много дыма.
Существуют важные месторождения торфа в Чили, Аргентине (Огненная Земля), Испании (Эспиноса-де-Серрато, Паленсия), Германии, Дании, Голландии, России, Франции..
![]()
Нефть, природный газ и битум
Он образовался в недрах, на больших глубинах и в особых условиях, как физических (высокие давления и температуры), так и химических (присутствие определенных каталитических соединений) в процессе, который занял миллионы лет.
Во время этого процесса C и H высвобождались из органических тканей и снова объединялись, образуя огромное количество углеводородов, которые смешиваются в соответствии с их свойствами, образуя природный газ, нефть и битум..
Нефтяные месторождения планеты расположены в основном в Венесуэле, Саудовской Аравии, Ираке, Иране, Кувейте, Объединенных Арабских Эмиратах, России, Ливии, Нигерии и Канаде..
Есть запасы природного газа в России, Иране, Венесуэле, Катаре, Соединенных Штатах, Саудовской Аравии и Объединенных Арабских Эмиратах, среди других..
Физико-химические свойства
Среди свойств углерода можно отметить следующие:
Химический символ
С.
Атомный номер
6.
Физическое состояние
Твердый, при нормальных условиях давления и температуры (1 атмосфера и 25 ° C).
цвет
Серый (графит) и прозрачный (алмаз).
Атомная масса
Точка плавления
Точка кипения
плотность
растворимость
Нерастворим в воде, растворим в четыреххлористом углероде CCl4.
Электронная конфигурация
Количество электронов во внешнем слое или валентности
4.
Пропускная способность
4.
сцепление
Обладает способностью образовывать химические соединения в длинных цепях..
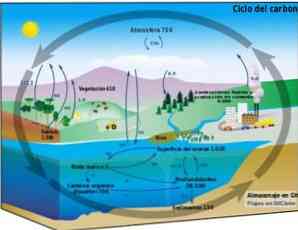
Биогеохимический цикл
Углеродный цикл представляет собой круговой биогеохимический процесс, посредством которого углерод может обмениваться между биосферой, атмосферой, гидросферой и земной литосферой..
Знание этого циклического углеродного процесса на Земле позволяет продемонстрировать действия человека в этом цикле и его последствия для глобального изменения климата..
Углерод может циркулировать между океанами и другими водоемами, а также между литосферой, почвой и недрами, атмосферой и биосферой. В атмосфере и гидросфере углерод существует в газообразной форме в виде СО2 (углекислый газ).
фотосинтез
Углерод в атмосфере поглощается наземными и водными организмами экосистем (фотосинтезирующими организмами)..
Фотосинтез позволяет химической реакции между СО происходить2 и вода, опосредованная солнечной энергией и хлорофиллом из растений, для производства углеводов или сахаров. Этот процесс превращает простые молекулы с низким содержанием энергии CO2, H2O и кислород O2, в сложных молекулярных формах высокой энергии, которые являются сахарами.
Гетеротрофные организмы, которые не могут осуществлять фотосинтез и являются потребителями в экосистемах, получают углерод и энергию при питании самих производителей и других потребителей..
Дыхание и разложение
Дыхание и разложение - это биологические процессы, которые выделяют углерод в окружающую среду в форме CO2 или СН4 (метан образуется при анаэробном разложении, то есть в отсутствие кислорода).
Геологические процессы
В результате геологических процессов и, как следствие, с течением времени, углерод анаэробного разложения может превращаться в ископаемое топливо, такое как нефть, природный газ и уголь. Кроме того, углерод также является частью других минералов и горных пород..
Вмешательство человеческой деятельности
Когда человек использует сжигание ископаемого топлива для получения энергии, углерод возвращается в атмосферу в виде огромных количеств СО2 которые не могут быть ассимилированы естественным биогеохимическим циклом углерода.
Это избыток СО2 вызванный деятельностью человека отрицательно влияет на баланс углеродного цикла и является основной причиной глобального потепления.
![]()
приложений
Использование углерода и его соединений чрезвычайно разнообразно. Наиболее выдающийся со следующим:
Нефть и природный газ
Основное экономическое использование углерода заключается в его использовании в качестве углеводородного ископаемого топлива, такого как газообразный метан и нефть..
Масло перегоняется на нефтеперерабатывающих заводах для получения различных производных, таких как бензин, дизельное топливо, керосин, асфальт, смазочные материалы, растворители и другие, которые, в свою очередь, используются в нефтехимической промышленности, которая производит сырье для пластмасс, удобрений, фармацевтической и лакокрасочной промышленности. среди прочих.
графит
Графит используется в следующих действиях:
- Используется при изготовлении карандашей, смешанных с глинами.
- Это часть производства огнеупорных кирпичей и тиглей, термостойких.
- В различных механических устройствах, таких как шайбы, подшипники, поршни и прокладки.
- Это отличная твердая смазка.
- Из-за его электрической проводимости и его химической инертности, он используется в производстве электродов, углей электродвигателей..
- Используется в качестве модератора на атомных электростанциях.
бриллиант
Алмаз обладает особенно исключительными физическими свойствами, такими как более высокая степень твердости и теплопроводность, известные до сих пор..
Эти особенности позволяют промышленное применение в инструментах, используемых для резки и полировки инструментов для их высокой абразивности.
Его оптические свойства, такие как прозрачность и способность расщеплять белый свет и преломлять свет, дают ему множество применений в оптических приборах, например, в производстве линз и призм..
Характерная яркость, полученная из его оптических свойств, также очень ценится в ювелирной промышленности..
антрацит
Антрацит с трудом поджигается, медленно горит и требует много кислорода. Его сгорание производит небольшое пламя бледно-синего цвета и выделяет много тепла.
Несколько лет назад антрацит использовался в термоэлектростанциях и для отопления домов. Его использование имеет такие преимущества, как производство небольшого количества золы или пыли, небольшое количество дыма и медленный процесс сгорания..
Из-за высокой экономической стоимости и дефицита антрацит был заменен природным газом на термоэлектростанциях и электроэнергией в домах..
Каменный уголь
Уголь используется в качестве сырья для получения:
- Кокс, топливо из доменных печей сталелитейных заводов.
- Креозот, полученный путем смешивания смолистых дистиллятов из каменного угля и используемый в качестве защитного герметика для древесины, подверженной атмосферным воздействиям.
- Крезол (химически метилфенол) извлекают из угля и используют в качестве дезинфицирующего и антисептического средства,
- Другие производные, такие как газ, смола или смола, а также соединения, используемые в производстве парфюмерии, инсектицидов, пластмасс, красок, шин и дорожных покрытий, среди прочих.
бурый уголь
Лигнит представляет собой топливо среднего качества. Струя, разновидность лигнита, характеризуется очень компактным из-за длительного процесса карбонизации и высокого давления и используется в ювелирном деле и украшении..
Углерод может существовать по крайней мере в шести кристаллических формах, не считая недавно синтезированных фуллеренов. Это α- и β-графит, алмаз, лонедейлит (гексагональный алмаз), чаоит и углерод(VI). При нормальных температуре и давлении наиболее термодинамически устойчив α-графит (гексагональный). Модификации различаются либо по координационному окружению атомов углерода, либо по порядку расположения слоев в кристалле. Эти различия оказывают существенное влияние и на физические, и на химические свойства углерода.
Атомы углерода в графите образуют плоские гексагональные слои:
![графит]()
В обычном α-графите слои чередуются в порядке •••ABAB•••, причем атомы углерода в слоях через один расположены друг над другом. В β-графите слои располагаются в порядке •••ABCABC•••. В обеих формах расстояние C-C внутри слоя равно 0,1415 нм, расстояние между слоями значительно больше - 0,3354 нм. Эти две формы переходят друг в друга при растирании (α→β) иди при нагревании выше 1025°С (β→α). Частичное превращение приводит к увеличению среднего расстояния между слоями; оно достигает максимума в 0,344 нм в турбостратическом графите, в котором чередование слоев носит случайный характер. Разница энтальпий образования α- и β-форм составляет всего 0,59±0,17 кДж•моль -1 .![алмаз]()
Структура алмаза, демонстрирующая тетраэдрическую координацию атомов С; пунктирными линиями обозначена кубическая элементарная ячейка, содержащая 8 атомов углерода.
В алмазе каждый атом углерода тетраэдрически окружен четырьмя равноудаленными соседними атомами углерода с межатомным расстоянием 0,15445 нм; тетраэдры образуют кубическую элементарную ячейку с параметром a0=0,35668 нм.
Две другие кристаллические формы углерода были открыты недавно. Чаоит, новая аллотропная модификация белого цвета, была впервые обнаружена в 1968 г. в графитовом гнейсе, сплавленном под ударом (Исполинский кратер, Бавария). Чаоит может быть получен искусственно в виде белых дендритов гексагональной симметрии путем возгонки пирографита в условиях свободного испарения при температуре выше ~2000°С и низком давлении (~10 -4 мм рт. ст.). Кристаллы имеют 0,5 мкм в толщину и 5-10 мкм в длину; параметры ячейки до = 0,8945 нм, c0 = 1,4071 нм, dрасч = 3,43 г·см -3 . Наконец, в 1972 г. вместе с чаоитом была получена новая аллотропная форма углерода - гексагональный углерод(VI). Он был получен при нагревании графита до ~2300 °С под действием электрического тока или облучения. Процесс осуществляли в атмосфере аргона при практически любом давлении в диапазоне от 10 -4 мм рт. ст. до 1 атм; лазерное облучение было даже более эффективно (параметры кристаллов a0 = 0,533 нм, c0 =1,22 нм, d > 2,9 г·см -3 ). Структуры чаоита и углерода(VI) еще до конца не изучены; полагают, что они включают цепочки типа карбина -C=C-C=C-. Обе эти модификации значительно более устойчивы к окислению и восстановлению, чем графит, по свойствам они ближе к алмазу. В настоящее время существует предположение, что в диапазоне от условий существования стабильного графита до его температуры плавления существует последовательность по крайней мере из шести стабильных аллотропных форм карбина.
Физические свойства
Модификация алмаз графит Молярная масса, г/моль 12,011 Температура плавления, °C 4440 (12,4 ГПа) 4489 (10,3 ГПа) Температура кипения, °C 3825 сублимация Плотность, г/см 3 3,513 2,2
Химические свойства и методы получения
Аморфный углерод
Аморфный углерод, получаемый в промышленности и в лабораториях, обычно содержит соединения углерода (с атомами H, O, N, S), зольные компоненты и адсорбированные газы или пары. Углерод очень высокой чистоты необходим при работах с высоковакуумной аппаратурой.
Для обычиых целей достаточно чистоты углерода 99%. Этому требованию отвечают коксующиеся угли, сажа, активированный уголь и графит, очищенные с помощью следующих методов.
Очистка от зольных компонентов. Многократное кипячение с разб. HNO3; прокаливание в потоке хлора при 900-1000°С; обработка плавиковой кислотой для удаления силикатов; многочасовое прокаливание при 2000-3000 *С в вакууме, в атмосфере СО или инертных газов (при этом происходит, правда, изменение структуры - графитизация, т. е. переход к структуре графита).
Для разрушения кислородсодержащих соединений, адсорбированных на поверхности, препарат углерюда выдерживают при 1000°С; при этом кислород удаляется в виде CO или CO2.
Очистка от адсорбированных газов и паров. Необходимо иметь в виду, что активированный углерод при комнатной температуре может адсорбировать CO2, H2O и другие газы в количествах до нескольких процентов (по массе). Для очистки необходимо нагревание в течение нескольких часов при 300°С в высоком вакууме.
Препараты углерода для специальных целей
Сажа из монооксида углерода. Интерес, проявляемый к этому препарату, вызван тем, что сажа используется для выращивания кристаллов графита среднего размера, которые лишь незначительно слипаются в более крупные агрегаты. Для получения препарата над тонкодисперсным чистым железом (например, из карбонилов железа) пропускают CO при 400-700 °С. В зависимости от температуры получают кристаллы определенного размера: ~5 нм (400°С), ~10 нм (500°С), 20 нм (700°С). Следует иметь в виду, что соединения железа, загрязняющие препараты, удается удалить дополнительной очисткой.
Графитированная сажа. При многочасовом прокаливании сажи при 2000-3000°С в вакууме или в атмосфере инертного газа образуется графитированная сажа, в которой содержится определенное количество кристаллов графита, незначительно отличающихся по размеру от частиц исходной сажи (из газовой сажи вырастают кристаллы (термическая сажа) размером ~20 нм, из пламенной сажи ~50-200 нм, из термакса ~30 нм). Возникшие кристаллы графита имеют форму полиэдров, состоящих из нескольких сросшихся вершинами пирамид; грани полиэдра образованы базисными плоскостями (001) графита.
Сажа из оксида графита состоит из тончайших графитовых чешуек толщиной ~2-5 нм, диаметр которых может доходить до нескольких сотых долей миллиметра, что зависит от природы исходного графита. Для получения этой сажи графит оксидируют. Оксид графита разлагается при быстром нагревании до 300-400 °С. Поскольку при этом освобождается кислород, связанный в виде CO и CO2 в оксиде графита, не исключено, что в решетке графита возникают пустоты атомарных размеров.
Хороший продукт с подобными свойствами можно получить по следующей методике. Щелочную суспензию оксида графита восстанавливают гидроксиламином при 80°С. Чтобы предотвратить слипание чешуек сажи при фильтровании и высушивании, обессоленную путем диализа суспензию вымораживают.
Сажа, полученная по обеим методикам, содержит всего ~80% C (наряду с O, H и другими примесями). Для очистки продукт можно тотчас подвергнуть коксованию, а также освободить от зольных компонентов.
Блестящий углерод. Хрупкая фольга (пленка) с совершенной отражательной поверхностью; образуется в результате ориентации базисных плоскостей кристаллического графита параллельно плоскости фольги. Диаметр кусочков фольги может достигать нескольких сантиметров, а толщина - десятых долей миллиметра. Пленки из блестящего углерода, нанесенные на керамический материал, используются в качестве высокоомных сопротивлений. Размер кристаллов составляет ~2,5 нм.
Блестящий углерод получают путем разложения углеводородов (крекинга) при низком давлении (например, паров пропана при ~10 мм рт. ст.) или паров бензина, разбавленных азотом (через бензин при комнатной температуре пропускают N2). Разложение производят на гладких поверхностях (например, фарфор или кварц) при 800—1000°С. Целесообразно к углеводороду добавлять немного O2 или водяных паров для того, чтобы избежать потерь наиболее реакционноспособного углерода из-за осаждения на шероховатой поверхности. По достижении толщины нескольких сотых миллиметра пленки углерода отслаиваются сами (их легко также отделить после охлаждения). Покрытие лучшего качества получается на не совсем гладких поверхностях.
Получение пленки из графита
Способ 1. Золь, приготовленный путем встряхивания или перемешивания 1-2 г оксида графита в 100 г воды, концентрируют путем испарения. При этом на дне сосуда образуется пленка оксида графита. При очень медленном и осторожном нагревании происходит выделение CO, CO2 и H2O. При 1000°С образуется пленка графита, которая, однако, содержит несколько процентов кислорода и водорода. Размеры полученной пленки и ее толщина соответствуют размерам исходной пленки из оксида графита; их можно регулировать, изменяя количество и концентрацию взятого золя оксида графита, а также размеры сосуда, в котором производили концентрирование последнего. Можно получить пленку графита с поверхностью, например, 50 см 2 .
Способ 2. Очень чистую графитовую пленку можно получить при многочасовом отжиге фольги блестящего графита в вакууме или в атмосфере CO при 2000-3000 °С. Размеры полученной пленки такие же, как исходной из блестящего углерода, например 1 см в диаметре.
Активированный уголь. Получение
Повышение адсорбционной способности достигается разрыхлением кристаллической структуры углерода путем осторожного окисления. Углерод с высокой адсорбционной способностью при комнатной температуре, например, при контакте с полунасыщенным паром тетрахлорида углерода адсорбирует количество CCl4, равное собственной массе угля.
Разрыхление проще всего провести путем отжига в потоке CO2 или водяных паров при 950°С; отжиг продолжают до тех пор, пока углерод не выгорит наполовину. Для этого следует медленно пропускать CO2 над углеродом, распределенным тонким слоем в лодочке. Можно рекомендовать дополнительную очистку от адсорбированного CO2 или H2O путем многочасового нагревания при 300°С в высоком вакууме. При доступе воздуха на поверхности образуются оксиды, которые можно удалить при коксовании.
wikiHow работает по принципу вики, а это значит, что многие наши статьи написаны несколькими авторами. При создании этой статьи над ее редактированием и улучшением работали авторы-волонтеры.
CO2 служит химическим символом для диоксида углерода. Это соединение вызывает шипение в газированной воде и многих алкоголесодержащих напитках, способствует разбуханию хлеба, выступает движущей силой для ряда аэрозолей, и является важной составляющей огнетушительной смеси. CO2 можно получить специально, либо в качестве побочного продукта других химических реакций.
![Изображение с названием Make CO₂ Step 01]()
- Если вы хотите получить CO2 для того, чтобы пополнить запасы диоксида углерода в аквариуме, такой бутылки будет как раз достаточно для 100-литрового (около 25 галлонов) аквариума.
![Изображение с названием Make CO₂ Step 02]()
Насыпьте в бутылку 2 чашки (473,18 мл) сахара. При этом используйте нерафинированный сахар, в котором содержится большее количество сложных соединений, и поэтому распад дрожжей займет более длительное время. Кроме того, нерафинированный сахар дешевле.
![Изображение с названием Make CO₂ Step 03]()
Залейте в бутылку теплую воду до того уровня, где бутылка начинает сужаться к горлышку. Используйте теплую воду из-под крана; не заливайте горячую воду, так как она погубит дрожжевые грибки.
![Изображение с названием Make CO₂ Step 04]()
Добавьте в бутылку 1/2 чайной ложки (2,46 мл) гидрокарбоната натрия. Это вещество является основным ингредиентом пищевой соды, которую легко можно приобрести в магазине.
![Изображение с названием Make CO₂ Step 05]()
- Примером дрожжевого экстракта может служить мармит, производимый в Великобритании. Из других экстрактов можно упомянуть веджимайт, боврил, ценомис.
![Изображение с названием Make CO₂ Step 06]()
Засыпьте 1/3 чайной ложки (1,64 мл) дрожжей. Пивные дрожжи бродят дольше, чем хлебные, но для наших целей будет достаточно и хлебных дрожжей, к тому же они дешевле.
![Изображение с названием Make CO₂ Step 07]()
![Изображение с названием Make CO₂ Step 08]()
Взболтайте бутылку, пока дрожжи и сахар не растворятся. На поверхности воды должна появиться небольшая пена.
Читайте также: