Как сделать сжатое олово
Добавил пользователь Владимир З. Обновлено: 05.10.2024
Разделение припоя на олово и свинец, с целью получения относительно чистого олова.
К катоду присоединил припой, анодом служит грифель, электролит медный купорос. Подождал пока весь купорос заместиться на SnSO4. На аноде вся медь выделилась, а после нее вместо должного олова начала выделяться какета черная "бурда" в виде губки. Наверное это SnO но я не уверен.
А с чего ты решил, что олово не выделяется?) )
Скорее всего, "черная бурда" - это оно и есть. Многие металлы в мелкодисперсном состоянии по внешнему виду не совсем похожи сами на себя. Попробуй переплавить эту "бурду".
Есть способ попроще. Олово можно выделить из консервных банок - они покрыты им изнутри для защиты стали от окисления. Банка - анод, катод - графитовый стержень. Электролит - гидроксид натрия, на худой конец простая сода.
Чтобы получить больше олова, на дно банки можно набросать еще нарезанных кусков от других банок.
Р. S. В домашних условиях раствор гидроксида натрия можно получить, прокипятив раствор соды с гашеной известью. После кипячения нужно отделить осадок карбоната кальция.
Кстати, оловом покрывают сейчас не все банки, существуют и другие виды покрытий. Различия легко определяются по внешнему виду.
С помощью медного купороса можно восстановить только медь из оксида меди, чтобы восстановить (получить) олово, нужна восстановительная среда именно для олова. (скорее всего станум хлор два)

Вы можете написать сейчас и зарегистрироваться позже. Если у вас есть аккаунт, авторизуйтесь, чтобы опубликовать от имени своего аккаунта.
Примечание: Ваш пост будет проверен модератором, прежде чем станет видимым.
Последние посетители 0 пользователей онлайн

Вы на 100 % уверены? что Германия? мерседесы и в Турции делают и в России. . Плов придумал Шеф повар - А. Македонского. = Ну не було у него электрической плиты. - и вкусно получилось = на века.




в немецкой плитке гореньё китайскый выключатель? да сам ты перегрелся. ты хочешь сказать что в контакторах за полторы тыщи рупий на контахтах золото-брилянты? и иэковскых автоматиках 100а за 200р тож на контахтных групах палладий?

Так и не понял, из-за чего весь сыр-бор: мощность плиты воистину запредельная, токи под 40 А, китайский выключатель. Как оно вообще может не гореть/не плавиться, если одна печь потребляет столько же, как целый четырехквартирный дом на моей улице?

2586
Многим радиолюбителям известно, как сделать припой для пайки. Для этого нужно знать характеристики припоев и соотношение элементов. В качестве сырья могут использоваться металлический бой или отработанные детали из приборов, батареек, монет и т. д. Что можно использовать в качестве припоя, и где найти вещества:
- Олово можно снять с лампочки или плат старой ненужной техники. Тонким слоем покрываются стенки пищевых банок, крышек.
- Свинец находится в чистом состоянии в аккумуляторах, кабелях, автомобильных дисках.
В качестве припоев используются легкоплавкие металлы (относительно температуры плавления соединяемых деталей). В основном это двухкомпонентные сплавы, реже 3-составные. Основное значение имеет соотношение этих элементов: при повышении содержания в составе более легкоплавкого металла, понижается температура плавления, и наоборот. Как сделать серебряный припой в домашних условиях, самый тугоплавкий из всех существующих, расскажем в статье.

Разновидности и особенности припоев ![]()
Важно! Легкоплавкие припои до 450° С наносятся при помощи паяльника, тугоплавкие (до 1100°С) сплавляются газовой горелкой.
Во избежание порчи изделия, можно узнать, как сделать припой в домашних условиях. Существует 3 основных типа.
Большая доля припоев, используемых для пайки радиоэлектроники, изготавливается на основе олова. Вторым и обязательным компонентом является свинец. В зависимости от пропорций отличаются свойства припоя: чем больше содержания свинца, тем выше температура плавления. Для повышения прочности и температуры плавления, в припой может быть добавлен третий элемент: кадмий, сурьма.
Бессвинцовые припои — это новая разработка химиков. Такие припои изготавливаются на основе олова, но с добавлением серебра, кадмия, цинка, меди, алюминия. Все припои на основе олова отличаются высокой адгезией с металлическими поверхностями. Хорошо смываются кислотами, а также позволяют проводить работы с большим количеством металлов. Они относятся к легкоплавким и маркируются индексами ПОС.
Тугоплавкие припои имеют температуру плавления 450-1100° С. В их состав входят такие элементы: медь, серебро, магний, никель в разных соотношениях. Предназначены для соединения меди, латуни, серебра, бронзы. Маркируются Cu-Ag как ПСР, а Cu-Zn как ПМЦ. Оба типа припоев можно изготовить в самостоятельно.
Выше перечисленные элементы встречаются во многих деталях, которые можно найти в хозяйстве, но можно ли чем заменить припой в домашних условиях? Сам припой — нет, но замену можно найти канифоли, используя нехитрые вещества, которые находятся в аптечке или на кухне. Это обычный аспирин (не шипучий), жир, смола хвойных деревьев, кислоты со стеарином, электролит из батарейки и, самый дорогой, — янтарь.
Инструкция по изготовлению ![]()
Готовим припой для пайки серебра своими руками. Поскольку для расплавления тугоплавких элементов используется горелка, делаем это в гараже или мастерской. Серебряный припой состоит из 2 элементов:
- серебра в количестве 3 гр;
- латуни (медь + цинк) 1 гр.
Серебро должно быть максимально чистым – 925 пробы. В качестве латуни можно использовать бой латунных изделий, монеты. Или взять в соотношении 70% меди и 30% цинка. Двухкомпонентный сплав должен быть именно в таком соотношении, поскольку при увеличении содержания цинка уже до 40%, повышается хрупкость.
Расплавлять элементы нужно в первую очередь те, которые иметь высокую температуру плавления и добавлять остальные по уменьшению. Температура плавления меди – 1080° С, серебра – 930° С, цинка — 420° С.

Для производства домашнего припоя нам понадобится небольшая изложница и чаша, в которой мы будем плавить. Лучше всего, если это будет чугун. Прогреваем изложницу и добавляем в нее немного воска, нагреваем чашу. Если мы используем готовую латунь, то плавление начинается с серебра. Если это 3 отдельных элемента, то плавление начинаем с меди. При неполном расплавлении добавим серебро, при смешивании процесс начинает происходить быстрее. В конце добавляем цинк. Не переставая нагревать чашу с металлом, сливаем получаемый расплав в изложницу. Охлаждение расплава происходит очень быстро, за считанные секунды. После кристаллизации можно полученную заготовку охладить.
Чем можно заменить припой для пайки оловянный? Эта категория отличается высокой пластичностью и адгезией к металлической поверхности. Невысокая тугоплавкость позволяет применять припой для цветных металлов и тонких деталей. Получается смесь при смешивании олова и свинца в чистом виде. Получить сами элементы можно химическим методом, извлекая олово из консервных банок и крышек. Делаем поэтапно:
- Наливаем воду в банку, ставим на огонь и кипятим. Моем.
- Соединяем 3 батарейки и аккумулятор на 9-2 вольт. Положительный полюс соединяем с банкой, отрицательный с металлом любой формы (пусть это будет электрод).
- Заполняем банку едким натрием или раствор соды.
- Опускаем электрод в банку, но так, чтобы он не дотрагивался до ее стенок.
- Со временем на аноде (электроде) появится осадок чистого олова.
Метод извлечения олова из старых плат требует использования соляной кислоты с последующим выщелачиванием.
Свинец получить в домашних условиях гораздо проще, для этого достаточно:
- разобрать старый аккумулятор;
- найти рыболовные грузила или дробь;
- разобрать и очистить свинцовый кабель;
- найдя ненужные пломбы с водного счетчика.
Рекомендации по применению ![]()
Важно! Первоначально расплавляется самый тугоплавкий металл, после чего по степени убывания добавляются остальные компоненты.
Припой применяется в 3 видах: проволока, порошок или стружка и пластина. Выбор формы указывается либо личными предпочтениями, либо особенностями конструкции.
Если вы ищете, где взять припой в домашних условиях, если нет под рукой покупного, определите степень значимости изделия. Возможно полученный припой не будет соответствовать желаемому химическому составу и не обеспечит механические параметры.
Заключение
Альтернатива, чем можно заменить припой, существует в нескольких вариантах. Выделим цели, которые достигаются пайкой: жесткое скрепление деталей (для электроники — сохранении токопроводящей способности элемента). Добиться такого результата можно, при использовании следующих видов клея:
- эпоксидной смолы;
- клеевого пистолета.
Недостатком такого соединения можно считать высокую хрупкость смолы и небольшую прочность горячего клея. Если эти недостатки недопустимы и припоя нет, то можно изготовить даже самый тугоплавкий — медный припой своими руками.
Данный рецепт жидкого олова сделан по мотивам раствора, приготовление которого рассматривалось в этой статье и отличается от предыдущего раствора химического лужения, немного измененной рецептурой и заменой соляной кислоты на серную.
Преимущество данного раствора в том, что им можно лудить при комнатной температуре, раствор жидкого олова не кристаллизуется.
Недостаток один, это наличие серной кислоты, от которой при неаккуратном использовании остаются дырки на штанах.
Приготовление раствора химического лужения
Рецепт раствора жидкого олова:
1. SnCl2*2H2O - 16 гр.
2. Аккумуляторный электролит - 130 мл.
3. Тиомочевина - 75 гр.
4. Гипофосфит натрия - 20 .. 40 гр.
5. Комплекс соли висмута с йодом - 2 мл.
6. ПАВ - 2..5 мл (средство Fairy)
7. Дистиллированная вода - до 1 литра.
Порядок приготовления раствора жидкого олова.
1. Взвешиваем 16 грамм хлорида олова и растворяем его в 130 мл. аккумуляторного электролита плотностью 1,27.


2. Навеску 75 грамм тиомочевины растворяем в 450 мл. горячей (90..95 градусов) воды. Затем смешиваем ее с раствором с хлоридом олова.



3. Взвешиваем 40 грамм гипофосфита натрия растворяем в 300 мл. горячей (90..95 градусов) воде и перемешиваем с остальным раствором.



4. Берем 1 грамм калия едкого и вливаем в него 25 мл. аптечного йода и хорошо перемешиваем
Йод обесцветился, в растворе на дно выпал осадок, отфильтровываем его, он (осадок) не нужен.




5. Растворяем 0,1 грамм сплава Розе в 2 мл азотной кислоты, отфильтровываем жидкость (осадок не нужен) и соединяем с раствором йода. В итоге получаем желтый раствор с осадком.


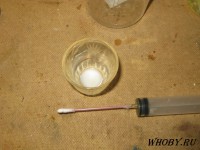

6. Встряхиваем этот желтый раствор, берем 2 мл. вместе с осадком и вливаем его в основной раствор. Тест без добавок D6B и D6Bi. На плате видно какие то белые разводы.



7. Добавляем в раствор ПАВ, хорошо перемешиваем. В данном случае использованы добавки для гальваники оловом D6B и D6Bi. Можно добавить любой ПАВ из имеющихся в наличии (например моющее средство Fairy), это не принципиально. Тест раствора с ПАВ. Плата покрылась ровным слоем химического олова.


Читайте статьи на сайте первоисточнике, не поддерживайте воров.
Тестирование жидкого олова для химического лужения
Фото для сравнения, слева с ПАВ, справа без ПАВ. Также готовая плата, с химически нанесенным оловом из этого раствора.


Видео работы раствора жидкого олова.
Заключение
Хотел добавить, что комплекс висмут-йод добавлять в раствор жидкого олова не обязательно, он влияет только на сохранение способности к пайке после длительного хранения платы после химического лужения.
Всем удачных плат.
Если вам понравилась статья, нажмите на кнопку нужной социальной сети расположенной ниже. Этим действием вы добавите анонс статьи к себе на страницу. Это очень поможет в развитии сайта.
Еще записи по теме



Доброго времени суток.
В пункте 3 на фотографии на банке написано "гипофосфит кальция", а в рецепте - "гипофосфит натрия". Это возможная замена?? Что лучше использовать? Или что более правильно? Заранее спасибо.

Нужен именно гипофосфит натрия и ни что другое, его и нужно использовать. На фотографию не обращайте внимания.
Всё почти замечательно. Раствор работает. Плата побелела мигом. Подожду час, посмотрю сколько нарастёт олова. Хотя есть небольшое НО. Не получается выполнить пункты 4 и 5, как на картинках. Вернее пункт 4 проходит. Йод обесцвечивается. Перехожу к 5. Растворяю 0,1 гр. сплава Розе в концентрированной азотке (70+)2 мл. для ускорения чуть подогреваю. После растворения осадок выбрасываю, жидкость использую. Так вот, после добавления этой соломенной жидкости к обесцвеченному йоду, он снова приобретает цвет йода и осадок не выпадает. Раствор прозрачный. То есть комплекс висмут-йод приготовлен неправильно. Нитрат висмута у нас быстро достать проблематично. Подскажите где я ошибся.

В 5 пункте попробуй добавить к раствору неправильного йода, немного KOH.
Вроде получилось. Хоть и не как на фото. При добавлении чешуек КОН, в какое-то время раствор скачком стал соломенно-желтый с белым осадком (как при первичном добавлении КОН к йоду). Так и должно быть? Подозреваю, что нейтрализовалась кислота нитрата висмута.
После часа пребывания тестовой платы в растворе, на меди осел довольно толстый слой олова. Медь на тестовой плате 18 мкм. По ощущениям слой хим.олова не тоньше (обман зрения). Паяется замечательно, даже с неправильным комплексом висмут-йод. Спасибо за рецепт. Имеется вопрос по хим.меди. Спрошу там.
а если в конце этапа 2 почти весь раствор кристаллизовался?

Вода горячая должна быть.
Аналогично как у zmulian при добавлении азотки с висмутом раствор темнеет и без осадка.
щелоч в 5 пункте добавляется до смешивания?
все же в рецепте что-то не то.

KOH добавляется в 4 пункте, в 5 пункте смешиваются растворы из 4 и 5 пункта.
Получилось только если добавлять чуть КОН в отфильтрованный раствор из 4 пункта..
и потом в него по каплять добавлять раствор из пункта 5, но гораздо меньше чем по рецепту. в какой-то момент получается желтая жидкость с осадком..при дальнейшем добавлении раствора п5 раствор начинает преобретать цвет йода и осадок пропадает.

Давно я это делал, возможно растворять нужно не 0,1 грамма сплава Розе, а больше, например 1 грамм. Тогда все получится (наверно).
Хотя нет, на фотках (в пунктах 4 и 5) вес именно тот, который был использован для получения нужных реактивов. Я не знаю, почему у вас не получается.

И повторю, то что получилось в пункте 5, не нужно лить в общий раствор по типу, кашу маслом не испортишь.
Тоже самое с ПАВ, если будет использоваться фейри, то достаточно четверть чайной ложки, не больше!
В 4 пункте изготовляется йодид калия. У меня имеется готовый. Сколько его нужно? Не слишком ли много азотки в 5 пункте. Предполагаю, что йод образуется при переходе в кислую среду на этапе 5.

Сколько его надо, не могу вспомнить. При добавлении к нитрату висмута, сначала черный раствор, потом нужно добавить избыток йодида калия до изменения цвета раствора (до розового).
Комплекс висмута с калием йодистым, нужен для того, чтобы висмут стал более селективен к меди и не выделялся контактно на ней в процессе химического лужения.
второй раствор(сделанный на кипятке) тоже кристаллизовался, только на следующий день.

А если опять разогреть и остудить? Не знаю, у меня такого не происходит, повторял рецепт много раз.
На серке раствор не кристаллизуется, на солянке кристаллизуется.
ХЗ. попробую.. единсвенное отличие было это не электролит, а дист вода 109г и серка ХЧ 38г(21мл) и в него уже хлорид олова.
п.с. и он должен ТАК вонять сероводородом?

130 мл электролита, содержит примерно 60 грамм серки. Из каких соображений было взято соотношение 109/38 грамм?
Сероводородом пахнет, но я бы не сказал что сильно.
хм. видимо из-за неправильной информации из интернета по приготовлению электролита из концентрированной серки 1.84

Вообще, кристаллизация из за большого количества тиомочевины еще бывает. Попробуй добавить кислоты до рецептного и воды примерно 100 мл. (возьми 100 мл воды, добавь в нее недостающую кислоту и влей в раствор).
Потом все это дело прогреть и посмотреть на кристаллизацию.
Вопрос, раствор то лудит?
да, лудит.. при том даже если окунуть и сразу же вынуть, уже на меди оседает олово, а если подержать несколько секунд, то цвет меди же не прослеживается, только олово..
Если я правильно понял, то необходимо взять 100г воды, добавить в нее 22г серки (60 минус 38), добавить в основной раствор и нагреть?
И еще, не в курсе, можно ли хим посуду греть напрямую на пламени спиртовки или газовой горелки, или только через асбестовую прокладку(посуда с значком спиртовки и белым квадратом.)? в интернете много противоречивой информации, а в школе это не объясняли, или объясняли но это очень давно было.. пробовал греть напрямую но только воду(воду не страшно пролить).

Да. Вода тут нужна для разбавления концентрации реактивов, на качество не повлияет. Если кристаллизация будет меньше, то можно добавить еще 100 мл воды (без кислоты), прогреть и посмотреть.
Греть открытым огнем я бы не стал, нужна прокладка. Но в данном случае можно греть в микроволновке, до момента пропадания кристаллизации (в растворе на соляной кислоте, кристаллизация уходит уже при 70 градусах).

И еще, не совсем понятно, кристаллизуется весь объем раствора или какая то его часть, например 1/3, 1/2. ?
где-то в районе 3/4, но это в бутылке в покое.. при том эти волокна легко разрушить взбалтыванием.. после взбалтывания они оседают примерно на 3/5 бутылки.

А хлорид олова 16 грамм? И он водный или безводный?
16 грамм ровно.. но олово двухводное (тоже что используется в активаторе и хим меднении).
Пардон.. в меднении он не используется.. (тот же что на п-активатор)

Пробуй добавить воды, кислоты.
А 60 ли грамм? Если я правильно нашел, то электролит 1.27, это около 37% концентрации, а это 48мл(из 130мл), а это уже 88,5грамм..
поправка. 1,27 это 32% по объему а это 41.6мл или 76.5г.. (итого необходимо добавить 55г)..

Продают электролит плотностью 1,27-1,28 - это в среднем 37% раствор серной кислоты.
В 1 литре 37% раствора содержится 472 грамма серной кислоты.
60 грамм серной кислоты содержится в 1000*60/472 = 127 мл электролита.

Если не хочется переводить на электролит, то в рецепте или 130 мл электролита плотностью 1,27 или 60 грамм концентрированной кислоты, плотностью 1,84.
Я добавил из расчета 76 грамм всего. при 50град волокна стали растворятся, к 55 все растворились.. догрел до 70 градусов и оставил..
Только еще не понятно нормальный ли добавил раствор висмута с йодом. и что теперь с ним делать..
но как 37%.. из 100 мл это 63мл воды и 37мл кислоты, что равно 68.1 грамма(1,84).. общее 68.1+63=131.1грамма /100 мл получается 1,31г/мл.. где моя ошибка?
Продают электролит плотностью 1,27-1,28 - это в среднем 37% раствор серной кислоты.
В 1 литре 37% раствора содержится 472 грамма серной кислоты.
60 грамм серной кислоты содержится в 1000*60/472 = 127 мл электролита.
снова нифига не врублюсь.. 472грамма это 256.5мл.. из литра.. в итоге 25,6% по объему.. и плотность получается 1,216г/мл

472*100/98 = 481 гр 100% кислоты
481/1,84 = 261 мл 100% кислоты
100 - 261 = 739 мл вода
Все равно, когда полностью остыл, кристаллизовался круглыми зонами не стенках и на дне. после встяхивания все опустилось на дно и заняло премерно 10% от всей бутылки.

Ну 10% это не вся емкость. Как писал выше, добавь еще 100 мл воды без кислоты. Если кристаллы уйдут (после прогрева /остывания), то советую в следующий раз, при разведении нового раствора, брать не 75 грамм тиомочевины, а например 65 грамм.
Дается мне, что дело в ней (верней в качестве этого реактива в конкретном случае).
Читайте также:


