Как сделать сравнительную характеристику химия
Обновлено: 07.07.2024
План урока:
Химическая формула
Например, самый лёгкий элемент – водород, но его символ читается как АШ. Кислород читаем – О. Медь – купрум.
Как записать и прочитать с чего состоит соединение, чтобы нас могли понять не только русскоговорящие, но и те, кто говорит на другом языке? Помогут нам в этом символы, а также индексы.
H 2 SO 4 – зелёным цветом выделены индексы – маленькая цифра, которая записывается справа от символа. Он служит показателем количественного состава.
H 2 SO 4 – красным выделены знаки элементов, они указывают качественный состав.
Рассмотрим примеры составления формул, используя условные обозначения на рисунке.
- Сернистый газ. Из условных обозначений видим, что он состоит из одного атома Серы и двух атомов Кислорода – SO2, читается как эс-о-два.
- Аммиак. Один атом Азота и три Водорода – NH3 (эн-аш-три).
- Фторид серы. Один атом Серы и шесть атомов Фтора – SF6 (эс-фтор-шесть).
Коэффициент записывается всегда в начале формулы и никогда не ставится в середину. С его помощью мы узнаём количество молекул, либо свободных атомов. Например, запись 6SiCl4 читаем как: шесть молекул хлорида кремния, 3H2S– 3 молекулы сероводорода.
Массовая характеристика вещества
Относительная атомная масса (ОАМ)
Представим перед собой два кубика одинакового объёма 1 см 3 , только один сделан из свинца, а второй – из алюминия. ρ(Al) = 2.7 г/см 3 , ρ(Pb) = 11,3 г/см 3 . Свинцовый кубик будет 4,2 раза тяжелее алюминиевого. С чем это связано?
Атомы отличаются между собой количеством протонов и электронов. Логично будет предположить, что отличие также будет в размере и массе частиц.
Атом очень мал, что его невозможно увидеть невооружённым глазом. Так, если представить в числах размер Углерода, то его радиус r = 1.5∙10 −10 м и масса m = 19.94∙10 −27 кг. Эти параметры достаточно сложно представить. Но если, к примеру, прочертить простым карандашом (стержень карандаша в химии это графит – одна из аллотропных форм Углерода) отрезок длиной 3 см. В данном отрезке будет содержаться около 1 млн. в ширину и 100 млн. атомов Углерода в длину.
Как показывают числовые данные - масса и радиус очень малы, их достаточно трудно увидеть даже в современные оптические микроскопы. Именно по этой причине стали сравнивать атомные массы. На данный момент стандартом сравнения является химический элемент Углерод, а точнее 1 /12 часть его массы.
Закономерно также возникает вопрос, а какую размерность имеет ОАМ: граммы, миллиграммы? Поскольку это число, которое указывает сравнение, то это будет безразмерная величина.
Чему равно Ar элемента подскажет периодическая система. Достаточно часто порядковый номер принимают за Ar. Чтобы избежать путаницы, запомним, что порядковый номер - целое число, а Ar записывается десятичной дробью, которую в химических расчётах общепринято округлять до целых (исключение составляет только Хлор).
Например: Ar(Mg) = 24,305 ~ 24
Ar(Fe) = 55,847 ~ 56
Ar(Cl) = 35.453 ~ 35,5
Относительная молекулярная масса (ОММ)
Данная величина относится также к количественным характеристикам. Более точное название - относительная формульная масса, потому что строение веществ бывает разным (в зависимости от того, какими частицами оно образовано).
Вычисляют ОММ (Mr) путём сложения Ar каждого элемента, которые входят в состав молекулы с учётом их индексов.
Здесь нам на помощь придут математические знания, а именно правила сложения, умножения и внимательное раскрытие скобок.
Определим ОММ, например:
Mr(H2S) = 2∙Ar(H) + Ar(S) = 2 ∙ 1 + 32 = 34
Так как в состав молекулы H2S входит 2 атома водорода, мы это учитываем выражением 2∙Ar(H) и один атом Серы Ar(S). В периодической таблице берём округлённое значение массы Н (1,00797 ~ 1) и S (32,064 ~ 32) и путём сложения вычисляем Mr(H2S).
Mr (Ca(OH)2) = Ar(Ca) + 2∙Ar(O) + 2∙Ar(H) = 40 + 2 ∙ 16 + 2 ∙ 1 = 74
Эта формула читается как кальций-о-аш-дважды. Что означает индекс два за скобками? Он показывает, что количество атомов H и O равно 2. Это будет равносильно, если раскрыть скобки и написать так: СаО2Н2.
Mr(Ca3(PO4)2) = 3∙Ar(Ca) + 2∙Ar(P) + 8∙Ar(O) = 3 ∙ 40 + 2 ∙31 + 8 ∙ 16 = 310
Кальций-три-пе-о-четыре-дважды. В состав данного вещества входит 3 атома Кальция, два атома Фосфора (индекс 2 относится и к Фосфору и к Кислороду) и 8 атомов Кислорода (2 ∙ 4 = 8). Или, раскрыв скобки Са3Р2О8.
7 молекул угольной кислоты 7 ∙ Н2СО3
Mr (7 ∙ H2CO3) = 7 ∙ (2 ∙ Ar(H) + Ar(C) + 3 ∙ Ar(O)) = 14 ∙ Ar(H) + 7 ∙ Ar(C) + 21 ∙ Ar(O) = 14 ∙ 1 + 7 ∙ 12 + 21 ∙ 16 = 434
Следует обратить внимание, что в химии знак умножение между коэффициентом и формулой не ставится. Более корректная запись 7H2CO3, и действие умножение делается по умолчанию, т. е. раскрываются скобки.
Важно запомнить
Так как ОММ показывает во сколько раз молекула тяжелее 1/12 атома Углерода, то это безразмерная величина.
Не стоит путать с массой молекулы, которая имеет обозначение mM и имеет размерность а.е.м. (атомные единицы массы).
Благодаря химической формуле можно посчитать массовую долю элемента в сложном веществе.
Где n – число атомов элемента.
Сложное вещество можно очень условно сравнить с корзиной, в которой, допустим, находятся ягоды: малины, клубники и арбуз. Возьмём соединение ВаСО3.
Mr(BaCO3) = Ar(Ba) + Ar(C) + 3∙Ar(O) = 137 + 12 + 3 ∙ 16 = 197
Не трудно догадаться, что арбузом будет атом бария, так как он занимает 69,6 % массы в корзинке фруктов.Проверить правильность решения можно, сложив доли элементов, в сумме должно получиться 100%.
Задача 1. Определите массовую долю Азота в натриевой селитре NaNO3
С помощью данных расчётов можно вычислить какая масса Азота, может быть получена из 1 кг натриевой селитры NaNO3.
m(N) = W (N) · m (NaNO3) = 0.1647 · 1 кг = 0,1647 кг или 164,7 г
Селитра применяется как азотное удобрение и с каждым кг растения получают 164,7 г азота.
Бывает так, что опытным путём определены массовые доли элементов и задача стоит в том, что необходимо определить количественный состав соединения. Такие задачи являются обратными идалее их.
Задача 2. Опытным путём установлено, что соединение состоит на 95,2% с Кальция и Водорода. Какова формула вещества?
Количество вещества
Порцию считаем в граммах, в штуках количество. Например, в магазине вы не покупаете 1000 штук зёрен риса или пшена, а просите взвесить определённый вес (1 кг, 10 кг) или берёте с полки уже расфасованный. Либо необходимо взять молочные продукты, мы берём пакеты объёмом 0,5 л или 1 л. Одинаковая по весу порция содержит примерно одинаковое количество зёрен. Этот принцип применяется и в химии. Порция атомов или молекул называется количеством вещества.
Если учесть, что атом Углерода имеет вес, (1.994 ∙ 10 −23 г), то не составит труда узнать, сколько атомов будет содержаться в порции 12 г.
Можно сделать вывод, что 1 моль любого вещества (воды, углекислого газа, поваренной соли, серной кислоты и т. д) будет содержать 6,02∙10 23 структурных единиц.
Это число является одним из важнейших не только в химии, но и в физике – оно носит название постоянная Авогадро (NA).
С этого следует, что NA показывает, сколько частиц содержится в 1 моль вещества, в этом и состоит её физический смысл.
Но что делать, если, к примеру, вещество дано в количестве 2 моль, 10 моль или 0.5 моль. Приведём сравнение с математикой, в одной корзине содержится 5 яблок, сколько яблок содержится в трёх таких корзинах. Ответ будет 15 яблок, полученный путём умножения 5 ∙ 3 = 15. Аналогично и с количеством молекул. Чтобы найти эту величину, используем формулу:
Где N – количество структурных единиц.
Важно: не путать эти две величины, оба эти параметра показывают количество, но:
N - количество структурных единиц,
n - количество вещества (моль)
Рассмотрим подробно данные выводы.
Задача 3. Какое количество вещества составляют 2.709 ∙ 10 24 молекул хлора?
Задача 4. Вычислите сколько атомов Кислорода содержатся в 5 моль глюкозы (C6H12O6)
Молярная масса
Масса 1 моля любого вещества называется молярной массой (размерность г /моль, обозначение М). Не стоит путать с Mr, хоть они численно равны, но отличаются в следующем. Молярная имеет размерность (г/моль).
Связь количества вещества и массы выражается в следующем виде:
Возьмём для примера метан, фруктозу и хлороводород количеством вещества 1 моль.
С расчётов делаем вывод, что масса 1 моль фруктозы тяжелее, в её состав входит большее количество атомов.
Задача 5. Какое количество вещества содержится в 61.5 г сернистой кислоты (H2SO3)?
Молярный объём газов
Вещества в газообразном состоянии, в отличие от жидких и твёрдых веществ, при одинаковых условиях (одинаковые давление и температура) будут занимать одинаковый объём.
Допустим, что имеем газ количеством вещества 1 моль. Как известно 1 моль любого соединения содержит 6,02 ∙ 10 23 структурных единиц.
Опытным путём установлено, что 1 моль любого газа при н. у. занимает объём равный 22,4 л/моль.
Связь количества вещества и объёма выражается в следующем виде:
Задача 6. Какой объём (н. у.) будет занимать 0,25 моль ацетилена (С2Н2)?
Как можно увидеть, количество вещества связывает три величины:
Приравняв между собой три выражения, а именно:
Получаем следующую взаимосвязь
Задача 7. Какую массу составляют 18.06 ∙10 23 молекул аммиака (NH3)?
Задача 8. Какой объём (н. у.) будет занимать 51 г сероводорода (H2S)?
Закон Авогадро и его следствия
Величина D – это относительная плотность газов. Зная Mr, легко вычислить относительную плотность газов. Приведём пример с шариками. Если один шарик наполнить гелием, а второй углекислым газом. Как вы думаете, какой полетит высоко в небо, а какой упадёт на пол? С детства вы знаете, что гелиевые шарики взлетают в небо, но почему так происходит? Это связано с относительной молекулярной массой.
Mr(CO2) = 12 + 2 ∙ 16 = 44
Воздух это смесь газов, его Mr = 29
Гелий легче воздуха, поэтому шарик, наполненный этим газом, взлетает высоко в небо. Шарик с углекислым газом остаётся лежать на земле, так как углекислый газ тяжелее воздуха.
Неорганическая химия - раздел химии, изучающий строение и химические свойства неорганических веществ.
Среди простых веществ выделяют металлы и неметаллы. Среди сложных: оксиды, основания, кислоты и соли. Классификация неорганических веществ построена следующим образом:

Большинство химических свойств мы изучим по мере продвижения по периодической таблице Д.И. Менделеева. В этой статье мне хотелось бы подчеркнуть ряд принципиальных деталей, которые помогут в дальнейшем при изучении химии.
Оксиды
Все оксиды подразделяются на солеобразующие и несолеобразующие. Солеобразующие имеют соответствующие им основания и кислоты (в той же степени окисления (СО)!) и охотно вступают в реакции солеобразования. К ним относятся, например:
- CuO - соответствует основанию Cu(OH)2
- Li2O - соответствует основанию LiOH
- FeO - соответствует основанию Fe(OH)2 (сохраняем ту же СО = +2)
- Fe2O3 - соответствует основанию Fe(OH)3 (сохраняем ту же СО = +3)
- P2O5 - соответствует кислоты H3PO4
Солеобразующие оксиды, в свою очередь, делятся на основные, амфотерные и кислотные.
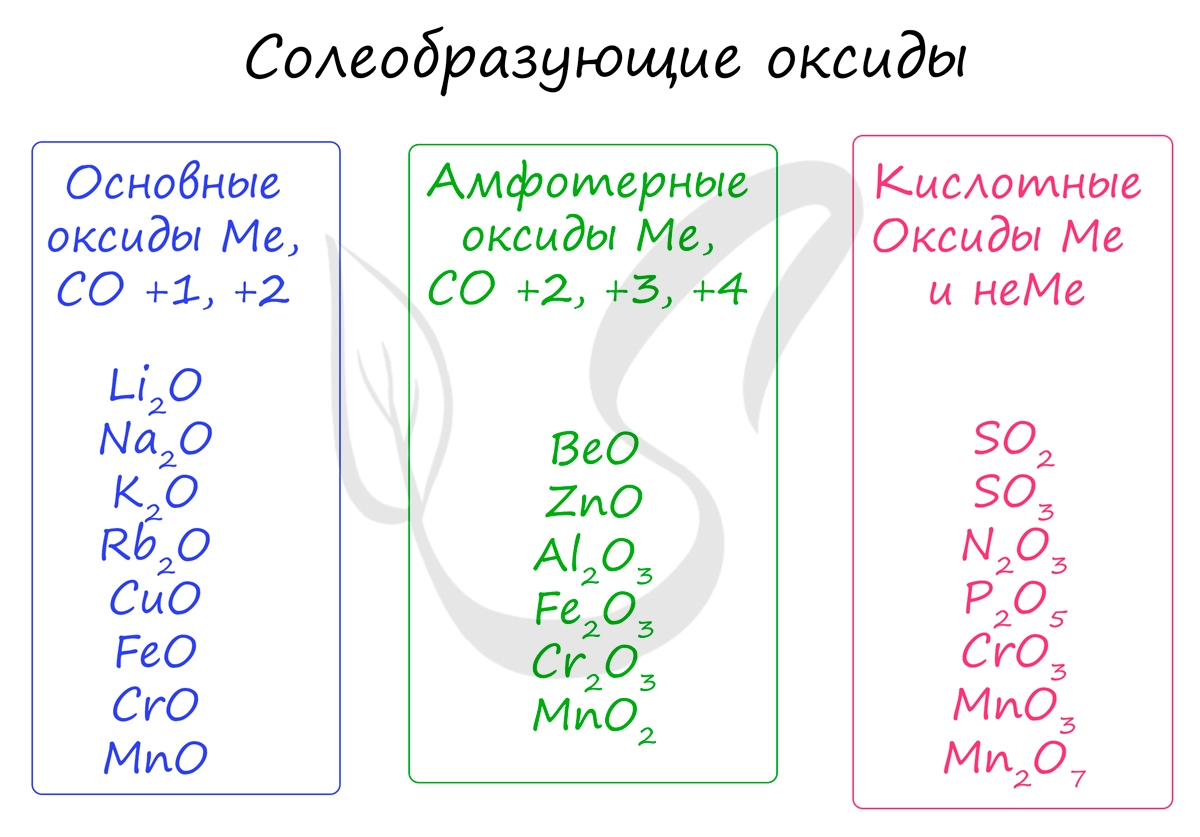
Основным оксидам соответствуют основания в той же СО. В химических реакциях основные оксиды проявляют основные свойства, образуются исключительно металлами. Примеры: Li2O, Na2O, K2O, Rb2O CaO, FeO, CrO, MnO.
Основные оксиды взаимодействуют с водой с образованием соответствующего основания (реакцию идет, если основание растворимо) и с кислотными оксидами и кислотами с образованием солей. Между собой основные оксиды не взаимодействуют.
Li2O + H2O → LiOH (основный оксид + вода → основание)
Здесь не происходит окисления/восстановления, поэтому сохраняйте исходные степени окисления атомов.
Эти оксиды действительно имеют двойственный характер: они проявляют как кислотные, так и основные свойства. Примеры: BeO, ZnO, Al2O3, Fe2O3, Cr2O3, MnO2, PbO, PbO2, Ga2O3.
С водой они не взаимодействуют, так как продукт реакции, основание, получается нерастворимым. Амфотерные оксиды реагируют как с кислотами и кислотными оксидами, так и с основаниями и основными оксидами.
ZnO + KOH + H2O → K2[Zn(OH)4] (амф. оксид + основание = комплексная соль)
ZnO + N2O5 → Zn(NO3)2 (амф. оксид + кисл. оксид = соль; СО азота сохраняется в ходе реакции)
Fe2O3 + HCl → FeCl3 + H2O (амф. оксид + кислота = соль + вода; обратите внимание на то, что СО Fe = +3 не меняется в ходе реакции)

Проявляют в ходе химических реакций кислотные свойства. Образованы металлами и неметаллами, чаще всего в высокой СО. Примеры: SO2, SO3, P2O5, N2O3, NO2, N2O5, SiO2, MnO3, Mn2O7.
- SO2 - H2SO3
- SO3 - H2SO4
- P2O5 - H3PO4
- N2O5 - HNO3
- NO2 - HNO2, HNO3
Кислотные оксиды вступают в реакцию с основными и амфотерными, реагируют с основаниями. Реакции между кислотными оксидами не характерны.
SO2 + Na2O → Na2SO3 (кисл. оксид + осн. оксид = соль; сохраняем СО S = +4)
SO3 + Li2O → Li2SO4 (кисл. оксид + осн. оксид = соль; сохраняем СО S = +6)
P2O5 + NaOH → Na3PO4 + H2O (кисл. оксид + основание = соль + вода)
При реакции с водой кислотный оксид превращается в соответствующую ему кислоту. Исключение SiO2 - не реагирует с водой, так как продукт реакции - H2SiO3 является нерастворимой кислотой.

- CO
- N2O
- NO
- SiO
- S2O
Реакции несолеобразующих оксидов с основаниями, кислотами и солеобразующими оксидов редки и не приводят к образованию солей. Некоторые из несолеобразующих оксидов используют в качестве восстановителей:
FeO + CO → Fe + CO2 (восстановление железа из его оксида)

Основания
Основания - химические соединения, обычно характеризуются диссоциацией в водном растворе с образованием гидроксид-анионов. Растворимые основания называются щелочами: NaOH, LiOH, Ca(OH)2, Ba(OH)2.
Гидроксиды щелочных металлов (Ia группа) называются едкими: едкий натр - NaOH, едкое кали - KOH.

Основания классифицируются по количеству гидроксид-ионов в молекуле на одно-, двух- и трехкислотные.

Так же, как и оксиды, основания различаются по свойствам. Все основания хорошо реагируют с кислотами, даже нерастворимые основания способны растворяться в кислотах. Также нерастворимые основания при нагревании легко разлагаются на воду и соответствующий оксид.
NaOH + HCl → NaCl + H2O (основание + кислота = соль + вода - реакция нейтрализации)
Mg(OH)2 → (t) MgO + H2O (при нагревании нерастворимые основания легко разлагаются)
Если в ходе реакции основания с солью выделяется газ, выпадает осадок или образуется слабый электролит (вода), то такая реакция идет. Нерастворимые основания с солями почти не реагируют.
Ba(OH)2 + NH4Cl → BaCl2 + NH3 + H2O (в ходе реакции образуется нестойкое основание NH4OH, которое распадается на NH3 и H2O)
KOH + BaCl2 ↛ реакция не идет, так как в продуктах нет газа/осадка/слабого электролита (воды)
В растворах щелочей pH > 7, поэтому лакмус окрашивает их в синий цвет.

Амфотерные оксиды соответствуют амфотерным гидроксидам. Их свойства такие же двойственные: они реагирую как с кислотами - с образованием соли и воды, так и с основаниями - с образованием комплексных солей.
Al(OH)3 + HCl → AlCl3 + H2O (амф. гидроксид + кислота = соль + вода)
Al(OH)3 + KOH → K[Al(OH)4] (амф. гидроксид + основание = комплексная соль)
При нагревании до высоких температур комплексные соли не образуются.
Al(OH)3 + KOH → (t) KAlO2 + H2O (амф. гидроксид + основание = (прокаливание) соль + вода - при высоких температурах вода испаряется, и комплексная соль образоваться не может)

Кислоты
Кислота - химическое соединение обычно кислого вкуса, содержащее водород, способный замещаться металлом при образовании соли. По классификации кислоты подразделяются на одно-, двух- и трехосновные.
Основность кислоты определяется числом атомов водорода, которое способна отдать молекула кислоты, реагируя с основанием. Определять основность кислоты по числу атомов водорода в ней - часто верный способ, но не всегда: например, борная кислота H3BO3 является слабой одноосновной кислотой, фосфористая кислота H3PO3 - двухосновной кислотой.

Кислоты отлично реагируют с основными оксидами, основаниями, растворяя даже те, которые выпали в осадок (реакция нейтрализации). Также кислоты способны вступать в реакцию с теми металлами, которые стоят в ряду напряжений до водорода (то есть способны вытеснить его из кислоты).
H3PO4 + LiOH → Li3PO4 + H2O (кислота + основание = соль + вода - реакция нейтрализации)
Zn + HCl → ZnCl2 + H2↑ (реакция идет, так как цинк стоил в ряду активности левее водорода и способен вытеснить его из кислоты)
Cu + HCl ↛ (реакция не идет, так как медь расположена в ряду активности правее водорода, менее активна и не способна вытеснить его из кислоты)
Записать эти кислоты в растворе в виде "H2CO3 или H2SO3" - будет считаться ошибкой. Пишите угольную и сернистую кислоты в разложившемся виде - виде газа и воды.

Все кислоты подразделяются на сильные и слабые. Напомню, что мы составили подробную таблицу сильных и слабых кислот (и оснований!) в теме гидролиз. В реакции из сильной кислоты (соляной) можно получить более слабую, например, сероводородную или угольную кислоту.
Однако невозможно (и противоречит законам логики) получить из более слабой кислоты сильную, например из уксусной - серную кислоту. Природу не обманешь :)
K2S + HCl → H2S + KCl (из сильной - соляной кислоты - получили более слабую - сероводородную)
K2SO4 + CH3COOH ↛ (реакция не идет, так как из слабой кислоты нельзя получить сильную: из уксусной - серную)
Подчеркну важную деталь: гидроксиды это не только привычные нам NaOH, Ca(OH)2 и т.д., некоторые кислоты также считаются кислотными гидроксидами, например серная кислота - H2SO4. С полным правом ее можно записать как кислотный гидроксид: SO2(OH)2
В завершении подтемы кислот предлагаю вам вспомнить названия основных кислот и их кислотных остатков.
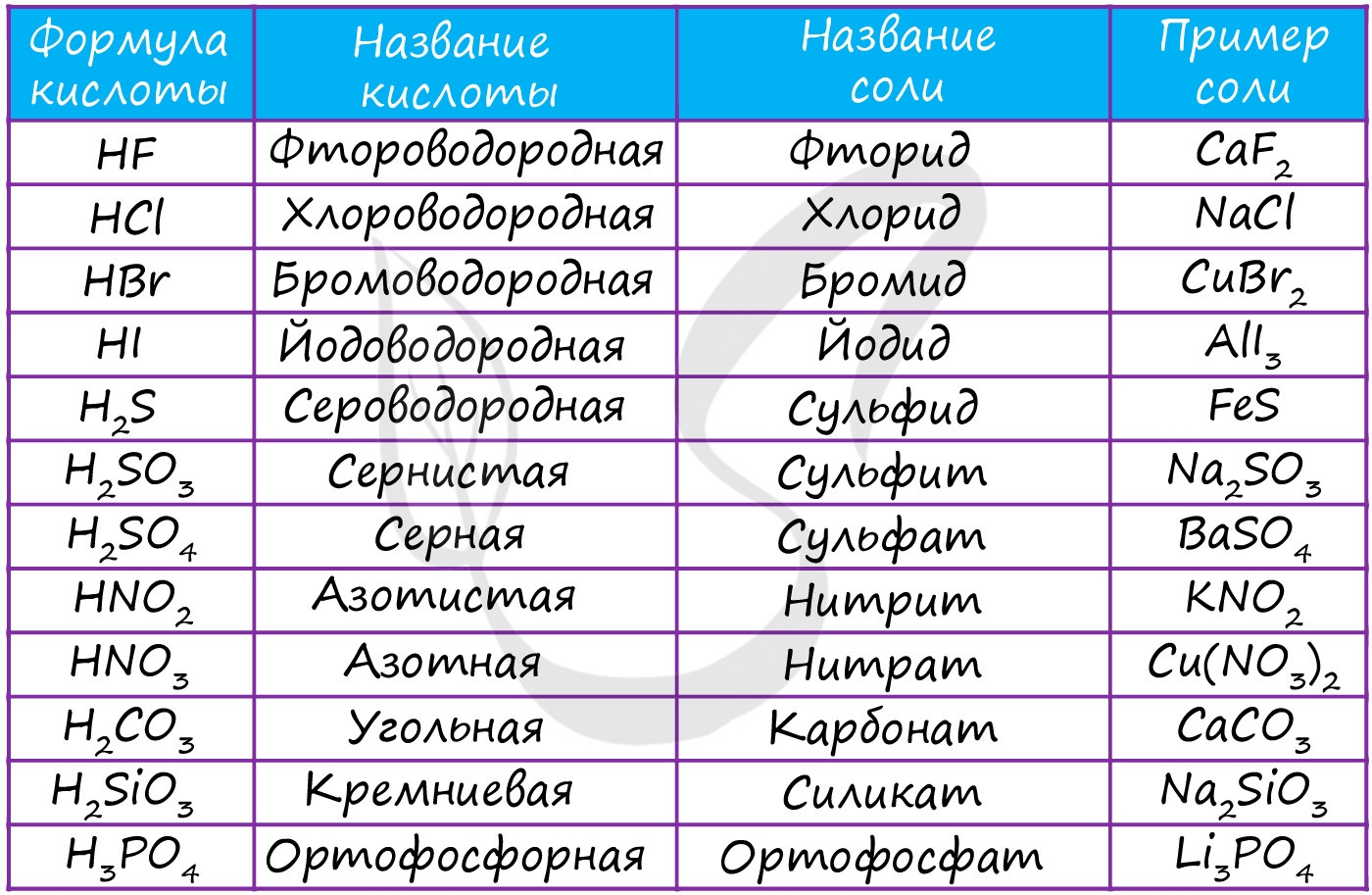
Соль - ионное соединение, образующееся вместе с водой при нейтрализации кислоты основанием (не единственный способ). Водород кислоты замещается металлом или ионом аммония (NH4). Наиболее известной солью является поваренная соль - NaCl.
- Средние - продукт полного замещения атомов водорода в кислоте на металл: KNO3, NaCl, BaSO4, Li3PO4
- Кислые - продукт неполного замещения атомов водорода: LiHSO4, NaH2PO4 и Na2HPO4 (гидросульфат лития, дигидрофосфат и гидрофосфат натрия)
- Основные - продукт неполного замещения гидроксогрупп на кислотный остаток: CrOHCl (хлорид гидроксохрома II)
- Двойные - содержат два разных металла и один кислотный остаток (NaCr(SO4)2
По многим физическим и химическим свойствам неметалл бор напоминает кремний.
Химически бор довольно инертен и при комнатной температуре взаимодействует только со фтором:
При нагревании бор реагирует с другими галогенами с образованием тригалогенидов, с азотом образует нитрид бора BN, с фосфором - фосфид BP, с углеродом - карбиды различного состава (B4C, B12C3, B13C2). При нагревании в атмосфере кислорода или на воздухе бор сгорает с большим выделением теплоты, образуется оксид B2O3:
С водородом бор напрямую не взаимодействует, хотя известно довольно большое число бороводородов (боранов) различного состава, получаемых при обработке боридов щелочных или щелочноземельных металлов кислотой:
При сильном нагревании бор проявляет восстановительные свойства. Он способен, например, восстановить кремний или фосфор из их оксидов:
Данное свойство бора можно объяснить очень высокой прочностью химических связей в оксиде бора B2O3.
При отсутствии окислителей бор устойчив к действию растворов щелочей. В горячей азотной, серной кислотах и в царской водке бор растворяется с образованием борной кислоты H3BO3.
При нормальных условиях алюминий покрыт тонкой и прочной оксидной плёнкой и потому не реагирует с классическими окислителями: с H2O (t°), O2, HNO3 (без нагревания). Однако при разрушении оксидной плёнки алюминий выступает как активный металл-восстановитель. Не допустить образования оксидной плёнки можно, добавляя к алюминию такие металлы, как галлий, индий или олово. При этом поверхность алюминия смачивают легкоплавкие эвтектики на основе этих металлов.
Легко реагирует с простыми веществами:
- 1. с кислородом, образуя оксид алюминия:
- 2. с галогенами (кроме фтора), образуя хлорид, бромид или иодид алюминия:
- 3. с другими неметаллами реагирует при нагревании:
- · со фтором, образуя фторид алюминия:
- · с серой, образуя сульфид алюминия:
- · с азотом, образуя нитрид алюминия:
- · с углеродом, образуя карбид алюминия:
- 5. Со сложными веществами:
- · с водой (после удаления защитной оксидной плёнки, например, амальгамированием или растворами горячей щёлочи):
- · со щелочами (с образованием тетрагидроксоалюминатов и других алюминатов):
- · легко растворяется в соляной и разбавленной серной кислотах:
- · При нагревании растворяется в кислотах - окислителях, образующих растворимые соли алюминия:
- · восстанавливает металлы из их оксидов (алюминотермия):
- o Галлий
Химические свойства галлия близки к свойствам алюминия, но реакции металлического галлия, как правило, идут гораздо медленнее из-за меньшей химической активности.
Оксидная плёнка, образующаяся на поверхности металла на воздухе, предохраняет галлий от дальнейшего окисления.
- 1. Галлий медленно реагирует с горячей водой:
- 2. При реакции с перегретым паром (350°C) образуется соединение GaOOH (гидрат оксида галлия или метагаллиевая кислота):
- 3. Галлий взаимодействует с минеральными кислотами с выделением водорода и образованием солей:
- 4. Галлий реагирует с галогенами: реакция с хлором и бромом идёт при комнатной температуре, с фтором - уже при ?35°C (около 20°C - с воспламенением), взаимодействие с йодом начинается при нагревании.
- 5. При высоких температурах нагреванием в запаянной камере можно получить неустойчивые галогениды галлия (I) - GaCl, GaBr, GaI:
- 6. Галлий не взаимодействует с водородом, углеродом, азотом, кремнием и бором.
- 7. С большинством металлов галлий образует галлиды, исключением являются висмут, а также металлы подгрупп цинка, скандия, титана.
- 8. Галлий образует гидридогаллаты:
- o Индий и таллий
В виде простых веществ индий и таллий - легкоплавкие серебристо-белые металлы. Индий в отличие от других блестящих металлов наиболее равномерно отражает световые волны всех длин и поэтому применяется для изготовления зеркал.
Подобно В и А1 галлий и индий с р-элементами V группы образуют соединения типа А В (где А - р-элемент П1 группы, В - р-эле-мент V группы). Эти соединения изоэлектронны соответствующим простымвеществам р-элементов IV группы. В большинстве соединений типа А В атомы находятся в состоянии 5р - гибридизации, т.е. в тетраэдрической координации друг относительно друга.
![]()
Общая характеристика некоторых элементов
в связи с их положением в Периодической системеЭлемент ЕГЭ: 1.2.2. Общая характеристика металлов IA-IIIA групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов. 1.2.3. Характеристика переходных элементов (меди, цинка, хрома, железа)… 1.2.4. Общая характеристика неметаллов IVA-VIIA групп…
1.2.2. Общая характеристика металлов IA-IIIA групп …
Все элементы IА–IIIА-групп Периодической системы относят к металлам (кроме бора). На внешнем энергетическом уровне эти элементы имеют не более трех электронов, что соответствует номеру группы, в которой они расположены.
Металлы IA-группы называют щелочными, так как при взаимодействии с водой они образуют щелочи. Металлы IIА-группы, за исключением бериллия и магния, называют щелочноземельными.
I группа, главная подгруппа —
щелочные металлы (литий, натрий, калий, рубидий, цезий).![Общая характеристика некоторых элементов. I группа, главная подгруппа]()
I группа, главная подгруппа — щелочные металлы: литий, натрий, калий, рубидий, цезий. С увеличением порядкового номера в ПСХЭ растет радиус атома, усиливаются восстановительная способность и химическая активность, металлические свойства, основный характер оксидов и гидроксидов.
II группа, главная подгруппа —
щёлочноземельные металлы (кальций, стронций, барий, радий)![II группа, главная подгруппа — щёлочноземельные металлы]()
II группа, главная подгруппа — щёлочноземельные металлы: кальций, стронций, барий, радий. С увеличением порядкового номера в ПСХЭ растет радиус атома, усиливаются восстановительная способность и химическая активность, металлические свойства, оснОвный характер оксидов и гидроксидов.
Элементы III группы главной подгруппы
(бор, алюминий, галлий, индий, таллий)![Элементы III группы главной подгруппы]()
Элементы III группы главной подгруппы: бор, алюминий, галлий, индий, таллий. С увеличением порядкового номера в ПСХЭ растет радиус атома, усиливаются металлические свойства. В — неметалл, Аl — переходный элемент, Ga, In, Тl — металлы.
1.2.3. Характеристика переходных элементов (меди, цинка, хрома, железа) …
Понятие переходный элемент относится к d-элементам, занимающим переходное положение между s- и p-элементами. Они расположены в побочных подгруппах (группах IБ-VIIIБ). Все d-элементы являются металлами, валентные электроны которых расположены на ns- и (n–1)d-подуровнях, т.е. они имеют электронную конфигурацию: (n–1)d 1–10 ns 1–2 .
Общая характеристика переходных элементов (меди, цинка, хрома, железа):
- Находятся в побочных подгруппах периодической системы.
- Валентные электроны расположены на внешних уровнях (s-электроны) и на предвнешних уровнях (d-электроны).
- Элементы — металлы.
- Для элементов, за исключением цинка, характерны переменные степени окисления.
- Соединения проявляют различные кислотно-основные свойства.
- С возрастанием степени окисления элемента в оксиде и гидроксиде кислотные свойства последних усиливаются.
Медь — I группа побочной подгруппы
![Медь — I группа побочной подгруппы]()
Цинк — II группа побочной подгруппы
![Цинк — II группа побочной подгруппы]()
Хром — VI группа побочной подгруппы
![Хром — VI группа побочной подгруппы]()
Железо — VIII группа побочной подгруппы
![Железо — VIII группа побочной подгруппы]()
1.2.4. Общая характеристика неметаллов IVA-VIIA групп …
Неметаллы занимают главные подгруппы IV–VIII-групп (или группы с IVA по VIIIA). Атомы неметаллов на внешнем энергетическом уровне могут содержать от 4 до 8 электронов. Исключение составляют: водород — 1 электрон, гелий — 2 электрона, бор — 3 электрона. У атомов неметаллов, как правило, происходит заполнение р-подуровня.
Элементы VIIA-группы носят название галогены, а элементы VIA-группы — халькогены.
Элементы IV группы главной подгруппы
(углерод, кремний, германий, олово, свинец)![Элементы IV группы главной подгруппы]()
Элементы IV группы главной подгруппы: углерод, кремний, германий, олово, свинец. С увеличением порядкового номера в ПСХЭ растет радиус атома, усиливаются, металлические и восстановительные свойства. С, Si, Ge, Sn — переходные элементы, Pb — металл.
Элементы V группы главной подгруппы
(азот, фосфор, мышьяк, сурьма, висмут)![Элементы V группы главной подгруппы]()
Элементы V группы главной подгруппы: азот, фосфор, мышьяк, сурьма, висмут. С увеличением порядкового номера в ПСХЭ растет радиус атома, усиливаются металлические и восстановительные свойства. У азота также возможны степени окисления +1; +2; +4.
Элементы VI группы главной подгруппы
(кислород, сера, селен, теллур, полоний)![Элементы VI группы главной подгруппы (халькогены)]()
Элементы VI группы главной подгруппы: кислород, сера, селен, теллур, полоний. С уменьшением порядкового номера в ПСХЭ усиливаются: неметаллические свойства, электроотрицательность, устойчивость соединений с водородом.
Элементы VII группы главной подгруппы —
галогены (фтор, хлор, бром, йод, астат)![Элементы VII группы главной подгруппы (галогены)]()
Элементы VII группы главной подгруппы — галогены: фтор, хлор, бром, йод, астат. С уменьшением порядкового номера в ПСХЭ усиливаются: неметаллические свойства, электроотрицательность, устойчивость соединений с водородом.
Читайте также:













