Как сделать пробиотик для животных
Добавил пользователь Morpheus Обновлено: 04.10.2024
В 2001г рабочей группой ВОЗ было дано современное определение пробиотиков, которое сохраняет свою актуальность: Пробиотики — это живые микроорганизмы, которые при применении в адекватных количествах вызывают улучшение здоровья организма-хозяина.
Большинство пробиотиков — это микроорганизмы, продуцирующие молочную кислоту и относящиеся к типичным представителям нормальной микробиоты человека.
При отборе пробиотических штаммов используются четкие критерии, в соответствии с которыми штаммы должны быть безопасными, то есть не могут обладать патогенными свойствами, должны быть кислотоустойчивыми – то есть сохраняться под воздействием желудочного сока (или бактерии должны быть заключены в кислотоустойчивую капсулу), должна проявляться способность выживать в просвете кишечника.
Пребиотики по сути являются пищевым субстратом для полезных бактерий.
Более точно — согласно определению, пребиотики: селективно ферментируемый ингредиент, который вызывает специфические изменения, как в составе, так и в функциональной активности микробиоты желудочно-кишечного тракта, оказывающие положительное влияние на здоровье организма хозяина.
Постбиотики – это неживые бактериальные продукты или продукты метаболизма пробиотических микроорганизмов, которые обладают биологической активностью в отношении организма-хозяина.
Пребиотики – этот термин используется для обозначения как пребиотиков (содержащих вещества, способствующие росту микроорганизмов), так и метабиотиков (содержащих метаболиты, продукты жизнедеятельности микрорганизмов). Самые распространённые из пребиотических компонентов: олигофруктоза, инулин, галакто-олигосахариды, лактулоза, олигосахариды грудного молока, бутират, молочная кислота и др.
Механизмы действия пребиотиков связаны с взаимодействием между микробиотой и макроорганизмом и разделяются на:
- Метаболические эффекты (продукция короткоцепочечных жирных кислот, абсорбция ионов кальция, железа, магния)
- Повышение иммунитета макроорганизма (продукция IgA, модуляция цитокинов)
К пребиотикам предъявляются достаточно строгие требования:
- не должны подвергаться гидролизу пищеварительными ферментами человека,
- не должны абсорбироваться в верхних отделах пищеварительного тракта,
- должны селективно стимулировать один вид или определенную группу микроорганизмов, резидентных для толстой кишки.
Рынок пребиотиков и синбиотиков - в основном рынок БАД.
Галоктоолигосахариды, олигофруктоза, фруктоолигосахариды (глюкоза, фруктоза, декстроза, мальтоза, мальтотриоза, мальтодекстрин – представлены в составе синбиотиков), лактулоза ( Дюфалак, Нормазе, Портлак, Прелакс и т.д. )
Водный субстрат продуктов обмена веществ Escherichia coli DSM 4087, Enterococcus faecalis DSM 4086, Lactobacillus acidophilus DSM 4149 и Lactobacillus helveticus DSM 4183 ( Хилак Форте )
Кальция бутират + инулин ( Закофальк )
Метаболиты бесклеточной культуральной жидкости бактерий B.subtilis штамм 3 + цеолит + ферментированный гидролизат соевой муки ( Бактистатин )
Секреторные ферменты от 16 штаммов лактобактерий, полученные путем брожения в течение 1 года на сое+лимонная кислота+молочная кислота ( Дайго )
Область применения пребиотиков: коррекция и профилактика дисбиотических состояний. [3,4]. При печеночной энцефалопатии и при функциональном запоре в качестве монотерапии рекомендована лактулоза с высоким уровнем доказательности (A-B, об уровнях доказательности читайте здесь ) [1]. В международных рекомендациях для профилактики (или профилактика рецидива) антибиотик-ассоциированной диареи (в т.ч. вызванной Clostridium difficile ) рекомендованы в комплексной терапии – олигофруктоза 4 г, три раза в день со средним уровнем доказательности [2]. При синдроме раздраженного кишечника назначение пребиотиков влияет на качество жизни (за счёт нормализации стула, уменьшения числа обострений и интенсивности абдоминального болевого синдрома),– короткоцепочечные фруктоолигосахариды 5 г/ежедневно или галакто-олигосахариды 3.5 г/ежедневно – с уровнем доказательности B-C [1].
Отметим, что в РФ фрукто- и олигосахариды представлены в только в виде комбинированных препаратов, а в рекомендуемых количествах только в составе некоторых синбиотиков, н апример, в БАД Энтеролактис, Максилак, РиоФлора. Во многих средствпх количественный состав не уточнен.
Синбиотики
Синбиотики - продукты, содержащие как пробиотики, так и пребиотики, оказывающие положительное влияние на состояние здоровья макроорганизма [1].
Lactobacillus acidophilus CBT LA1 + Lactobacillus rhamnosus CBT LR5 + Bifidobacterium longum CBT BG7 + Bifidobacterium lactis CBT BL3 + Bifidobacterium bifidum CBT BF3 +Streptococcus thermophilus CBT ST3 + фруктоолигосахариды ( Необиотик Лактобаланс )
Lactobacillus acidophilus CBT LA14 + Lactobacillus rhamnosus CBT LR32 + Bifidobacterium lactis CBT BL4 + инулин + витамины группы В-В1,В6,В12 ( Флориоза )
Lactobacillus rhamnosus + Bifidobacterium bifidum + Lactobacillus acidophilus + Lactobacillus plantarum + Lactobacillus bulgaricus +инулин+псилиум ( Фитомуцил Сорбент форте )
Lactobacillus Acidofilus LA-5 и Bifidobacterium ВВ-12 + фруктоолигосахариды + нутриоза + гидроксипропилметилцеллюлоза ( Флорок форте )
Bifidobacterium animalis subspecies lactis BS01 + инулин, мальтодекстрин ( Пробиолог транзит [H7] )
Bifidobacterium bifidum + Bifidobacterium longum + Bifidobacterium infantis + Lactobacillus rhamnosus+ микрокристаллическая целлюлоза + олигофруктоза ( Флоросан )
L.rhamnosus R049 + L.caseiR215 + L.plantarum R202 + L.acidophilus R053 + B.longum R023 + B.bifidum R071 + B.breve R070 + фруктоолигосахариды ( Флора-Дофилус )
Bifidobacterium bifidum W23 + Bifidobacterium lactis W51 + Lactobacillus acidophilus W37 + Lactobacillus acidophilus W55 + Lactobacillus paracasei W20 + Lactobacillus plantarum W62 + Lactobacillus rhamnosus W71 + Lactobacillus salivarius W24 + инулин + фруктоолигосахариды 1,2% ( РиоФлора )
Bifidobacterium longum + Bifidobacterium breve + Lactobacillus acidophilus + Lactobacillus rhamnosus + Lactobacillus plantarum + Lactobacillus casei + Lactococcus lactis + Streptococcus thermophilus + Фруктоолигосахариды 5 г + микрокристаллическая целлюлоза ( Максилак )
Lactobacillus paracasei , штамм CNCM I-1572 + фруктоолигосахариды 5 г ( Энтеролактис )
Lactobacillus acidophilus DDS®-1, B.bifidum UABB-10, B.longum UABL-14, B.lactis UABLA-12, рисовый мальтодекстрин, фруктоологосахариды ( ЛББ )
В настоящий момент со средним и низким уровнем доказательности (B-C), ввиду недостаточного количества исследований, рекомендованы следующие комбинации:
Увеличение количества компонентов не сделало синбиотики универсальными препаратами. При разных состояниях показали свою эффективность разные комбинации микроорганизмов.
Подводим итог по всем биотикам
На данный момент все рекомендации по биотикам имеют слабую силу. Для некоторых нозоологий (неспецифический язвенный колит, болезнь Крона, диарея, псевдомембранозный колит) назначение пробиотиков, особенно комбинаций, не рекомендуется из-за недостаточной степени изученности [1,5]. Так же есть вероятность развития сепсиса, вызванного штаммами пробиотических микроорганизмов, у групп риска – наличие иммунного дефицита, ослабленные пациенты, в т.ч. с онкологическими заболеваниями, нарушением кишечного эпителиального барьера. [6]
В настоящий момент основное место применения для про-, пре или синбиотика это профилактика дисбиотических состояний и лечение дисбиоза при конкретной патологии в составе комплексной терапии. В клинической практике продолжают использоваться пробиотики всех поколений. Эффект от пребиотика проявится быстрее, но пробиотик будет работать дольше. Выбор препарата будет обусловлен не только клиническими рекомендациями, безопасностью препарата, но также конкретной клинической ситуацией: при наличии синдрома диареи – препаратом выбора может быть пробиотик 4го поколения или синбиотик, при наличии синдрома избыточного бактериального роста – санирующие пробиотики 2-го поколения, а при запоре – лучше показали себя некоторые пребиотики. Но то, как будет работать про- или пребиотик в каждой конкретной ситуации зависит не только от самого препарата, но и от индивидуальных особенностей микробиоты человека.
Применение пробиотических и пребиотических и синбиотических препаратов продолжает оставаться перспективным для дальнейших клинических исследований. Пробиотические препараты широко используются в медицинской реабилитации и комплексе профилактических мероприятий [2]. Дальнейшие исследования будут способствовать усилению требований к данным препаратам с точки зрения безопасности и доказанной эффективности. Несмотря на большое разнообразие различных штаммов микроорганизмов и их комбинаций, остается нерешенной проблемой индивидуального подбора препаратов. Это связано с тем, что кишечный микробиом у каждого человека индивидуален, а современные методы для оценки состава кишечной микробиоты не применяются широко.
В 2001г рабочей группой ВОЗ было дано современное определение пробиотиков, которое сохраняет свою актуальность: Пробиотики — это живые микроорганизмы, которые при применении в адекватных количествах вызывают улучшение здоровья организма-хозяина.
Большинство пробиотиков — это микроорганизмы, продуцирующие молочную кислоту и относящиеся к типичным представителям нормальной микробиоты человека.
При отборе пробиотических штаммов используются четкие критерии, в соответствии с которыми штаммы должны быть безопасными, то есть не могут обладать патогенными свойствами, должны быть кислотоустойчивыми – то есть сохраняться под воздействием желудочного сока (или бактерии должны быть заключены в кислотоустойчивую капсулу), должна проявляться способность выживать в просвете кишечника.
Пребиотики по сути являются пищевым субстратом для полезных бактерий.
Более точно — согласно определению, пребиотики: селективно ферментируемый ингредиент, который вызывает специфические изменения, как в составе, так и в функциональной активности микробиоты желудочно-кишечного тракта, оказывающие положительное влияние на здоровье организма хозяина.
Постбиотики – это неживые бактериальные продукты или продукты метаболизма пробиотических микроорганизмов, которые обладают биологической активностью в отношении организма-хозяина.
Пребиотики — компоненты пищи, которые не перевариваются и не усваиваются в верхних отделах желудочно-кишечного тракта, но ферментируются микрофлорой толстого кишечника человека для стимуляции ее роста и жизнедеятельности. Большая часть пребиотиков является олигосахаридными углеводами. Наиболее выраженными свойствами обладают фруктозо-олигосахариды, инулин, галакто-олигосахариды, лактулоза и лактитол [1].
Неуглеводные олигосахариды
Некоторые соединения не классифицированы как углеводы, но все же включены в группу пребиотиков, например, флаванолы, полученные из какао. Эксперименты in vivo и in vitro показали, что флаванолы могут стимулировать молочнокислые бактерии [1].
Механизмы влияния пребиотиков на микробиоту кишечника
Пребиотики, являясь источником энергии для микробиоты кишечника, способны модулировать состав и функционирование микроорганизмов. В процессе проведения функциональной метагеномики было выяснено, что отдельные виды бактерий в ходе филогенеза передали способность метаболизировать определенный пребиотик. Например, некоторые участки метагенома микробиоты человека идентифицированы как участники метаболизма нескольких пребиотиков в ксеногенном хозяине, таком как E. coli. Клоны различных видов, таких как Actinobacteriae, Bacteroidetes и Firmicutes, могут ферментировать фруктоолигосахариды, галактоолигосахариды и ксилоолигосахариды. Важный фактор для определения видов, способных ферментировать определенный пребиотик — длина цепочки. Например, инулин (DP ≤ 60 — здесь и далее: степень полимеризации) может быть ферментирован только несколькими видами, тогда как фруктоолигосахариды могут метаболизироваться гораздо большим количеством микроорганизмов (с DP ≤ 10). Побочный продукт ферментации сложного пребиотика может быть субстратом для какого-либо микроорганизма. Например, Ruminococcus bromii может разлагать резистентный крахмал, и некоторые виды микроорганизмов могут использовать продукты ферментации этой реакции, которые, в основном, представляют собой кислоты, снижающие рН кишечника. Изменение рН кишечника с 6,5 до 5,5 может способствовать модуляции популяции кишечной микробиоты, влияя на чувствительные к кислоте виды (например, Bacteroides) и оказывать бутирогенный эффект (образование бутирата бактериями Firmicutes) [1].
.
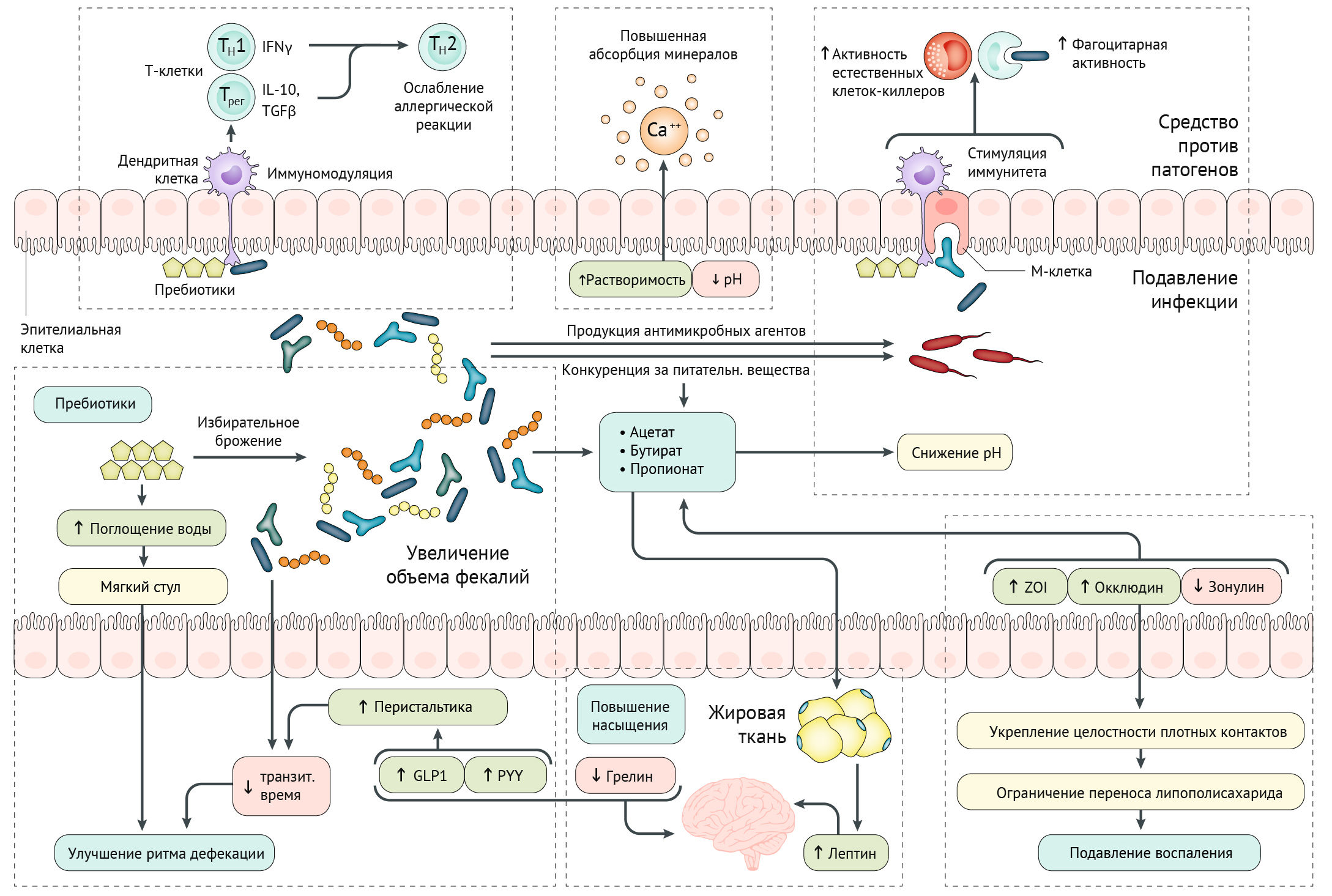
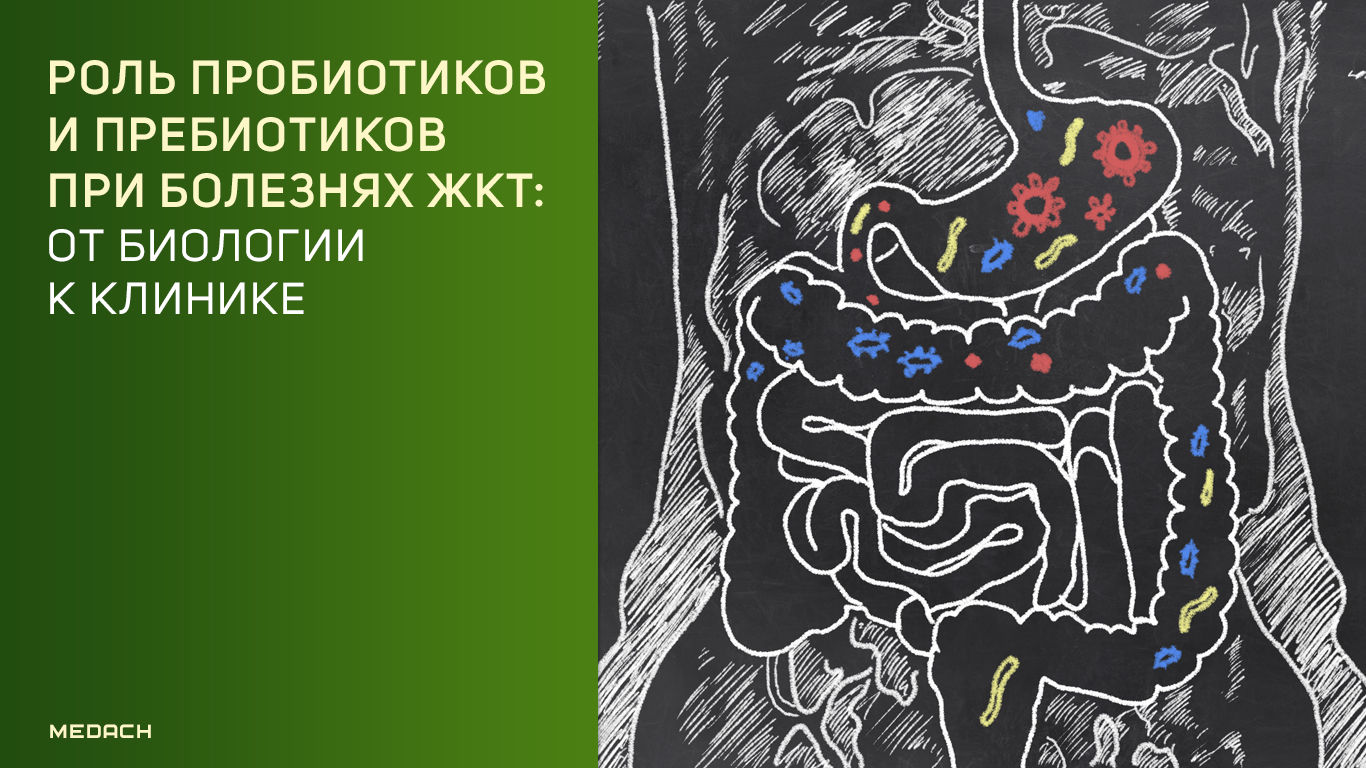
Пребиотики, попадая в кишечник, избирательно используются как энергетический субстрат, способствуя росту бактерий определенных видов, что в итоге благоприятно сказывается на организме в целом. Благодаря росту количества микробов происходит увеличение объема фекалий и учащение ритма дефекации. Увеличение биомассы и компонентов клеточной стенки бактерий могут также влиять и на иммунную регуляцию организма. Бактерии, отвечающие на потребление пребиотиков, могут влиять на состав микробиоты путем выработки антимикробных веществ (например, пептидов) и других конкурентных взаимодействий, уменьшая активность инфекционных агентов, содержащих липополисахариды.
Пробиотики
Пробиотики — это микроорганизмы, использующиеся в терапевтических целях; также к ним относятся пищевые продукты и биологически активные добавки, содержащие живые микрокультуры [2]. Пробиотики приобрели широкую популярность, при этом клинические исследования, направленные на их изучение, неоднозначны. Результаты метаанализов позволяют предположить, что пробиотики могут обеспечить преимущества при лечении некоторых состояний, таких как инфекционная диарея и диарея, развившаяся после приема антибиотиков [3].
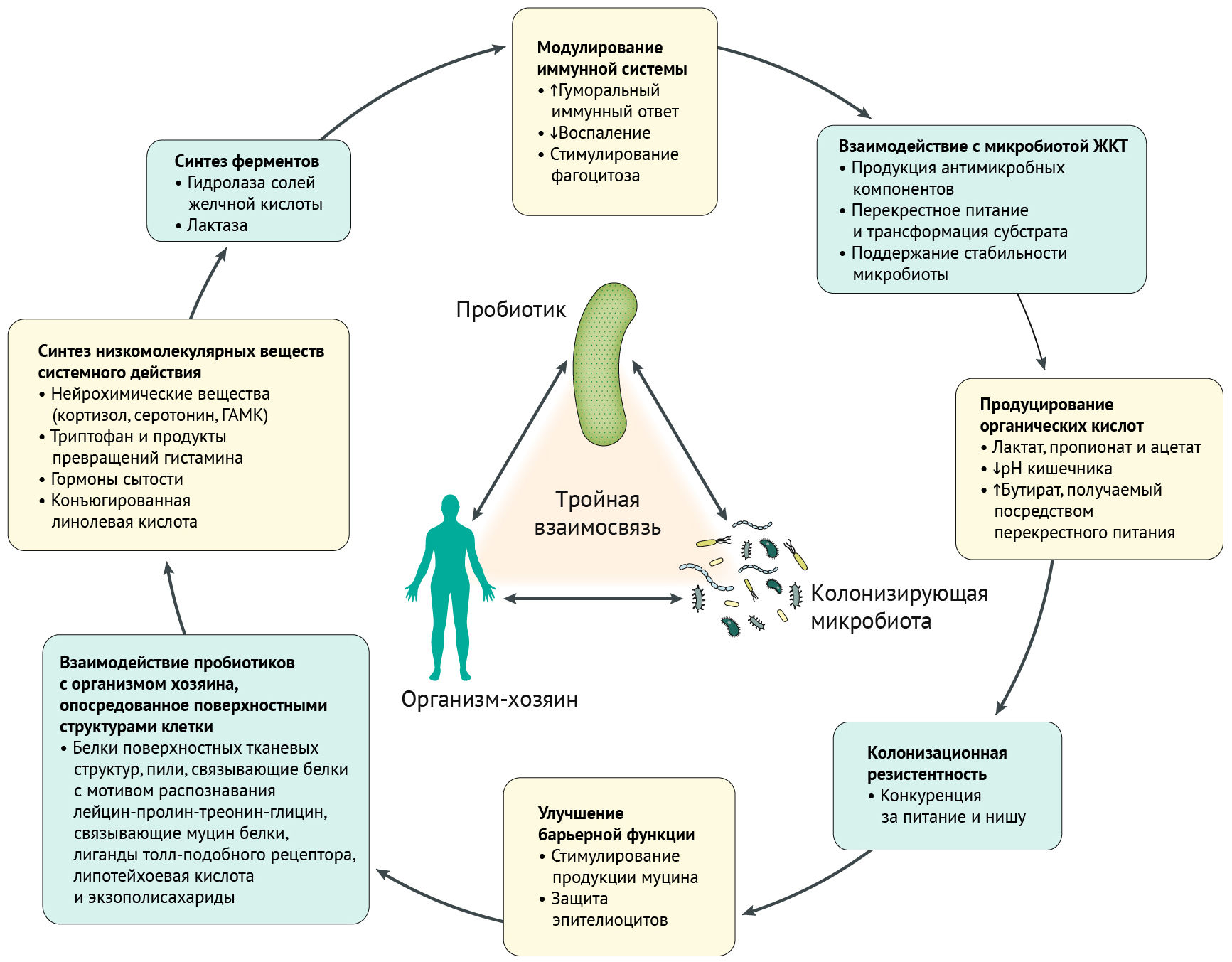
Польза пробиотиков обусловлена разнообразными механизмами. Например, синтез противомикробных продуктов и конкурентное питание с другими микроорганизмами; эти механизмы напрямую управляются взаимодействием с резидентной микробиотой.
Изучение механизмов работы пробиотиков часто основывались на исследованиях in vitro или на животных. Не все механизмы были подтверждены у людей и имеются у каждого штамма. Вероятно, в одном пробиотике может сочетаться несколько механизмов, и важность конкретного зависит от многих факторов. Например, в воспаленном кишечнике самой важной будет способность к подавлению активности воспалительных медиаторов и улучшение функции эпителиального барьера, в то время как в толстой кишке для нормализации моторики особенно важно будет увеличение количества короткоцепочечных жирных кислот и гидратация [4].
Недавние исследования
Суэз (Suez) с коллегами занимались изучением восстановления микробиоты кишечника после лечения антибиотиками и обнаружили, что пробиотики быстро колонизируют кишечник, но препятствуют его повторному заселению нормальной микробиотой на срок до пяти месяцев. В группе, прошедшей трансплантацию аутологичной фекальной микробиоты, было отмечено быстрое восстановление микробиоты и ее возвращение к норме в течение нескольких дней. Также авторы показали, что колонизация происходит по индивидуальным паттернам. В ЖКТ некоторых людей пробиотики не приживались в принципе. Из этого следует, что многие люди, принимающие добавки с пробиотиками, впустую тратят свои деньги [3].
Фридман (Fridman) и его коллеги провели рандомизированное контролируемое исследование пробиотика, содержащего Lactobacillus rhamnosus и Lactobacillus helveticus, с участием детей, поступивших в отделение неотложной помощи с гастроэнтеритом. Вопреки ожиданиям, ученые обнаружили, что пробиотик не предотвращает развитие умеренного или тяжелого гастроэнтерита в течение 14 дней после включения в исследование. В другой работе Шнаудер (Schnadower) и его коллеги получили схожие результаты в исследованиях с Lactobacillus rhamnosus штамма GG. В обоих исследованиях использовались пробиотики, отпускающиеся без рецепта в Северной Америке, и значительных отличий от плацебо в отношении продолжительности диареи, рвоты и количества незапланированных посещений врача показано не было [3].
Каждый из нас имеет уникальный кишечный микробиом, и воздействие различных бактерий — очень индивидуальный фактор. Поэтому использование пробиотиков для достижения оптимальных результатов должно быть персонализированным. Широко доступные добавки могут не содержать нужные штаммы или содержать недостаточное количество бактерий. Вместо приема биодобавок и лекарств, лучше отдавать предпочтение организации здорового и разнообразного питания. Такой подход принесет больше пользы здоровью [3].
Применение определенных пробиотических штаммов при конкретных показаниях, в свою очередь, может быть оправдано и эффективно: некротический энтероколит [5], антибиотикоассоциированная диарея у детей [6] и ее предотвращение [7], редкий стул и ощущение дискомфорта [8], детская колика [9], язвенный колит легкой и средней степени тяжести [10], синдром раздраженного кишечника [11], острая диарея [12], профилактика инфекции Clostridium difficile (связанной с диареей [13] и сепсисом у новорожденных [14]). Метаанализ, опубликованный в 2019 году, показал, что применение пробиотиков у детей может уменьшить необходимость применения антибиотиков [15]. Предложены также рекомендации по применению пробиотиков у детей, проживающих в Азиатско-Тихоокеанском регионе, кроме того недавно опубликован обзор литературы и рекомендаций, сделанный экспертами из Южной Америки [4].
В настоящее время имеются доказательства того, что профили микробиоты стула у пациентов с воспалительными заболеваниями кишечника отличаются от таковых у пациентов без патологии, но пока не ясно почему. Неизвестно, вызваны ли эти различия основным диагнозом или каким-либо другим фактором, например, лекарственным препаратом или изменением привычного питания [4].
Применение пребиотиков и пробиотиков обещает смягчить прогрессирование заболевания или его симптомов с помощью модуляции микробиоты. Понимание состава и функций микробиома у донора и реципиента может дать понять, насколько клинический успех зависит от этих факторов. Действительно, в некоторых клинических исследованиях отмечается важность исходного состава микробиоты у испытуемых. На характер микробиоты могут также влиять образ и условия жизни, диета, лекарства, консистенция стула, а также другие факторы, в том числе возраст. Кроме того, методология исследований и управление данными могут подвести к ложной интерпретации оценок микробиоты, что может ввести исследователей в заблуждение. Хотя при применении пребиотиков и пробиотиков наблюдаются клинические улучшения, ученые все же должны выяснить роль микробиома в этих экспериментах для того, чтобы оптимизировать данные о краткосрочных и долгосрочных результатах. Учет фенотипических и генотипических характеристик участников исследования имеет важное значение для успеха клинических испытаний. Изучение генетических характеристик может иметь значение для пациентов с микробиом-опосредованным воспалением кишечника. Наличие генов, связанных с развитием патологии, как правило, является фактором риска. Среди воспалительных заболеваний кишечника в данном аспекте чаще всего рассматривают болезнь Крона и язвенный колит. Существуют генетические мутации, ассоциированные с болезнью Крона, это в свою очередь усложняет разработку эффективных терапевтических стратегий. Данный аспект может частично объяснить, почему использование пробиотических штаммов для лечения болезни Крона, как правило, неэффективно. Неизвестно, почему после приема пробиотиков при язвенном колите легкой или средней степени тяжести состояние несколько улучшается, а при болезни Крона — нет. Для успешных манипуляций с микробиотой необходимо понимание связи между микробиомом и генетическими факторами риска для человека. Это потребует перехода от микробного геномного секвенирования к транскриптомным, метаболическим и протеомным исследованиям. Ученые продолжают изучать перспективы лечения заболеваний с помощью влияния на микробиом путем применения пробиотиков [4].
Вдохновившись результатами исследования, заинтересованные стороны часто забывают, что ассоциация каких-либо фактов не всегда является их прямой причинно-следственной связью. Например, слепое исследование 34 образцов ткани пищевода (полученных при помощи биопсии) показало, что микробиомы можно разделить на два типа. У первого типа отмечалось преобладание рода Streptococcus, ткани были фенотипически нормальными. У второго типа отмечалась большая доля грамотрицательных анаэробов и/или микроаэрофилов, что коррелировало с эзофагитом и наличием пищевода Барретта. Данное исследование не подтверждает причинно-следственную связь, так как существует множество потенциальных причин различий микробиома, включая характер питания, прием лекарств и образ жизни. Согласно одной из гипотез, применение в качестве терапии бактерий Streptococcus может уменьшить прогрессирование эзофагита и синдрома Барретта, но эта теория пока не доказана. Различие в микробиомах означает, что его модификация не обязательно приведет к улучшению состояния здоровья [4].
Для более эффективного применения пребиотиков и пробиотиков в клинике необходимо следующее [1]:
Читайте также:

