Как сделать практическую работу по химии 7 класс получение кислорода из гидроген пероксида
Добавил пользователь Евгений Кузнецов Обновлено: 04.10.2024
В лаборатории кислород получают разложением перманганата калия при нагревании или разложением пероксида водорода в присутствии катализатора:
Обнаружить выделившийся кислород можно с помощью тлеющей лучинки. В сосуде с кислородом лучинка разгорается ярким пламенем.
В лаборатории водород получают действием соляной или разбавленной серной кислоты на металлы (цинк, железо, алюминий).
Собирают водород вытеснением воды или воздуха. Сосуд для водорода при вытеснении воздуха располагают дном вверх.
Вид урока: лабораторная работа.
Цель урока: получить в лабораторных условиях кислород и изучить его химические свойства.
- продолжить изучение кислорода на примере исследования его химических свойств;
- формировать практические умения в процессе получения кислорода из пероксида водорода;
- способствовать развитию исследовательских компетенций при сравнении процессов горения веществ на воздухе и в чистом кислороде; в процессе получения кислорода с участием катализатора и без него;
- включить обучающихся в активный познавательный процесс, предоставляя возможность выбора действия на уроке: лабораторная работа, анализ и наблюдение, описание увиденного, работа с текстом учебника, запись уравнений, химический диктант и др.
- заинтересовать пассивную часть обучающихся используя стихотворную, лабораторную и другие формы работы;
- продолжить работу по накоплению фактического материала для усвоения понятий и обобщений мировоззренческого характера о роли кислорода на Земле;
- воспитывать бережное отношение ко времени урока, развивать умение работать в быстром темпе.
Сухая пробирка с Н2О2, стакан, газоотводная трубка, спички, держатель, спиртовка, лучинка, штатив для пробирок.
Стакан, лучинка, спички, газоотводная трубка, известковая вода, катализатор МпО2, раствор Н2О2
2 пробирки с пробками, чашка с водой, стакан с водой, газоотводная трубка, 2 металлические ложки, спички, спиртовка, штатив лабораторный, красный фосфор, сера (кристаллическая), колба с кислородом, пробирка с кислородом.
Задача.
Какая колба весит больше: с сухим или мокрым кислородом? (2 колбы с надписями “сухой кислород”, “мокрый кислород”)
1. Формулировка темы урока, целеполагание.
2. Актуализация знаний (через химический диктант).
2. Проверка диктанта, самооценка.
4. Изучение нового материала:
а) Фронтальная беседа.
б) Лабораторная работа (выполняют ученики)
- Опыт №1 “Получение кислорода из пероксида водорода (тв.), собирание и распознавание”.
- Опыт №2 “Получение кислорода в присутствии катализатора”.
в) Демонстрационный опыт (выполняет учитель)
Опыт №3 “Химические свойства кислорода”.
г) Словарная работа – знакомство с новыми понятиями: оксиды, катализатор, реакция окисления, окислитель.
6. Закрепление нового материала – через выделение главного – разгадывание шифровки.
7. Решение задачи.
Химический диктант
1. Это газ, имеющий запах (нет).
2. Он занимает 1 место во Вселенной по распространенности (нет).
3. При обычных условиях это газ без цвета, вкуса и запаха (да).
4. В лаборатории его можно получить из марганцовки (да).
5. Он легче воздуха (нет).
6. Он может быть твердым (да).
7. Его первым получил Ломоносов (нет).
8. В природе он в свободном состоянии не встречается, только в связанном (нет).
9. При температуре минус сто восемьдесят три градуса он превращается в жидкость (да).
10. В 1000 мл воды растворяется 30 мл этого газа (да).
11. Он получен Дж. Лавуазье из оксида ртути (да).
12. Его рейтинг на планете Земля самый высокий среди других элементов (да).
4. Проверка диктанта (на доске записаны правильные ответы) и самооценка
Поднимите руки, кто получил “5”? Кто получил – “4”? Кто получил – “3”?
Мы только начали изучать данную тему и у вас есть возможность поработать над своими ошибками и пробелами в знаниях.
5. Изучение нового материала.
В тетрадях записываем лабораторная работа, тему и цель: получить, собрать, распознать газ кислород и изучить его взаимодействие с другими веществами.
- Из каких веществ можно получить кислород? (Перечислить, написать уравнения)
- Как можно собрать кислород? (Назвать два способа и обьяснить на каких свойствах кислорода они основаны)
- Как распознать кислород?
- Уравнение.
- Способ собирания кислорода.
- Распознавание кислорода.
- Вывод.
В пробирке – кусочек Н2О2 (тв.) – закройте пробирку газоотводной трубкой, конец ее поместите в стакан, закрепите ее в держателе и нагревайте. Кислород тяжелее воздуха, он будет вытеснять воздух и займет объем стакана. Зажгите лучинку, потушите, тлеющею внесите в стакан с О2. Что мы наблюдаем? Где лучше горит лучинка? Почему?
Какой вывод сделаем? (Лучинке лучше гореть в кислородной среде, чем в воздухе, т.к. в воздухе есть другие вещества.)
Проведем опыт №2 “Получение О2 из Н2О2 в присутствии МпО2”.
Снова будем получать О2 из Н2О2 – но не твердой, а раствора. МпО2 – это оксид марганца, порошок черного цвета. Прилейте к нему раствор Н2О2, закройте пробкой с газоотводной трубкой, конец ее поместите в стакан и наблюдайте.
- Что происходит с раствором (в нем появляются пузырьки ).
- Почему появились пузырьки? Какой газ при этом выделяется? (Кислород). Как доказать, что это кислород? (Тлеющей лучинкой).
- Опустите в стакан тлеющую лучинку, что происходит? (Лучинка загорается).
Дайте лучинке погореть и добавьте раствор Са(ОН)2 - известковой воды. Что наблюдаем? (Прозрачный раствор известковой воды мутнеет, т.к. при горении лучинки образуется углекислый газ, который взаимодействует с известковой водой, образуя нерастворимую соль карбонат кальция).
Запишите в тетрадь:
Опыт № 2 “Получение кислорода из Н2О2 в присутствии МпО2”
- Уравнение.
- Способ собирания кислорода.
- Распознавание.
- Вывод:
- Как вы считаете, какой способ получения О2 более простой? Более безопасный? Обоснуйте свою точку зрения. Запишите вывод. (В присутствии МпО2 – катализатора, реакция идет быстрее. Катализаторы – вещества, которые ускоряют химические реакции).
А сейчас рассмотрим с какими веществами реагирует кислород.
Опыт №3 “Химические свойства О2”
Для проведения опытов я получу и соберу О2 из Н2О2 способом вытеснения воды. Пробирки с О2 закрою пробкой. О2 – мало растворим в воде, поэтому его можно так собрать.
- Вы уже провели реакцию взаимодействия О2 с углем (С), напишем уравнение.
- Внесем Р - фосфор и S – серу в пробирки с О2, запишем уравнение реакции:
- Напишите уравнение, сверьте с учебником параграф 20.
- Что можно сказать о химической активности О2 в сравнении с воздухом?
- Какой сделаем вывод на основе наблюдений?
- (О2 - активное вещество, реакции с его участием протекают более энергично, чем на воздухе).
- Обратите внимание на вещества, которые получились. Что общего в составе? Из скольких элементов они состоят? Это оксиды – сложные вещества, состоящие из 2-х элементов, один из которых кислород.
Реакции с участием О2 называется реакцией окисления (горения).
6. Что же самое главное вы должны знать о кислороде? В каких важнейших процессах он участвует?
Я зашифровала это с помощью цифр – ключ такой: цифра – это порядковый номер в таблице элементов, берите первую букву русского названия элемента.

7. Решение задачи.
Демонстрирую учащимся 2 колбы, на одной из них надпись “сухой кислород”, а на другой “мокрый кислород”. Задаю вопрос: “ Какая колба весит больше с сухим или влажным кислородом?”. Ученики рассчитывают молярную массу кислорода и воды, сравнивают их и делают вывод, что сухой кислород тяжелее, чем мокрый.
Что? Почему? Зачем? И где?
Живут в земле, в огне, в воде.
Вот в первый раз огонь добыт.
(А почему огонь горит?)
Зерно под солнцем проросло.
(Зачем растению тепло?)
Дым лёгкий, а скала тверда.
Что значит лед, а что - вода?
Что? Почему? Зачем? И где?
Мы всё узнать хотим,
Соль растворяется в воде,
А мел нерастворим.
Бумага не сгорит дотла:
В печи останется зола.
А если медь в печи нагреть,
То станет тяжелее медь.
С окалиною вместе.
Не верите – так взвесьте.
Открытий путь - нелёгкий путь,
Но человеку – не свернуть,
Что? Почему? За ним следят,
Чтоб шел вперёд, а не назад.
Вот почему из года в год
Наука движется вперёд!
Можно ли наш урок назвать исследованием, а вас исследователями? (Ответ аргументируйте).

Цель работы: Получить кислород (методом вытеснения воздуха) и изучить его свойства.
Содержимое разработки
8 класс Практическая работа №3
Практическая работа №3
Получение и свойства кислорода
Цель работы:
Получить кислород (методом вытеснения воздуха) и изучить его свойства.
Приборы и оборудование: KMnO4 – перманганат калия (марганцовка), пробка с газоотводной трубкой, лучинка, сухое горючее, спички, стакан, вата, пробирка.
Ход работы:

1. Соберите прибор для получения газов,
как показано на рисунке. В пробирку
насыпьте примерно на 1/4 её объёма
перманганата калия и у отверстия
пробирки положите кусочек ваты.
Закройте пробирку пробкой с газоотводной
трубкой. Укрепите пробирку в лапке штатива
под углом 90°, конец газоотводной трубки
в колбу для собирания газа кислорода. Соберите кислород в колбу.
При работе со спиртовкой соблюдайте технику безопасности!
2. Наличие кислорода в колбе проверить при помощи тлеющей лучинки.
Данная практическая работа по химии разработана для учащихся 8 класса. В содержании работы имеется цели обучения, критерии оценивания и дескрипторы, ход работы, а также вопросы дифференцированного типа. Материал можно использовать, как рабочий лист учащегося. При планировании уроков нет необходимости использовать материал полностью, можно частично выбрать только нужное. Все задания интересны и направлены на развитие практических и мыслительных навыков учащихся.Данную практическую работу можно использовать при разработки уроков или планировании экспериментов.
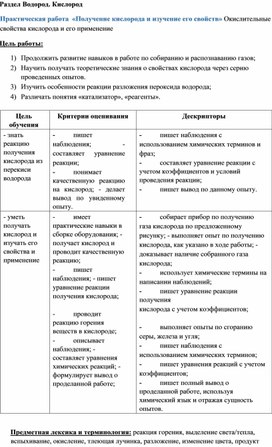
Раздел Водород. Кислород
Цель работы:
1) Продолжить развитие навыков в работе по собиранию и распознаванию газов;
2) Научить получать теоретические знания о свойствах кислорода через серию проведенных опытов.
3) Изучить особенности реакции разложения пероксида водорода;
Цель обучения
Критерии оценивания
Дескрипторы
реакцию получения кислорода из перекиси водорода
- пишет наблюдения; - составляет уравнение реакции;
- понимает качественную реакцию на кислород; - делает вывод по увиденному опыту.
- пишет наблюдения с использованием химических терминов и фраз;
- составляет уравнение реакции с учетом коэффициентов и условий проведения реакции;
- пишет вывод по данному опыту.
- уметь получать кислород и изучать его свойства и применение
- имеет практические навыки в сборке оборудования; - получает кислород и проводит качественную реакцию;
- пишет наблюдения; - пишет уравнение реакции получения кислорода;
- проводит реакцию горения веществ в кислороде;
- описывает наблюдения; - составляет уравнения химических реакций; - формулирует вывод о проделанной работе;
- собирает прибор по получению газа кислорода по предложенному рисунку; - выполняет опыт по получению кислорода, как указано в ходе работы; - доказывает наличие собранного газа кислорода;
- использует химические термины на написании наблюдений;
- пишет уравнение реакции получения
кислорода с учетом коэффициентов;
- выполняет опыты по сгоранию серы, железа и угля;
- пишет наблюдения с использованием химических терминов;
- пишет уравнения реакций с учетом коэффициентов;
- пишет полный вывод о проделанной работе, используя химический язык и отражая сущность опытов.
Предметная лексика и терминология: реакция горения, выделение света/тепла, вспыхивание, окисление, тлеющая лучинка, разложение, изменение цвета, продукт реакции разложения, оксиды, шипение, разогревание смеси, выделение газа, изменение цвета раствора, катализатор, реагент, продукты, ускоритель, разложение.
Оборудование и реактивы: пробирка с газоотводной трубкой, асбестовая сетка, металлический штатив, химические стаканы на 50 мл (4 шт.), химическая ложечка для сжигания веществ, спички, сера, тонкая железная проволока, кусочки древесного угля, щипцы, 3% раствор пероксида водорода, перманганат калия (крист.).
ТБ: Все опыты следует проводить после проведения учителем инструктажа по технике безопасности. Опыты по сжиганию серы проводить в вытяжном шкафу!
Получение кислорода из перманганата калия Задание 1:
А) Соберите прибор, как показано на рисунке 3.

Рис.3 Прибор для получения кислорода из перманганата калия, методом вытеснения воздуха
В) Осуществите опыт.
С) Проведите качественную реакцию на кислород. Возьмите тлеющую лучинку и внесите её в сосуд с кислородом.
Установите пробирку в лапку штатива. Налейте в пробирку раствор перекиси водорода и добавьте совсем немного диоксида марганца (или несколько кристалликов марганцовки). Проведите качественную реакцию на кислород.
Попросите учащихся ответить на вопросы и выполнить задания:
1) Какой тип реакции был продемонстрирован?
2) Чем являлся диоксид марганца в данной реакции?
3) Составьте уравнение реакции получения кислорода.
4) Что является качественной реакцией на кислород?
6) В организме человека перекись водорода вырабатывается клетками киллерами – это лейкоциты и гранулоциты. Введённая перекись водорода подвергается воздействию фермента каталазы, которая также расщепляет ее на атомарный (активный) кислород и воду. Как в биологии называют подобные реакции?
Взаимодействие угля, железа, серы с кислородом
Задание 3: Соберите четыре стакана кислорода (50 мл)/ или возьмите заранее собранные склянки у лаборанта.
А) Положите в ложечку для сжигания веществ кусочек древесного угля и раскалите его в пламени спиртовки. Затем ложечку с тлеющим углем внесите в стакан с кислородом.
В) Сделайте из тонкой железной проволоки небольшую спираль и прикрепите к ней спичку. Держите проволоку щипцами. Подожгите спичку. Дайте ей разгореться и внесите в стакан с кислородом.
С) Опыт проводить в вытяжном шкафу! В ложечку для сжигания веществ поместите немного порошка серы и подожгите её в пламени спиртовки. Проведите наблюдение горения серы в воздухе.
Затем горящую серу поместите в стакан с кислородом.
Как изменилось пламя? Почему?
Сформулируйте вывод о проделанной работе?
Контрольные вопросы
1) Как можно назвать реакции, протекающие с выделением тепла и света?
2) Напишите название реакции синтеза кислорода в природе.
3) Где используется кислород? Напишите не менее 5 областей применения.
4) Каковы физические свойства кислорода? Допишите там, где это необходимо
Читайте также:

