Как сделать планетарную модель атома
Добавил пользователь Skiper Обновлено: 04.10.2024
На уроке рассматриваются: понятия атомное ядро, опыты Резерфорда, планетарная модель строения атома; сравниваются модели атома Томсона и Резерфорда, даны некоторые сведения о фактах, подтверждающих сложное строение атома, о работах учёных по созданию модели строения атома.
Атомное ядро — тело малых размеров, в котором сконцентрирована почти вся масса и весь положительный заряд атома.
Размеры ядра: диаметр порядка 10 -12 —10 -13 см (у разных ядер диаметры различны).
Размер атома: примерно 10 -8 см, т. е. от 10 до 100 тысяч раз превышает размеры ядра.
Планетарная модель атома Резерфорда: в целом атом нейтрален, в центре атома расположено положительно заряжённое ядро, в котором сосредоточена почти вся масса атома, электроны движутся по орбитам вокруг ядра, заряд ядра, как и число электронов в атоме, равен порядковому номеру элемента в периодической системе Д.И.Менделеева.
Ядро атома водорода названо протоном и рассматривается как элементарная частица.
Ядро атома водорода имеет положительный заряд, равный по модулю заряду электрона, и массу, примерно в 1836,1 раза больше массы электрона.
Частота излучений атома водорода составляет ряд серий: серия Бальмера, серия Лаймана, серия Пашена и другие, каждая из которых образуется в процессе перехода атома в одно из энергетических состояний.
Обязательная литература по теме урока:
Основное содержание урока
Долгое время, физика накапливала факты о свойстве вещества для полного представления о строении атома. И только в XIX веке изучение атомического строения вещества существенно сдвинулось с точки покоя.
Большую роль в развитии атомистической теории сыграл выдающийся русский химик Дмитрий Иванович Менделеев, разработавший в 1869 году периодическую систему элементов, в которой впервые был поставлен вопрос о единой природе атомов.
Важным свидетельством сложной структуры атомов явились исследования спектров, излучаемые веществом, которые привели к открытию линейчатых спектров атомов. В начале XIX века в излучении атома водорода были открыты спектральные линии в видимой части спектра.
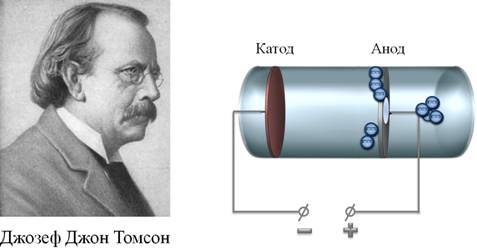
Идеи электронной структуры атома теоретически и гипотетически формулировались учёными. В 1896 году Хендрик Лоренц создал электронную теорию о том, что электроны являются частью атома. Эту гипотезу в 1897 году подтвердили эксперименты Джозефа Джона Томсона. Им был сформулирован вывод о том, что существуют частицы с наименьшим отрицательным зарядом - электроны и они являются частью атомов.
Таким образом, к началу XX века учёные сделали вывод о том, что атомы материи имеют сложную внутреннюю структуру. Они являются электрически нейтральными системами, а носителями отрицательного заряда атомов являются лёгкие электроны, масса которых составляет лишь малую долю массы атомов. Однако модель атома Томсона находилась в полном противоречии с экспериментами по изучению распределения положительных зарядов.
Электрон – наименьшая электроотрицательная заряжённая элементарная частица
Масса покоя электрона me = 9,1·10 -31 кг;

- отношение заряда электрона к его массе.
Немецкий физик Филипп фон Ленард в 1903 году проводил опыты, в которых пучок быстрых электронов легко проходил через тонкую металлическую фольгу. На основании этого Ленард предположил, что атом состоит из нейтральных частиц или нейтральных дуплетов с совмещённым положительным и отрицательным зарядами, рассредоточенными в атоме, где большая площадь представляет собой пустоту.

В 1904 году японский физик Хентаро Нагаока выдвинул гипотезу о том, что атом состоит из тяжелого положительно заряженного ядра, окруженного кольцами из большого числа электронов, колебания которых и являются причиной испускания атомных спектров, по аналогии с теорией устойчивости колец Сатурна.

Но в физике уже более 200 лет существует главное правило: окончательный выбор между гипотезами может быть сделан только на основе опыта. Эксперименты, проведенные в первый раз Эрнестом Резерфордом, сыграли решающую роль в понимании структуры атома.

30.08.1871 г. – 19.10.1937 г.
Британский физик новозеландского происхождения
Лауреат Нобелевской премии по химии 1908 года
Для экспериментального изучения распределения положительного заряда, а значит, и массы внутри атома Эрнест Резерфорд в 1906 г. предложил применить зондирование атома α-частицами, скорость которых составляет 1/15 скорости света.
Эти частицы возникают при распаде, например, радия и некоторых других радиоактивных элементов. Сами же α-частицы – это ионизированные атомы гелия, положительный заряд гелия в два раза больше заряда электрона +2He. Этими частицами Резерфорд бомбардировал атомы тяжёлых элементов (золото, медь и др.). Если бы электроны были равномерно распределены по всему объёму атома (по модели атома Томсона), электроны не могли бы заметно изменять траекторию α –частиц, так как размеры и масса электронов в 8000 раз меньше массы α-частиц. Точно так же камушек в несколько десятков граммов при столкновении с автомобилем не может изменить его скорость.
Изменение направления движения α-частиц может вызвать только массивная часть атома, при этом положительно заряжённая. Весь прибор размещался в сосуде, из которого был откачан воздух. Радиоактивный препарат, помещался внутри свинцового цилиндра, вдоль которого был высверлен узкий канал. Пучок α -частиц из канала падал на тонкую фольгу из тяжёлого металла. После рассеяния α-частицы попадали на полупрозрачный экран, покрытый сульфидом цинка. Столкновение каждой частицы с экраном сопровождалось сцинтилляцией (вспышкой света), которую можно было наблюдать в микроскоп.
Чтобы обнаружить отклонение α-частиц на большие углы Резерфорд окружил фольгу экранами. Сотрудники Резерфорда вели счёт α-частиц, попадающих в регистрирующее устройство при отклонении их на от первоначального направления на определённый угол φ (фи). Данные из серии опытов, за определённый период времени, приведены в таблице:
Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена.
Вы можете отредактировать эту статью, добавив ссылки на авторитетные источники.
Эта отметка установлена 6 мая 2012.


Новую модель строения атома Резерфорд предложил в 1911 году как вывод из эксперимента по рассеянию альфа-частиц на золотой фольге, проведённого под его руководством. При этом рассеянии неожиданно большое количество альфа-частиц рассеивалось на большие углы, что свидетельствовало о том, что центр рассеяния имеет небольшие размеры и в нём сосредоточен значительный электрический заряд. Расчёты Резерфорда показали, что рассеивающий центр, заряженный положительно или отрицательно, должен быть по крайней мере в 3000 раз меньше размера атома, который в то время уже был известен и оценивался как примерно 10 -10 м. Поскольку в то время электроны уже были известны, а их масса и заряд определены, то рассеивающий центр, который позже назвали ядром, должен был иметь противоположный электронам заряд. Резерфорд не связал величину заряда с атомным номером. Этот вывод был сделан позже. А сам Резерфорд предположил, что заряд пропорционален атомной массе.
Недостатком планетарной модели была её несовместимость с законами классической физики. Если электроны движутся вокруг ядра как планеты вокруг Солнца, то их движение ускоренное, и, следовательно, по законам классической электродинамики они должны были бы излучать электромагнитные волны, терять энергию и падать на ядро. Следующим шагом в развитии планетарной модели стала модель Бора, постулирующая другие, отличные от классических, законы движения электронов. Полностью противоречия электродинамики смогла решить квантовая механика.
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое "Планетарная модель атома" в других словарях:
планетарная модель атома — planetinis atomo modelis statusas T sritis fizika atitikmenys: angl. planetary atom model vok. Planetenmodell des Atoms, n rus. планетарная модель атома, f pranc. modèle planétaire de l’atome, m … Fizikos terminų žodynas
Боровская модель атома — Боровская модель водородоподобного атома (Z заряд ядра), где отрицательно заряженный электрон заключен в атомной оболочке, окружающей малое, положительно заряженное атомное ядро … Википедия
Модель (в науке) — Модель (франц. modèle, итал. modello, от лат. modulus мера, мерило, образец, норма), 1) образец, служащий эталоном (стандартом) для серийного ли массового воспроизведения (М. автомобиля, М. одежды и т. п.), а также тип , марка какого либо… … Большая советская энциклопедия
Модель — I Модель (Model) Вальтер (24.1.1891, Гентин, Восточная Пруссия, 21.4.1945, близ Дуйсбурга), немецко фашистский генерал фельдмаршал (1944). В армии с 1909, участвовал в 1 й мировой войне 1914 18. С ноября 1940 командовал 3 й танковой… … Большая советская энциклопедия
СТРОЕНИЕ АТОМА — (см.) построен из элементарных частиц трёх видов (см.), (см.) и (см.), образующих устойчивую систему. Протон и нейтрон входят в состав атомного (см.), электроны образуют электронную оболочку. В ядре действуют силы (см.), благодаря которым… … Большая политехническая энциклопедия
Атом — У этого термина существуют и другие значения, см. Атом (значения). Атом гелия Атом (от др. греч … Википедия
Резерфорд Эрнест — (1871 1937), английский физик, один из создателей учения о радиоактивности и строении атома, основатель научной школы, иностранный член корреспондент РАН (1922) и почетный член АН СССР (1925). Родился в Новой Зеландии, после окончания… … Энциклопедический словарь
Άτομο — Атом гелия Атом (др. греч. ἄτομος неделимый) наименьшая часть химического элемента, являющаяся носителем его свойств. Атом состоит из атомного ядра и окружающего его электронного облака. Ядро атома состоит из положительно заряженных протонов и… … Википедия
Корпускул — Атом гелия Атом (др. греч. ἄτομος неделимый) наименьшая часть химического элемента, являющаяся носителем его свойств. Атом состоит из атомного ядра и окружающего его электронного облака. Ядро атома состоит из положительно заряженных протонов и… … Википедия
Корпускулы — Атом гелия Атом (др. греч. ἄτομος неделимый) наименьшая часть химического элемента, являющаяся носителем его свойств. Атом состоит из атомного ядра и окружающего его электронного облака. Ядро атома состоит из положительно заряженных протонов и… … Википедия
Открытие сложного строения атома — важнейший этап становления современной физики, наложивший отпечаток на все ее дальнейшее развитие.
В процессе создания количественной теории строения атома, позволившей объяснить атомные спектры, были открыты новые законы движения микрочастиц — законы квантовой механики.
Модель Томсона
Первая модель атома была предложена английским физиком Дж. Дж. Томсоном, открывшим электрон.
По мысли Томсона, положительный заряд атома занимает весь объем атома и распределен в этом объеме с постоянной плотностью.
Простейший атом (атом водорода) представляет собой положительно заряженный шар радиусом около 10 -8 см, внутри которого находится электрон.
У более сложных атомов в положительно заряженном шаре находится несколько электронов, так что атом подобен кексу, в котором роль изюминок выполняют электроны.
Однако модель атома Томсона оказалась в полном противоречии с известными уже к тому времени свойствами атома, главным из которых является устойчивость.
Опыты Резерфорда
Масса электронов в несколько тысяч раз меньше массы атомов.
Так как атом в целом нейтрален, то, следовательно, основная масса атома приходится на его положительно заряженную часть.
Для экспериментального исследования распределения положительного заряда, а значит, и массы внутри атома Эрнест Резерфорд предложил в 1906 г. применить зондирование атома с помощью α-частиц.
Эти частицы возникают при распаде радия и некоторых других элементов.
Их масса примерно в 8000 раз больше массы электрона, а положительный заряд равен по модулю удвоенному заряду электрона.
Это не что иное, как полностью ионизированные атомы гелия.
Скорость α-частиц очень велика: она составляет 1/15 скорости света.
Этими частицами Резерфорд бомбардировал атомы тяжелых элементов.
Электроны вследствие своей малой массы не могут заметно изменить траекторию а-частицы, подобно тому как камушек в несколько десятков граммов при столкновении с автомобилем не может значительно изменить его скорость.

Рассеяние (изменение направления движения) α-частиц может вызвать только положительно заряженная часть атома.
Таким образом, по рассеянию α-частиц можно определить характер распределения положительного заряда и массы внутри атома.
Схема опытов Резерфорда:

Радиоактивный препарат, например радий, помещался внутри свинцового цилиндра 1, вдоль которого был высверлен узкий канал.
Пучок -частиц из канала падал на тонкую фольгу 2 из исследуемого материала (золото, медь и пр.).
После рассеяния α-частицы попадали на полупрозрачный экран 3, покрытый сульфидом цинка.
Столкновение каждой частицы с экраном сопровождалось вспышкой света (сцинтилляцией), которую можно было наблюдать в микроскоп 4.
Весь прибор размещался в сосуде, из которого был откачан воздух.
При хорошем вакууме внутри прибора в отсутствие фольги на экране возникал светлый кружок, состоящий из сцинтилляций, вызванных тонким пучком α-частиц.
Но когда на пути пучка помещали фольгу, α-частицы из-за рассеяния распределялись на экране по кружку большей площади.
Модифицируя экспериментальную установку, Резерфорд попытался обнаружить отклонение α-частиц на большие углы.
Для этого он окружил фольгу сцинтилляциоными экранами и определил число вспышек на каждом экране.
Совершенно неожиданно оказалось, что небольшое число α-частиц (примерно одна из двух тысяч) отклонилось на углы, большие 90°.
Позднее Резерфорд признался, что, предложив своим ученикам провести эксперимент по наблюдению за рассеянием α-частиц на большие углы, он сам не верил в положительный результат.
В самом деле, предвидеть этот результат на основе модели Томсона было нельзя.
При распределении по всему атому положительный заряд не может создать достаточно сильное электрическое поле, способное отбросить α-частицу назад.
Максимальная сила отталкивания может быть определена по закону Кулона:

где
qα — заряд α-частицы;
q - положительный заряд атома;
R — его радиус;
k — коэффициент пропорциональности.
Напряженность электрического поля равномерно заряженного шара максимальна на поверхности шара и убывает до нуля по мере приближения к центру.
Поэтому чем меньше радиус R, тем больше сила, отталкивающая α-частицы.
Определение размеров атомного ядра
Резерфорд понял, что α-частица могла быть отброшена назад лишь в том случае, если положительный заряд атома и его масса сконцентрированы в очень малой области пространства.
Так Резерфорд пришел к мысли о существовании атомного ядра — тела малых размеров, в котором сконцентрированы почти вся масса и весь положительный заряд атома.

На рисунке показаны траектории α-частиц, пролетающих на различных расстояниях от ядра.
Подсчитывая число α-частиц, рассеянных на различные углы, Резерфорд смог оценить размеры ядра.
Оказалось, что ядро имеет диаметр порядка 10 -12 —10 -13 см (у разных ядер диаметры различны).
Размер же самого атома 10 -8 см, т. е. в 10—100 тысяч раз превышает размеры ядра.
Впоследствии удалось определить и заряд ядра.
При условии, что заряд электрона принят за единицу, заряд ядра в точности равен номеру данного химического элемента в периодической системе Д. И. Менделеева.
Планетарная модель атома
На основе своих опытов Резерфорд создал планетарную модель атома.
В центре атома расположено положительно заряженное ядро, в котором сосредоточена почти вся масса атома.
В целом атом нейтрален.
Поэтому число внутриатомных электронов, как и заряд ядра, равно порядковому номеру элемента в периодической системе.
Ясно, что покоиться электроны внутри атома не могут, так как они упали бы на ядро.
Они движутся вокруг ядра, подобно тому как планеты обращаются вокруг Солнца.
Такой характер движения электронов определяется действием кулоновских сил притяжения со стороны ядра.

В атоме водорода вокруг ядра обращается всего лишь один электрон.
Ядро атома водорода имеет положительный заряд, равный по модулю заряду электрона, и массу, примерно в 1836,1 раза бо́льшую массы электрона.
Это ядро было названо протоном и стало рассматриваться как элементарная частица.
Размер атома водорода — это радиус орбиты его электрона.
Простая и наглядная планетарная модель атома имеет прямое экспериментальное обоснование.
Она кажется совершенно необходимой для объяснения опытов по рассеиванию α-частиц.
Но на основе этой модели нельзя объяснить факт существования атома, его устойчивость.
Ведь движение электронов по орбитам происходит с ускорением, причем весьма немалым.
Ускоренно движущийся заряд по законам электродинамики Максвелла должен излучать электромагнитные волны с частотой, равной частоте его обращения вокруг ядра.
Излучение сопровождается потерей энергии.
Теряя энергию, электроны должны приближаться к ядру, подобно тому как спутник приближается к Земле при торможении в верхних слоях атмосферы.
Как показывают расчеты, основанные на механике Ньютона и электродинамике Максвелла, электрон за ничтожно малое время (порядка 10 -8 с) должен упасть на ядро.
Атом должен прекратить свое существование.
В действительности ничего подобного не происходит.
Атомы устойчивы и в невозбужденном состоянии могут существовать неограниченно долго, совершенно не излучая электромагнитные волны.
Не согласующийся с опытом вывод о неизбежной гибели атома вследствие потери энергии на излучение — это результат применения законов классической физики к явлениям, происходящим внутри атома.
Отсюда следует, что к таким явлениям законы классической физики неприменимы.
Резерфорд создал планетарную модель атома: электроны обращаются вокруг ядра, подобно тому как планеты обращаются вокруг Солнца.
Эта модель проста, обоснована экспериментально, но не позволяет объяснить устойчивость атома.
Атомная физика. Физика, учебник для 11 класса - Класс!ная физика

На этом уроке мы узнаем о том, как устроен атом, какие об этом были представления раньше, и чем располагает наука на сегодняшний день. Также мы расскажем о соответствующих опытах, проведенных Эрнестом Резерфордом.
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Строение атома. Опыты Резерфорда"
«Отыщи всему начало и
Козьма Прутков
В данной теме рассмотрим основные гипотезы о строении атома с соответствующими опытами.
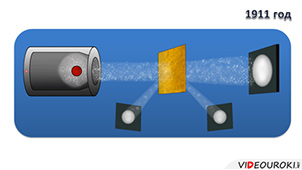
Известно, что испускание электронных пучков обусловлено явлением термоэлектронной эмиссии, о котором говорилось в курсе физики 10 класса. В процессе проведения опыта, Томсон выяснил, что электронные пучки отклоняются под действием магнитного поля.


Согласно этой модели облако положительного заряда распределено по всему размеру атома, а внутри этого облака расположены электроны, подобно тому, как изюминки расположены в пудинге. Суммарный отрицательный заряд электронов равен положительному заряду облака. Но от этой модели почти сразу пришлось отказаться: дело в том, что это противоречило уже известному свойству атомов – устойчивости (то есть, тому факту, что атомы существуют в течение длительного времени).
Новую модель атома предложил ученик Томсона – Эрнест Резерфорд. Прежде чем мы обратимся к опытам Резерфорда, обратите внимание на следующие факты: атом в целом электрически нейтрален. При этом, масса электронов, находящихся в атоме, в тысячи раз меньше массы самого атома. Это говорит о том, что основная масса атома приходится на его положительно заряженную часть. Исходя из этого, Резерфорд заключил, что для исследования распределения массы атома, можно исследовать распределение положительного заряда. В 1906 году он предложил бомбардировать тяжелые элементы с помощью a-частиц. На то время уже было известно, что такие частицы испускаются в процессе радиоактивного распада радия. Масса этих частиц в тысячи раз превышает массу электрона. Также, a-частицы обладают положительным зарядом, который по модулю вдвое больше заряда электрона. Наконец, альфа-частицы двигаются с очень большими скоростями (примерно 20000 км/с). Очевидно, что электроны не могут существенно изменить траекторию движения таких частиц. Поэтому, рассеяние (то есть заметное изменение направления движения) альфа-частиц может вызвать только положительная часть атома. Этим фактом и воспользовался Резерфорд, проводя свои опыты в 1911 году.

Рассмотрим установку, которая использовалась для проведения данных опытов. В свинцовый цилиндр с узким отверстием помещался радий. Далее располагалась фольга из золота, а за ней – экран. За экраном можно было наблюдать с помощью микроскопа. Вся эта установка располагалась в специальном сосуде, из которого был откачан воздух. Итак, в процессе распада, радий испускал a-частицы, которые при прохождении через фольгу рассеивались. При попадании каждой a-частицы на экран, в микроскоп можно было наблюдать вспышку света (такая вспышка называется сцинтилляцией). Было обнаружено, что если убрать фольгу, то сцинтилляции, возникающие на экране, образуют светлый кружок. Но при наличии фольги, площадь этого кружка увеличивалась. Это свидетельствовало о рассеянии a-частиц при прохождении через фольгу. Но Резерфорд на этом не остановился. Он немного модифицировал исходную установку, с целью выяснить: могут ли a-частицы отклоняться на ещё большие углы? Для этого, он окружил фольгу сцинтилляционными экранами и повторил опыт.

К его великому удивлению, некоторые частицы отклонились на углы, превышающие 90 градусов. То есть, фактически небольшое число частиц были отброшены назад. Действительно, такой результат предвидеть было очень и очень сложно, поскольку расчеты говорили о том, что электрическое поле положительного заряда, распределенного по всему атому, не может быть достаточно сильным, чтобы отбросить a-частицу назад. Напомним, что силу отталкивания можно определить исходя из закона Кулона.

В данной формуле имеется коэффициент пропорциональности k, заряд a-частицы, положительный заряд атома и его радиус.
Напряженность заряженного шара убывает по мере приближения к центру шара и максимальна на поверхности шара. Следовательно, сила отталкивания увеличивается по мере того, как уменьшается радиус. Это навело Резерфорда на мысли о том, что положительный заряд сконцентрирован в очень малой области пространства атома, а не равномерно распределен по всему атому. В связи с этим было введено понятие атомного ядра. Атомное ядро – это тело малых размеров, в котором сконцентрированы почти вся масса и весь положительный заряд атома. Легко понять, что чем ближе к ядру атома пролетают альфа-частицы, тем больше их отклонение.
Резерфорд подсчитал число частиц, рассеянных на различные углы, и, исходя из полученных данных, оценил размер ядра. Выяснилось, что диаметр ядра составляет порядка 10 –14 – 10 –15 м, в то время как диаметр атома составляет порядка 10 –10 м. Из этого можно заключить, что размеры атомного ядра в десятки, а иногда и в сотни тысяч раз меньше размеров самого атома. Позднее был вычислен и заряд ядра, который можно узнать из таблицы Менделеева. Принимая модуль заряда электрона за единицу, заряд ядра любого химического элемента равен номеру этого элемента в таблице Менделеева. Например, заряд ядра азота равен семи, заряд ядра кислорода равен восьми, заряд ядра алюминия равен тринадцати и так далее.
Эрнест Резерфорд провел серьезные исследования и, основываясь на них, создал планетарную модель атома. Согласно этой модели, в центре атома находится положительно заряженное ядро, вокруг которого вращаются отрицательно заряженные электроны. Поскольку атом электрически нейтрален, число электронов в атоме, также равно порядковому номеру элемента в таблице Менделеева. Разумеется, электроны не могут покоиться внутри атома. Они непрерывно движутся вокруг ядра, подобно тому, как планеты вращаются вокруг Солнца (именно поэтому, модель Резерфорда получила название планетарной модели атома).
Наиболее простым атомом является атом водорода: вокруг его ядра вращается всего один электрон.

Из этого можно заключить, что ядро атома водорода имеет положительный заряд, численно равный заряду электрона. Резерфорд предположил, что ядра всех атомов содержат ядро атома водорода. Это предположение было обусловлено тем, что масса ядра любого химического элемента кратна массе ядра водорода. Поэтому, ядро водорода стало рассматриваться как элементарная частица. Такую частицу назвали протоном.
Таким образом, рассмотрено экспериментальное обоснование справедливости планетарной модели атома. Но эта модель, так же, как и пудинговая модель, не в состоянии объяснить устойчивость атома. Электроны двигаются по определенным орбитам с достаточно большими скоростями. Известно, что любое криволинейное движение является ускоренным, следовательно, при движении электронов имеет место изменение скорости движения. Поэтому, электроны должны испускать электромагнитные волны, причем с частотой, равной частоте обращения вокруг ядра.
Излучая электромагнитные волны, электроны должны терять энергию, а это привело бы к тому, что электроны начали бы приближаться к ядру из-за снижения скорости. Если выполнить соответствующие расчеты, основываясь на классической механике Ньютона, то можно убедиться, что за время порядка 0,01 мкс, электрон должен упасть в ядро. Это приведет к тому, что атом попросту прекратить своё существование. Тем не менее, известно, что ничего подобного не происходит. Большинство атомов устойчивы и могут существовать сколь угодно долго. При этом, конечно, не наблюдается излучение каких-либо электромагнитных волн.
Почему же наблюдения и опыты не согласуются с теорией? Дело, конечно, не в том, что классическая механика является несостоятельной теорией. Дело в том, что к подобным явлениям классическая механика неприменима. К явлениям, происходящим внутри атомов нужно применять квантовую механику.
Основные выводы:
– В результате исследований Резерфорда была предложена планетарная модель атома.
– Атомное ядро – это тело малых размеров, в котором сконцентрированы почти вся масса и весь положительный заряд атома.
– Ядро атома водорода рассматривается как элементарная частица и называется протоном.
– Процессы, происходящие внутри атомов необходимо рассматривать с точки зрения квантовой механики.
– Планетарная модель атома, созданная Резерфордом, обоснована экспериментально, но, тем не менее, данная модель не объясняет устойчивость атома.
Читайте также:

