Как сделать овр
Добавил пользователь Алексей Ф. Обновлено: 05.10.2024
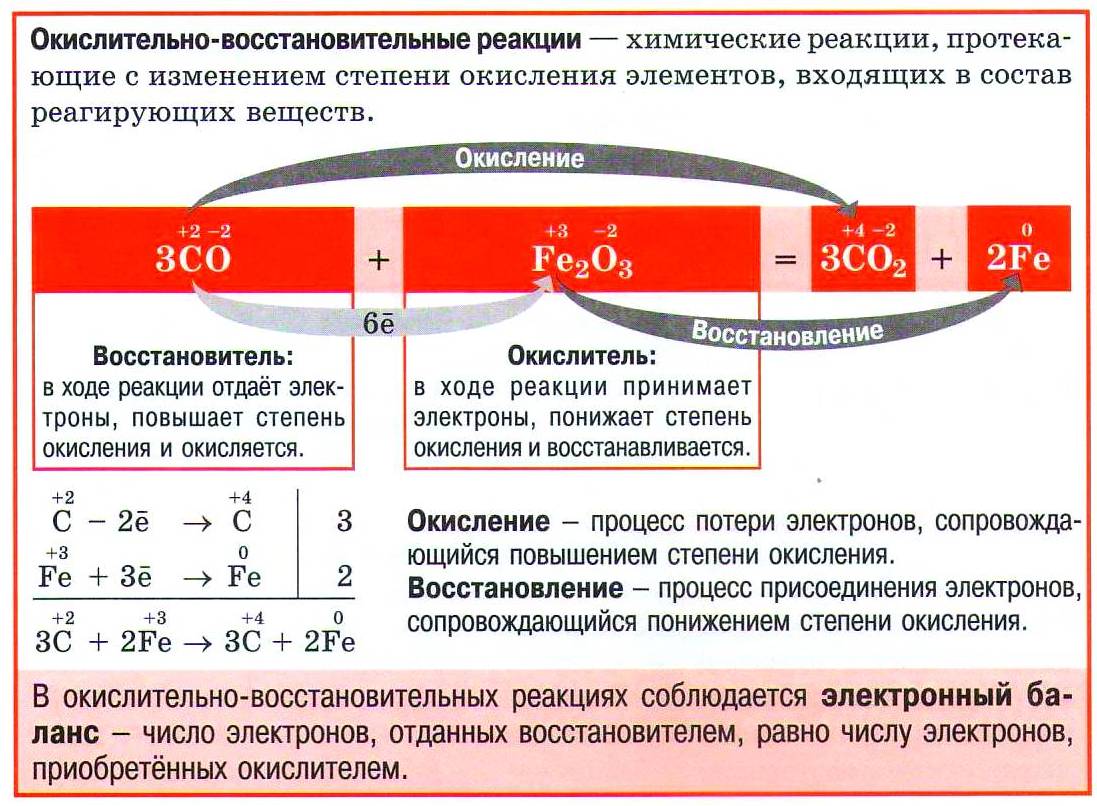
Окислительно-восстановительные реакции (ОВР) — такие реакции, которые протекают с изменением степеней окисления элементов.
Изменение степеней окисления происходит из-за полной или частичной передачи электронов от одних атомов к другим:
Процесс приобретения атомом дополнительных электронов называется восстановлением:
Вещество, которое содержит восстанавливающиеся атомы, называют окислителем.
В примере выше окислителем является азотная кислота HNO3.
Аналогично повышение степени окисления происходит в том случае, когда атом элемента теряет некоторое количество своих электронов. Процесс потери атомом электронов называют окислением:
Химическое вещество, которое содержит окисляющиеся атомы, называют восстановителем. В указанном примере восстановителем является фосфин PH3.
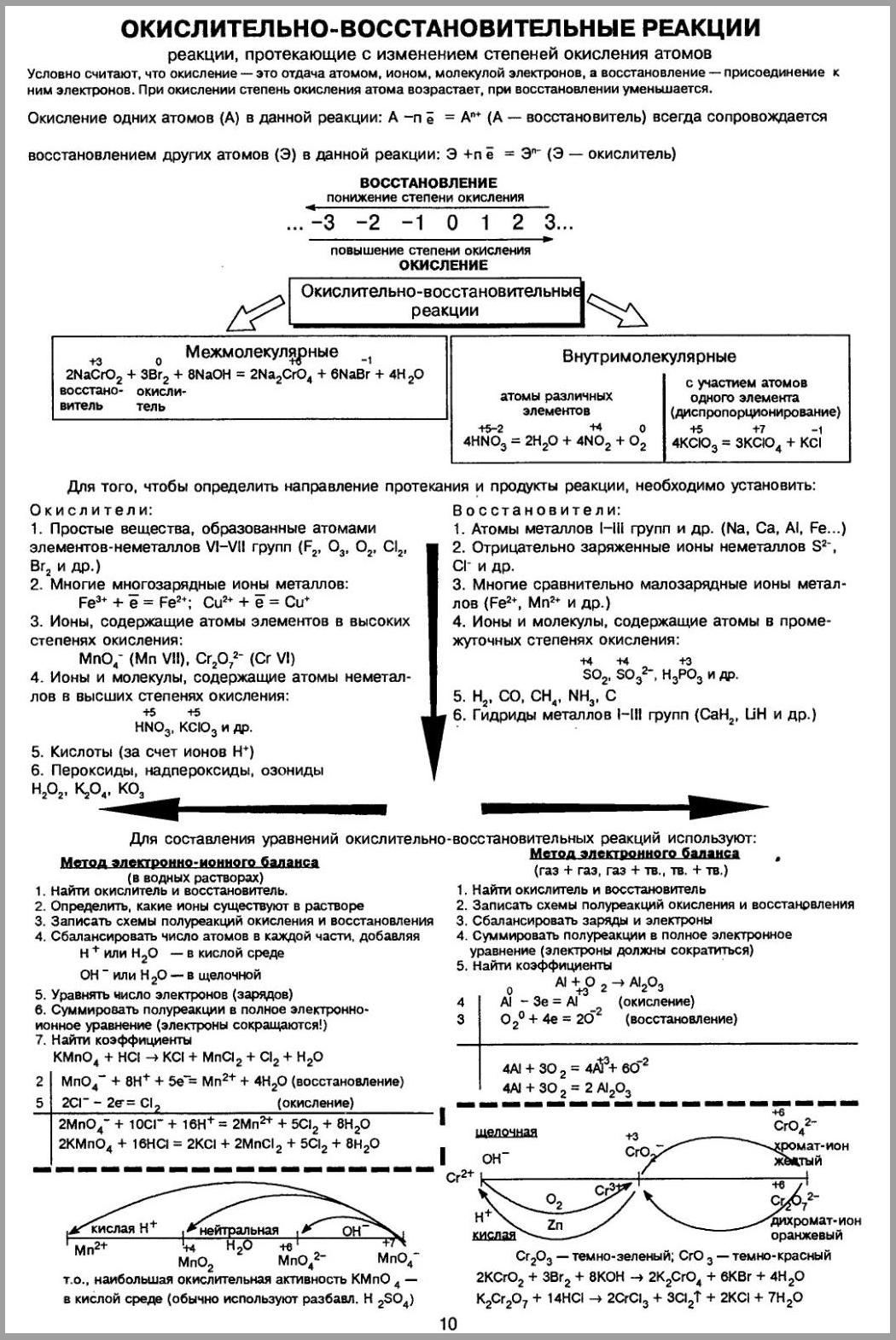
Виды окислительно-восстановительных реакций
Межмолекулярные ОВР
Межмолекулярные окислительно-восстановительные реакции — такие реакции, в которых атомы окислителя и атомы восстановителя находятся в разных веществах. Например:
Внутримолекулярные ОВР
Внутримолекулярные окислительно-восстановительные реакции — такие реакции, в которых атомы восстановителя и атомы окислителя содержатся в одном веществе. Например:
Реакции диспропорционирования
Реакциями диспропорционирования называют такие реакции, в которых атомы одного химического элемента, являются окислителями и восстановителями и при этом находятся в одном веществе. Такие реакции также называют реакциями самоокисления-самовосстановления. Например, к таким реакциям относятся все реакции взаимодействия галогенов с растворами щелочей:
Расстановка коэффициентов в окислительно-восстановительных реакциях
Метод электронного баланса
Метод электронного баланса — метод расстановки коэффициентов в окислительно-восстановительной реакции, основанный на том, что количество электронов, отданных восстановителем, равно числу электронов, полученных окислителем.
Алгоритм расстановки коэффициентов данным методом выглядит следующим образом:
1) Следует записать схему реакции, указав формулы всех реагентов и продуктов. Например, при взаимодействии концентрированной серной кислоты с фосфором образуется фосфорная кислота, диоксид серы и вода:
2) Далее следует расставить все степени окисления и найти те элементы, у которых изменилось значение степени окисления.
3) После расстановки степеней окисления химических элементов находят те элементы, которые изменили свои степени окисления. Далее записывают уравнения полуреакций окисления и восстановления. В нашем случае они имеют вид:
4) Поскольку количество отдаваемых электронов восстановителем должно быть равно количеству принимаемых электронов окислителем, далее следует подобрать дополнительные множители к записанным полуреакциям:
5) Подобранные к полуреакциям множители переносятся в схему реакции:
6) Отталкиваясь от тех коэффициентов, которые уже известны из электронного баланса, оставшиеся коэффициенты расставляют методом подбора:
Примечание:
Следует отметить, что если в одной структурной единице какого-либо участника реакции содержится не один атом химического элемента, изменившего степень окисления, а 2 или больше, то это обязательно следует учитывать при записи уравнений полуреакций. Обратите внимание на составление электронного баланса для реакции горения этана в кислороде:
Во второй полуреакции мы также учли, что в левой части уравнения реакции не может быть менее двух атомов кислорода, поскольку 2 атома O содержатся в одной молекуле O2. Однако как вы могли заметить, в случае простого вещества кислорода мы не стали писать 2O, а записали O2. Также следует поступать и в случае других простых молекулярных веществ, например, O2, F2, Cl2, N2, H2 и т.д.
Очевидно, что электронный баланс — не самая сложная часть в процессе составления уравнения окислительно-восстановительной реакции. Часто трудности возникают в том, какие продукты записывать в правой части схемы реакции.
Ниже представлены основные окислительно-восстановительные переходы окислителей и восстановителей в зависимости от среды. Во многих случаях указаны не целые формулы веществ, а формулы ионов, входящих в их состав. В таком случае для записи уравнения реакции в молекулярном виде формулу иона требуется дополнить противоионами. Катионы металлов, чаще всего, объединяют с кислотными остатками, если среда кислая, а анионы с катионами металлов (если среда щелочная) или водорода, если среда кислая или нейтральная.
Окислители
Восстановители
Коррозия металлов и способы защиты от нее
Коррозией металла называют процесс его самопроизвольного разрушения в результате контакта с окружающей средой.
Коррозия бывает химическая и электрохимическая.
Химическая коррозия — вид коррозии, при котором металл разрушается из-за его взаимодействия с газами или жидкостями, не проводящими электрический ток. Так, например, к химической коррозии относится образование окалины при взаимодействии железа с кислородом при высоких температурах, а также разрушение металлического оборудования под действием нефтяных фракций, содержащих сернистые соединения.
Электрохимической коррозией называют разрушение металла в растворе электролита вследствие возникновения в данной системе электрических токов. Электрические токи, способствующие коррозии, возникают в тех случаях, когда в растворе электролита изделие из металла контактирует с другим менее активным металлом. Также такие токи могут появляться из-за химической неоднородности металлического материала, из которого выполнено изделие.
Так, например, из-за электрохимической коррозии страдают подводные части судов, паровые котлы, трубопроводы, металлические конструкции в почве и т.д.
Способы защиты металлов от коррозии
1) Контроль условий, в которых эксплуатируется металлическое оборудование. Например, хранение и использование изделий из стали на открытом воздухе нежелательно и этого, по возможности, следует избегать. Эксплуатация металлического оборудования в помещениях с низкой влажностью существенно продлит его срок службы.
2) Создание защитных покрытий, изолирующих металлоконструкцию от контакта с окружающей средой. Среди таких покрытий различают:
— неметаллические покрытия — всевозможные краски, лаки, эмали, а также пленки из таких полимеров, как полиэтилен, поливинилхлорид и т.д.;
— химические покрытия (оксидные, нитридные, фосфатные и т.д.) (Такие покрытия получают специальной химической обработкой поверхности металла.);
Металлические покрытия получают нанесением на защищаемую металлическую конструкцию тонкого слоя другого металла (чаще всего с помощью процесса электролиза).
При этом, если в качестве покрытия используется менее активный металл, то такое покрытие будет защищать металлоконструкцию только при условии его целостности. В случае, если целостность такого покрытия будет нарушена, защищаемый металл будет ускоренно корродировать.
Также широко используется покрытие металлоконструкций более активным металлом. Например, распространено использование так называемого оцинкованного железа. Такое покрытие защищает металлические объекты даже при нарушении его целостности, поскольку пока практически полностью не исчезнет слой покрытия из более активного металла, коррозия металла, из которого сделан защищаемый объект, не начнется.
3) Электрохимические методы защиты:
— катодная защита — вид защиты, при котором металлический объект подключается с помощью проводников к катоду внешнего источника тока либо же приводится в контакт с более активным металлом.
Частный случай катодной защиты, при котором металлическая конструкция приводится в контакт с более активным металлом, называют протекторной защитой.
4) Изменение химических свойств среды, в которой эксплуатируется металлическое изделие, в частности:
— добавление в среду веществ, замедляющих коррозию (ингибиторов коррозии).
— дегазация среды (удаление растворенных в ней газов, в частности, кислорода). Например, такой метод работает для защиты от ржавления железа, поскольку в процессе ржавления железа активное участие принимает не только вода, но и кислород:
Основные правила составления окислительно-восстановительных реакций
Существует несколько основных правил, которые сильно упрощают составление окислительно-восстановительных реакций. Более подробно эти и другие правила рассматривается на других страницах этого раздела, но для ЕГЭ достаточно знать правила из этого списка.
Реакции простых веществ: металлов и неметаллов с щелочами, кислотами и солями:
1.1) Из металлов только Al, Zn и Be взаимодействуют со щелочами с выделением водорода:
Zn + 2NaOH + 2H2O → Na2[Zn(OH)4] + H2
Be + 2NaOH + 2H2O → Na2[Be(OH)4] + H2
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2
1.2) Из неметаллов только S, P, Si и галогены реагируют с щелочами:
Cl2 + 2NaOH → NaCl + NaClO + H2O (аналогично для Br2, I2)
3Cl2 + 6NaOH → 5NaCl + NaClO3 + 3H2O (при нагревании, аналогично для Br2, I2)
2.1) Металлы ( стоящие в ряду активности металлов до H2) реагируют с кислотами-неокислителями с выделением водорода:
2HCl + Fe → FeCl2 + H2
H2SO4(р) + Fe → FeSO4 + H2
2.2) Все металлы, кроме Pt и Au, реагируют с кислотами-окислителями без выделения водорода:
2H2SO4(к) + 2Ag → Ag2SO4 + SO2 + 2H2O
6H2SO4(к) + 2Fe → Fe2(SO4)3 + 3SO2 + 6H2O
2.3) Более сильные металлы вытесняют более слабые из растворов их солей:
3) Неметаллы не реагируют с кислотами-неокислителями:
C + HCl → реакция не идет
4) Такие неметаллы, как S, C, P могут реагировать с солями, проявляющими окислительные свойства (KClO3, KNO3 в расплавленном состоянии):

C + 2KNO3 (расплав) → CO2 + 2KNO2

S + 2KNO3 (расплав) → SO2 + 2KNO2
Важная реакция получения фосфора:
5) Из неметаллов только S, C, и P реагируют с кислотами-окислителями (в рамках ЕГЭ), а также I2 с HNO3(к):
C + H2SO4(конц.) → CO2 + 2SO2 + 2H2O (t)

S + 2H2SO4(конц.) → 3SO2 + 2H2O (t)

2P + 5H2SO4(конц.) → 2H3PO4 + 5SO2 + 2H2O (t)

C + 4HNO3(конц.) → CO2 + 4NO2 + 2H2O

P + 5HNO3(конц.) → H3PO4 + 5NO2 + H2O

S + 6HNO3(конц.) → H2SO4 + 6NO2 + 2H2O

I2 + 10HNO3(к) → 2HIO3 + 10NO2+ 4H2O (t, другие галогены с кислотами не реагируют)
Фосфор
1) Наиболее устойчивая степень окисления фосфора +5, следовательно, любые другие соединения фосфора окисляются сильными окислителями до этой степени окисления (с образованием P2O5 или фосфат-иона):
Азот
1) Аммиак, как правило, окисляется до азота N2:

8NH3 + 3KBrO4 → 3KBr + 4N2 + 12H2O

2NH3 + 3CuO → 3Cu + N2 + 6H2O
Исключением является каталитическое окисление аммиака:
4NH3 + 5O2 → 4NO + 6H2O (катализатор)
Обычное горение аммиака протекает с образованием N2 (как и горение любых органических азотсодержащих соединений):
4NH3 + 3O2 → 2N2 + 6H2O
2) Нитрит-ионы окисляются до нитрат-ионов:

3KNO2 + 2KMnO4 + H2O → 3KNO3 + 2MnO2 + 2KOH
3) Нитрит-ионы восстанавливаются до азота в реакциях с солями аммония:

NaNO2 + NH4Cl → N2 + NaCl + 2H2O (по сути, идет разложение нитрита аммония: NH4NO2 → N2 + 2H2O)

Ca(NO2)2 + (NH4)2SO4 → 2N2 + CaSO4 + 4H2O
4) Нитрит-ионы восстанавливаются до оксида азота (II) в реакциях с типичными восстановителями: HI, йодидами, солями Fe +2 и др.:

2KNO2 + 2KI + 2H2SO4 → 2NO + I2 + 2K2SO4 + 2H2O

HNO2 + 2HI → 2NO + I2 + 2H2O
Следующий тип реакций встречается в вариантах Ю.Н. Медведева.
5) Нитрат-ионы могут восстанавливаться до нитрит-ионов (соединениями Cr, Mn, Fe, сплавление в щелочной среде):
6) Восстановление нитратов до аммиака в реакциях с такими металлами, как Al, Zn, Mg (встречается очень редко):

3NaNO3 + 8Al + 5NaOH +18H2O → 3NH3 + 8Na[Al(OH)4]

NaNO3 + 4Zn + 7NaOH + 6H2O → NH3 + 4Na2[Zn(OH)4]
KNO3 + 4Mg + 6H2O → NH3 + 4Mg(OH)2 + KOH
Кислород
1) Перекись водорода окисляется до кислорода O2 типичными окислителями:
KMnO4, K2Cr2O7, галогены, соли кислородсодержащих кислот хлора (например, KClO3) и некоторыми другими.

5H2O2 + KMnO4 + 3H2SO4 → 2MnSO4 + K2SO4 + 5O2 + 8H2O
3H2O2 + 2KNO3 + H2SO4 → K2SO4 + 2NO + 3O2 + 4H2O
2) Перекись водорода восстанавливается до H2O типичными восстановителями:
KI (HI, йодиды), K2SO3 (SO2, сульфиты), KNO2 (нитриты), PbS (H2S, сульфиды), соединения Cr +3 в щелочной среде, соединения Fe +2 , NH3 и некоторыми другими.
Галогены
1) Галогены диспропорционируют в щелочах:
Cl2 + 2NaOH → NaCl + NaClO + H2O (аналогично для Br2, I2)
3Cl2 + 6NaOH → 5NaCl + NaClO3 + 3H2O (при нагревании, аналогично для Br2, I2)
2) Простые вещества галогены и соединения галогенов в любой положительной степени окисления восстанавливаются, как правило, до галогенид-ионов (т.е. до ст. ок. -1) в реакциях с типичными восстановителями:
KClO3 + 6Fe(OH)2 + 18HCl → 6FeCl3 + KCl + 15H2O
2Br2 + CrCl2 + 8NaOH → Na2CrO4 + 2NaCl + 4NaBr + 4H2O
Исключение: соединения йода в высоких степенях окисления могут восстанавливаться до I2, а не до йодид-иона
KIO3 + 5KI + 3H2SO4 → 3I2 + 3K2SO4 + 3H2O.
3) Галогенид-ионы окисляются, как правило, до простых веществ: Cl2, Br2, I2:
14HCl + K2Cr2O7 → 3Cl2 + 2CrCl3 + 2KCl + 7H2O
16HCl + 2KMnO4 → 5Cl2 + 2MnCl2 + 2KCl + 8H2O
4) Йодид меди восстанавливает серную кислоту до SO2, тогда как йодиды активных металлов до H2S:
5) Концентрированной серной кислотой окисляются только бромид- и йодид-ионы. В первом случае образуется SO2, во втором H2S.
Сера
1) Сульфид-ионы обычно окисляются до S типичными окислителями: Br2, I2, растворами солей K2Cr2O7, KMnO4 и др.:
3Na2S + K2Cr2O7 + 7H2SO4 → 3S + Cr2(SO4)3 + K2SO4 + 3Na2SO4 + 7H2O
5Na2S + 2KMnO4 + 16HCl → 5S + 2MnCl2 + 10NaCl + 2KCl + 8H2O
H2S + Br2 → S + 2HBr
H2S + H2O2 → S + 2H2O (образование H2SO4 возможно, зависит от условий задания)
2) С H2SO4(к) сероводород и сульфиды реагируют с образованием SO2, аналогично реакции кислоты с серой:
S + H2SO4(конц.) → 3SO2 + 2H2O (t)
H2S + 3H2SO4(конц.) → 4SO2 + 4H2O (t)

K2S + 4H2SO4(конц.) → K2SO4 + 4SO2 + 4H2O
В этой реакции сульфид-ион окисляется до SO2: S –2 -6e → S +4 .
Часть сульфат-ионов восстанавливается также до SO2 и часть остается для образования соли K2SO4.
3) Окисление H2S и сульфидов до сульфат-ионов протекает в реакциях с такими окислителями, как Cl2 в воде, H2O2, HNO3(конц.) при нагревании:

H2S + 4Cl2 + 4H2O → H2SO4 + 8HCl
H2S + 8HNO3(конц.) → H2SO4 + 8NO2 + 4H2O (образование S будет считаться ошибкой!)
PbS + 4H2O2 → PbSO4 + 4H2O (черный сульфид свинца превращается в белый сульфат)
4) Сульфит-ионы любыми окислителями окисляются до сульфат-иона:
3Na2SO3 + 2KMnO4 + H2O → 2MnO2 + 2Na2SO4 + 2KOH
Медь
1) Соединения Cu +2 окисляют соединения S +4 и I – (восстанавливаясь до Cu +1 ):
2CuCl2 + SO2 + 2H2O → 2CuCl + 2HCl + H2SO4
2Cu(NO3)2 + 4KI → 2CuI + I2 + 4KNO3

В реакции с аммиаком выделяется металлическая медь:
3CuO + 2NH3 → N2 + 3Cu + 3H2O
2) Йодиды меди реагируют с H2SO4(к) с образованием SO2, тогда как йодиды щелочных металлов с образованием H2S:
3) Медь по-разному реагирует с галогенами:
Cu + Cl2 → CuCl2
Cu + Br2 → CuBr2
2Cu + I2 → 2CuI (соль меди +1)
4) Медь в степени окисления +2 восстанавливается самой медью:
CuO + Cu → Cu2O (t)
CuCl2 + Cu → 2CuCl (t).
Железо
1) Соединения Fe +3 окисляют соединения S –2 , S +4 , I – и некоторые слабые металлы (восстанавливаясь до Fe +2 ):

Fe2O3 + 6HI → 2FeI2 + I2 + 3H2O
2FeCl3 + 3Na2S → 2FeS + S + 6NaCl

2FeCl3 + H2S → 2FeCl2 + S + 2HCl
2FeCl3 + Cu → CuCl2 + 2FeCl2 (соль железа +2)
2) В кислой среде соединения Fe +2 окисляются такими окислителями, как KMnO4, K2Cr2O7, HNO3, H2SO4(к) и др. до солей Fe +3 :
3) Железо по-разному реагирует с галогенами:
4) Соединения Fe +2 , Fe +3 также могут быть окислены до степени окисления +6 (до ферратов, например, Na2FeO4) очень сильными окислителями, но на ЕГЭ знание этих реакций не проверяется (источник: вебинары от разработчиков экзамена):
3FeSO4 + 2NaClO3 + 12NaOH → 3Na2FeO4 + 2NaCl + 3Na2SO4 + 6H2O.
Марганец
1) В кислой среде образуются соли Mn +2 :
K2MnO4 + 8HBr → MnBr2 + 2Br2 + 2KBr + 4H2O
2KMnO4 + 5SO2 + 2H2O → 2MnSO4 + K2SO4 + 2H2SO4

2) В щелочной среде образуется манганат-ион MnO4 2– (зеленого цвета):
MnSO4 + 2Br2 + 8KOH → K2MnO4 + 4KBr + Na2SO4 + 4H2O
2KMnO4 + 2FeSO4 + 6NaOH → K2MnO4 + 2Fe(OH)3 + Na2MnO4 + 2Na2SO4
3) В нейтральной среде образуется осадок бурого цвета MnO2:
3MnSO4 + 2KMnO4 + 2H2O → 5MnO2 + K2SO4 + 2H2SO4
2KMnO4 + 3K2S + 4H2O → 2MnO2 + 3S + 8KOH
K2MnO4 + Na2S + 2H2O → S + MnO2 + 2NaOH + 2KOH
Хром

1) Восстановление дихроматов в кислой среде протекает с образованием солей Cr +3 :
Na2Cr2O7 + 6NaI + 7H2SO4 → Cr2(SO4)3 + 3I2 + 4Na2SO4 + 7H2O
K2Cr2O7 + 6FeSO4 + 7H2SO4 → Cr2(SO4)3 + 3Fe2(SO4)3 + K2SO4 + 7H2O
K2Cr2O7 + 3KNO2 + 8HNO3 → 2Cr(NO3)3 + 5KNO3 + 4H2O
2) Окисление соединений Cr +2 в кислой среде протекает с образованием солей Cr +3 :
3) Окисление соединений Cr +3 очень сильными окислителями с щелочами или с карбонатами щелочных металлов протекает с образованием хроматов (типичные окислители: KNO3, Cl2, KClO3, H2O2 и др. в щел. среде):
4) Соединения Cr +6 в различных средах:
В щелочной среде устойчивы соли хромовой кислоты (хроматы, желтого цвета), например, Na2CrO4.
В кислой среде устойчивы соли дихромовой кислоты (дихроматы, оранжевого цвета), например, Na2Cr2O7.
2K2CrO4 + H2SO4 → K2Cr2O7 + K2SO4 + H2O (в кислотной среде желтая окраска переходит в оранжевую).
Na2Cr2O7 + 2NaOH → 2Na2CrO4 + H2O (в щелочной среде оранжевая окраска переходит в желтую).
Среда раствора
1) С карбонатами щелочных металлов реакции протекают аналогично щелочной среде реакции:
2) Если в реакцию вступает оксид серы (IV) SO2 в нейтральном растворе, то реакция протекает аналогично кислой среде раствора:
Поэтому очень важно не зубрить окислительно-восстановительные реакции, а знать какие соединения проявляют окислительные, а какие восстановительные свойства, и знать основные правила, приведенные выше.
Среди тысяч химических превращений, которыми овладел человек, особое и самое большое место занимают окислительные и восстановительные процессы.
Они – суть самой жизни. В круговороте веществ на нашей планете, в осуществлении фотосинтеза, дыхания и метаболизма живыми организмами – всюду протекают взаимосвязанные реакции окисления и восстановления (ОВР).
Понятие о степени окисления (С.О.)
С.О. – основная характеристика состояния химических элементов.
Она условно обозначает заряд атома в химическом веществе, приобретенный этим атомом в процессе отдачи или принятия электронов от других элементов.
У элемента, отдавшего электрон, появляется положительная С.О., у принявшего электрон – отрицательная.
Важно помнить. В веществах молекулы электронейтральны, и сумма С.О. всех входящих в эти молекулы атомов будет всегда нулевой.
Это позволяет находить С.О. по формулам соединений.
Сущность окислительно-восстановительных реакций
Взаимодействия веществ с изменением С.О. атомов составляющих их элементов называют окислительно-восстановительными реакциями.
В этой трансформации заключается их главный и характерный признак
Ещё одно определение ОВ-реакций – это химическое преобразование, протекающее с переносом электронов от одних частиц (восстановителей) к другим (окислителям).
2Na 0 + Cl2 0 = 2Na + Cl -
Приведенный пример ОВР умозрительно можно представить состоящим из двух полуреакций:
2Na 0 – 2e - = 2Na + – здесь идёт отдача электроотрицательных частиц (электронов) от атома натрия, являющимся в данном случае восстановителем. Происходит окисление.
Во втором полупроцессе Cl2 + 2e - = 2Cl - – окислитель хлор, принимая электрон, участвует в восстановлении.
Усвоению этих процессов и обозначающих их терминов может помочь схема:

Советы для избежания путаницы в этих понятиях:
-
Составить аббревиатуру по первым буквам терминов:
Окислитель – взял е - - восстановился → ОВВ
Восстановитель – отдал е - - окислился → ВОО
Восстановитель — это тот, кто электроны отдает.
Сам отдает грабителю, злодею-окислителю.
Отдает — окисляется, сам восстановителем является.
Типичные окислители
Типичные восстановители
- Простые вещества группы металлов, например, железо Fe 0 , цинк Zn 0 , алюминий Al 0 и др.
- Положительно заряженные частицы металлов в самой низкой С.О., например, олова Sn 2+ , железа Fe 2+ , свинца Pb 2+ и др.
- кислородсодержащие кислоты со своими окислами, в которых кислотообразующий элемент находится в низшей степени окисления, к примеру, сернистая кислота H2SO3, азотистая кислота HNO2 и т.д.
- группа бескислородных кислот и их солей: иодистовородная кислота НI, иодид калия KI, сероводород Н2S, сульфид натрия Na2S и т.д.
У веществ, содержащих атомы элементов с промежуточной С.О., может возникать окислительно-восстановительная двойственность. Так, азотистокислый натрий будет восстановителем относительно сильных окислителей (K2Cr2O7) и окислителем относительно типичного восстановителя KI.
Разновидности ОВР
- Межмолекулярные. К ним относят ОВ-реакции, в которых С.О. меняются у атомов разных соединений.
Cl2 0 + H2 + O -2 = H + Cl - + H + Cl + O -2
Хлор Cl2 здесь и окисляющий и восстанавливающий элемент.
Составление ОВР методом электронного баланса
При написании ОВ-реакций важно соблюдать не только закон сохранения масс веществ до и после взаимодействия, но и равенство (баланс) электрических зарядов исходных реагентов и полученных продуктов.
При способе электронного баланса производится сравнение С.О.в левой и правой части уравнения. При этом необходимо знать формулы получаемых веществ.
Правило. В уравнении ОВР слева сначала записывается восстановитель, отдающий электроны, потом окислитель, их принимающий. Справа, в первую очередь пишут продукт окисления, потом восстановления, после все остальные вещества.
Пример составления уравнения ОВР углерода (С) с алюминием (Al).
- Сначала следует определить элементы, изменившие свои С.О.
Al 0 + C 0 → Al4 +3 C3 -4
- Алюминий, отдав три электрона, сменил С.О. с 0 до +3
Al 0 → Al +3
1Al 0 - 3e - → 1Al +3
- Углерод, приняв четыре электрона, сменил свою С.О. с 0 на – 4
C 0 → C +4
1C 0 + 4e - → 1C -4
- Далее уравнение нужно сбалансировать, подбирая множители. Число отданных Al электронов подставить в полуреакцию углерода C, а число принятых углеродом электронов записать в схему полуреакции алюминия:
4| 1Al 0 -3e - → 1Al +3
3| 1C 0 +4e - → 1C -4
В результате алюминий лишился 4×3 = 12 электронов, а углерод принял 3×4 = 12 электронов.
- Последний этап – уравнивание количества атомов слева и справа с помощью стехиометрических коэффициентов: реакцию вступило 4·1Al 0 =4Al 0 атома алюминия и 3·1C 0 =3C 0 атома углерода.
Окончательно уравнение выглядит так:
Коррозия металлов
Разрушение металла от воздействий окружающей среды называется коррозией. По сути коррозия – химический окислительно-восстановительный процесс, зависящий от места, где он происходит.
Следует различать химическую (Х.К.) и электрохимическую (Э.Х.К.) коррозию.
- При химической коррозии металлы подвергаются деструкции от вредных влияний газов, жидкостей, не способных проводить электричество. Например, появление окалины на железе от контакта с кислородом при повышенных температурах. Или разрушение металлического оборудования, трубопроводов от воздействия сернистых соединений, содержащихся в нефтяных фракциях.
- Электрохимическая коррозия непосредственно связана с деструкцией металла в электролитном растворе под действием возникающего в нем электрического тока. Для возникновения разрушительных электрических токов необходим контакт металлов разной активности или наличие неоднородных участков на поверхности корродирующего металла. Таким электрохимическим разрушениям часто подвергаются морские корабли, котельное оборудование, заглублённые в почву металлические сооружения.
Справка. В мире ежегодно из-за коррозии теряется 25% произведённого человечеством железа!
Защита от коррозии
- Создание щадящих условий эксплуатации металлоконструкций и аппаратов. Размещение их в помещениях с пониженной влажностью, под навесами, защищающими от атмосферных воздействий.
- Нанесение защищающих неметаллических покрытий: красок, лаков, эмалей, полимерных плёнок (ПЭ, ПВХ).
- Обработка металлических изделий химическим способом для создания на них изолирующих оксидных, нитридных, фосфатных покрытий.
- Нанесение гальваническими технологиями защитных металлопокрытий: никелевых, хромовых, цинковых, кадмиевых.
- Оцинковывание железных листов термическим способом.
- Антикоррозионная защита электрохимическим методом:
- катодной защитой при подключении металлосооружения проводниками к катодному полюсу источника электротока или к куску более активного металла (протектору).
- Легирование металлов при их выплавке специальными добавками хрома, никеля, цинка (пример нержавеющей стали).
- Воздействие на агрессивную среду, в которой эксплуатируется металлический объект, например, добавлением в неё ингибиторов (замедлителей) коррозии или дегазацией – удаление газов, вызывающих разрушение.
Значение ОВР
В начале статьи говорилось о значении ОВ - процессов для жизни на Земле.
Люди научились применять их для своих нужд. Используют для получения металлов, необозримого количества веществ и материалов, для очистки окружающей среды от загрязняющих её продуктов своей жизнедеятельности.
Ключевые слова конспекта по химии для 11 класса: Окислительно-восстановительные реакции. Степень окисления. Окисление и восстановление. Окислитель и восстановитель. Метод электронного баланса.
Химия даёт множество примеров, иллюстрирующих один из основных философских законов — единства и борьбы противоположностей.
Единую структуру атома отражают его положительное ядро и отрицательно заряженные электроны оболочки. Природа амфотерных соединений заключается в единстве их кислотных и основных свойств. Обратимый гидролиз солей — это результат противоположных процессов: взаимодействия кислот и оснований с образованием соли и воды и разложение продуктов этого взаимодействия водой. Это утверждение справедливо для всех обратимых реакций: единство прямого и обратного химических процессов. Окислительно-восстановительные реакции — ещё один пример действия этого философского закона.
В пробирку налейте 4—5 мл раствора сульфата меди(II) и опустите в неё стальную канцелярскую скрепку. Оставьте пробирку в штативе на 1—2 мин. При наблюдении легко заметить, что в результате реакции стальная скрепка покрылась красноватым налётом свободной меди:
CuSO4 + Fe = FeSO4 + Сu
Для того чтобы выполнить задание, сформулированное в условии эксперимента, вам необходимо записать степени окисления элементов, образующих реагенты и продукты данной реакции.
Для дальнейшего рассмотрения окислительно-восстановительных реакций необходимо уметь быстро и безошибочно определять степени окисления атомов . Приведём основные правила, которые необходимо знать.
Рассмотрим пример расстановки степеней окисления атомов в перманганате калия КМnO4:

Следовательно,

Вернёмся к выполнению задания, указанного в лабораторном опыте:
Как видите, степени окисления в данной реакции изменили атомы железа и меди. Следовательно, эта реакция является окислительно-восстановительной.

Атомы железа в степени окисления 0 отдали два электрона, превратившись при этом в ион с зарядом +2: — процесс окисления.

Ионы меди в исходном веществе имели степень окисления +2, а в продукте реакции — степень окисления 0, т. е. каждый из них принял по два электрона: — процесс восстановления.


Итак, на схеме показано, что железо в этой реакции окисляется, являясь восстановителем; сульфат меди(II), а точнее, ионы , входящие в его состав, принимают 2 электрона, выступая в роли окислителя, т. е. восстанавливаются.

Окислительно–восстановительные реакции играют важную роль и в органической химии. Рассмотрим, например, реакцию горения метана и повторим, как рассчитываются коэффициенты и составляются уравнения окислительно–восстановительных реакций с использованием метода электронного баланса, т. е. равенства числа отданных и принятых электронов.

Убедиться, что атомы углерода в этой реакции теряют именно 8 электронов, поможет схема, где на числовом луче показаны степени окисления атомов, а также изменение этой величины в процессах окисления и восстановления.
Одно вещество в реакциях может выступать и в роли окислителя, и в роли восстановителя.
Во-первых, в состав вещества могут входить атомы элементов, один из которых проявляет свойства окислителя, а другой — восстановителя. Например, хлороводород (и его водный раствор — соляная кислота) проявляет окислительные свойства при взаимодействии с металлами за счёт катиона водорода и восстановительные благодаря наличию галогена в минимальной степени окисления :


Во-вторых, вещество может содержать атомы элемента в промежуточной степени окисления и выступать в качестве окислителя, принимая чужие электроны, или в качестве восстановителя, отдавая электроны другим атомам. Так, оксид серы(IV) в реакции с кислородом выступает в роли восстановителя, а в реакции с углеродом — окислителя:
Окислительно-восстановительные реакции используются на производстве (все металлургические процессы, синтез аммиака, производство кислот) и играют важную роль в процессах жизнедеятельности (процессы дыхания, горения и фотосинтеза).
В заключение подчеркнём единство окислительно–восстановительных процессов. Ведь если какой-то элемент или вещество окисляется (отдаёт электроны), то другое вещество обязательно восстанавливается (принимает эти электроны) с соблюдением электронного баланса. Эти процессы неразрывно связаны между собой.
Без изменения степеней окисления элементов протекают, например, реакции ионного обмена.

Окислительно-восстановительные реакции.
Шпаргалка по всей теме курса.
Читайте также:

