Как сделать оксид серы
Обновлено: 07.07.2024

ДАЮ 25 БАЛЛОВ СРОЧНО ПОМОГИТЕ Сравни характеристики томов. е числа 1. Число электронов, недостающих до завершения внешнего слоя в атоме азота недоста … ющих электронов в атоме углерода. 2. Восстановительные свойства углерода - восстановительных свойств азота.
Перетворіть на хімічні рівняння схеми реакцій, під час яких утворюється кисень; хімія 7 клас11 балів
Решите пожалуста срочно надо . У зерносховищах для звільнення приміщення від шкідників зерна часто спалюють сірку з розрахунку аби кожний кубічни … й метр повітря містив не менше як 50 г сульфору (4) оксиду SO2. Обчисли масу сірки яку потрібно спалити в приміщенні об'ємом 5000м3
Пожалуйста ПОМОГИТЕ . Химия 8 класс . 100 БАЛЛОВ Задача:n (H2SO4) = 0,5 моль + Fe (OH)3 ; Знайти : m(солі)
Щелочи - это: растворимые в воде основания нерастворимые в воде основания растворимые в воде оксиды нерастворимые в воде оксиды Формула гидроксида алю … миния: 1. Al2O3 2. АГОН 3. Al(OH)3 4. Al(OH)2 В поле для ответа впишите цифру, которая соответствует номеру правильного ответа Основание, которое разлагается при нагревании: 1. Ca(OH)2 2. NaOH 3. Fe(OH)3 4. RbOH В поле для ответа впишите цифру, которая соответствует номеру правильного ответа. Щёлочь LiOH вступает в реакцию: термического разложения при нагревании с водой с растворами солей кальция с Кислотами ( тут вроде с кислотами но не уверена) Установите соответствие между индикатором и изменением его окраски в щелочной среде. Ответ запишите в виде сочетания цифр и букв без пробелов и запятых, например, 162a3г. 1. фенолфталеин | а) бесцветный 2. лакмус 6) желтый 3. метилоранж в) синий г) красный д) малиновый Щёлочь NaOH реагирует с: 1. S02 2. Na2SO4 3. FeSO4 4. Сао Укажите только вариант ответа. Например: 2 Закончите уравнение реакции, характеризующее химические свойства оснований, расставьте коэффициенты. Fe(OH)3+HCI → В поле ответа укажите сумму коэфициентов в уравнении реакции.
Из приведенных ниже формул веществ, основанием является: 1. CuSO4 2. Н3РО4 3. Mn(OH)2 4. СІ,07 В поле для ответа впишите цифру, которая соответствует … номеру правильного ответа.
Приведите уравнения всех известных вам реакций, в ходе которых возможно получение SO2. Укажите условия протекания этих реакций: температуру, давление, катализатор, внешние факторы и т.д.
Получение SO2 возможно из простых веществ серы и кислорода:
![]()
Диоксид серы образуется в ходе взаимодействия сероводорода с серной кислотой:
![]()
![]()
В результате сгорания сероводорода на воздухе одним из продуктов является оксид серы (IV):
![]()
При действии холодного концентрированного раствора серной кислоты на сульфит натрия выделяется двуокись серы:
![]()
В результате действия концентрированной серной кислоты на тяжелые металлы (Cu, Ag, Hg), стоящие в ряду активности после водорода, протекает окислительно-восстановительная реакция, результатом которой является образование :
![]()
Диоксид серы образуется в ходе взаимодействия серной кислоты с серой, графитом и твердым бромидом калия:
![]()
![]()
![]()
![]()
) пирита:
![]()
Сероводород H2S – это бинарное летучее водородное соединение соединение с серой. H2S — бесцветный ядовитый газ, с неприятным удушливым запахом тухлых яиц. При концентрации > 3 г/м 3 вызывает смертельное отравление.
Сероводород тяжелее воздуха и легко конденсируется в бесцветную жидкость. Растворимость в воде H2S при обычной температуре составляет 2,5.
В твердом состоянии имеет молекулярную кристаллическую решетку.
Геометрическая форма молекулы сероводорода представляет собой сцепленные между собой атомы H-S-H с валентным углом 92,1 о .

Качественная реакция для обнаружения сероводорода
Для обнаружения анионов S 2- и сероводорода используют реакцию газообразного H2S с Pb(NO3)2:
Влажная бумага, смоченная в растворе Pb(NO3)2 чернеет в присутствии H2S из-за получения черного осадка PbS.
Химические свойства серы
H2S является сильным восстановителем
При взаимодействии H2S с окислителями образуются различные вещества — S, SО2, H2SO4
- Взаимодействие с кислотами-окислителями:
- Взаимодействие со сложными окислителями:
- Сероводородная кислота H2S двухосновная кислота и диссоциирует по двум ступеням:
1-я ступень: H2S → Н + + HS —
2-я ступень: HS — → Н + + S 2-
H2S очень слабая кислота, несмотря на это имеет характерные для кислот химические свойства. Взаимодействует:
- с малоактивными металлами (Аg, Си, Нg) при совместном присутствии окислителей:
- с некоторыми солями сильных кислот, если образующийся сульфид металла нерастворим в воде и в сильных кислотах:
Реакция с нитратом свинца в растворе – это качественная реакция на сероводород и сульфид-ионы.
Сульфиды
Получение сульфидов
- Непосредственно из простых веществ:
S + Fe → FeS
- Восстановление сульфатов при прокаливании с углем:
Физические свойства сульфидов
Сульфиды – это бинарные соединения серы с элементами с меньшей электроотрицательностью, в том числе с некоторыми неметаллами (С, Si, Р, As и др.).
По растворимости в воде и кислотах сульфиды классифицируют на:
- растворимые в воде — сульфиды щелочных металлов и аммония;
- нерастворимые в воде, но растворимые в минеральных кислотах — сульфиды металлов, расположенных до железа в ряду активности (белые и цветные сульфиды ZnS, MnS, FeS, CdS);
- нерастворимые ни в воде, ни в минеральных кислотах — черные сульфиды (CuS, HgS, PbS, Ag2S, NiS, CoS)
- гидролизуемые водой — сульфиды трехвалентных металлов (алюминия и хрома (III))
По цвету сульфиды можно разделить на:
Химические свойства сульфидов
Обратимый гидролиз сульфидов
- Хорошо растворимыми в воде являются сульфиды щелочных металлов и аммония, но в водных растворах они в значительной степени подвергаются гидролизу. Реакция среды — сильнощелочная:
S 2- + H2O → HS — + ОН —
- Сульфиды щелочно-земельных металлов и Mg, при взаимодействии с водой подвергаются полному гидролизу и переходят в растворимые кислые соли — гидросульфиды:
При нагревании растворов сульфидов гидролиз протекает и по 2-й ступени:
Необратимый гидролиз сульфидов
- Сульфиды некоторых металлов (Cr2S3, Fe2S3, Al2S3) подвергаются необратимому гидролизу, полностью разлагаясь в водных растворах:
Нерастворимые сульфиды гидролизу не подвергаются
NiS + HСl ≠
- Некоторые из сульфидов растворяются в сильных кислотах:
- Сульфиды Ag2S, HgS, Hg2S, PbS, CuS не pacтворяются не только в воде, но и во многих кислотах.
- Сульфиды обладают восстановительными свойствами и вступают в реакции с окислителями:
- Окислительный обжиг сульфидов является важной стадией переработки сульфидного сырья в различных производствах
Взаимодействия сульфидов с растворимыми солями свинца, серебра, меди являются качественными на ион S 2− :
Оксид серы (IV), диоксид серы, сернистый газ, сернистый ангидрид (SO2)
Способы получения сернистого газа
- Окисление серы, сероводорода и сульфидов кислородом воздуха:
- Действие высокой температуры на сульфиты (термическое разложение):
- Действие сильных кислот на сульфиты:
- Взаимодействие концентрированной H2SO4 с восстановителями, например с неактивными металлами:
Физические свойства сернистого газа
При обычной температуре SO2 — газ с резким запахом без цвета. В воде растворим хорошо — при 20°С в 1 л воды растворяется 40 л SO2.
Химические свойства сернистого газа
SO2 – типичный кислотный оксид. За счет того, что сера находится в промежуточной степени окисления (+4) SO2 может проявлять свойства как окислителя так и восстановителя.
- При растворении в воде SO2 частично соединяется с молекулами воды с образованием слабой сернистой кислоты.
- Как кислотный оксид, SO2 вступает в реакции с щелочами и оксидами щелочных и щелочноземельных металлов:
- При взаимодействии с окислителями SO2проявляет восстановительные свойства. При этом степень окисления серы повышается:
Обесцвечивание раствора перманганата калия KMnO4 является качественной реакцией для обнаружения сернистого газа и сульфит-иона
- SO2 проявляет окислительные свойства при взаимодействии с сильными восстановителями, восстанавливаясь чаще всего до свободной серы:
Оксид серы (VI), триоксид серы, серный ангидрид (SO3)
Способы получения серного ангидрида
- SO3 можно получить из SO2путем каталитического окисления последнего кислородом:
- Разложением сульфата железа (III):
Физические свойства серного ангидрида
SO3 – тяжелее воздуха, хорошо растворим в воде.
Химические свойства серного ангидрида
Оксид серы (VI) – это кислотный оксид.
- Хорошо поглощает влагу и реагирует с водой образуя серную кислоту:
- Как кислотный оксид, SO3взаимодействует с щелочами и основными оксидами, образуются средние или кислые соли:
SO3 + MgO → MgSO4 (при сплавлении):
SO3 + ZnO = ZnSO4
- SO3проявляет сильные окислительные свойства, так как сера в находится в максимальной степени окисления (+6).
Вступает в реакции с восстановителями:
- При растворении в концентрированной серной кислоте образует олеум (раствор SO3 в H2SO4).
Сернистая кислота (H2SO3)
Способы получения сернистой кислоты
При растворении в воде SO2 образует слабую сернистую кислоту, которая сразу частично разлагается:
Физические свойства сернистой кислоты
Сернистая кислота H2SO3 – двухосновная кислородсодержащая кислота. При обычных условиях неустойчива.
Валентность серы в сернистой кислоте равна IV, а степень окисления +4.

Химические свойства сернистой кислоты
Общие свойства кислот
- Сернистая кислота – слабая кислота, диссоциирует в две стадии. Образует два типа солей:
- кислые – гидросульфиты
Соли сернистой кислоты, сульфиты и гидросульфиты
Способы получения сульфитов
Соли сернистой кислоты получаются при взаимодействии SO2 с щелочами и оксидами щелочных и щелочноземельных металлов:
Физические свойства сульфитов
Сульфиты щелочных металлов и аммония растворимы в воде, сульфиты остальных металлов — нерастворимы или не существуют.
Гидросульфиты металлов хорошо растворимы в Н2O, а некоторые из них, такие как Ca(HSO3)2 существуют только в растворе.
Химические свойства сульфитов
Cернистая кислота – двухосновная, образует нормальные (средние) соли — сульфиты Mex(SO3)y и кислые соли — гидросульфиты Me(HSO3)x.
- Водные растворы сульфитов подвергаются гидролизу. Реакция среды – щелочная(окрашивают лакмус в синий цвет):
Реакции, протекающие без изменения степени окисления:
- Нормальные сульфиты в водных растворах, при избытке SO2, переходят в гидросульфиты:
- Ионно-обменные реакции с другими солями, протекающие с образованием нерастворимых сульфитов:
Сульфиты, также как и SO2, могут быть как восстановителями, так и окислителями, т.к. атомы серы в анионах находятся в промежуточной степени окисления +4
- Окисление водных растворов сульфитов, и гидросульфитов до сульфатов:
- Твердые сульфиты при хранении на воздухе также медленно окисляются до сульфатов:
- При нагревании сухих сульфитов с активными восстановителями (С, Mg, Al, Zn) сульфиты превращаются в сульфиды:
- При нагревании сухих сульфитов до высоких температур сульфиты диспропорционируют, превращаются в смесь сульфатов и сульфидов:
Серная кислота (H2SO4)
Способы получения серной кислоты
В промышленности серную кислоту производят из серы, сульфидов металлов, сероводорода и др.
Наиболее часто серную кислоту получают из пирита FeS2.
Основные стадии получения серной кислоты включают:
1.Обжиг пирита в кислороде в печи для обжига с получением сернистого газа:
2. Очистка полученного сернистого газа от примесей в циклоне, электрофильтре.
3. Осушка сернистого газа в сушильной башне
4. Нагрев очищенного газа в теплообменнике.
5. Окисление сернистого газа в серный ангидрид в контактном аппарате:
6. Поглощение серного ангидрида серной кислотой в поглотительной башне – получение олеума.

Физические свойства, строение серной кислоты
При обычных условиях серная кислота – тяжелая бесцветная маслянистая жидкость, хорошо растворимая в воде. Максимальная плотность равна 1,84 г/мл
При растворении серной кислоты в воде выделяется большое количество теплоты. Поэтому, по правилам безопасности в лаборатории при приготовлении разбавленного раствора серной кислоты во избежание разбрызгивания необходимо наливать серную кислоту в воду тонкой струйкой по стеклянной палочке при постоянном перемешивании. Но не наоборот!
Валентность серы в серной кислоте равна VI.
Качественные реакции для обнаружения серной кислоты и сульфат ионов
Для обнаружения сульфат-ионов используют реакцию с растворимыми солями бария. В результате взаимодействия, образуется белый кристаллический осадок сульфата бария:
Химические свойства серной кислоты
Серная кислота — сильная двухосновная кислота, образует два типа солей: средние – сульфаты, кислые – гидросульфаты.
- Серная кислота практически полностью диссоциирует в разбавленном в растворе по первой ступени и достаточно по второй ступени:
Характерны все свойства кислот:
- Реагирует с основными оксидами, основаниями, амфотерными оксидами, амфотерными гидроксидами и аммиаком:
- Вытесняетболее слабые кислоты из их солей в растворе (карбонаты, сульфиды и др.) и летучие кислоты из их солей (кроме солей HBr и HI):
- Концентрированная серная кислота реагирует с твердыми солями, например нитратом натрия, хлорида натрия.
Разбавленная серная кислота взаимодействует с металлами, расположенными в ряду напряжения металлов до водорода. В результате реакции образуются соль и водород:
Концентрированная серная кислота — сильный окислитель. Реакция с металлами протекает без вытеснения водорода из кислоты. В зависимости от активности металла образуются различные продукты реакции:
- Активные металлы и цинк при обычной температуре с концентрированной серной кислотой образуют соль, сероводород (или серу) и воду:
- Металлы средней активности с концентрированной H2SO4 образуют соль, серу и воду:
- Такие металлы, как железо Fe, алюминий Al, хром Cr пассивируются концентрированной серной кислотой на холоде. При нагревании, при удалении оксидной пленки реакция возможна.
- Неактивные металлы восстанавливают концентрированную серную кислоту до сернистого газа:
- В реакциях с неметаллами концентрированная серная кислота также проявляет окислительные свойства:
- Концентрированная серная кислота широко используется в химических процессах как водоотнимающий агент, т.к. проявляет сильное водоотнимающее действие. В органической химии ее используют при получении спиртов, простых и сложных эфиров, альдегидов и т.д.
Соли серной кислоты, сульфаты, гидросульфаты
Способы получения солей серной кислоты
Сульфаты можно получить при взаимодействии серной кислоты с металлами, оксидами, гидроксидами (см. Химические свойства серной кислоты). А также при взаимодействии с другими солями, если продуктом реакции является нерастворимое соединение.
Физические свойства солей серной кислоты
Кристаллы разного цвета. Многие средние и кислые сульфаты растворимы в воде. Плохо растворяются или не растворяются в воде сульфаты многозарядных щёлочноземельных металлов (BaSO4, RaSO4), сульфаты лёгких щёлочноземельных металлов (CaSO4, SrSO4) и сульфат свинца.
Средние сульфаты щелочных металлов термически устойчивы. Кислые сульфаты щелочных металлов при нагревании разлагаются.
Многие средние сульфаты образуют устойчивые кристаллогидраты:
CuSO4 ∙ 5H2O − медный купорос
FeSO4 ∙ 7H2O − железный купорос
ZnSO4 ∙ 7H2O − цинковый купорос
KАl(SO4)2 x 12H2O – алюмокалиевые квасцы.
Химические свойства солей серной кислоты
Разложение сульфатов на различные классы соединений в зависимости от металла, входящего в состав соли.
Ключевые слова конспекта: соединения серы, сернистый газ, сульфаты, строение, получение, использование.
Оксид серы (IV) — сернистый газ
Оксид серы (IV) SO2 – вещество молекулярного строения, молекула имеет угловую конфигурацию.
При обычных условиях оксид серы (IV) SO2 – бесцветный газ с удушливым запахом, растворим в воде (1 объём воды при комнатной температуре растворяет 36 объёмов SO2).
Оксид серы (IV) SO2 – кислотный оксид.
- Взаимодействует с водой, образуя сернистую кислоту (слабый электролит):
В водном растворе она ступенчато диссоциирует:

Наличие ионов водорода обусловливает изменение окраски индикатора. Например, при пропускании сернистого газа через раствор лакмуса окраска меняется с фиолетовой на красную.
- Реагирует с основаниями и основными оксидами. В реакциях могут образовываться как средние соли, так и кислые соли (гидросульфиты). Например:
SO2 + 2КОН = K2SO3 + H2О или SO2 + КОН = KHSO3

Так как в SO2 степень окисления серы промежуточная +4, для диоксида серы характерна окислительно-восстановительная двойственность. В реакциях с более сильными восстановителями SO2 – окислитель:

А в реакциях с более сильными окислителями SO2 – восстановитель:

В промышленности сернистый газ получают при обжиге пирита (FeS2) и других сульфидов:
или сжиганием серы в кислороде: S + O2 = SO2
В лаборатории сернистый газ получают действием сильных кислот на сульфиты. Обычно используют концентрированную H2SO4 и твёрдый сульфит натрия Na2SO3:

Сульфаты
Сульфаты – соли серной кислоты. Серная кислота образует два ряда солей: средние (содержат сульфат–ион SO4 2– ) и кислые (содержат гидросульфат-ион HSO4 – ).
Сульфаты можно рассматривать как ионные соединения, в узлах кристаллической решётки – катионы металлов и сульфат-анионы.
Сульфаты – твёрдые кристаллические вещества. Большинство сульфатов бесцветны, но окраска может быть обусловлена наличием того или иного катиона (например, медный купорос – кристаллы синего цвета, железный купорос – кристаллы светло–зелёного цвета и т. п.). Растворимость сульфатов в воде различна. Часто сульфаты кристаллизуются в виде кристаллогидратов.

Для распознавания сульфатов можно воспользоваться качественной реакцией на сульфат-ион. Реагентом является растворимая соль бария Ba(NO3)2, ВаCl2, (СН3СОО)2Ва. При взаимодействии реагента с раствором сульфата выпадает белый кристаллический осадок:
Сера, проявляя степени окисления +4 и +6, образует два устойчивых оксида состава — оксид серы(IV), или сернистый газ, и — оксид серы(VI).
Оксид серы(IV)
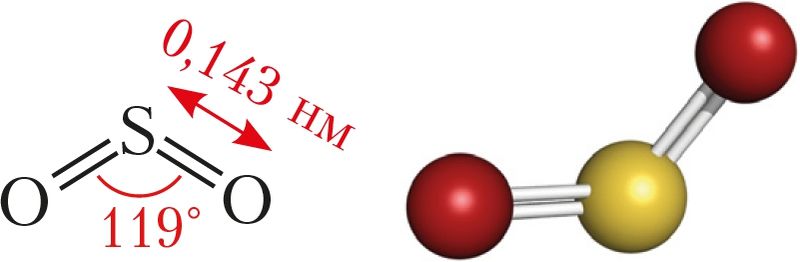
Рис. 79. Структурная формула и шаростержневая модель молекулы сернистого газа
Оксид серы(IV) — вещество молекулярного строения ( рис. 79 ).
Физические свойства. Оксид серы(IV) при нормальных условиях представляет собой бесцветный газ с характерным резким запахом — запахом загорающейся спички. Газ токсичен. В одном объёме воды растворяется около 40 объёмов газа при 20 °С , что гораздо ниже, чем в случае хлороводорода и аммиака.
Рис. 80. Хранение сжиженного сернистого газа (сернистого ангидрида)
Температура его кипения намного выше, чем у кислорода, и равна –10 °С . Газ легко сжижается при комнатной температуре уже при небольшом давлении, что позволяет хранить и транспортировать сжиженный газ в баллонах ( рис. 80 ).
Химические свойства. В химических реакциях, протекающих без изменения степени окисления, оксид серы(IV) должен проявлять свойства кислотного оксида: с водой он должен образовывать кислоту, со щелочами и основными оксидами — соли. Поскольку низшая степень окисления серы равна –2 , а высшая +6, следует предположить, что для сернистого газа характерны реакции как с повышением степени окисления серы, так и с её понижением.
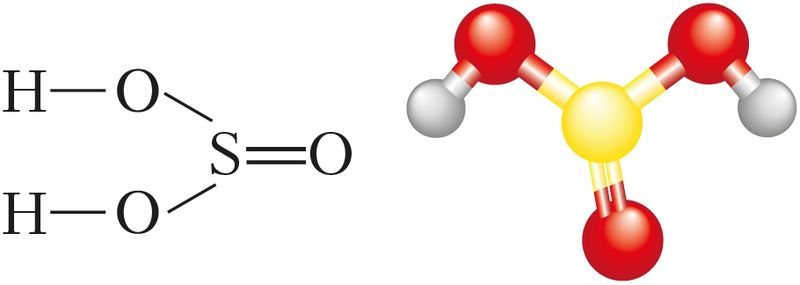
Рис. 81. Структурная формула и шаростержневая модель молекулы сернистой кислоты
Прокомментируем выше сказанное и поясним уравнениями химических реакций.
I. Реакции без изменения степени окисления.
1. Реакция с водой. При пропускании сернистого газа через воду, в которую добавлен лакмус, окраска меняется от фиолетовой до красной — образуется сернистая кислота:
Структурная формула сернистой кислоты изображена на рисунке 81.
Сернистая кислота является слабой. Как двухосновная кислота она диссоциирует ступенчато:
Это также означает, что сернистая кислота образует два ряда солей — средние (сульфиты) и кислые (гидросульфиты).
2. Реакция с растворами щелочей приводит к образованию солей. Состав продуктов зависит от мольного соотношения реагентов:
3. С основными оксидами сернистый газ также образует соли:
II. Реакции с изменением степени окисления.
Реакции с окислителями. Взаимодействие с кислородом приводит к образованию оксида серы(VI):
что свидетельствует о восстановительных свойствах оксида серы(IV).
Реакция обратимая, протекает со значительной скоростью лишь при повышенной температуре (более 440 °С ) в присутствии катализаторов (например, V2O5).
Реакции с восстановителями. Примером такой реакции может служить утилизация сернистого газа углеродом. Так получают серу из отходящих газов в металлургической промышленности:
Применение оксида серы(IV). Сернистый газ в промышленных масштабах является промежуточным продуктом при получении серной кислоты. Как пищевая добавка (Е220) он используется в пищевой промышленности в качестве консерванта. Им окуривают хранилища овощей, плодов и фруктов для обеззараживания. Его применяют для отбеливания шёлка и шерсти, так как хлор в данном случае использовать нельзя.
Сернистый газ образуется при сжигании серы и обжиге сульфидов металлов (например, пирита, сульфида цинка).
Оксид серы(IV) в лаборатории получают действием серной кислоты на сульфиты или медь:
Следует отметить, что сернистый газ — один из загрязнителей атмосферы. Его источником являются предприятия чёрной и цветной металлургии, теплоэлектростанции.
Оксид серы(VI)
Оксид серы(VI) — высший оксид серы ( рис. 82 ).
Оксид серы(VI) образуется при окислении сернистого газа кислородом или озоном:
.jpg)
Рис. 82. Структурная формула и масштабная модель молекулы оксида серы(VI)
Физические свойства. Оксид серы(VI) является бесцветной жидкостью в узком интервале температур: от 16,9 °С до 4 4,9 °С . Обладает удушающим запахом. При попадании на кожу вызывает тяжёлые ожоги.
Химические свойства. — типичный кислотный оксид и сильный окислитель. Как кислотный оксид реагирует с водой, образуя серную кислоту:
В реакциях со щелочами и основными оксидами образует соли:
Особым свойством оксида серы(VI) является его способность растворяться в серной кислоте.
Такой раствор называют олеумом. Он представляет собой дымящую на воздухе бесцветную маслянистую вязкую жидкость или даже кристаллы.
Олеум перевозят в стальных цистернах. Из него разбавлением получают серную кислоту нужной концентрации. При этом первоначально разбавляют серной кислотой, так как при вливании олеума в воду происходит вскипание, в результате чего образуется ядовитый сернокислотный туман.
В составе олеума, помимо серной кислоты, содержатся и другие кислоты серы(VI), например дисерная (или пиросерная):
Как окислитель SO3 реагирует с восстановителями. Атомы серы в составе оксида имеют высшую степень окисления +6 и могут её только понижать, принимая электроны от восстановителей. Примером окислительных свойств оксида серы(VI) может служить реакция с фосфором как восстановителем:
Важнейшими кислородными соединениями серы являются два кислотных оксида — оксид серы(IV), или сернистый газ SO2, и оксид серы(VI) SO3. Как кислотные оксиды они образуют кислоты при взаимодействии с водой и соли в реакциях со щелочами и основными оксидами.
Оксид серы(IV) проявляет и окислительные, и восстановительные свойства, а оксид серы(VI) — только окислительные.
Вопросы, задания, задачи
1. Запишите формулы оксидов серы и соответствующих им кислот, укажите их названия.
2. Назовите области использования сернистого газа.
3. В колбу с дистиллированной водой непродолжительное время пропускали сернистый газ, а затем добавили несколько капель индикатора. Назовите окраску содержимого колбы, если этим индикатором был:
- а) лакмус;
- б) метилоранж;
- в) фенолфталеин.
4. Для сернистого газа рассчитайте:
- а) плотность при н. у. по формуле ;
- б) относительную плотность по водороду;
- в) относительную плотность по воздуху.
| Реагенты | Оксид серы(IV) | Оксид серы(VI) |
Сделайте вывод о сходстве и различии химических свойств указанных оксидов серы.
6. Рассчитайте, чему равен объём (н. у.) оксида серы(IV), прореагировавшего с раствором гидроксида натрия, если при этом образовалась средняя соль массой 37,8 г .
7. Составьте уравнения реакций согласно схеме, назовите каждое из исходных веществ:
8. Рассчитайте минимальный объём (н. у.) сернистого газа, который нужно пропустить через раствор массой 200 г с массовой долей гидроксида натрия 2 % , чтобы получить только кислую соль.
9. Расставьте коэффициенты методом электронного баланса:
Укажите, окислителем или восстановителем является SO2.
10. Рассчитайте массовую долю серы в смеси, содержащей сульфит натрия количеством 0,5 моль и гидросульфит натрия количеством 0,2 моль .
*Самоконтроль
1. С наименьшими потерями сернистым газом можно наполнить сосуд:
а)
б)
в)
г)
2. При нормальных условиях оксид серы(VI):
- а) не существует;
- б) газ;
- в) жидкость;
- г) твёрдое вещество.
3. Относительно обоих оксидов серы(IV, VI) верно, что:
- а) при растворении в воде образуют кислоты;
- б) являются причиной загрязнения атмосферы и выпадения кислотных дождей;
- в) реагируя со щелочами, могут образовывать и кислые, и средние соли;
- г) могут реагировать с оксидом бария.
4. Оксид серы(VI) проявляет свойства кислотного оксида, реагируя с:
5. Сумма коэффициентов в уравнении реакции cернистого газа с избытком гидроксида калия в полной ионной форме равна:
Читайте также:

