Как сделать молекулу бензола
Добавил пользователь Евгений Кузнецов Обновлено: 05.10.2024
Тип урока: урок изучения нового материала.
Вид урока: проблемная лекция.
Главная дидактическая цель урока: добиться понимания содержания учебного материала всеми учащимися.
Обучающие цели урока:
- углубить знания об углеводородах;
- познакомить учащихся с новым типом химической связи, характерным для данной группы соединений, на примере бензола; дать понятие об ароматичности;
Развивающие цели урока:
- развивать у учащихся умение выделять главное, существенное в учебном материале, сравнивать, обобщать и систематизировать, устанавливать причинно-следственные связи;
- способствовать развитию волевых и эмоциональных качеств личности;
- особое внимание обратить на развитие интереса к предмету и речи учащихся.
Воспитательные цели урока: содействовать формированию мировоззренческих идей:
- материальность мира;
- непрерывность процесса познания.
Оборудование урока:
- реактивы: бензол, р-р КМnО4, бромная вода;
- шаростержневая модель молекулы бензола (по Кекуле);
- опорные конспекты, таблицы.
Ход урока
Эпиграф к уроку:
На прошлом уроке я задала повторить решение задач на нахождение формулы вещества и характеристику веществ изученных классов.
Решаем задачи на нахождение молекулярной формулы вещества и даем характеристику веществам, отвечающим полученному составу.
К доске:
1+2 учащихся (решают задачи по карточкам).
Вывести формулу вещества, содержащего 82,75% углерода 17,25% водорода. Относительная плотность паров этого вещества по воздуху равна 2.
Определите молекулярную формулу углеводорода, массовая доля углерода в котором равна 85,7% ,а водорода – 14,3%. Относительная плотность вещества по водороду равна 28.
Класс + ученик у доски:
Какова молекулярная формула вещества, в котором массовая доля углерода равна 93,2%. Относительная плотность по водороду равна 39.
Ответ:С6Н6 истиная формула
- При решении третьей задачи получили в-во состава С6Н6. К какому же из известных классов углеводородов можно отнести это вещество?
- Это вещество мы не можем отнести ни к одному из изученных классов углеводородов.
- Итак, проблема!, которую нам предстоит вместе решить. Сегодня мы познакомимся с новой группой углеводородов, которые называются ароматические.
ТЕМА УРОКА: Ароматические углеводороды (арены). Бензол. Строение молекулы.
Наши главные задачи сегодня:
- Углубить знания об углеводородах, расширить представления о многообразии органических соединений.
- Познакомиться с новым типом химической связи, характерным для данной группы углеводородов.
План лекции:
- Арены – один из классов углеводородов.
- История открытия бензола.
- Строение молекулы бензола.
а) строение бензола по Кекуле;
б) современные представления об электронном строении бензола;
в) понятие об ароматическом ядре и полуторной связи.
Д/з с. 51-53, оформить конспект лекции.
Сегодня на уроке мы познакомимся с новой группой углеводородов, которые называются ароматические или арены.
Ароматическими эти углеводороды были названы потому, что первые известные представители их обладали приятным запахом. Позднее оказалось, что большинство веществ, которые по хим. свойствам принадлежат к той же группе, не имеют ароматного запаха. Однако исторически сложившееся общее название этих соединений осталось за ними до наших дней.
Простейший представитель ароматических углеводородов – бензол.
Предыдущие классы углеводородов изучались на основе причинно – следственных связей: состав – строение – свойства – применение. Этот же логический принцип мы оставим и сейчас.
Состав вещества мы установили – С6Н6. Это бензол. Бензол – это тоже углеводород, но углеводород, принципиально отличающийся от тех, о которых шла речь. Что же такое бензол?
В 1825 г. М. Фарадей выделил из светильного газа, производившегося в то время в Англии из каменного угля, жидкость, состоящую из углерода и водорода. Через несколько лет (в1834 г.)
Э.Митчерлих при перегонке бензойной кислоты получил вещество, тождественное фарадеевскому, назвал его бензином, для того чтобы подчеркнуть генетическую связь с бензойной кислотой, и установил, что оно имеет элементарный состав С6Н6 (в англосаксонских странах и сейчас за бензолом сохранилось это название).
Позднее Ю. Либих рекомендовал дать этому соединению укоренившееся название – бензол (окончание – ол указывает на его маслянистый характер от лат. оleim – масло). В 1845 г. А.В.Гофманн выделил впервые бензол из каменноугольной смолы.
Переходим к следующему этапу: установим строение молекулы бензола. Как мы уже определили ни к одному из известных классов углеводородов бензол отнести нельзя. Но, попробуем представить себе какие могут быть варианты его формулы:
Можно еще придумать изомеры, отличающиеся положением двойных и тройных связей.
Теперь у нас есть то, что называется рабочей гипотезой. Попробуем проверить ее. Если удастся доказать правильность одной из предложенных нами структур, гипотеза превратится в теорию, если нет – будем думать дальше.
Есть очень простая реакция, которая позволяет быстро и надежно установить наличие двойных или тройных связей в ненасыщенных углеводородах. Какая?
- Это присоединение брома по кратным связям. Если предположить, что верна 3-я формула, то должно получиться следующее соединение: СН2Вr-СНВr-CВr2-СВr2-CH2Вr-СН2Вr
Достаточно несколько раз встряхнуть непредельный углеводород с бромной водой, как желтый раствор обесцветиться.
Встряхиваем бензол с бромной водой - никакого эффекта!
- Значит наши предположения неверны.
Можно попробовать присоединить к молекуле бензола не бром, а водород. В наших условиях это сделать нельзя. Но если это сделать в специальном приборе над катализатором, то можно получить из бензола углеводород с формулой
Если подействовать на него бромной водой – реакция отрицательная. Тогда остается предположить, что углеводород С6Н12 имеет замкнутое циклическое строение. Это кольцо состоит из шести групп СН2:
По- видимому, бензол тоже имеет циклическую структуру. И формула для него напрашивается такая:
С двойными связями? Но бромная вода.
Приходится предположить, что три двойные связи, сведенные в месте в одном шестичленном кольце ведут себя как-то по-новому.
Формула бензола – шестиугольник с тремя двойными связями – подтверждается синтезом бензола из ацетилена. Из трех молекул ацетилена получается одно бензольное кольцо. При этом одна из трех связей ацетилена как бы идет на образование простой связи с углеродным атомом другой молекулы, а две остаются. В результате получаем чередование двойных и простых связей.
Так или примерно так рассуждал немецкий химик Фидрих Август Кекуле, когда в 1865 году впервые пришел к выводу, что бензол – это шестиугольник с чередующимися двойными и простыми связями.
Формула Кекуле была встречена бурными дебатами, которые не утихали еще в течение многих десятилетий. Действительно, какие-то свойства бензола эта формула хорошо объясняла, а какие-то ей противоречили.
Оказалось, что бензол все-таки может при некоторых условиях присоединять галогены, например шесть атомов хлора, по всем трем двойным связям. Но с другой стороны, атомы водорода в бензоле очень легко могут быть замещены на другие группы (мы еще поговорим об этом). Эта способность – одна из основных в комплексе свойств бензола, которая называется ароматичностью. Ароматичность (т.е. способность легко заменять атомы водорода) никак не объясняется формулой Кекуле. Далее. Для каждого двузамещенного бензола, судя по этой формуле, должны существовать два изомера. Например, для орто – ксилола это изомеры:
Споры вокруг теории строения бензола прекратились всего несколько десятилетий назад. Каковы же современные представления об электронном строении бензола ?
Немецкий химик Э. Хюккель применил к ароматическим соединениям квантомеханическую теорию и показал, что каждый атом углерода находится в SP² гибридизированном состоянии. Что это значит?
Класс (ученик у доски).
Из четырех электронов каждого углерода один S и два P – электрона образуют три совершенно одинаковые SP² - гибридные орбитали, которые лежат в одной плоскости под углом 120° друг к другую. Две из этих орбиталей используются для перекрывания с такими же орбиталями двух соседних углеродов, а одна – для образования с атомом водорода.
Все эти электроны образуют электронный остов бензола.
Над и под каждым углеродным атомом расположена объемная восьмерка Р – электрона.
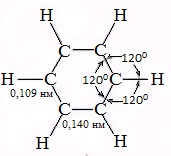
Если формула Кекуле верна, то расстояние в молекуле бензола между двумя соседними атомами углерода должны быть разными: 0,154 нм между атомами у которых р- облака не перекрываются и 0,133 нм между углеродами, связанными П – связью.
Но исследование бензола физическими методами показало, что все расстояния в молекуле строго одинаковы и длинна связи С – С равна 0,140 нм, т.е. среднему значению между длинами простой и двойной связями. Логично предположить, что каждая электронная восьмерка – орбиталь перекрывается одинаково и одновременно с такими же восьмерками двух соседей.
В проекции на плоскость молекулы эти электронные облака будут казаться перекрывающимися окружностями (показать по таблице). В молекуле образуется не три отдельные П – связи, а единая П – электронная система из шести электронов, общая для всех атомов углерода. Под влиянием этого общего для молекулы П- электронного облака и сокраается расстояние между атомами углерода с 0,154 до 0,140 нм.
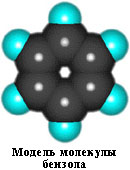
Масштабная (объемная) модель молекулы бензола представлена в таблице (показать). Поскольку электронная плотность распределяется в молекуле равномерно, все связи между атомами С оказываются совершенно одинаковыми.
Таким образом, химические связи в бензоле не одинарные и не двойные, а как принято поворить полуторные, промежуточные по своему характеру. Эти связи еще называют ароматическими, они прочнее П – связей (поэтому бромная вода не обесцветилась – атомы брома не присоединяются).
Чтобы показать равномерность распределения электр. Плотности в молекуле бензола, структурную формулу его часто изображают в виде шестиугольника с окружностью внутри:
Такая структура называется бензольным или ароматическим ядром. А углеводороды, в составе молекул, в котором содержится ароматическое ядро, называются ароматическими углеводородами.
Фактически, эта структура молекулы бензола несет в себе черты строения и первой и второй структуры и представляет качественно новую систему. Давайте проведем аналогию, построенную на ваших биологических знаниях : гибрид лошади и осла – мул. Мул несет в себе признаки и лошади, и осла, но является совершенно новым животным с присущими только ему признаками. И поэтому, если мы хотим человеку, никогда не видевшему мула, описать это животное, мы можем рассказать о лошади, об осле, а потом заявить: мул – это нечто среднее.
Но и сейчас нередко еще пользуются формулой Кекуле, учитывая при этом, что она лишь условно передает строение молекулы.

Ароматическими называют молекулы, обладающие рядом особенных свойств. В первую очередь, они должны быть плоскими, замкнутыми в кольцо. Кроме того, над плоскостью кольца должно располагаться облако электронов из сопряженных химических связей — такие электроны могут легко путешествовать от одной связи к другой. Третье требование к ароматическим молекулам — при делении на четыре количество электронов в облаке должно давать остаток два. Соблюдение этих требований приводит к значительному изменению свойств молекулы, в частности, к увеличению ее стабильности.


2b и 2a — исходные молекулы, использованные для синтеза триангулена
Niko Pavliček et al. / Nature Nanotechnology, 2017
В качестве гладкой подложки исследователи использовали твердый ксенон, охлажденный до пяти кельвинов. На него химики осаждали дигидротриангулен — вещество, молекулы которого обладают тем же углеродным скелетом, что и требуемый триангулен. На атомах углерода, на которых должны располагаться неспаренные электроны, в этой молекуле находятся по дополнительному атому водорода.
С помощью иглы с молекулой угарного газа ученые направленно отрывали эти атомы водорода — попросту прикладывая к системе электрическое напряжение. После этого молекула превратилась сначала в монорадикал, а затем и в искомый бирадикал, стабильный благодаря низкой температуре и инертному окружению. По словам авторов, полученная система — очень хорошая модель для изучения взаимодействий между парой электронных спинов.
Как отмечает Филип Мориарти, специалист по манипуляции одиночными атомами из Университета Ноттингема, авторы продемонстрировали принципиально новый подход к химическому синтезу. Кроме ксеноновых подложек химики воспользовались также кристаллами меди и хлорида натрия. Мориарти отдельно упоминает необычно высокую стабильность триангулена по отношению к меди — в некоторых экспериментах молекула сохранялась на поверхности на протяжении нескольких дней.
Ранее, благодаря использованию атомно-силовых микроскопов ученые из исследовательского центра IBM научились смыкать и размыкать циклы внутри одиночных молекул, а также увидели связи в аринах — высокоактивных химических соединениях.
Современная теория строения молекулы бензола базируется на представлении о гибридизации орбиталей атома углерода.
Согласно этой теории, атомы углерода в бензоле находятся в состоянии sp 2 -гибридизации.
Каждый атом углерода образует три σ-связи (две с атомами углерода и одну – с атомом водорода). Валентные углы между каждой парой σ-связей равны 120°. Таким образом, все шесть атомов углерода и все σ-связи С-С и С-лежат в одной плоскости, образуя правильный шестиугольник (σ-скелет молекулы бензола).
Каждый атом углерода имеет одну негибридную р-орбиталь. Шесть таких орбиталей располагаются перпендикулярно плоскому σ-скелету и параллельно друг другу. Все шесть р-электронов взаимодействуют между собой, образуя π-связи, не локализованные в пары, как при образовании обычных двойных связей, а образующие единое π-электронное облако и единую химическую связь для всех атомов углерода.
Таким образом, в молекуле бензола осуществляется круговое сопряжение, образуется единая сопряженная π-система. Наибольшая π-электронная плотность в этой сопряженной системе располагается над и под плоскостью σ-скелета.
Сочетание шести σ-связей с единой π-системой называется ароматической связью.
Цикл из шести атомов углерода, связанных ароматической связью, называется бензольным кольцом, или бензольным ядром.
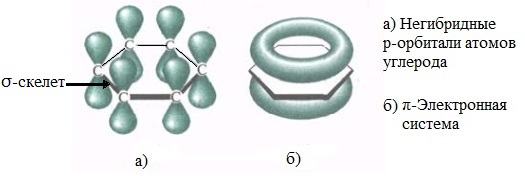
π-Электронное облако обусловливает сокращение расстояния между атомами углерода.
Поэтому структурную формулу бензола изображают в виде правильного шестиугольника (σ-скелет) с окружностью внутри, обозначающего делокализованные π-связи.
Такое электронное строение объясняет все особенности бензола. Становится понятно, почему бензол трудно вступает в реакции присоединения – это приводит к нарушению сопряжения. Такие реакции возможны только в очень жестких условиях.
Таким образом, наряду с формулой Кекуле используется формула бензола, где обобщенное электронное облако изображают замкнутой линией внутри кольца.
Первым представителем ряда простейших ароматических углеводородов – аренов – является бензол. Все ароматические соединения – как гомологи бензола, так и арены более сложного строения – представляют собой его производные. Отличительный признак аренов – наличие в структуре молекулы бензольного кольца.
Строение ароматической связи

Углеродный скелет бензольного кольца имеет форму шестиугольника, в плоскости которого лежат оси соединяющих атомы -связей. Все эти связи одинаковы, угол между ними равен 120°. Поэтому негибридные p-облака, ориентированные перпендикулярно плоскости цикла, также равнозначны.
Результатом их перекрывания становится обобществление всех p-электронов в единое -электронное облако с делокализованной плотностью. Сочетание прочных -связей и -облака – ароматическая связь – образует стабильную структуру, называемую бензольным ядром.

При записи ядро условно обозначается шестиугольным циклом либо с тремя чередующимися двойными связями, либо с вписанной делокализационной окружностью, которая подчеркивает особый характер ароматической связи.

Гомологический ряд бензола
Молекула бензола состоит только из ароматического ядра. Остальные представители гомологического ряда имеют в составе молекулы алкильные радикалы, присоединенные к ядру, и называются алкилбензолами.
Состав гомологов бензола определяется общей формулой . Гомологическая разность выражается через звено углеводородной цепочки радикала.
Ряд бензола включает только арены с насыщенными радикалами и одним бензольным ядром. К числу ароматических углеводородов относятся соединения с непредельными радикалами, а также с несколькими бензольными кольцами, например:

Эти углеводороды не являются гомологами бензола, они входят в состав других рядов класса аренов.
Строение углеводородов бензольного ряда представлено в таблице:


Арильные (содержащие бензольное ядро) радикалы носят следующие названия:

Каждый гомолог бензола может быть представлен как предельный углеводород с ароматическим радикалом:
Номенклатура и изомерия алкилбензолов

Всем соединениям гомологического ряда свойственна структурная изомерия, обусловленная наличием одной или нескольких боковых цепей. Не имеют изомеров только бензол и его ближайший гомолог – толуол, обладающий единственным простейшим метильным радикалом .
Строение углеродного скелета

В зависимости от количества, состава и строения алкильных заместителей для соединений состава характерно широкое разнообразие. Число изомерных форм быстро растет с увеличением n.



При наименовании алкилбензолов соблюдаются следующие правила:



Позиции одинаковых заместителей
В полизамещенных алкилбензолах с радикалами одного типа возникает изомерия, связанная с их взаимным положением. Для позиционных изомеров в ряду бензола существуют специальные обозначения:


Физические свойства некоторых алкилбензолов
Бензол и углеводороды его ряда – бесцветные жидкости со специфическим запахом, не смешивающиеся с водой и нерастворимые в ней. Высшие гомологи представляют собой твердые вещества. Термические характеристики соединений бензольного ряда зависят от изомерии и длины боковых алкильных цепей.
Основные физические свойства бензола и наиболее близких его гомологов приведены в таблице.
Химические свойства алкилбензолов
Несмотря на то, что по составу бензол и другие представители гомологического ряда являются ненасыщенными соединениями, они склонны к типичным для алканов реакциям замещения, а ароматическое ядро чрезвычайно устойчиво. Тем не менее, алкилбензолы способны и к процессам присоединения, хотя реакции данного типа значительно затруднены по сравнению с непредельными углеводородами.
Различные заместители оказывают влияние на стабильность и реакционную способность бензольного ядра; оно, в свою очередь, воздействует на свойства радикалов. Поэтому изомерия играет важную роль в химических взаимодействиях алкилбензолов.
Замещение
Поскольку ароматическая система насыщена электронной плотностью, бензол и гомологи охотно реагируют с электрофильными соединениями по донорно-акцепторному механизму. Для бензольного кольца типичны процессы ионного замещения.
В отсутствие катализатора алкилбензолы не взаимодействуют с галогенами и их растворами (хлорной или бромной водой). На никелевом, железном или алюминиевом катализаторе, способствующем активации галогена, замещение идет по преимуществу в бензольном ядре:

В молекулах гомологов галогены замещают водород главным образом в орто-и пара-позициях к углеводородному радикалу:

Замещение может происходить и в боковой цепи. Для этого требуется воздействие яркого света либо нагревание до 300°C:

При этом галоген атакует ближайший к кольцу углеродный атом.
Для реакции необходима нитрующая смесь концентрированных азотной и серной кислот:


Замещение водорода алкильными радикалами является одним из методов получения гомологов бензола. Оно проводится несколькими путями:

Если неразветвленный галогеналкан содержит более двух углеродных атомов, происходит изомеризация продукта алкилирования:



Водород может замещаться ацильным остатком галогенангидрида или ангидрида карбоновой кислоты:
Присоединение
В специальных условиях алкилбензолы способны к реакциям присоединения с разрушением ароматической связи.

Из всех соединений гомологического ряда хлор присоединяется только к бензолу:

При воздействии галогена на любой из гомологов бензола происходит не присоединение, а замещение в алкильном радикале.
Окисление
Бензол стоек к воздействию окислителей, таких как перманганат калия, даже в присутствии кислот и щелочей. Но его гомологи в жестких условиях подвергаются окислению.
При повышенной температуре в нейтральной среде алкилбензолы окисляются до калиевой соли бензойной кислоты:


В кислой среде происходит образование бензойной кислоты:

Гомологи с длинной боковой цепью образуют две кислоты, так как при отрыве цепи от углеродного атома, соединенного с бензольным циклом, образуется остаток, содержащий более одного атома:

Если в реакции участвует полизамещенный алкилбензол, продуктом его окисления становится многоосновная ароматическая кислота:

Углеводороды ряда бензола горят с интенсивным выделением теплоты. Продукты горения зависят от количества вступающего в реакцию кислорода:


Взаимодействие радикалов с бензольным ядром
Заместители в зависимости от своей электрической природы по-разному влияют на распределение электронной плотности в ароматической системе. Соответственно изменяется и реакционная активность бензольного ядра в процессах замещения.
Заключение
Особенности электронного строения алкилбензолов не только оказывают влияние на их структуру и обусловливают многообразие изомерных форм. Они также непосредственно воздействуют на реакционную активность, определяя направление химических процессов с участием бензола и его гомологов. Это свойство алкилбензолов делает их ценным химическим продуктом, благодаря чему они находят широкое применение в промышленности и науке.
Бензол является ароматическим углеводородным соединением, представляющим собой прозрачную жидкость, которая имеет слегка сладковатый запах. Структурная формула бензола - C6H6.
Это вещество является составной частью нефтепродуктов, применяется в промышленной и медицинской областях, входит в состав пластмассы, резины и различных красок.
Характеристики и физические свойства бензола
Некоторые углеводородные соединения сильно похожи на бензол. Однако они отличаются видом реакции, в которую вступают. Так, этилен, являющийся ненасыщенным углеводородом, вступает в реакцию присоединения, в то время как бензол вступает в реакцию замещения. Это происходит из-за того, что атомы бензола располагаются в одной плоскости.
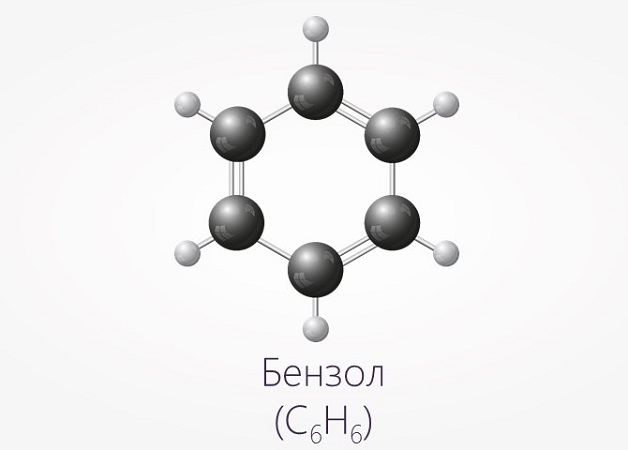
Еще одним отличием является наличие в формуле бензола бензольного кольца. Таким образом, если в химической формуле вещества имеется бензольное кольцо — однозначно это бензол.
Строение этого углеводорода представлено в виде шестиугольника.
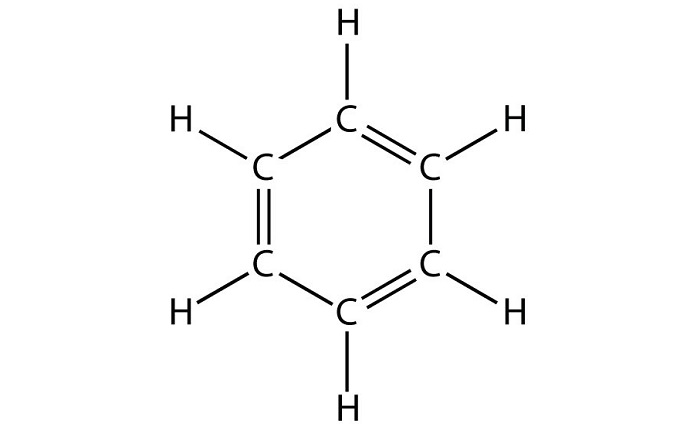
Данный углеводород имеет следующие физические свойства:
вещество представляет собой жидкость, имеющую не совсем приятный запах;
температура плавления бензола составляет 5,5 0 C;
температура кипения — 80 0 C;
общая плотность вещества — 0,879 г/см 3 ;
молярная масса 78,1 г/моль;
без проблем реагирует с органическими растворителями;
при попадании воздуха образует взрывоопасное соединение;
в процессе горения на свету видны следы копчения;
растворим в воде, нагретой до 25 0 C.
Получение бензола
Российским ученым-химиком Зелинским Н. Д. было доказано, что бензол возможно получить не только в процессе коксования угля, при котором данное сырье нагревается, выделяя бензол и иные летучие вещества. Данное вещество может быть образовано из циклогексана, в случае взаимодействия его с платиной или палладием.
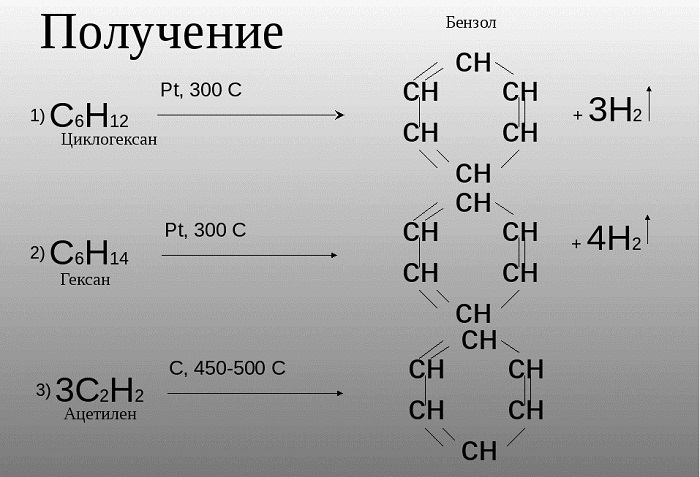
Также, бензол можно получить путем нагревания гексана.
Зелинский также считал, что бензол возможно получить путем тримеризации ацетилена:
В настоящее время, большой популярностью пользуются такие способы получения бензола, как получение его из циклопарафинов и предельных углеводородов. Связано это прежде всего, с тем, что необходимость этого вещества сильно возросла.
Химические свойства бензола
Бензол активно вступает в реакции с кислотами, а также веществами из класса алкенов, галогенов, аренов и хлоралканов. В основном данный углеводород вступает в реакцию замещения. Высокая температура и сильное давление оказывают влияние на разрыв бензольного кольца.
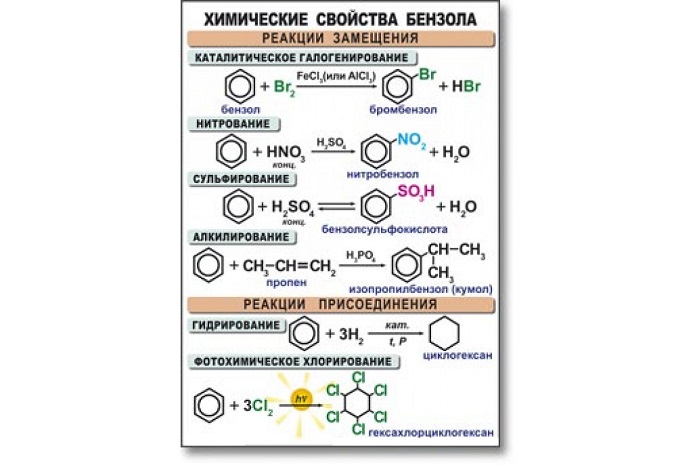
Уравнения реакции бензола:
- в случае наличия катализатора, бром вступает в реакцию с хлором, образуя при этом хлорбензол:
- алкилирование бензола. Алкилбензол образуется в результате соединения бензола с алканами:
- к гомологам бензола относятся алкилбензолы, которые вступают в реакцию окисления, образуя при этом бензойную кислоту:
Применение бензола
В настоящее время бензол применяется во многих областях нашей жизни.

Наиболее часто данный углеводород применяется для синтезирования иных органических веществ. Используя реакцию нитрирования получают нитробензол; хлорирования — хлорбензол (растворитель), и другие вещества.
Хлорбензол часто используется в сфере сельского хозяйства, поскольку он является прекрасным средством для защиты растений. Данным веществом, при замене в его структуре молекул водорода молекулами хлора, протравливают семена растений, чтобы защитить их от грызунов и насекомых.
В области химической промышленности бензол играет немаловажную роль. Помимо его участия при создании других веществ, он также выступает в качестве растворителя. С помощью бензола возможно растворить любое органическое соединение.
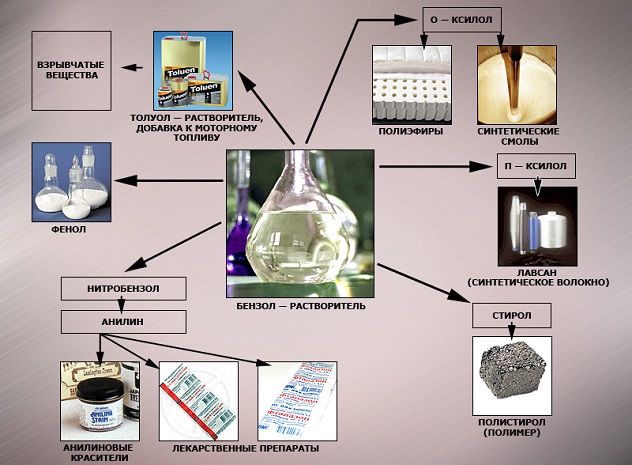
Сегодня этот углеводород чаще всего используется при синтезировании этилбензола и кумола. Однако он редко применяется в чистом виде. В основном используются его производные компоненты. Этилбензол успешно применяется в качестве одного из компонентов автомобильного топлива, а также для синтезирования ионообменной смолы.
Помимо сельскохозяйственной и химической промышленности, бензол успешно применяется в области медицины.
Впервые бензол начали применять для лечения такого заболевания, как белокровие. В начале 20 века медики всего земного шара использовали бензол для лечения лейкемии, однако вскоре выяснилось, что вылечить эту болезнь таким методом нельзя.
Сначала бензол принимали перорально, затем стали вводить в качестве инъекции. Такое его применение было связано с тем, что первоначальные исследования показали возможность данного вещества снижать уровень лейкоцитов в крови, но вскоре выяснилось, что его применение в этих целях очень опасно.
Читайте также:

