Как сделать модель кристаллической решетки алмаза
Обновлено: 07.07.2024
Модель предназначена для демонстрации атомной структуры кристаллической решетки алмаза.
Габаритные размеры в упаковке (дл.*шир.*выс.), см: 15,5*11*5. Вес, кг, не более 0,2.
Комплектность: шары чёрного цвета – 30 шт., трубки соединительные – 40 шт., руководство по эксплуатации – 1 шт.
Модель собирается из черных шариков, обозначающих атомы, и соединительных трубок, обозначающих связи.
Модель позволяет демонстрировать одно из аллотропных видоизменений углерода и взаимосвязь строения кристаллической решетки с физическими свойствами вещества. Также позволяет демонстрировать кристаллическую структуру таких полупроводников, как кремний, германий; в комплекте с моделью кристаллической решетки графита демонстрирует явление полиморфизма углерода.

У каждого вещества есть набор физических свойств. Например, соли легко растворяются в воде и проводят электрический ток, а металлы имеют характерный блеск и ковкость. Такие характеристики зависят от строения вещества — от его кристаллической решетки. В этом материале мы расскажем о видах кристаллических решеток и о том, какие свойства придает веществу каждая из них.
О чем эта статья:
11 класс, ЕГЭ/ОГЭ
Статья находится на проверке у методистов Skysmart.
Если вы заметили ошибку, сообщите об этом в онлайн-чат (в правом нижнем углу экрана).
Что такое кристаллическая решетка
Как известно, все вещества состоят из частиц — атомов, которые могут располагаться хаотично или в определенном порядке. У аморфных веществ частицы расположены беспорядочно, а у кристаллических они образуют определенную структуру. Эта структура называется кристаллической решеткой. Она определяет такие характеристики вещества, как твердость, хрупкость, температура кипения и/или плавления, пластичность, растворимость, электропроводность и т. д.

Кристаллическая решетка — это внутренняя структура кристалла, порядок взаимного расположения атомов, ионов или молекул. Точки, в которых находятся эти частицы, называются узлами решетки.
Частицы удерживаются на своих местах благодаря химическим связям между ними. В зависимости от того, какой вид связи удерживает атомы или ионы данного вещества, в химии выделяют основные типы кристаллических решеток:
атомная (ковалентные связи),
молекулярная (ковалентные связи и притяжение между молекулами),
металлическая (металлические связи),
ионная (ионные связи).
Не путайте эти два понятия — кристаллическая решетка и химическая связь. Тип решетки говорит о том, как расположены атомы/ионы в молекуле вещества, а тип связи — по какому принципу они между собой взаимодействуют.

Строение и агрегатное состояние веществ
Выделяют три агрегатных состояния: твердое тело, жидкость и газ. Каждое из них предполагает определенное расположение частиц. Ниже мы расскажем подробнее, как связаны в химии кристаллическая решетка и агрегатное состояние вещества, а пока осветим общие закономерности.
Если частицы хаотично движутся, а расстояние между ними многократно превышает их собственные размеры — это газ. За счет большой удаленности друг от друга молекулы и атомы в таком веществе слабо взаимодействуют между собой.
Если частицы расположены все так же беспорядочно, но на небольшом расстоянии друг от друга — это жидкость. В жидком состоянии вещества его молекулы и атомы имеют более прочные связи, которые сложнее разорвать.
Если частицы собраны близко друг к другу и в определенном порядке — это твердое тело. В таком состоянии связи между ними наиболее прочны. Частицы могут двигаться только в пределах своего расположения и почти не перемещаются в пространстве.
Большинство веществ могут находиться и в твердом, и в жидком, и газообразном состоянии, а в зависимости от давления и температуры легко переходить из одного в другое. Типичный пример — вода, которая при нагревании превращается в пар, а при остывании становится твердым льдом.

Атомная кристаллическая решетка
Согласно своему названию, атомная кристаллическая решетка — это структура, в узлах которой расположены атомы. Они взаимодействуют с помощью ковалентных связей, то есть один атом отдает другому свободный электрон или же электроны из разных атомов образуют общую пару. В кристаллах с атомной решеткой частицы прочно связаны, что обуславливает ряд физических характеристик.
Свойства веществ с атомной решеткой:
неспособность к растворению в воде,
высокая температура кипения и плавления.
К примеру, атомную кристаллическую решетку имеет алмаз — самый твердый минерал в мире.
Другие примеры: германий Ge, кремний Si, нитрид бора BN, карборунд SiC. Типичный представитель этой группы — обычный песок, который по сути является оксидом кремния SiO2.
Если нужно рассказать о свойствах веществ с атомной кристаллической решеткой, достаточно вспомнить песок и перечислить его характеристики.

Молекулярная кристаллическая решетка
Как и в предыдущей группе, в этой находятся вещества с ковалентными связями между атомами. Но физические характеристики этих веществ совершенно иные — они легко плавятся, превращаются в жидкость, растворяются в воде. Почему так происходит? Все дело в том, что здесь кристаллы строятся не из атомов, а из молекул.
Молекулярная кристаллическая решетка — это структура, в узлах которой находятся не атомы, а молекулы.
Внутри молекул атомы имеют прочные ковалентные связи, но сами молекулы связаны между собой слабо. Поэтому кристаллы таких веществ непрочные и легко распадаются.
Молекулярная кристаллическая решетка характерна для воды. При комнатной температуре это жидкость, но стоит нагреть ее до температуры кипения (которая сравнительно низка), как она тут же начинает превращаться в пар, т. е. переходит в газообразное состояние.
Некоторые молекулярные вещества — например, сухой лед CO2, способны преобразоваться в газ сразу из твердого состояния, минуя жидкое (данный процесс называется возгонкой).

Свойства молекулярных веществ:
у некоторых — наличие запаха.
Помимо воды к веществам с молекулярной кристаллической решеткой относятся аммиак NH3, гелий He, радон Rn, йод I, азот N2 и другие. Все благородные газы — молекулярные вещества. Также к этой группе принадлежит и большинство органических соединений (например, сахар).

Ионная кристаллическая решетка
Как известно, в ходе ионной химической связи один атом отдает другому ионы и приобретает положительный заряд, в то время как принимающий атом заряжается отрицательно. В итоге появляются разноименно заряженные ионы, из которых и состоит структура кристалла.
Ионная решетка — это кристаллическая структура, в узловых точках которой находятся ионы, связанные взаимным притяжением.
Ионную кристаллическую решетку имеют практически все соли, типичным представителем можно считать поваренную соль NaCl. О ней стоит вспомнить, если нужно перечислить физические характеристики этой группы. Также ионную решетку имеют щелочи и оксиды активных металлов.
Свойства веществ с ионной структурой:
способность растворяться в воде.
Примеры веществ с ионной кристаллической решеткой: оксид кальция CaO, оксид магния MgO, хлорид аммония NH4Cl, хлорид магния MgCl2, оксид лития Li2O и другие.

Металлическая кристаллическая решетка
Для начала вспомним, как проходит металлическая химическая связь. В молекуле металла свободные отрицательно заряженные электроны перемещаются от одного иона к другому и соединяются с некоторыми из них, а после отрываются и мигрируют дальше. В результате получается кристалл, в котором ионы превращаются в атомы и наоборот.
Металлическая кристаллическая решетка — это структура, которая состоит из ионов и атомов металла, а между ними свободно передвигаются электроны. Как несложно догадаться, она характерна лишь для металлов и сплавов.
Свободные электроны, мигрирующие между узлами решетки, образуют электронное облако, которое под воздействием электротока приходит в направленное движение. Это объясняет такое свойство металлов, как электрическая проводимость.
В химии типичным примером вещества, которое имеет металлическую кристаллическую решетку, считается медь. Она очень ковкая, пластичная, имеет высокую тепло- и электропроводность. Впрочем, все металлы ярко демонстрируют эти характеристики, поэтому назвать физические свойства данной группы несложно.

Свойства веществ с металлической кристаллической решеткой:
При этом температура плавления веществ может существенно различаться. Например, у ртути это −38,9°С, а у бериллия целых +1287°С.
Подведем итог: о характеристиках разных типов кристаллических решеток расскажет таблица.
Частицы в узлах решетки
Тип связи между частицами
Физические свойства веществ
Как определить кристаллическую решетку
Как понятно из предыдущего материала, строение вещества, его состав и физические характеристики тесно связаны. Поэтому для определения вида кристаллической решетки можно руководствоваться теми данными, которые у нас есть. Как правило, известен состав вещества, а значит, мы можем сделать вывод о химических связях внутри его молекулы, что позволит в свою очередь предположить тип решетки.
Также можно провести быстрый анализ:
если это неметалл, который при комнатной температуре представляет собой твердое тело — скорее всего он имеет атомную решетку;
если в обычных условиях это жидкость или газ либо речь об органическом веществе — предполагаем молекулярную решетку;
если это соль либо щелочь — кристаллы имеют ионную решетку;
если это металл или сплав — решетка точно будет металлической.
Вопросы для самопроверки:
Назовите виды кристаллических решеток.
Чем отличается кристаллическая решетка от химической связи?
Назовите примеры веществ с металлической кристаллической решеткой, с ионной, атомной и молекулярной.
Выберите лишнее вещество: молекулярную кристаллическую решетку имеет вода, поваренная соль, аргон, криптон.
Примерно 97 % алмазов, которые используются в промышленности — синтетические . Давайте разберём как их получают! Технологией производства синтетических алмазов владеют всего около десятка компаний во всем мире.
История
Желание синтезировать алмаз появилось у людей в конце XVIII века сразу, когда стало ясно, что от графита он отличается лишь кристаллической решёткой. С конца XIX века ученые предпринимали попытки превратить дешевые и доступные формы углерода (уголь или графит) в алмаз. Однако на практике, разрушить структуру алмаза оказалось легче, чем сформировать. Многие учёные сообщали миру о достигнутом успехе, однако реальных свидетельств не было. Первый искусственный алмаз, предъявленный миру, был получен в 1954 году в лаборатории компании General Electric.
Компания GE вдохновилась естественными процессами образования алмазов. По догадкам учёных, натуральные алмазы образуются при температуре 1300°С и давлении 50 000 атм. на глубине около двухсот километров под поверхностью Земли в толще мантии планеты. на глубине сотен. Лампроиты, кимберлиты и другие магматические породы выносят кристаллы на поверхность Земли.
Технология, имитирующая такие условия, называется HPHT (High Pressure High Temperature — высокое давление, высокая температура). Именно она была взята за основу при получении недорогих технических алмазов и алмазного порошка.
Как выращивают алмазы сегодня
На сегодняшний день существует множество технологий по производству алмазов, однако промышленность использует для этих целей преимущественно одну из двух технологий — это вышеупомянутая технология HPHT и технология CVD .
HPHT
Выращивание алмазов производится при высокой температуре (около 1500 °C, с нужным градиентом) и высоком давлении (50−70 тыс. атм.). В данном методе используются затравочные кристаллы алмаза (до 0,5 миллиметров в диаметре), которые кладут на пласт из графита. Сначала располагается основа с затравкой, потом идет сплав металла (железо, никель, кобальт и др.), который является катализатором, затем прессованный графит. Гидравлический пресс обжимает специальный контейнер со всеми вышеперечисленными компонентами. Сквозь камеру протекает электрический ток, разогревающий расплав до нужной температуры. Под воздействием температур и давления ковалентные пи-связи графита преобразуются в сигма-связи алмаза. Металл в процессе плавится, и графит оседает на затравку. На подложке может находится одна или несколько затравок, поэтому синтез продолжается от 4 до 13 дней, все зависит от требуемых размеров камня. — небольших кристаллов алмаза.
CVD
Синтез CVD-алмазов (Chemical Vapor Deposition, осаждение из газовой фазы). Второе название процедуры — пленочный синтез. Технология более старая и проверенная, чем HPHT-производство. С помощью этой технологии производятся промышленные алмазы, например для лезвий в микрохирургии. Алмазная затравка помещается на подложку в специальной камере. С помощью СВЧ-излучения углеводородный газ разогревается до высоких температур (~3000°С ), образуется ионизированный газ. Углерод, который был в газе, оседает на подложку, нагретую до температуры 600−700°С. Синтетический алмаз, созданный по этой технологии, получается более чистым, без примесей азота, однако он имеет ограниченное применение в электронике и оптике. Скорость роста — от 0,1 до 100 мкм/ч. Толщина пластин обычно ограничена 2−3 мм, поэтому вырезанные из нее алмазы можно использовать в качестве ювелирных, но их размер, как правило, не превышает 1 карата.
Детонационный метод синтеза
Методы взрывного синтеза алмазов основаны на кратковременном воздействии высоких давлений и температур на углеродсодержащий материал (графит, уголь, кокс) и с быстрым последующим охлаждением образовавшейся алмаза, чтобы он не перешёл в более стабильную форму — графит. Для этого используются взрывчатые вещества. Таким способом получают алмазные нанокристаллы диаметром 5 нм.
Чем различаются природные и синтетические алмазы?
Одно из существенных отличий природных алмазов — дефекты кристаллической решетки, которые придают камням окраску. Например, желтый — последствие вкраплений атомов азота, коричневый и розовый оттенок камня — последствия искривления кристаллической решетки. При этом, управляя процессом создания, в искусственных алмазах можно добиться кристаллической решетки, близкой к идеальной, а чистота содержания углерода в них может доходить до 99,999%.
Чем отличается алмаз от графита можно узнать в этой статье .
Уважаемый читатель, очень рад что ты дочитал статью, Спасибо! Надеюсь тебе понравилось. Оценивай статью и пиши комментарии :)
Элементарную ячейку алмаза можно построить двумя способами.
Второй способ. Как и в предыдущем случае возьмем за основу гранецентрированную кубическую решетку Бравэ с атомами углерода в углах и центре граней. Затем еще раз повторим полученный структурный мотив, сдвинув его на 1/4 телесной диагонали вдоль исходной кубической ячейки. Полученный результат будет аналогичен предыдущему. Второй вариант вывода элементарной ячейки алмаза представляет особый интерес вследствие того, что наглядно демонстрирует каким образом в ее структуре можно выделить две кубические гранецентрированные подрешетки, сдвинутые относительно друг друга на четверть телесной диагонали. Такая схема позволяет понять многие физические и морфологические особенности реальных кристаллов алмаза.
Рис. 26. Элементарную ячейку алмаза: а ¾ деление элементарного куба на 8 октантов (а – параметр ячейки) (рис. 130, Шаскольская), две подрешетки, сдвинутые по телесной диагонали одна относительно другой.
Проекция элементарной ячейки структуры алмаза на плоскость (001) показана на рис. 27, б, где хорошо видно действие алмазных плоскостей и винтовых осей симметрии 41. Атом в вершине куба можно совместить с атомом в середине октанта, если его отразить в плоскости d и сместить на расстояние (b+c)/4. Атом в центре грани и близлежащие атомы на высотах 1/4, 1/2, 3/4 совместятся, если их поворачивать вокруг оси четвертого порядка и одновременно передвигать вдоль оси на 1/4 периода трансляции.
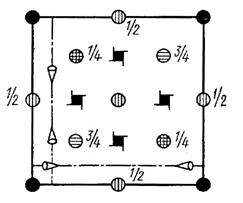
Рис. 27. Элементарная ячейка структуры алмаза (а) и проекция элементарной ячейки структуры алмаза на плоскость (001) (б)
Для простоты на чертеже показаны только две плоскости d; такие же плоскости, параллельные этим, проходят через каждые ¼ параметра ячейки. Разными кружками обозначены одинаковые атомы, находящиеся: 1 – в вершинах ячейки; 2 – в центрах граней; 3 – в центрах пары квадрантов на высоте ¼; 4 – в центрах противоположной пары квадрантов на высоте ¾
Кристаллическую структуру алмаза характеризуют следующие элементы симметрии:
3 - инверсионная ось 3-го порядка вдоль [111];
4 - инверсионная ось ось 4-го порядка вдоль[100];
41 - винтовая ось 4- го порядка параллельная 4;
m - зеркальная плоскость симметрии, совпадающая с диагональной 110> кристаллографической плоскостью;
n - плоскость скользящего отражения типа n (1/2 [110] 220>);
d - плоскость скользящего отражения типа d.
Итак, алмаз относится к пространственной группе Fd3m.
В структуре алмаза не достигается плотнейшей упаковки, но слои, параллельные объемной диагонали кубической ячейки упакованы плотнее других ¾ это октаэдрические плоскости 111>. Наиболее плотноупакованное направление в алмазе совпадает с диагональю грани кубической ячейки ¾ [110].
В кристаллической решетке алмаза каждый атом углерода окружен четырьмя атомами углерода, расположенными в вершинах правильного тетраэдра (рис. 28). При этом атомы углерода связаны с другими ковалентной связью.
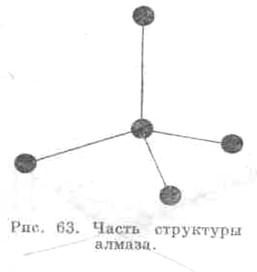
Рис. 28. Тетраэдрическая координация атомов углерода в алмазе.
Ковалентная связь осуществляется с помощью спаренных электронов. Два спаренных электрона в алмазе принадлежат одновременно двум соседним атомам углерода. Ковалентные связи строго направлены. Векторы связей ориентированы в пространстве под углом 109 0 20' одна по отношению к другой. Энергия каждой связи составляет 170 Ккал/моль. Этим обеспечивается рекордная прочность алмаза.
Аналогичную кристаллическую структуру имеют также полупроводники кремний, германий и серое олово (a-Sn). Все они расположены в 4-й группе периодической таблицы Менделеева При этом ни один из перечисленных материалов не обладает прочностью алмаза. Объясняют это тем, что расстояние между атомами у них гораздо больше, чем в алмазе. Кроме того чем ниже расположен элемент 4-й групппы в таблице Менделееева, тем больше у него тенденция к металлической связи. У олова есть более известная и более распространенная структурнвая модификация ¾ металлическое белое олово (b-Sn). располагются
Алмазоподобная структура установлена также у бинарных соединений A II B IV : CdTe, ZnTe, ZnSe и других. Структуру такого вида часто называют структурой сфалерита (ZnS), впервые установленной у этого минерала. Структура сфалерита отличается от алмазной тем, что в двух гранецентрированных кубических подрешетках, сдвинутых одна относительно другой на 1/4 объемной диагонали куба, узлы заняты атомами разных элементов. Все перечисленные бинарные соединения способны кристаллизоваться в двух полиморфных модификациях: кубической (структура сфалерита) и гексагональной (структура вюртцита).
Читайте также:

