Как сделать модель атома
Добавил пользователь Валентин П. Обновлено: 05.10.2024
| атом | ||
| ядро | электроны | |
| протоны | нейтроны | |
| p + | n o | e - |
| Масса протона | Масса нейтрона | Масса электрона |
| 1,0073 а.е.м. | 1,0087 а.е.м. | 0,0005 а.е.м. |
| Заряд протона | Заряд нейтрона | Заряд электрона |
| +1 | -1 |
Кроме протонов, в состав ядра большинства атомов входят нейтроны, не несущие никакого заряда. Как видно из табл. 1, масса нейтрона практически не отличается от массы протона. Протоны и нейтроны составляют ядро атома и называются нуклонами ( nucleus – ядро). Их заряды и массы в атомных единицах массы (а.е.м.) показаны в таблице 1. При расчете массы атома массой электрона можно пренебречь.
Масса атома (массовое число) равна сумме масс, составляющих его ядро протонов и нейтронов. Массовое число обозначается буквой А. Из названия этой величины видно, что она тесно связана с округленной до целого числа атомной массой элемента. A = Z + N
Химическим элементом называется совокупность атомов с одинаковым зарядом ядра.
Изотопами называются разновидности атомов одного и того же химического элемента с одинаковым зарядом ядра (то есть с одинаковым числом протонов), но с разным числом нейтронов в ядре.
Изотопы отличаются друг от друга только массовым числом. Это обозначается либо верхним индексом в правом углу, либо в строчку: 12 Сили С-12. Если элемент содержит несколько природных изотопов, то в периодической таблице Д.И. Менделеева указывается, его средняя атомная масса с учетом распространённости. Например, хлор содержит 2 природных изотопа 35 Cl и 37 Cl, содержание которых составляет соответственно 75% и 25%. Таким образом, атомная масса хлора будет равна:
Аr(Cl)=0,75 . 35+0,25 . 37=35,5
Для тяжёлых искусственно-синтезированных атомов приводится одно значение атомной массы в квадратных скобках. Это атомная масса наиболее устойчивого изотопа данного элемента.
3. Основные модели строения атома
Основные модели строения атома
Исторически первой в 1897 году была модель атома Томсона.
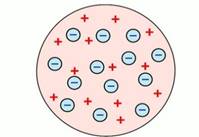
Рис. 1. Модель строения атома Дж. Томсона
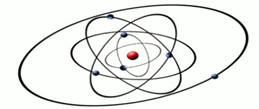
Рис. 2. Модель строения атома Э. Резерфорда
В 1910 году английский физик Эрнст Резерфорд со своими учениками Гейгером и Марсденом провели эксперимент, который дал поразительные результаты, необъяснимые с точки зрения модели Томсона. Эрнст Резерфорд доказал на опыте, что в центре атома имеется положительно заряженное ядро (рис. 2), вокруг которого, подобно планетам вокруг Солнца, вращаются электроны. Атом в целом электронейтрален, а электроны удерживаются в атоме за счет сил электростатического притяжения (кулоновских сил). Эта модель имела много противоречий и главное, не объясняла, почему электроны не падают на ядро, а также возможность поглощения и излучения им энергии.
Датский физик Н. Бор в 1913 году, взяв за основу модель атома Резерфорда, предложил модель атома, в которой электроны-частицы вращаются вокруг ядра атома примерно так же, как планеты обращаются вокруг Солнца.
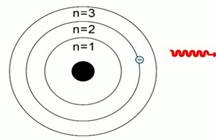
Рис. 3. Планетарная модель Н. Бора
Бор предположил, что электроны в атоме могут устойчиво существовать только на орбитах, удаленных от ядра на строго определенные расстояния. Эти орбиты он назвал стационарными. Вне стационарных орбит электрон существовать не может. Почему это так, Бор в то время объяснить не мог. Но он показал, что такая модель (рис. 3) позволяет объяснить многие экспериментальные факты.
4. Формы атомных орбиталей
В настоящее время для описания строения атома используется квантовая механика. Это наука, главным аспектом в которой является то, что электрон обладает свойствами частицы и волны одновременно, т. е. корпускулярно-волновым дуализмом. Согласно квантовой механике, область пространства, в которой вероятность нахождения электрона наибольшая, называется орбиталью.Чем дальше электрон находится от ядра, тем меньше его энергия взаимодействия с ядром. Электроны с близкими энергиями образуют энергетический уровень. Число энергетических уровней равно номеру периода, в котором находится данный элемент в таблице Д.И. Менделеева. Существуют различные формы атомных орбиталей. (Рис. 4). d-орбиталь и f-орбиталь имеют более сложную форму.
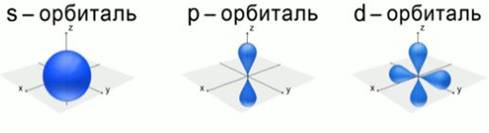
Рис. 4. Формы атомных орбиталей
В электронной оболочке любого атома ровно столько электронов, сколько протонов в его ядре, поэтому атом в целом электронейтрален. Электроны в атоме размещаются так, чтобы их энергия была минимальной. Чем дальше электрон находится от ядра, тем больше орбиталей и тем сложнее они по форме. На каждом уровне и подуровне может помещаться только определенное количество электронов. Подуровни, в свою очередь, состоят из одинаковых по энергии орбиталей.
На первом энергетическом уровне, наиболее близком к ядру, может существовать одна сферическая орбиталь (1s). На втором энергетическом уровне – сферическая орбиталь, большая по размеру и три р-орбитали:2s2ppp. На третьем уровне: 3s3ppp3ddddd.
Максимальное число электронов на энергетическом уровне определяется по формуле N=2n 2.
Где n – главное квантовое число (номер энергетического уровня). См. табл. 2
| Энергетический уровень | N | Электронная конфигурация |
| 1-ый | 1s 2 | |
| 2-ой | 2s 2 2p 6 | |
| 3-ий | 3s 2 3p 6 3d 10 | |
| 4-ый | 4s 2 4p 6 4d 10 4f 14 |
В зависимости от того, на какой орбитали находится последний электрон, различают s, p-, d-элементы.Элементы главных подгрупп относятся к s, p-элементам. В побочных подгруппах находятсяd-элементы
Чтобы понять, как нарисовать атом, следует определить, каков его внешний вид. Электроны, то есть мелкие шары, которые были нарисованы в предыдущем пункте, движутся вокруг протонов, то есть более крупных кругов. Поэтому у них есть своя траектория или путь. Он изображается в виде эллипсов, которые проходят через электроны. Эллипсы — это маршрут мелких частиц.
Эти вытянутые овалы располагают через основной круг, перекрещивая между собой. В среднем могут получиться около трех таких кругов. Если нарисовать окружности так, чтобы они пересекали электроны, сложно, то можно сначала нарисовать эти пути, а уже на них расположить электроны.
Теперь можно подтереть все карандашные наброски, выделить четкой линией то, что должно остаться, а сам атом раскрасить.

В общем смысле рисунок атома – это сборище маленьких кругов, кружащих вокруг центра из более крупных шаров. Это и есть наш атом, и теперь все знают, как нарисовать его. Раскрасить его можно так, как душе угодно!
Видео
Инструменты для работы
- расческа, имеющая редкие зубцы и заостренный конец;
- бигуди с фиксатором или коклюшки нужного диаметра, около 50-80 штук;
- неметаллические емкости;
- поролоновые губки;
- зажимы из пластика;
- мерный стакан;
- перчатки, а также повязка для головы;
- целлофановый колпак;
- два полотенца.
Принцип действия
Прежде чем приступать к созданию эффекта Бифельда-Брауна своими руками, важно понять, почему возникает данное явление.

В сильных электрических полях появляется коронный разряд. Это приводит к тому, что рядом с острыми гранями возникает ионизация атомов воздуха. На практике чаще всего используют 2 электрода. Первый имеет тонкую и острую грань, вокруг которой напряжение электрического поля достигает максимальных значений. Этого достаточно, чтобы началась ионизация воздуха. Второй электрод, напротив, обладает широкими и плавными гранями. Чтобы эффект сработал, напряжение между электродами должно составлять несколько десятков киловольт (или даже мегавольт). Эффект исчезнет, если между электродами произойдет пробой. Схема эффекта Бифельда-Брауна представлена на картинках.
Рядом с острым электродом происходит ионизация воздуха. Образующиеся ионы начинают двигаться к широкому электроду. В результате движения они сталкиваются с молекулами воздуха, что приводит к передаче энергии от ионов к молекулам. Последние либо начинают быстрее двигаться, либо сами превращаются в ионы. Это приводит к тому, что от острого электрода к широкому возникает поток воздуха. Силы этого потока достаточно, чтобы поднять в воздух небольшую модель. Данное устройство обычно называют ионолетом или лифтером.

Проведенные эксперименты показывают, что эффект Бифельда-Брауна в вакууме не работает. Наличие газовой среды является обязательным условием для создания явления.

Все в мире состоит из атомов. Но откуда они взялись, и из чего состоят сами? Сегодня отвечаем на эти простые и фундаментальные вопросы. Ведь многие люди, живущие на планете, говорят, что не понимают строения атомов, из которых сами и состоят.
Атом – это частица вещества микроскопических размеров и массы, наименьшая часть химического элемента, которая является носителем его свойств. Иными словами, это мельчайшая частица того или иного вещества, которая может вступать в химические реакции.
История открытия и строение
Понятия атома было известно еще в Древней Греции. Атомизм – физическая теория, которая гласит, что все материальные предметы состоят из неделимых частиц. Наряду с Древней Грецией, идеи атомизма параллельно развивался еще и в Древней Индии.
Не известно, рассказали тогдашним философам об атомах инопланетяне, или они додумались сами, но экспериментально подтвердить данную теорию химики смогли много позже – только в семнадцатом веке, когда Европа выплыла из пучины инквизиции и средневековья.
Долгое время господствующим представлением о строении атома было представление о нем как о неделимой частице. То, что атом все-таки можно разделить, выяснилось только в начале двадцатого века. Резерфорд, благодаря своему знаменитому опыту с отклонением альфа-частиц, узнал, что атом состоит из ядра, вокруг которого вращаются электроны. Была принята планетарная модель атома, в соответствии с которой электроны вращаются вокруг ядра, как планеты нашей Солнечной системы вокруг звезды.
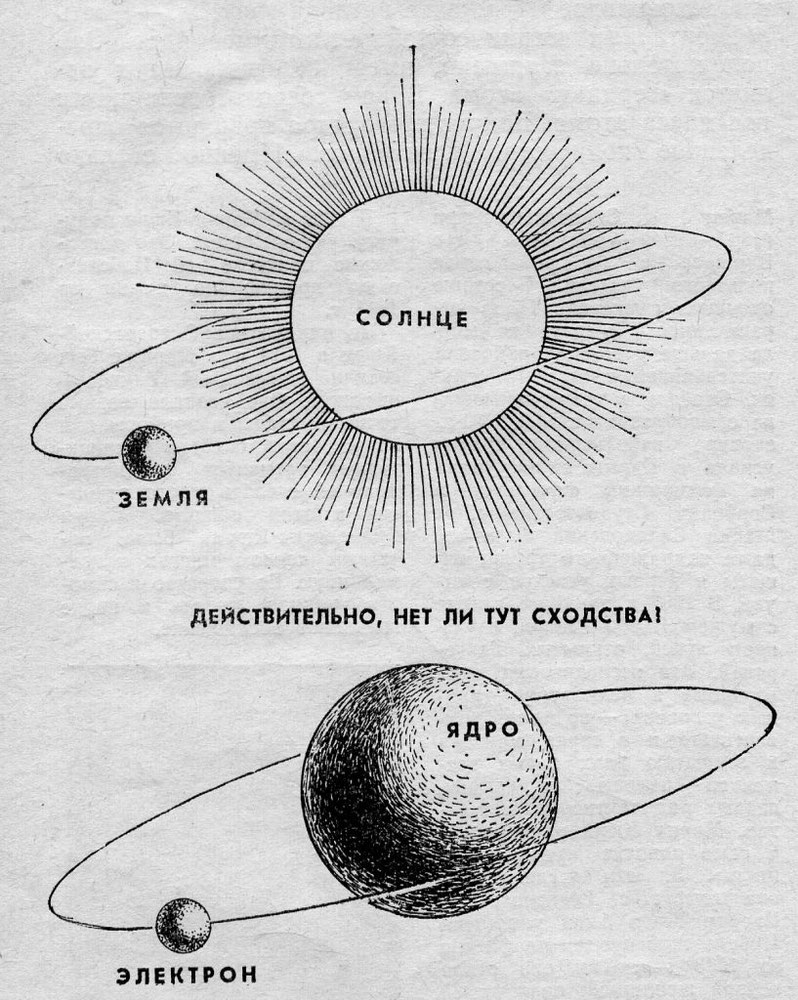
Современные представления о строении атома продвинулись далеко. Ядро атома, в свою очередь, состоит субатомных частиц, или нуклонов – протонов и нейтронов. Именно нуклоны составляют основную массу атома. При этом протоны и нейтроны также не являются неделимыми частицами, и состоят из фундаментальных частиц - кварков.
Ядро атома имеет положительный электрический заряд, а электроны, вращающиеся по орбите – отрицательный. Таким образом, атом электрически нейтрален.
Ниже приведем элементарную схему строения атома углерода.

Схема строения атома
Свойства атомов
Масса
Массу атомов принято измерять в атомных единицах массы – а.е.м. Атомная единица массы представляет собой массу 1/12 части свободно покоящегося атома углерода, находящегося в основном состоянии.
В химии для измерения массы атомов используется понятие "моль". 1 моль – это такое количество вещества, в котором содержится число атомов, равное числу Авогадро.
Размер
Размеры атомов чрезвычайно малы. Так, самый маленький атом – это атом Гелия, его радиус – 32 пикометра. Самый большой атом – атом цезия, имеющий радиус 225 пикометров. Приставка пико означает десять в минус двенадцатой степени! То есть , если 32 метра уменьшить в тысячу миллиардов раз, мы получим размер радиус атома гелия.
При этом, масштабы вещей таковы, что, по сути, атом на 99% состоит из пустоты. Ядро и электроны занимают крайне малую часть его объема. Для наглядности, рассмотрим такой пример. Если представить атом в виде олимпийского стадиона в Пекине (а можно и не в Пекине, просто представьте себе большой стадион), то ядро этого атома будет представлять собой вишенку, находящуюся в центре поля. Орбиты электронов при этом находились бы где-то на уровне верхних трибун, а вишня весила бы 30 миллионов тонн. Впечатляет, не так ли?

Если предсавить атом в виде стадиона, ядро будет размером с вишню в центре поля
Откуда взялись атомы?
Как известно, сейчас различные атомы сгруппированы в таблицу Менделеева. В ней насчитывается 118 (а если с предсказанными, но еще не открытыми элементами - 126) элементов, не считая изотопов. Но так было далеко не всегда.


Так что, можно сказать, что все атомы, из которых мы состоим, когда-то были частью древних звезд.
Почему ядро атома не распадается?
В физике существует четыре типа фундаментальных взаимодействий между частицами и телами, которые они составляют. Это сильное, слабое, электромагнитное и гравитационное взаимодействия.
Не так давно люди поняли, что при расщеплении ядер атомов высвобождается огромная энергия. Деление тяжелых атомных ядер является источником энергии в ядерных реакторах и ядерном оружии.

Итак, друзья, познакомив Вас со структурой и основами строения атома, нам остается только напомнить о том, что наши авторы готовы в любой момент прийти Вам на помощь. Не важно, нужно Вам выполнить диплом по ядерной физике, или самую маленькую контрольную – ситуации бывают разные, но выход есть из любого положения. Подумайте о масштабах Вселенной, закажите работу в Zaochnik и помните – нет поводов для беспокойства.
Из кожуры апельсина получаются отличные розочки которые можно использовать для декора и натурального ароматизатора для дома.
Готовые розы, а также сушеные дольки апельсина, лимона можно сложить вот в такую вазочку (нашлась в кладовке у бабушки — чуть не выбросили)))
Для того чтобы аромат был ярче, берем эфирное масло лимона — и капаем несколько капель на розочки в вазе. И красота — запах держится около 3 недель, когда выветрится — повторяем процедуру.
Для того чтобы сделать розы из апельсина своими руками необходимо:
Видео
Модель по химии своими руками
Многие школьники не любят химию и считают ее скучным предметом. Многим этот предмет дается с трудом. Но ее изучение может быть интересным и познавательным, если подойти к процессу творчески и показать все наглядно.
Предлагаем вам подробное руководство по лепке молекул из пластилина.
Перед изготовлением молекул нам нужно заранее определиться с тем, какие химические формулы будем использовать. В нашем случае это этан, этилен, метилен. Нам понадобятся: пластилин контрастных цветов (в нашем случае – красный и синий) и немного зеленого пластилина, спички (зубочистки).
1. Из красного пластилина скатываем 4 шарика диаметром около 2 см (атомы углерода). Затем из синего пластилина скатываем 8 шариков поменьше, диаметром около сантиметра (атомы водорода).
2. Берем 1 красный шарик и вставляем в него 4 спички (или зубочистки)так, как показано на рисунке.
3. Берем 4 синих шарика и надеваем их на свободные концы вставленных в красный шарик спичек. Получилась молекула природного газа.
4. Повторяем шаг №3 и получаем две молекулы для следующего химического вещества.
5. Сделанные молекулы нужно соединить между собой спичкой для того, чтобы получилась молекула этана.
6. Также можно создать молекулу с двойной связью – этилен. Для этого, из каждой молекулы, полученной при выполнении шага № 3 вынимаем по 1 спичке с надетым на нее синим шариком и соединяем детали между собой двумя спичками.
7. Берем красный шарик и 2 синих и соединяем их между собой двумя спичками так, чтобы получилась цепочка: синий – 2 спички – красный – 2 спички – синий. У нас получилась еще одна молекула с двойной связью – метилен.
8. Берем оставшиеся шарики: красный и 2 синих и соединяем их спичками между собой как показано на рисунке. Затем скатываем из зеленого пластилина 2 маленьких шарика и прикрепляем к нашей молекуле. У нас получилась молекула с двумя отрицательно заряженными электронами.
Инструменты для работы
- расческа, имеющая редкие зубцы и заостренный конец;
- бигуди с фиксатором или коклюшки нужного диаметра, около 50-80 штук;
- неметаллические емкости;
- поролоновые губки;
- зажимы из пластика;
- мерный стакан;
- перчатки, а также повязка для головы;
- целлофановый колпак;
- два полотенца.
Соберите модель атома
Ядро или ядро каждого атома состоит из протонов и нейтронов. Сделайте ядро, прикрепив протоны и нейтроны друг к другу. Например, для ядра гелия вы должны склеить 2 протона и 2 нейтрона . Сила, удерживающая частицы вместе, невидима. Вы можете склеить их с помощью клея или другого удобного средства.
- Невидимая нейлоновая леска
- Строка
- Зубочистки
- Соломинки для питья
Принцип действия
Прежде чем приступать к созданию эффекта Бифельда-Брауна своими руками, важно понять, почему возникает данное явление.

В сильных электрических полях появляется коронный разряд. Это приводит к тому, что рядом с острыми гранями возникает ионизация атомов воздуха. На практике чаще всего используют 2 электрода. Первый имеет тонкую и острую грань, вокруг которой напряжение электрического поля достигает максимальных значений. Этого достаточно, чтобы началась ионизация воздуха. Второй электрод, напротив, обладает широкими и плавными гранями. Чтобы эффект сработал, напряжение между электродами должно составлять несколько десятков киловольт (или даже мегавольт). Эффект исчезнет, если между электродами произойдет пробой. Схема эффекта Бифельда-Брауна представлена на картинках.
Рядом с острым электродом происходит ионизация воздуха. Образующиеся ионы начинают двигаться к широкому электроду. В результате движения они сталкиваются с молекулами воздуха, что приводит к передаче энергии от ионов к молекулам. Последние либо начинают быстрее двигаться, либо сами превращаются в ионы. Это приводит к тому, что от острого электрода к широкому возникает поток воздуха. Силы этого потока достаточно, чтобы поднять в воздух небольшую модель. Данное устройство обычно называют ионолетом или лифтером.

Проведенные эксперименты показывают, что эффект Бифельда-Брауна в вакууме не работает. Наличие газовой среды является обязательным условием для создания явления.
Читайте также:

