Как сделать модель атома водорода
Обновлено: 08.07.2024
В 1913 году датский физик Нильс Бор (1885—1962) попытался нарисовать наглядную картину: как может быть построен атом из положительного ядра и электронов и при каких условиях он излучает свет. Физики называют такую наглядную картину моделью атома.
Задача была сложная. Модель должна была учесть новый, необычный характер внутриатомных законов, о которых нам говорят опыты с атомами. Модель должна была объяснить: 1) почему атомы устойчивы, несмотря на то, что и в невозбужденном атоме электроды движутся, 2) закон разности частот, излучаемых атомами, 3) закон поглощения и излучения энергии только квантами (порциями).

Рис. 35. Модель атома водорода. Стрелками показаны возможные переходы электрона при излучении
Однако есть разница в состоянии электрона, когда он находится на орбите № 1 и когда он движется на более удаленных орбитах. В первом случае состояние электрона очень устойчивое. Он может как угодно долго двигаться по орбите № 1, с ним ничего не произойдет. На более удаленных орбитах состояние электрона неустойчиво: он продержится на них в среднем около одной стомиллионной доли секунды, а затем перескочит на одну из орбит, более близких к ядру, и в конце концов на орбиту № 1.
Бор утверждает: атом испускает свет только во время перескоков электронов с орбит более удаленных на орбиты более близкие к ядру. Подсчитав энергии электрона на возможных для него орбитах, физики нашли, что при перескоке 2—1 (так мы будем обозначать перескок электрона с орбиты № 2 на орбиту № 1) атом водорода должен испускать излучение с частотой 24,7·10 14 циклов, при перескоке 3—1 — с частотой 29,2·10 14 циклов, при перескоке 4—1 — с частотой 30,9·10 14 циклов, при перескоке 3—2 — с частотой 4,6·10 14 циклов, при перескоке 4—2 — с частотой 6,2·10 14 циклов, а при перескоке 4—3 — с частотой 1,6·10 14 циклов. Таким образом, оказалось, что частота света, излучаемого парами раскаленного водорода, определяется тем, с какой орбиты на какую перескакивают электроны в его атомах.
Перескоками электродов можно объяснить и тот факт, что разности между отдельными частотами тоже являются частотами излучения атомов. Когда электрон обращается, скажем, по четвертой орбите, атом имеет один запас энергии. При перескоке электрона на вторую орбиту атом теряет часть энергии на излучение. Обозначим ее так: Э4,2. Но ту же энергию атом может потерять за два приема: при перескоках электрона с четвертой орбиты на третью и с третьей на вторую. Если обозначить энергии, потерянные при отдельных перескоках, через Э4,3 и Э3,2, то сказанное можно записать: Э4,2 = Э4,3 + Э3,2. Отсюда следует, что энергия, потерянная при перескоке 4—2, минус энергия, потерянная при перескоке 4—3, равна энергии, потерянной три перескоке 3—2. Но мы уже знаем, что энергия излучения тем больше, чем больше частоты излучения. Следовательно, если существует закон разности энергий излучений, то существует и закон разности частот излучений. Это мы и видим на примере частот, указанных в предыдущем абзаце. В самом деле: 6,2·10 14 — 1,6·10 14 = 4,6· 10 14 .
Следует заметить, что при каждом отдельном перескоке электрона атом испускает излучение только одной частоты. Если же в спектре водорода мы наблюдаем излучения не одной, а нескольких частот, то это потому, что мы всегда наблюдаем результат действия не одного, а множества атомов. В одних атомах электроны перескакивают со второй орбиты на первую, в других — с третьей на вторую, с третьей на первую и т. д.
Такое же объяснение можно дать и частотам спектров других элементов.
Такова была модель атома, нарисованная Бором. Она была только первым шагом в изучении строения атома, так как не объясняла, почему электроны ведут себя в атоме так странно, в противоречии с установленными ранее законами. Она только указывала (да и то лишь в простейших случаях), как они себя ведут, в силу каких-то новых, еще не открытых законов, верных для мира малых величин. Эти законы были открыты не сразу. Они нашли освещение в новой науке — квантовой механике.
Модель Бора отображает го, что происходит в простых атомах, лишь в грубом приближении. А для сложных атомов она вовсе непригодна. Но в случаях, когда большая точность не требуется, физики пользуются этой моделью ввиду ее простоты.
В этой модели сохранятся не геометрические образы (орбиты электронов), а главные физические черты, подтвержденные экспериментом; а именно: возбужденные атомы находятся в различных энергетических состояниях, вполне определенных для атомов данного элемента; это энергетическое состояние атом может изменять только скачком, переходя при этом на более низкий энергетический уровень и испуская квант света (фотон) определенной частоты (и, следовательно, определенной энергии), в зависимости от того, какой из возможных переходов он при данных условиях совершает.
МОДЕЛЬ: АНСАМБЛЬ ПУЗЫРЬКОВ
МОДЕЛЬ: АНСАМБЛЬ ПУЗЫРЬКОВ Поговорим в начале главы об одной мудрой и красивой модели кристалла. По пути к концу книги она нам понадобится много раз.О модели мертвого кристалла или, быть может, правильнее о мертвой модели кристалла мы недавно вспоминали: деревянные
МОДЕЛЬ: РЕЗИНОВАЯ ТРУБКА
МОДЕЛЬ: РЕЗИНОВАЯ ТРУБКА В истории науки подобных примеров множество: появляется новая идея, или обнаруживается новое явление природы, и при этом вдруг оказывается, что ранее, в связи с совсем иными задачами и ввиду совсем иных целей, ученые высказали соображения или
МОДЕЛЬ: ЛУННАЯ ДОРОЖКА
МОДЕЛЬ: ЛУННАЯ ДОРОЖКА В этом очерке лунная дорожка — та, которую все видели на поверхности воды, — лишь удобная модель. А рассказывать я намерен о строении поверхности кристалла, о том, как она рассеивает свет, как на ней образуется световая дорожка, подобная той, какую мы
Стандартная модель
Стандартная модель Сегодня поле Янга-Миллса открыло возможность всеобъемлющей теории материи. Мы настолько уверены в этой теории, что ласково называем ее Стандартной моделью.Стандартная модель способна объяснить все экспериментальные данные, касающиеся субатомных
Глава 3. Строение атома
Глава 3. Строение атома Радиоактивность Блестящая серия физических открытий в последнее десятилетие XIX века поистине явилась началом научной революции. Прологом к ней послужило открытие, сделанное в 1896 году французским физиком Антуаном Анри Беккерелем, который
8. Факторы, влияющие на перенапряжение водорода. Перенапряжение кислорода
8. Факторы, влияющие на перенапряжение водорода. Перенапряжение кислорода Факторы, влияющие на ?Н2:1) ?тока (плотность тока). Зависимость от плотности тока описывается уравнением Тафеля;2) природа материала катода – ряд по возрастанию ?, ?– перенапряжение.В уравнении Тафеля
Какова структура атома
Какова структура атома Модель атома водорода В 1913 году датский физик Нильс Бор (1885—1962) попытался нарисовать наглядную картину: как может быть построен атом из положительного ядра и электронов и при каких условиях он излучает свет. Физики называют такую наглядную
II. Строение атома
II. Строение атома Каждое химическое вещество состоит из однородных частиц, называемых молекулами. Если разложить молекулу на более элементарные составные части, мы получим атомы.Атом принято схематически изображать в виде ядра с вращающимися вокруг него электронами.
4.9. Корпускулярная модель света
4.9. Корпускулярная модель света В описанных выше экспериментах и наблюдениях доказано, что движение объекта природы, называемого светом, как и всех остальных объектов природы, подчиняется классическому закону сложения скоростей. Изучены и другие его свойства, по которым
Модель горячей Вселенной
Стандартная модель
Стандартная модель К середине 1970-х все теоретические и опытные наработки СЛИЛИСЬ в единую теорию, названную стандартной моделью. В ее основе лежат математические выкладки, не являющиеся предметом настоящей книги, так что не следует забывать, что модель опирается на
РАДИОАКТИВНОСТЬ И СТРОЕНИЕ АТОМА
РАДИОАКТИВНОСТЬ И СТРОЕНИЕ АТОМА 1.6. Явления радиоактивности, открытые А. Беккерелем в 1896 г. и вслед затем изучавшиеся Пьером и Марией Кюри, Э. Резерфордом и многими другими, сыграли ведущую роль в открытии общих законов строения атома и в подтверждении эквивалентности
Глава 8. Внутри атома
Глава 8. Внутри атома Университетских студентов 1900 года учили тому, что обычное вещество — то, из которого состоят кирпичи, сталь, уран и все прочее, — и само состоит из мельчайших частиц, именуемых атомами. Однако, из чего состоят атомы, этого не знал никто. Общее мнение
Первая модель атома
Первая модель атома В заключение, мы можем сказать, что в первые годы XX в. был дан первый, может быть не полный, ответ на вопрос как излучается свет, а атомы с их электрическими зарядами были сочтены ответственными за это. Однако, как устроены атомы и, соответственно, каковы
Глава 4 Стандартная модель
Глава 4 Стандартная модель Почему Большой адронный коллайдер не уничтожил Землю?[56] 21 марта 2008 года Уолтер Вагнер и Луис Санчо начали процесс в Федеральном суде США с единственной простой целью – спасти человечество. Истцы утверждали, что в ближайшие несколько месяцев
Водород – первый элемент Периодической таблицы. Обозначение – H. Расположен в первом периоде, I группе, А подгруппе.
Относится к неметаллам. Заряд ядра равен 1. Атомный вес может варьироваться: 1, 2, 3, что связано с наличием изотопов дейтерия и трития.
Электронное строение атома водорода
В атоме водорода имеется положительно заряженное ядро (+1), 1 протон и один электрон. Поскольку водород имеет самое простейшее строение атома из всех элементов Периодической системы, он хорошо изучен. В 1913 году Нильс Бор предложил схему строения атома водорода, согласно которой положительно заряженное ядро находится в центре, а вокруг него по единственной орбитали движется электрон (рис. 1). В соответствии с этой схемой он вывел спектр излучения этого химического элемента. Который был позже доказан с помощью квантово-механических расчетов уравнения Шредингера (1925-1930 годы).
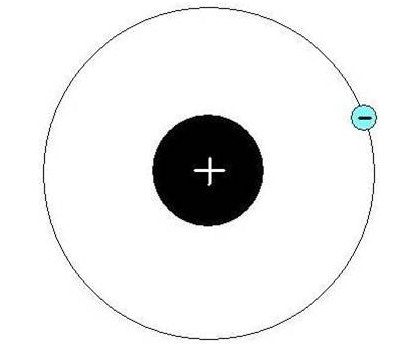
Рис. 1. Схема строения атома водорода.
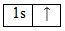
Электронная конфигурация атома водорода будет выглядеть следующим образом:
Водород относится к семейству s-элементов. Энергетическая диаграмма атома водорода имеет вид:
Единственный электрон, который имеется у водорода является валентным, т.к. участвует в образовании химических связей. В результате взаимодействия водород может как терять электрон, т.е. являться его донором, так и принимать, т.е. быть акцептором. В этих случаях атом превращается либо в положительно, либо отрицательно заряженный ион (H + /Н — ):
Атомы каждого химического элемента имеют строго индивидуальный линейчатый спектр, присущий только данному элементу и не меняющийся от опыта к опыту. Как это можно объяснить? Как вывести формулу, дающую весь набор частот атомного спектра? Чтобы сделать это, нужно узнать, как устроен атом.
Модель Томсона
Согласно Томсону атом представляет собой шар размером порядка см. По этому шару некоторым образом распределён положительный заряд, а внутри шара, подобно изюминкам, находятся электроны (рис. 1 ).

Рис. 1. Модель атома Томсона
Суммарный заряд электронов в точности равен положительному заряду шара, поэтому атом в целом электрически нейтрален.
Излучение атомов объясняется колебаниями электронов около положений равновесия (как вы помните, любой ускоренно движущийся заряд излучает электромагнитные волны). Однако вся совокупность экспериментальных данных по атомным спектрам не укладывалась в модель Томсона. Например, для некоторых химических элементов были подобраны формулы, хорошо описывающие их спектры, но эти формулы из модели Томсона никак не следовали.
Опыты Резерфорда
Резерфорд говорил об -частицах как об ионах гелия; сейчас мы знаем, что это ядра гелия.
Но в те времена об атомных ядрах ещё ничего не знали — о них Резерфорду лишь предстояло догадаться, глядя на результаты своих знаменитых опытов!
Каково же было всеобщее удивление, когда такие частицы обнаружились! Да, как и следовало ожидать, подавляющая доля -частиц отклонялась несущественно. Но совсем небольшая их часть (примерно одна частица из нескольких тысяч) отклонялась на угол, больший (рис. 2 ).

Рис. 2. Рассеяние -частиц на атомах
Эти отклонения казались совершенно невероятными. По словам Резерфорда, дело выглядело так, словно артиллерийский снаряд налетел на кусок бумаги и от удара повернул назад.
Расчёты, однако, показывают, что такое поле оказывается слишком слабым — его тормозящего действия никак не хватит для того, чтобы остановить -частицу и отбросить её назад!
Таким образом, наличие -частиц, отброшенных фольгой, опровергло модель Томсона. Что же было предложено взамен?
Планетарная модель атома
Чтобы отбросить -частицу, положительный заряд атома должен создавать куда более сильное электрическое поле, чем то, которое получается в модели Томсона. А чтобы создать такое поле, положительный заряд должен быть сосредоточен в области, гораздо меньшей размера атома.
Размер этой области можно вычислить. Если положительный заряд занимает область размером , то вблизи заряда создаётся электрическое поле с потенциалом
Зная кинетическую энергию -частицы, можно найти величину тормозящего потенциала , а затем и размер положительно заряженной области. Вычисления, проведённые Резерфордом, дали следующий результат:
Эта величина на пять порядков (в сто тысяч раз!) меньше размера атома. Так на смену модели Томсона пришла планетарная модель атома (рис. 3 ).

Рис. 3. Планетарная модель атома
В центре атома находится крошечное положительно заряженное ядро, вокруг которого, словно планеты вокруг Солнца, движутся электроны. Между ядром и электронами действуют силы кулоновского притяжения, но упасть на ядро электроны не могут за счёт своего движения — точно так же, как и планеты не падают на Солнце, хоть и притягиваются к нему.
Заряд ядра по модулю равен суммарному заряду электронов, так что атом в целом электрически нейтрален. Однако электроны могут быть выбиты из своих орбит и покинуть атом — тогда атом превращается в положительно заряженный ион.
Масса электронов составляет очень малую часть общей массы атома. Например, в атоме водорода всего один электрон, и его масса в раз меньше массы ядра. Следовательно, почти вся масса атома сосредоточена в ядре — и это при том, что ядро в сто тысяч раз меньше самого атома.
Чтобы лучше почувствовать соотношение масштабов атома и ядра, представьте себе, что атом стал размером с Останкинскую телебашню ( м). Тогда ядро окажется горошиной размером мм, лежащей у вас на ладони. И тем не менее, почти вся масса атома заключена в этой горошине!
Вот таким удивительным объектом оказался атом. Однако планетарная модель атома, объяснив результаты опытов Резерфорда по рассеянию -частиц, оказалась лишь первым шагом на пути к пониманию внутриатомных процессов. А именно, планетарная модель приводила к одному серьёзному противоречию, и преодоление этого противоречия Нильсом Бором положило начало физике атома. Читаем следующий листок!



Рис. 4. Схема молекулы водорода Н2 :
а) и b) - ортоводород; c) - параводород
На рис. 4 а) и b) направления векторов магнитных моментов Ме обоих электронов совпадают, а значит, совпадают и направления векторов их кинетических моментов h . Данную структуру назовем ортоводородом. На рис. 4 c) указанные векторы противоположны, поэтому такую структуру назовем параводородом.
Пришла пора изучить молекулу кислорода. Кислород - довольно сложное образование. Он имеет восемь электронов, и показать их все на плоской схеме сложно. Модель имеет пространственную форму. Главная особенность этой формы заключается в том, что атом кислорода имеет один явно выделенный из всей структуры электрон. Это восьмой электрон. Он играет ведущую роль во взаимодействиях этого атома с атомами или ионами других химических элементов. Короче говоря, это связующее звено - главный валентный электрон. Если другой атом кислорода является положительным ионом, то есть таким, у которого отсутствует восьмой электрон, то восьмой электрон первого атома может соединиться с протоном этого ядра. Так образуется молекула из двух атомов кислорода (рис. 5).

Рис. 5. Схема молекулы кислорода
Конечно, это плоский рисунок. В действительности модель любого атома или молекулы имеет пространственную структуру. Если Вы просматривали учебник по химии, то там представлены аналогичные модели молекул. Химики давно интуитивно почувствовали, что валентные электроны связывают ядра разных атомов и показывают эту связь в виде коротких линий между химическими символами. Теперь эти линии представляют собой оси валентных электронов. Причем они могут соединяться посредством разноименных магнитных полюсов, как с валентными электронами соседних атомов, так и с протонами в их ядрах. Таким образом, валентные электроны – это связующие элементы, которые являются общими для соседних атомов в молекуле вещества.
Мэйер в своих трудах в качестве объяснений использует орбитальную (плоскую) модель молекулы воды.

В связи с тем, что это представление не совсем правильно, а кроме того, молекулы водорода имеют три модификации, то и молекулы воды, включающие в себя водород, имеют не одну объёмную схему расположения протонов и электронов. Рассмотрим их.
Прежде всего, вспомним, как обычно представляют магнитный диполь молекулы воды.


Рис. 6. Схема первой (заряженной) модели молекулы воды:
1,2,3,4,5,6,7,8 - номера электронов атома кислорода;
N -ядро атома кислорода;
P - ядра атомов водорода (протоны);
e1 и e2 - номера электронов водорода;
e7 и e8 - поверхностные электроны атома кислорода
Предположим, что восьмой и седьмой электроны атома кислорода отсутствуют в молекуле воды и их места занимают электроны атомов водорода. Существуют возможности формирования молекулы воды не с десятью, а с восемью электронами (рис. 7). Такую модель назовем второй.

Рис. 7. Схема второй (разряженной) модели молекулы воды
Главные различия между первой и второй моделями молекулы воды заключаются в том, что в ячейках восьмого и седьмого электронов атома кислорода первой модели молекулы воды находятся по два спаренных электрона, а во второй модели эти электроны не спаренные.
Исходя из первых двух моделей молекулы воды, мы можем получить и две другие модели. Когда спаренные электроны занимают только восьмую ячейку атома кислорода, такую модель назовем третьей (рис. 8).

Рис. 8. Схема третьей модели молекулы воды
Возможны и такие условия, при которых спаренные электроны занимают только седьмую ячейку атома кислорода, а в восьмой ячейке оказывается только один электрон с протоном. Такую модель назовем четвертой (рис. 9).

Рис. 9. Схема четвертой модели молекулы воды
Если гипотеза о разном количестве электронов в молекулах воды подтвердится, то этот факт окажется решающим при получении избыточной энергии при электролизе воды. Он определит причину положительных и отрицательных результатов многочисленных экспериментов, которые ставились для проверки факта существования дополнительной энергии при электролизе воды. Если вода содержит больше заряженных молекул, то эксперимент даст положительный результат. При большем количестве разряженных молекул результат будет отрицательный. Примерные расчеты показывают наличие разницы в массе одного литра заряженной и разряженной воды. Её можно зафиксировать современными измерительными приборами. Известно, что вода может обладать щелочными или кислотными свойствами. Щелочные свойства формируются за счет увеличенного содержания в воде гидроксила ОН – (рис. 10). Другими словами восьмой, или седьмой электрон кислорода не имеет связей с другими молекулами.

Рис. 10. Схема модели гидроксила ОН –
Кислотные свойства воды формируются, как принято сейчас считать, свободными протонами Н + , но мы с этой идеей не соглашаемся потому, что протон - слишком активное образование и поэтому не может существовать в воде в свободном состоянии. Во всех моделях молекулы воды (рис. 6-9) шестой электрон атома кислорода остается свободным, формируя зону отрицательного потенциала на ее поверхности. Большая часть его электрических и магнитных силовых линий включена в связь с ядром атома кислорода, поэтому он менее активен, чем восьмой и седьмой электроны. Чтобы этот электрон вступил в связь с протоном или электроном соседнего атома, ему необходимо подняться в своей ячейке и удалиться от ядра атома. Для реализации такого процесса ему необходимо поглотить фотон из окружающей среды. Если это произойдет, то он удалится от ядра, приблизится к поверхности атома и лишь тогда появятся условия для соединения силовых линий его электрического поля с силовыми линиями электрического поля протона или электрона. Если шестой электрон атома кислорода соединится с протоном, то образуется ион гидроксония Н3О + , который и сформирует кислотные свойства воды.
При таком развитии событий на поверхности молекулы воды появятся три зоны с положительным потенциалом, и она станет положительно заряженным ионом , который называют гидроксонием (рис. 11). Поскольку мы уже показали, что в электролитическом растворе отсутствуют протоны в свободном состоянии, то из этого следует, что кислотные свойства раствора определяет не протон (положительный ион Н + ), а положительный ион гидроксония Н3О + .

Рис. 11 Схема иона гидроксония Н3О +
Активность электрона зависит от расстояния, на котором он расположен от ядра своего атома. Чем больше энергия ионизации, тем электрон ближе расположен к ядру и дальше от поверхности атома. Поэтому есть основания полагать, что пятый электрон атома кислорода не участвует в химических процессах.
На схемах молекулы воды (рис. 6-9), гидроксила (рис. 10) и гидроксония (рис. 11) указаны энергии связи между протонами и электронами, взятые из результатов расчетов спектров атомов и ионов. Энергии связей электронов с ядрами атомов, определенные не путем химических расчетов, а из результатов спектроскопии атомов и ионов, ближе к данным, получаемым при электролизе воды.
При поглощении фотонов энергия связи электрона с ядром уменьшается и он, продолжая вращаться и прецессировать на ядре, удаляется от него, приближаясь к поверхности атома.
Из рис. 6-11 видно, что если молекула воды Н2О, или ион гидроксония Н3О + окажутся в потенциальном электрическом поле, то их поверхностные протоны начнут взаимодействовать с катодом. Поверхностные протоны атомов водорода, соединенных с восьмыми электронами атомов кислорода (рис. 12), в результате контакта с катодом получат от него электроны ек. Затем две молекулы объединяются, и в зоне их соединения формируется молекулярный водород. Самой слабой связью в образовавшейся цепочке является связь между протонами атомов водорода в молекуле воды и их электронами. Эти связи обрываются, и молекула водорода появляется в свободном состоянии (рис. 12, с).

Рис. 12. Схема образования молекулы ортоводорода (см. рис. 4, а)

Рис. 13. Схема образования второй молекулы ортоводорода
( см. рис. 4, b); а) и b) схемы молекул воды; с) ортоводород

Рис. 14. Схема образования молекулы пароводорода (см. рис. 4, c):
а) и b) молекулы воды; с) молекула пароводорода
Вывод
С теорией профессора Канарёва о строении молекул воды, кислорода и водорода мы ознакомились. В следующей статье мы также вкратце, без "нагрузки на мозг" ознакомимся с реакторами профессора Канарёва производящими Газ Брауна посредством низкоамперного электролиза.
Читайте также:

