Как сделать коллагеновую таблетку
Обновлено: 05.07.2024
Причины, замедляющие синтез коллагена:
- свободные радикалы, которые вызывают окислительный стресс, что приводит к повреждению клеток кожи;
- погодные условия (холод, солнце, ветер, уровень влажности). Лучи солнца проникают глубоко в слои кожи, разрушая коллаген;
- вредные привычки (курение, употребление алкоголя, кофеин). Многие клинические исследования доказали, что вредные привычки ослабляют барьерные функции кожи и ускоряют процесс формирования морщин.
Как улучшить синтез коллагена? Инъекции коллагена – инновационное омоложение естественным путем – поможет вам на пути к поддержанию молодости и красоты. Коллагенотерапия кожи представляет собой курс процедур, целью которого является последовательная стимуляция фибробластов с целью получения долговременного эстетического эффекта.
Чем по-настоящему уникальная эта процедура, так это широтой области применения. Восстановление синтеза коллагена требуется женщинам и мужчинам разного возраста и в разных ситуациях. Это делает инъекции коллагена очень популярной услугой в области современной косметологии.
Показания к коллагеновому омоложению:
- профилактика хроно- и фотостарения кожи
- восстановление дермы и гиподермы, стимуляция фибробластов и механизмов синтеза коллагена для улучшения микроциркуляции крови и устранения морщин
- восстановление коллагенового каркаса возрастной кожи
- подготовка к пластическим операциям, пилингам, лазерным шлифовкам и восстановление после этих процедур
- устранение рубцов и растяжек
Инъекции коллагена – противопоказания:
- беременность и грудное вскармливание
- аутоиммунные заболевания
- диабет
- келоидные рубцы
Как проходит процедура реструктуризации кожи?
Коллаген I типа вводится в глубокий слой дермы, что стимулирует фибробласты вырабатывать новые, эластичные волокна коллагена III типа. Во время процедуры стимулятор коллагена вводится в область:
Инъекции равномерно распределяются в трех областях, что обеспечивает комплексный эффект. Также коллаген может использоваться в области кистей рук, а также на других участках тела, требующих коррекции.
Преимущества коллагенового омоложения Nithya:
- исключительный уровень чистоты и безопасности коллагена
- видимый эффект уже на 16 день после первой процедуры
- длительный результат
- отсутствие периода реабилитации – у инъекций практически не наблюдается побочных действий
Подготовка к процедуре
Как подготовиться процедуре коллагенового омоложения? Специальной подготовки не требуется, но нужна очная консультация врача-косметолога.
Результат процедуры
После курса процедур наблюдается значительное улучшение состояния кожи и видимый эффект омоложения. Инъекции коллагена позволяют добиться:
- улучшения качества кожи
- повышения ее тонуса
- уменьшения количества морщин вокруг глаз и губ, на шее, руках и в области декольте
- восстановления контуров лица
- компенсации утраченного объема тканей
Первые изменения на коже видны через 16 дней после процедуры!
Фото до и после
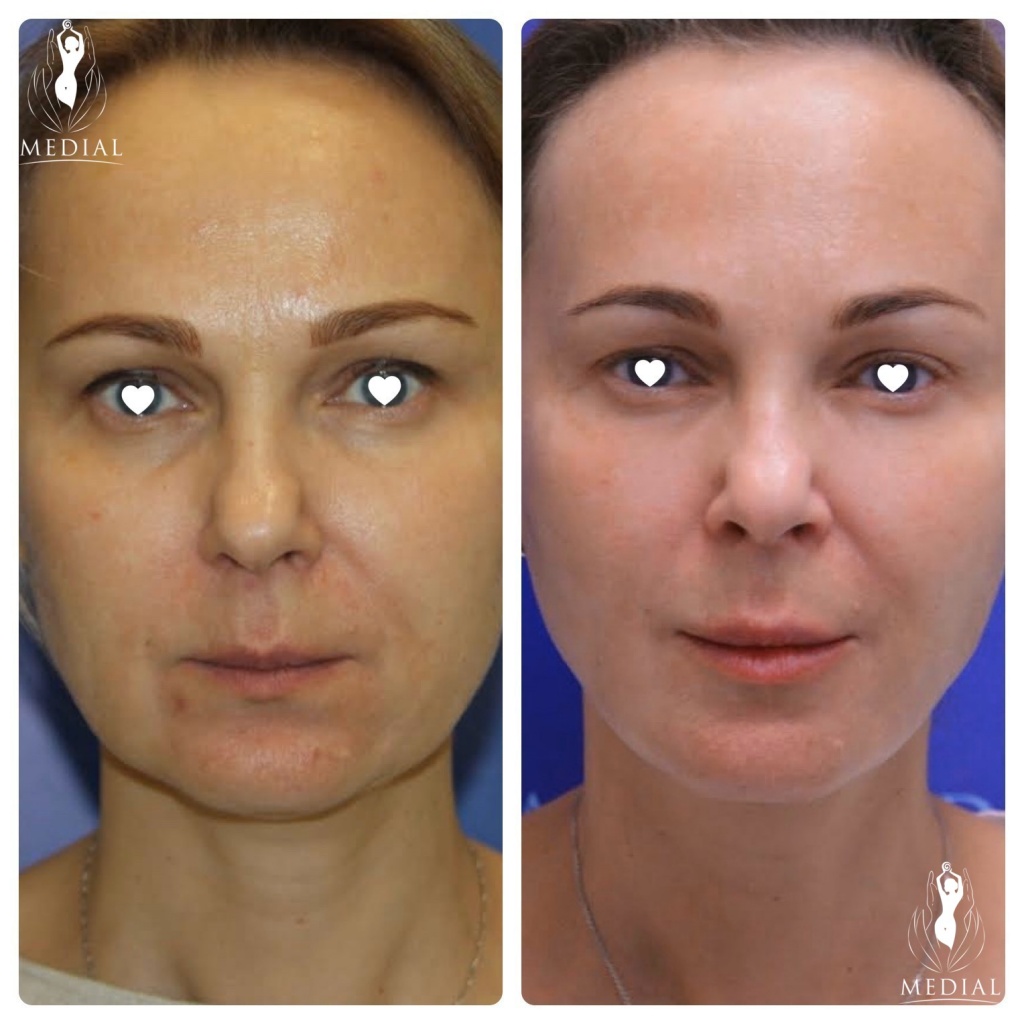


Рекомендованное количество процедур Nithya
3 процедуры с интервалом в 15 дней. Курс терапии можно повторить через 3 месяца после последней инъекции.
После курса процедур наблюдается эффект трехмерной реструктуризации и лифтинга кожи.
Уход после процедуры
Специального ухода после процедуры коллагенового омоложения не требуется.
Как долго держится эффект?
После курса процедур коллагенового омоложения Нития результат обычно сохраняется на протяжении 1-1,5 лет.
Стоимость 1 мл коллагенсодержащего препарата – 5 000 руб. Итоговая стоимость процедуры зависит от объемов коррекции плюс анестезия. Так, для области вокруг глаз хватает 1-2 мл, для лица (без области вокруг глаз) потребуется 2 мл. Точную информацию вам предоставит врач на очной консультации.
С возрастом выработка коллагена в коже снижается, в связи с чем, она начинает теряет упругость и здоровый цвет. Все это приводит к образованию глубоких морщин, обвисанию и потере четких контуров. Благодаря введению инъекций чистого коллагена можно не только замедлить эти процессы, но и обратить их вспять, спровоцировав выработку новых клеток.



- истощенная внешними факторами кожа лица: блеклая, дряблая, склонная к морщинам
- увядающая шея и рыхлая зона декольте
- потеря четкости контуров овала лица
- незначительные рубцы и шрамы, постакне, растяжки
- необходимость коррекции фигуры (дряблая кожа рук, ног, живота и ягодиц, растяжки)
Для введения инъекций препарата не требуется анестезия, однако в случае низкого болевого порога у пациента, корректируемая зона может быть обработана анестетиком. Специалист вводит чистый коллаген глубоко в кожу множеством микроинъекций. Процедура занимает не более четверти часа и после нее можно сразу же вернуться к привычному образу жизни. Мелкие папулы (шарики) в местах введения рассасываются в течение нескольких часов. На особо чувствительной коже возможно возникновение небольших синячков от инъекций.
Посмотрите короткое видео о революционной методике омоложения и как проходит сам процесс процедуры.
Ежегодно создаются новые методики и препараты для улучшения синтеза коллагена с целью профилактики инволюционных процессов в организме и уменьшения выраженности возрастных изменений.
Но за стремлением повлиять на коллагеногенез извне порой забывают о тех веществах, без достаточного количества которых в самом
организме синтез коллагена крайне затруднен. Никто не будет отрицать, что продукция этого жизненно важного белка зависит от гормонов, гормоны, в свою очередь, от присутствия металлов, усвоение металлов — от витаминов; и эту цепочку можно продолжать долго, тем более что она замкнутая. Осветить все нюансы в одной статье не представляется возможным, но сделать шаг навстречу пониманию некоторых процессов — в наших силах.
Синтез и процессинг (созревание) коллагена включает в себя несколько этапов:
- транскрипция генов, кодирующих коллагены, в которой участвуют десятки магнийи кальцийзависимых белков;
- синтез препроколлагена на рибосоме, поддерживаемый магний- и кальцийзависимыми белками;
- транспорт цепи препроколлагена в эндоплазматический ретикулум посредством сигнального пептида на N-концевом участке аминокислотной цепи;
- удаление сигнального пептида в препроколлагене посредством фермента пептидазы;
- гидроксилирование аминокислотных остатков пролина с участием Fe2+ и аскорбат-аниона в качестве кофакторов;
- гликозилирование моносахаридами аминокислотных остатков лизина в препроколлагене в присутствии ферментов, содержащих ионы марганца;
- сборка тройной спирали проколлагена из 3 аминокислотных цепей препроколлагена;
- внесение необходимых конформационных изменений в проколлаген посредством изомеризации остатков цистеина и пролина;
- упаковка проколлагена в транспортный везикул, перенос во внеклеточный матрикс;
- вне клетки модификация молекулы проколлагена с помощью протеиназ проколлагена, нуждающихся в ионах Zn2+ как кофакторе;
- формирование коллагеновых фибрилл из тропоколлагена посредством лизилоксидазы, кофакторами которой являются ионы Cu+ и тирозил-хинон (рис. 1) [1].
Всем известно об участии магния и кальция в синтезе соединительной ткани и коллагена, но о железе, цинке, меди, витаминах С и D часто забывают. Именно эти кофакторы рассмотрим в статье.
Железо
Железодефицитная анемия в той или иной степени присутствует у 40–60 % женщин детородного возраста по всему миру [2, 26]. И это при том, что железо — один из важнейших микроэлементов, необходимых для нормального функционирования биологических систем организма. Оно требуется для осуществления функции дыхания, кроветворения, участвует в иммунобиологических и окислительно-восстановительных реакциях.
Причины дефицита железа:
- недостаточное поступление в организм железа из-за нарушения режима питания (например, при вегетарианской диете);
- снижение всасываемости железа в кишечнике (рис. 3);
- нарушение регуляции обмена витамина С;
- избыточное поступление в организм фосфатов, оксалатов, кальция, цинка, витамина Е;
- поступление в организм железосвязывающих веществ;
- усиленное расходование железа (в периоды интенсивного роста и беременности);
- потери железа, связанные с травмами, кровопотерями во время операций, обильными менструациями, язвенными болезнями, донорством, занятиями спортом;
- нарушение функции щитовидной железы;
- различные системные и опухолевые заболевания [21].
Учитывая высокую распространенность дефицита железа в популяции, сложно говорить о нормальном синтезе коллагена при таких состояниях.
Цинк — единственный металл, представленный в небелковой части ферментов каждого класса, и никаким другим металлом цинк не может быть заменен. Несмотря на малую концентрацию цинка в крови, стабильные связи с макромолекулами делают его доступным для всех тканей организма, что в дальнейшем позволяет удовлетворять потребности в нем белков и ферментов, выполняющих различные биологические функции [28].
Распространенность дефицита цинка в мире не менее значительная, чем железа и витамина С, и составляет до 60% [29].
Для транспорта эритроцитами кислорода и углекислого газа абсолютно необходим цинк, и большая часть цинка крови содержится именно в эритроцитах в составе цинковых металлоферментов — карбоангидраз. Карбоангидразы катализируют превращения углекислого газа в угольную кислоту (угольная кислота участвует в поддержании pH крови в физиологическом диапазоне (7,25–7,35). В капиллярах легких эти процессы идут в обратном направлении: угольная кислота распадается на углекислый газ и воду, и углекислый газ удаляется наружу [18].
Без нормального дыхания ни одна клетка не способна осуществлять свои функции.
В мире распространенность дефицита меди в организме, приводящего, наряду с железом, к анемии, составляет до 30%. А ведь этот микроэлемент крайне необходим для нормальной физиологии организма.
Если говорить о коже, то медь играет ключевую роль в ангиогенезе, синтезе и стабилизации белков внеклеточного матрикса [3].
В физиологически значимых концентрациях (2 мг — средняя суточная потребность) медь ускоряет заживление ран [16].
Ионы меди, которые являются кофакторами лизилоксидазы, принимают участие в последнем этапе синтеза коллагена. Медь имеет важное значение для формирования внутри- и межмолекулярных поперечных связей в коллагене, а соответственно, и прочности коллагеновых и эластиновых фибрилл [8, 13,
15]. Недостаток меди ухудшает формирование сшивок коллагена и приводит к тяжелой патологии костей, легких и сердечно-сосудистой системы [12].
Компенсация дефицита этого микроэлемента, бесспорно, улучшает синтез коллагена, в том числе в коже (рис. 4) [7, 10].
Аскорбиновая кислота (витамин С)
Аскорбиновая кислота играет в организме фундаментальную роль — нет фактически ни одного физиологического процесса, в котором бы она не принимала участия.
Роль витамина С в организме
Аскорбиновая кислота в организме человека оказывает влияние на множество важнейших биологических процессов:
- образование кортикостероидов (при стрессе в несколько раз возрастает уровень потребления витамина С тканями и органами) [20];
- обмен тирозина (влияние на обмен гормонов щитовидной железы) [22];
- трансформация дофамина в норадреналин [25];
- превращение токсичных соединений ванадия в безвредные [23];
- превращение фолиевой кислоты в ее активную форму — тетрагидрофолат [27];
- активация мРНК ацетилхолинового рецептора [20];
- образование активных форм витамина D (транспортной формы [25(OH)D] — в печени и активной гормональной формы [1,25(ОН)2D] — в почках), что служит основным фактором профилактики остеопороза [20];
- потенцирование всасывания железа [24].
Распространенность дефицита витамина С в мире по разным данным составляет 20–40% [14, 15].
В последнее время много исследований посвящено аскорбиновой кислоте и ее биодоступности для кожи [9]. При недостатке витамина С в организме его нанесение на кожу не будет иметь ожидаемого эффекта, так как не сможет восполнить нутритивный дефицит. В ходе проведенных исследований выяснилось, что витамин С ускоряет заживление ран, участвует в активизации синтеза коллагена I типа (рис. 5) и снижении параметров
окислительного стресса. Никаких значимых побочных эффектов при добавлении витамина С в питание в ходе проведенных исследований выявлено не было [5, 6].
Синтез коллагена зависит от гормонов, гормоны, в свою очередь, от присутствия металлов, усвоение металлов — от витаминов, и эту цепочку можно продолжать долго, тем более что она замкнутая.
Витамин D
Распространенность дефицита витамина D в российской популяции составляет более 90% (в мире 50–60%) [19]. Этот витамин стимулирует увеличение синтеза секретируемых белков TGF-β (регулируют деление
и дифференцировку различных типов клеток, включая фибробласты и кератиноциты) и их связывание с рецепторами на мембране клеток. Поэтому при его дефиците происходит нарушение активности сигнальных каскадов TGF-β, что ухудшает заживление кожи после любой травмы (включая косметологические манипуляции). Например, во время термолифтинга часть коллагеновых волокон дермы сжимается и уменьшается в объеме. Это приводит к повышению зернистости базального слоя и при достаточном количестве витамина D создает благоприятные условия для воздействия его активных форм на экспрессию TGF-β1, который и способствует обновлению соединительной ткани [11].
Выводы
Мы кратко обсудили лишь некоторые кофакторы, участвующие в синтезе коллагена. Но даже этот незначительный пласт информации позволяет судить о зависимости синтеза коллагена от нутритивного статуса организма, чем не следует пренебрегать, решая многие эстетические задачи. Изменение синтеза
коллагена происходит постепенно и усугубляется нутритивным дефицитом [19].
В представленном обзоре рассмотрена роль коллагеновых гидролизатов в лечении и профилактике заболеваний суставов. Коллаген является основным структурным белком костей, хрящей, связок, сухожилий в суставах. Гидролизованный коллаген, как источник специфических аминокислот, может быть строительным материалом для образования фибрилл коллагена в соединительных тканях. Ферментативный гидролиз хрящей цыплят позволил получить комплекс гидролизата коллагена типа II и гликозаминогликанов. В клинических исследованиях были проверены гидролизаты кожного коллагена, хрящевого коллагена типа II, а также хрящевого неденатурированного коллагена типа II. Применение коллагеновых гидролизатов в течение продолжительного времени (5–6 мес.) позволило улучшить функционирование коленного сустава у пациентов не только с лёгкой формой, но и с тяжелой формой остеоартроза. Нутрицевтики из гидролизатов коллагена типа II в комплексе с витамином С более эффективно влияют на образование фибрилл коллагена, протеогликанов в хрящевом матриксе и таким образом могут повлиять на увеличение подвижности суставов.

1. Лазерная инженерия хрящей. / Багратишвили В.Н., Соболь Э.Н., Шехтер А.Б. – М: ФИЗМАТЛИТ, 2006. – 488 c.
2. Кадурина Т.И., Горбунова В.Н. Дисплазия соединительной ткани. Руководство для врачей. – СПб: ЭЛБИ, 2009. – 704 c.
4. Moskowitz R.W. Role of collagen hydrolysate in bone and joint disease. // Seminars in Arthritis and Rheumatism. – 2000. Vol. 30. – P. 87–99.
6. Liu Z.-Y., D. Chen D., Su Y.-C., and Zeng M.-Y. Optimization of hydrolysis conditions for the production of the angiotensin-I converting enzyme inhibitory peptides from sea cucumber collagen hydrolysates. // J. Aquat. Food Prod. Technol. – 2011. Vol. 20. – P. 222–232.
7. Liu F., Liub C., Lorenac D. et al. Evaluation of the antioxidant activity of collagen peptide additive extracted from cod skin. // J. Environ. Protect. Ecology. – 2012. Vol.13. P. 1836–1841.
8. Yu P. and Chen H.. Optimization of conditions for enzymatic production collagen hydrolysates from a long-value acaudinamolpadioides and their activites. // J. Food Biochem. – 2013, Vol. 38. – P. 227–235.
10. Oesser S. and Seifert J. Stimulation of type collagen biosynthesis and secretion in bovine chondrocytes cultured with degraded collagen. // Cell Tissue Res. 2003, Vol. 311. – P. 393–399.
13. Trentham D.E., Dynesius-Trentham R.A., Orav E.J. et al. Full text of Harvard study effects of oral administration of type II collagen on rheumatoid arthritis. // Science. – 1993, Vol. 261. – P. 1727–1730.
14. Lopez H.L. Osteoarthritis supplement nutritional interventions to prevent and treat osteoarthritis. Part II: Focus on vicronutrients and supportive nutraceuticals. // Amer. Acad. Physic. Med. Rehab. – 2012, Vol. 4. – P. S155–S168.
Болезни хрящей: артриты и артрозы суставов, разрушения межпозвонковых дисков в позвоночнике являются распространенными хроническими заболеваниями. Фармакологическими средствами (стероидными и другими препаратами) болезни опорно-двигательного аппарата c трудом поддаются лечению. Применяемые лекарства направлены преимущественно на уменьшение боли и повышение подвижности суставов. Поэтому медицинские учреждения и пациенты ищут нестандартные методы устранения нарушений здоровья. В последние годы наряду с традиционной фармакотерапией развивается полифармацевтика и биофармацевтика. Клиническая нутрициология представляет одно из новых направлений биофармацевтики. По определению, принятому в США и Великобритании, нутрицевтиком является пища с фармацевтическими свойствами. Одна из п роблем рационального поиска природных лекарственных средств, способных оказывать биофармацевтическое и полифармацевтическое действие, может быть решена разработкой нутрицевтиков из компонентов соединительных тканей . Широкое распространение приобрели нутрицевтические средства, содержащие гидролизат коллагена, глюкозамин, хондроитин сульфат, гиалуроновую кислоту, витамин C и другие вещества. Гликозаминогликаны – хондропротекторы – давно применяются при болезнях опорно-двигательного аппарата. В данном обзоре мы рассматриваем коллаген, как основной белок соединительных тканей, фибриллы которого укрепляют матрикс тканей в суставах. Применяя коллагеновые гидролизаты, пациенты могут предотвратить или облегчить симптомы болезней. Целью представленного обзора является анализ нутрицевтиков, полученных на основе гидролизатов коллагена, а также оценка эффективности их действия в профилактике и лечении заболеваний суставов .
Структура соединительных
тканей суставов
Такой сложный орган как сустав состоит из костей, хрящей, связок, сухожилий, стекловидного тела. Хрящевая ткань локализована в тех участках опорно-двигательного аппарата, которые испытывают наибольшую механическую нагрузку. Изменения в суставах при болезнях начинаются прежде всего в гиалиновом хряще, а затем распространяются на кость и другие ткани. С оединительные ткани суставов образованы из специализированных клеток и внеклеточного матрикса (ВКМ). Матрикс содержит коллагеновые и эластиновые фибриллы, протеогликаны и гликопротеины. Механическая прочность матрикса определяется жесткой структурой коллагеновых и эластиновых фибрилл. Коллаген является основным структурным белком соединительных тканей. Фибриллы формируются из коллагенов типов I, II, III и их комплексов с минорными коллагенами типов IX, X, XI, XII, XIV. В хрящах преобладает коллаген типа II [1]. Фибриллы коллагена типа VI
соединяют основные фибриллы между собой. Коллагеновые фибриллы в матриксе образуют трехмерную сеть. П ротеогликаны и г ибкие фибриллы малого диаметра, но содержащие большое количество ковалентных поперечных связей, придают эластичность тканям. Протеогликаны и гликопротеины заполняют пространство между фибриллами и клетками. Гликопротеины, связываясь с рецепторами на поверхности хондроцитов, осуществляют взаимодействие матрикса с клетками. Протеогликаны образуются из комплексов аггреканов, связущего белка и гиалуроновой кислоты. В состав аггреканов входят гликозаминогликаны: хондроитин-4-сульфат, хондроитин-6-сульфат, кератан-сульфат. Специфическая структура матрикса обеспечивает как биомеханические свойства хряща, так и способствует его питанию путем диффузии. Известно, что кровеносная система в гиалиновых хрящах отсутствует [1]. Тем не менее внутритканевая вода, ее большое количество и растворенные в ней вещества обеспечивают интенсивный обмен веществ. Протеогликаны, обладая катионными и анионными свойствами, регулируют физико-химические свойства матрикса. Изменение содержания коллагеновых белков, протеогликанов, гликозаминогликанов, ионов металлов, воды нарушает структуру хрящевой ткани, приводит к болезням. Патологические процессы при артрозах сопровождаются пониженными концентрациями коллагена и гликозаминоглика-
нов [5]. Ослаблена структура коллагеновых фибрилл в суставах при наследственном заболевании гипермобильность суставов, при котором также истончается кожа [2]. Нарушения структуры матрикса и размеров коллагеновых фибрилл в таких разных тканях, как хрящи и кожа, происходят в отсутствии коллагена типа VI, дефиците солей и витаминов [2]. Восполнение недостающих компонентов матрикса в организме человека можно проводить применением лечебных средств профилактического действия, а также нутрицевтиков. Лекарствами-хондропротекторами являются гиалуроновая кислота и сульфатированные гликозаминогликаны. Их выделяют из п ротеогликановых комплексов, содержащихся в тканях позвоночных животных и гидробионтов. Заложенные природой в организме человека и животных макромолекулы соединительных тканей могут быть лекарствами полифармацевтического и биофармацевтического действия.
Получение гидролизатов коллагена и нутрицевтиков на их основе
Несмотря на то что коллаген является основным белком суставов, коллагеновые нутриенты относительно недавно стали применять для лечения артритов и артрозов. В организм человека к оллаген поступает с пищей после ее тепловой обработки. Денатурированным видом коллагена является лекарственный и пищевой желатин. Коллагеновые белки и желатин под действием ферментов желудочно-кишечного тракта (ЖКТ) могут расщепляться до аминокислот и полипептидов. Большая длина молекул и фибрилл коллагена, имеющих относительно высокую молекулярную массу, препятствует их эффективному перевариванию. Гидролизаты коллагена, содержащие набор аминокислот и полипептидов, более доступны для усвоения в организме человека. Поступающие в кровь аминокислоты накапливаются в соединительных тканях и клетках. Гидролизованный коллаген, как источник специфических аминокислот, может быть строительным материалом для биосинтеза матрикса этих тканей. Из экстрактов кожной ткани получали фармацевтический желатин. Для того, чтобы повысить усвоение желатина, дополнительно проводили его ферментативный гидролиз [4].
Актуальной задачей является получение гидролизатов коллагена с большим содержанием свободных аминокислот и полипептидов низкой молекулярной массы. Ферментативный гидролиз коллагена представляет необходимый этап создания нутрицевтиков эффективного действия и получения нутриентов с регулируемыми характеристиками. Степень гидролиза (DH) является наиболее значимой характеристикой глубины гидролиза. Индекс DH коррелирует с распределением длин молекулярных цепей и с молекулярной массой пептидов. Молекулярные параметры гидролизатов варьируют в зависимости от вида животного и условий гидролиза ткани. Более тонкая кожа рыб (треска и другие виды) способствует образованию гидролизатов коллагена более высокой степени гидролиза, если сравнивать с гидролизатами гидробионтов (трепанги) [6–8] . Исследовали гидролиз тканей под влиянием разных ферментов, времени действия фермента, а также в зависимости от температуры, рН, соотношения фермент/субстрат. Оптимизация условий ферментативного гидролиза позволяет повышать степень гидролиза коллагена. В работе [7] совместное действие ферментов (щелочная протеаза и папаин) привело к увеличению индекса DH, если сравнивать действие этих ферментов по отдельности.
Эксперименты в культуре клеток
Показано, что в хондроцитах in vitro после 11 дней культивирования в среде с гидролизатом коллагена типа II количество аминокислот возрастает в 2,5 раза по сравнению с контролем (среда без гидролизата коллагена) [10]. Стимуляция коллагенообразования из аминокислот в клетках регулируется ферментами, на активность которых влияют витамины и катионы металлов. Синтез коллагена и его фибриллообразование – сложный многоэтапный процесс. Биосинтез протекает в специализированных клетках (хондроциты в хрящах), а фибриллообразование – вблизи поверхности клеток. Реакции гидроксилирования позволяют модифицировать молекулы коллагена. Катализируют гидроксилирование ферменты: пролил-4-гидроксилаза и лизил-5-гидроксилаза с целью превращения пролина в оксипролин, а лизина в оксилизин. Ферменты активны в том случае, если железо находится в двухвалентной форме, что обеспечивается аскорбиновой кислотой (витамин С). Особенностью фибрилл коллагена высокой степени прочности является большое содержание аминокислотных остатков с альдегидными группами. В норме из лизина и оксилизина образуются их альдегидные формы аллизин и оксиаллизин, которые участвуют в образовании прочных ковалентных связей между молекулами коллагена. Поэтому нутрицевтики из гидролизатов коллагена в комплексе с аскорбиновой кислотой (витамин С) более эффективно влияют
на фибриллообразование.
Хрящ суставов аккумулирует аскорбиновую кислоту. В хондроцитах аскорбиновая кислота и дигидроаскорбат перемещаются, соответственно, через натрий-зависимый транспорт витамина C (SVCT-2) и транспорт глюкозы GLUT 1 [11]. In vitro аскорбат и аскорбиновая кислота стимулировали в хондроцитах суставов синтез коллагена типов I, II, протеогликанов и аггреканов [11].
Исследование in vivo на мышах линии STR/ort (у которых развили остеоартрит) показало, что длительный приём гидролизата коллагена может снижать дегенеративность хрящевой ткани, поражённой остеоартритом, и задерживать его развитие [11].
После клинических испытаний хондропротекторов наблюдали как положительные, так и отрицательные результаты от применения хондроитин-сульфата и гиалуроновой кислоты [5]. Установлено также незначительное влияние этих хондропротекторов на снижение боли у пациентов. Противоречивость наблюдаемого различия, по-видимому, обусловлена разным источником и методом получения хондропротекторов. Если наряду с гликозаминогликанами в состав лекарства входят коллагеновые белки, лекарство может обладать стимулирующим действием. Недостаток коллагеновых белков в осполняется приемом нутрицевтиков.
Проверяли влияние фармацевтического гидролизата коллагена (ФГК) на обмен веществ у больных остеоартритом [4]. Пациенты с остеоартритом коленного сустава принимали ежедневно по 10 г ФГК или 12 г лактозы (плацебо) на протяжении 24 недель. Клинические исследования в медицинских центрах трех стран выявили улучшение функций суставов и преимущество лечения ФГК над плацебо лишь в Германии. Ни в США, ни в Великобритании не были получены статистически достоверные результаты.
Определена специфичность соединительной ткани для получения гидролизатов коллагена и более эффективного лечения суставов. После применения гидролизата коллагена типа II в течение 24 недель в группе спортсменов – здоровых людей, но с внутрисуставной болью – наблюдали увеличение подвижности суставов, снижение болевого синдрома и уменьшение зависимости от анальгетиков [12]. У пациентов с первичным остеоартрозом при тех же условиях приема гидролизата коллагена происходило улучшение функционирования коленного сустава по оценке визуальной аналоговой шкалы и WOMAC. У пациентов с симптомами лёгкого остеоартроза коленного сустава, которые применяли гидролизат коллагена (10 г/день) с кальцием (300 мг/день) и витамином C (60 мг/день) в течение 14 недель, по изометрическим и изокинетическим тестам повышалась функциональная подвижность колена. Также более высокие результаты наблюдали у пациентов с тяжёлыми формами остеоартроза.
Нутрициология в профилактике болезней суставов
В настоящее время задачами лечения больных артритом и артрозом является повышение подвижности суставов и снижение боли. Подвижность суставов определяется оптимальными размерами коллагеновых фибрилл и протеогликанов. Известно, что в хрящах обновление матрикса происходит через год [1]. Поэтому длительное и систематическое применение комплекса из специфических аминокислот и гликозаминогликанов в гидролизатах коллагена типа II позволяет восстановить и укрепить структуру тканей суставов человека. Рекомендуемая доза – 10 г гидролизата коллагена в день [4, 14]. Нутрицевтики на основе гидролизата коллагена эффективно влияют как на раннюю стадию болезней суставов, так и на профилактику таких болезней. Хронические болезни человека вследствие дисплазии соединительной ткани (ДСТ) закладываются на эмбриональной стадии развития и/или на этапах роста детей и подростков. Нутрицевтические добавки из аминокислот коллагена помогают ослабленным детям в укреплении хрящевой, костной и других соединительных тка-
ней [2]. Применением нутрицевтиков из гидролизатов коллагена в комплексе с гликозаминогликанами, витаминами и катионами металлов можно стимулировать в клетках биосинтез макромолекул и структуру ВКМ, нарушенных в результате болезней. Если действие современных лекарств направлено на снижение воспалительных и болевых симптомов в период болезни или ее обострения, то нутрицевтики имеют преимущество в профилактике заболеваний.
Принимая во внимание, что коллаген является основным структурным белком костей, хрящей, связок, сухожилий в суставах, рассмотрена роль коллагеновых гидролизатов в лечении и профилактике заболеваний суставов. Для получения гидролизатов с высоким содержанием аминокислот эффективен биокаталитический подход и оптимизация ферментативного гидролиза. Представленные в обзоре данные показывают, что коллагеновые гидролизаты могут облегчить симптомы болезней суставов. Однако роль питания в снижении развития заболевания остаётся слабо изученной. Исследования по лечению и профилактике болезней соединительных тканей с помощью нутрицевтиков находятся на начальной стадии развития. Было получено и испытано всего лишь несколько видов гидролизата коллагена. Более того, определена специфичность гидролизата коллагена типа II из хрящевой ткани для улучшения функционирования суставов. Поскольку увеличение подвижности суставов может регулироваться размерами фибрилл коллагена и протеогликанов, потребуется определить взаимосвязь между составом коллагеновых гидролизатов и структурой матрикса. Если фармакологический метод основан на исследовании одна молекула/одна цель, то нутрициология является более целостным видом методологии: многие ингредиенты/множественные цели. Нутрициология, как раздел современной биофармацевтики, представляет ее новое направление, исследует возможные механизмы и способы для предупреждения заболеваний человека.
Рецензенты:
Рассмотрены возможности медикаментозного воздействия на систему соединительной ткани с позиций влияния различных медикаментозных препаратов, макро-, микроэлементов, витаминов и биостимуляторов на обменные процессы в соединительной ткани с целью укрепления
Possibilities of drug effect on connecting tissue system accounting for different preparation’, macronutrients’, trace elements’, vitamins’ and biostimulant’s effects on metabolic process in connecting tissue to fixation of components of connecting tissue has been analyzed.
Однако генная терапия наследственных заболеваний человека пока остается проблемной. Результаты этой этиотропной терапии остаются весьма скромными. В основном в литературе указывается на пробные методики лечения болезней с установленными и конкретным генным дефектами (наследственные заболевания или дифференцированные формы ДСТ). Стратегия лечения пациентов с генетически детерминированной патологией (недифференцированная ДСТ) при большом разнообразии генетического дефекта сводится к коррекции метаболизма соединительной ткани, лежащего в основе патогенеза данного состояния. При этом не ставятся задачи повышения синтеза коллагена или предупреждение деградации белков, так как стратегия лечения должна строиться на выравнивании двух этих процессов.
Медикаментозная коррекция не решает проблемы комплексного многоуровневого воздействия на систему соединительной ткани и поэтому не может быть признана единственно возможной. Однако применение медикаментозного воздействия на систему соединительной ткани предпринято с позиций влияния различных медикаментозных препаратов, макро-, микроэлементов, витаминов, биостимуляторов на обменные процессы в соединительной ткани, направленных на укрепление компонентов соединительной ткани, и может применяться как фундамент в программах лечения.
Согласно литературным данным у подавляющего большинства пациентов с ДСТ имеет место снижение уровня большинства макро- и микроколлагеноспецифических биоэлементов. Наиболее часто встречается дефицит кремния (100%), селена (95,6%), калия (83,5%); кальция (64,1%); меди (58,7%); марганца (53,8%), магния (47,8%). Все они принимают активное участие в минерализации костной ткани, синтезе и созревании коллагена [3]. В связи с этим показаны продукты, обогащенные веществами, участвующими в метаболизме соединительной ткани: витаминами С, Е, В6, D, Р (флавоноиды), макро- и микроэлементами (магний, медь, марганец, цинк, кальций, калий, селен) [4, 5].
Витамин С
Свежие овощи, фрукты, черноплодная рябина, черная смородина, шиповник, сладкий красный перец, горох, клубника, капуста (кочанная, брюссельская, брокколи), хвоя, мандарины, апельсины, грейпфрут, помидоры, зелень петрушки, укропа и пр.
Витамин Р
Листья чая, листья руты пахучей, цитрусовые, плоды шиповника, рябины черноплодной, цветки гречихи, софоры, трава горца птичьего, листья подорожника большого, трава володушки многожильчатой, астрагала шерстистоцветкового, листья боярышника кроваво-красного, каштана обыкновенного, дуба, плоды черники обыкновенной, калины обыкновенной, земляники лесной, малины обыкновенной.
Витамин В6
Хлеб из муки грубого помола, зерна злаков, бобовые, гречневая и овсяная крупы, бананы, капуста, картофель, мясо, печень, почки, домашняя птица, молоко, творог, сыр, рыба, дрожжи.
Витамин D
Печень тунца, трески, палтуса, кита, сельдь, лосось, сардины, цельное молоко, желтки яйца.
Витамин Е
Зародыши злаковых культур, зеленые органы овощей, кукурузное, оливковое, виноградное, льняное, подсолнечное и другие растительные масла, многие овощи и фрукты, печень, мясо, рыба, сливочное масло, молоко; плоды облепихи крушевидной, рябины черноплодной, смородины черной, ежевики сизой, масло плодов ореха грецкого.
Магний
Палтус, семена тыквы, ячмень, гречка, йогурт, бобовые, шпинат, свежая зелень, нерафинированные крупы.
Печень, почки, мозги, морепродукты, гречневая крупа, миндаль, репа, авокадо, шпинат, перец сладкий красный, пшеничные зародыши, пшеничные отруби, пшенная, ячневая крупа, морковь, огурцы, томаты, редис, свекла, капуста, бобовые, земляника лесная, смородина черная, шоколад, какао, кофе, цитрусовые, крыжовник, грибы, яблоки.
Марганец
Пророщенная пшеница, орехи фундук, мука пшеничная, хлеб из муки цельного помола, какао-бобы, миндаль, хлеб ржаной, крупа гречневая, фасоль.
Кальций
Молоко пастеризованное, сметана, кефир, творог, йогурт, молоко сгущенное, сыр, брынза, плавленый сыр, рыба, петрушка, кунжут, миндаль, фасоль, абрикосы сушеные.
Маковое семя, семена подсолнуха, семя льна, соевая мука, соя, бразильский орех, чечевица сухая, арахис, грецкий орех, миндаль, орех кешью, лесной орех, белый гриб, хрен, фисташки, крапива.
Селен
Морская и каменная соль, почки (свиные, говяжьи и телячьи), печень, сердце, яйца, морская рыба, крабы, омары, лангусты, креветки, пшеничные отруби, проросшие зерна пшеницы, зерна кукурузы, помидоры, пивные дрожжи, грибы, чеснок, черный хлеб, другие продукты из муки грубого помола.
Однако назначением диетотерапии скомпенсировать дефицит микроэлементов сложно, кроме этого из всего списка микроэлементов есть наиболее значимые для стабилизации и укрепления структуры соединительной ткани. Безусловно, основой терапии пациентов с ДСТ является назначение препаратов. содержащих магний, т. к. для структуры соединительной ткани крайне важна роль магния, который является одним из основных биоэлементов, обеспечивающих физиологический метаболизм соединительной ткани. При дефиците магния — а это весьма частое явление у лиц с ДСТ — белковый синтез соединительной ткани замедляется, активность матричных металлопротеиназ увеличивается и внеклеточный матрикс прогрессивно деградирует, так как структурная поддержка ткани (в частности, коллагеновые волокна) разрушается быстрее, чем синтезируется [6].
На основе собственных многолетних клинических наблюдении был сделан вывод о безопасности и эффективности препаратов магния (Магнерот и Магне В6) в плане уменьшения вегетативной дисрегуляции и клинических проявлений ДСТ (нормализация частоты сердечных сокращений, артериального давления, снижение эпизодов нарушения ритма и т. д.), было установлено позитивное влияние на физическую работоспособность и целесообразность их применения на подготовительном этапе перед занятиями лечебной физкультурой, особенно у пациентов с ДСТ, имеющих изначально низкую толерантность к физическим нагрузкам [7, 8].
Опираясь на литературные и собственные данные о благоприятном влиянии магния на укрепление соединительной ткани, пациентам с ДСТ в качестве первого курса терапии рекомендовано назначение одного из вариантов препаратов (Магнерот или Магне В6), содержащих магний, продолжительностью курса не менее 4–6 нед.
Но не только магний имеет ключевое значение для поддержания метаболизма соединительной ткани, ионы меди являются интегральной частью активного центра лизилоксидазы — фермента, обеспечивающего химическую модификацию коллагена и эластина соединительной ткани.
Дефицит меди приводит к нарушению коллагена и эластина, что способствует формированию аномалий развития сердечно-сосудистой системы и скелета. Нарушение метаболизма при недостаточности меди приводит к различным патологическим синдромам, нередко имеющим генетическую природу (синдром Марфана, синдром Элерса–Данло и др.). У лиц с недифференцированной ДСТ дефицит меди часто проявляется сопровождающейся повышенной растяжимостью кожи, гиперэластозом, гипермобильностью суставов.
С целью стабилизации коллагена и эластина пациентам с ДСТ необходимо назначать 1% раствор сульфата меди — 10 капель на прием 3 раза в день продолжительностью до 4 недель.
Цинк необходим для функционирования многих металлоферментов, регулирующих ремоделирование коллагена в соединительной и костной тканях. Цинк активирует ферменты (матриксные металлопротеиназы), которые способствуют образованию фагоцитов и усиливают активность макрофагов, вследствие чего фибробласты поступают в пораженную область, восполняя дефицит гиалуроновой кислоты, которая относится к гликозамингликанам, формирующим аморфное вещество соединительной ткани. Таким образом, назначение препаратов цинка при лечении пациентов с ДСТ не менее важно, как и препаратов, содержащих магний и медь.
Положительное влияние на синтез коллагена и образование поперечных сшивок в его макромолекуле оказывает и аскорбиновая кислота, при ведении пациентов с ДСТ при отсутствии оксалатурии и семейного анамнеза по мочекаменной патологии возможно назначение аскорбиновой кислоты в виде коктейлей с молоком, йогуртом; доза — не более 1 г в день в зависимости от возраста.
Назначение микроэлементов это основа медикаментозной терапии в лечении пациентов с ДСТ с целью стимуляции коллагенообразования. Для достижения успеха в лечении пациентов с ДСТ целесообразно проводить комплексную метаболическую терапию [5]:
1) коррекция нарушений синтеза и катаболизма гликозаминогликанов (хондроитина сульфат);
2) стабилизация минерального обмена (витамин D2 и его активные формы, препараты кальция);
3) коррекция уровня свободных аминокислот крови (метионин, глутаминовая кислота, глицин);
4) улучшение биоэнергетического состояния организма (Мексикор, Милдронат, Лецитин, Лимонтар).
1-й курс
Препарат Магне В6 в ампулах: взрослым рекомендуется принимать 3–4 ампулы в сутки. Детям старше 1 года (масса тела более 10 кг) суточная доза составляет 10–30 мг/кг и равняется 1–4 ампулам. Суточную дозу следует разделить на 2–3 приема, принимать во время еды, запивая стаканом воды. Раствор в ампулах растворяют в 1/2 стакана воды для приема 2–3 раза в день во время еды. В таблетках: взрослым рекомендуется принимать по 6–8 табл./сут; детям старше 6 лет (массой тела более 20 кг) — 4–6 табл./сут.
Магне В6 форте взрослым назначают 3–4 табл./сут, разделенные на 2–3 приема. Детям в возрасте старше 6 лет (с массой тела около 20 кг) назначают в дозе 10–30 мг/кг/сут (0,4–1,2 ммоль/кг/сут), т. е. 2–4 таб./сут, разделенные на 2–3 приема.
Магнерот назначают по 2 табл. 3 раза в день в течение 7 дней, затем — по 1 табл. 2–3 раза в сутки ежедневно. Продолжительность курса — не менее 4–6 нед. При необходимости Магнерот можно применять длительное время. При ночных судорогах икроножных мышц рекомендуется принимать по 2–3 табл. вечером.
Аскорбиновая кислота (при отсутствии оксалатурии и семейного анамнеза мочекаменной болезни) — до 0,6 г в день — 4 недели.
Милдронат — взрослым 5 мл раствора внутривенно на аутокрови № 10, далее по 250 мг 2 раза в день — 4–6 недель.
2-й курс
Цинкит — по 1 таблетке 2 раза в день — 1,5 месяца.
Мексикор — 100 мг 2% раствора внутривенно № 10, затем по 1 капсуле 3 раза в день –3 месяца.
3-й курс
Сульфат меди — 1% раствор, 10 капель на прием 3 раза в день — 4 недели.
Кальций Сандоз Форте — 500 мг в сутки 1–2 месяца, или Кальцемин Адванс — 1 таблетка 2 раза в сутки до 4 месяцев (индивидуально).
На фоне указанных курсов рекомендуется применение лимфотропных трав (корень шиповника, трава манжетки, кровохлебки) в виде отваров — 2–3 раза в день — с заменой состава сбора каждые 2 недели.
Главное помнить, что ведущим компонентом терапии должны быть немедикаментозные воздействия, направленные на улучшения гемодинамики (лечебная физкультура, дозированные нагрузки, аэробный режим). Однако нередко существенным фактором, ограничивающим достижение целевого уровня физических нагрузок у пациентов с ДСТ, оказывается плохая субъективная переносимость тренировок (обилие астенических, вегетативных жалоб, эпизоды гипотонии), что снижает приверженность пациентов к этому виду реабилитационных мероприятий. Так, по нашим наблюдениям до 63% пациентов имеют низкую толерантность к физической нагрузке по данным велоэргометрии, большинство из этих пациентов отказываются от продолжения курса лечебной физкультуры [9]. В основе низкой толерантности к физической нагрузке этиологическим фактором выступает гипокинетический тип гемодинамики у пациентов с ДСТ. А. Темниковой предложена методика патогенетической коррекции гипокинетического типа гемодинамики с помощью венотонического препарата — диосмина (Детралекс 500 мг), нормализующего структуру венозного притока у лиц с низкой толерантностью к физическим нагрузкам. После приема препарата по 2 таблетки в два приема в течение 4 недель у 100% пациентов отмечалось улучшение самочувствия, снижение утомляемости, увеличение работоспособности, в 62% случаях — уменьшение проявлений вегетативной дисфункции (синусовой тахикардии и дыхательной аритмии) с отчетливой тенденцией к увеличению ударного и минутного объемов правого и левого желудочков [10].
В связи с этим представляется единственно верным применение в комплексе с лечебной физкультурой препаратов метаболического действия для качественного лечения пациентов с дисплазией соединительной ткани. Не стоит забывать, что помимо базисной метаболической терапии, приведенной в данной статье, необходимо подходить индивидуально к каждому пациенту и, учитывая синдромное течение недифференцированной ДСТ, проводить активное лечение и профилактику ведущего синдрома на фоне базисной терапии.
Наибольшего внимания заслуживают аритмический и сосудистый синдром, в связи с повышенным риском внезапной смерти у данных пациентов. Согласно литературным данным β-адреноблокаторы предотвращают риск внезапной смерти у пациентов с ДСТ, способствуя устранению тахикардии, кроме того, данная группа препаратов имеет положительное влияние на диаметр аорты, особенно это выражено при диаметре аорты более 4 см. Патогенетически это происходит за счет уменьшения выброса в аорту и соответственно снижения нагрузки на стенки восходящего отдела, тем самым корригируя сопутствующую гемодинамическую артериальную гипертензию [11]. Применение β-адреноблокаторов нередко приводит к ухудшению самочувствия, так как большинство пациентов с ДСТ имеют нормальное или пониженное артериальное давление. Пациенты жалуются на усиление головокружения, слабость, снижение работоспособности, что приводит к отказу от лечения как самим пациентом, так и лечащим врачом. По нашим данным подбор β-адреноблокаторов из-за системной гипотонии следует подбирать методом титрования как при сердечной недостаточности. Согласно полученным нами данным при назначении β-адреноблокаторов (бисопролол) в начальной дозе 1,25 мг/сут с дальнейшим увеличением дозы до 2,5 мг/сут через 2 недели и дальнейшей титрации до достижения уровня частоты сердечных сокращений 59–69 ударов в минуту, отмечалось улучшение самочувствия и насосной функции сердца, снижение активации симпатического отдела нервной системы и тревожности [12]. Возможно также применение и других β-адреноблокаторов, таких как пропранолол в дозе от 40 до 200 мг в сутки или длительно действующих β-адреноблокаторов, например, атенолола в дозе от 25 до 150 мг/сутки или метопролола 50–200 мг в сутки.
Аневризма и дилатация грудной аорты являлись основной причиной ранней смерти пациентов с синдромом Марфана до 1970 г. За последние 30 лет продолжительность жизни пациентов с синдромом Марфана увеличилась прежде всего за счет своевременной диагностики жизнеугрожающих состояний и совершенствования тактики ведения пациентов в целом. Тем не менее, следует обратить внимание, что в значительном числе случаев наличие аневризмы аорты констатируется впервые только при секционном исследовании: в 95% случаев первым симптомом оказывается смерть, в то время как симптомы-предвестники разрыва или диссекции аневризмы аорты регистрируются только в 5% случаев. Если при синдроме Марфана существует статистика о распространенности дилатации и аневризме грудной аорты, то точная частота формирования данных изменений грудной аорты при недифференцированной форме ДСТ не известна. Накапливаются данные о большем в сравнении с общей популяцией диаметре аорты у пациентов с деформациями грудной клетки, а также у пациентов с пролапсом митрального клапана без признаков синдромной формы ДСТ. В последние годы появились работы, демонстрирующие перспективы применения ингибиторов ангиотензинпревращающего фермента (иАПФ) и блокаторов рецепторов ангиотензина II при расширении аорты у пациентов с синдромом Марфана [13, 14]. Таким образом, на сегодняшний день у врачей имеется достаточный арсенал средств для борьбы с прогрессированием ДСТ и предотвращения развития осложнений.
Литература
- Наследственные нарушения соединительной ткани. Российские рекомендации. М., 2012. 49 c.
- Яковлев В. М., Нечаева Г. И. Кардиореспираторные синдромы при дисплазии соединительной ткани. Омск: Изд-во ОГМА, 1994. 217 с.
- Кадурина Т. И., Аббакумова Л. Н. Принципы реабилитации больных с дисплазией соединительной ткани // Лечащий Врач. 2010. № 4. С. 28–31.
- Нечаева Г. И., Конев В. П., Друк И. В. и др. Выявление и тактика ведения пациентов с недифференцированной дисплазией соединительной ткани. Методические рекомендации для врачей. Под ред. акад. А. И. Мартынова. М.: РГ ПРЕ100, 2011. 52 c.
- Мартынов А. И., Яковлев В. М., Нечаева Г. И. и др. Диагностика и тактика ведения пациентов с дисплазией соединительной ткани в условиях первичной медико-санитарной помощи. Методические рекомендации для врачей. Омск, 2013. 133 c.
- Громова О. А. Магний и пиридоксин: основы знаний. М.: РСЦ Институт микроэлементов, Юнеско, 2006. 176 с.
- Нечаева Г. И., Яковлев В. М., Друк И. В., Тихонова О. В. Нарушения ритма сердца при недифференцированной дисплазии соединительной ткани // Лечащий Врач. 2008. № 6. C. 2–7.
- Нечаева Г. И. и др. Комплексная реабилитация больных с дисплазией соединительной ткани в условиях многопрофильного клинического учреждения. Омск, 2001. С. 39–44.
- Дубилей Г. С., Борисенко И. А., Гусев Д. А., Мазурова Л. Э. Комплексный подход к вопросу восстановительного лечения пациентов с дисплазией соединительной ткани / Дисплазия соединительной ткани: Материалы симпозиума, Омск, 1 ноября 2002. С. 160–162.
- Темникова Е. А. Медикаментозная коррекция нарушений гемодинамики при дисплазиях соединительной ткани: автореф. дис. … канд. мед. наук. Томск, 2001. 18 с.
- Shores J., Berger K. R., Murphy E. A., Pyerit R. E. Progression of aortic root dilatation and the benefit of long-term beta-adrenergic blockade in Marfan’s syndrome // N Engl J Med. 1994; 330: 1384–1385.
- Нечаева Г. И., Дрокина О. В. Возможности применения бисогаммы для контроля частоты сердечных сокращений у пациентов молодого возраста с дисплазией соединительной ткани // Кардиология. 2014. № 5. С. 14–18.
- Ahimastos A. A. et al. Effect of Perindopril on Large Artery Stiffness and Aortic Root Diameter in Patients With Marfan Syndrome // JAMA. 2007. № 298 (13). P. 1539–1547.
- Groenink M., den Hartog A. W., Franken R. et al. Losartan reduces aortic dilatation rate in adults with Marfan syndrome: a randomized controlled trial // Eur. Heart. J. 2013. Vol. 34. P. 3491–3500.
Г. И. Нечаева 1 , доктор медицинских наук, профессор
О. В. Дрокина
И. В. Друк, кандидат медицинских наук
М. В. Вершинина, кандидат медицинских наук
Е. А. Лялюкова, кандидат медицинских наук
И. В. Колменкова
Читайте также:

