Как сделать карбоновую кислоту
Добавил пользователь Валентин П. Обновлено: 04.10.2024
Карбоновые кислоты встречаются в хвоинках, листьях крапивы, фруктах и овощах. Индейцы в древности смазывали стрелы ядом – производными уксусной кислоты. Из многих карбоновых кислот синтезируются сложные эфиры, которые обладают приятными ароматами и применяются в производстве. Карбоновые кислоты – соединения с одной или несколькими карбоксильными группами – СООН. Они придают фруктам и овощам кислый вкус.
Лучшие условия по продуктам Тинькофф по этой ссылке
Дарим 500 ₽ на баланс сим-карты и 1000 ₽ при сохранении номера
. 500 руб. на счет при заказе сим-карты по этой ссылке
Лучшие условия по продуктам
ТИНЬКОФФ по данной ссылке
План урока:
Строение карбоновых кислот
Карбоксил, или карбоксильная группа, – сложная функциональная группа, содержащая карбонильную С=О и гидроксильную – ОН группы. Электронная плотность в молекуле стягивается на кислородный атом. Для карбонильного углерода характерно состояние sp 2 -гибридизации. Он образует три σ-связи и одну π-связь.
Виды карбоновых кислот
Номенклатура карбоновых кислот
Алгоритм названия соединения
Схема названия карбоновой кислоты.
Гомологический ряд
Первое соединение гомологического ряда – метановая кислота. Она входит в состав выделений муравьев. Медведи после зимней спячки часто ложатся на муравейник, чтобы муравьи своей кислотой убивали паразитов, скопившихся в мехе за зиму.
Гомологический ряд карбоновых кислот.
Смесь капроновой, каприловой и каприновой кислот содержится в козьем молоке.
Виды изомерии карбоновых кислот
Для соединений этого класса свойственны оба вида изомерии.
Структурная изомерия
Для непредельных представителей класса характерна изомерия положения двойной или тройной связи.
Пространственная изомерия
Оптическая изомерия возможна при наличии ассиметричного атома углерода. Цис-транс-изомерия свойственна для соединений, содержащих двойную связь.
Методы получения карбоновых кислот
Представители класса нередко встречаются в природе, но также есть промышленные и лабораторные методы их получения.
Реакции окисления
Карбоновые кислоты получают путем окисления первичных спиртов. В этом случае окислителями могут выступать перманганат или дихромат калия.
Также их синтезируют путем окисления альдегидов. Окислители – перманганат или дихромат калия.
CH3CHO + Ag2O (аммиачный раствор) → CH3COOH + Ag↓
Карбоновые кислоты могут быть синтезированы путем неполного окисления алканов. Данная реакция возможна только при высоких температурах и наличии катализатора.
С помощью окисления бутана в присутствии катализатора в промышленности синтезируют уксусную кислоту.
Из гомологов бензола получают бензойную кислоту.
Щелочной гидролиз тригалогенидов
Представителей класса получают взаимодействием водного раствора щелочи и тригалогеналкана, в котором атомы галогена расположены при одном углеродном атоме. При этой реакции галогены замещаются на гидроксильные группы.
Реакция соли и минеральной кислоты
Карбоновые кислоты получают действием минеральной кислоты на соли.
R-COOK + HCl→ R-COOH + KCl
Взаимодействие сложных кислот и воды
При наличии минеральной кислоты и при нагревании из сложных эфиров можно синтезировать карбоновые кислоты.
Синтез муравьиной кислоты путем взаимодействия щелочи и угарного газа
Реакция проводится при повышенном давлении.
Синтез карбоновых кислот с помощью реактивов Гриньяра
Из реактивов Гриньяра (алкилгалогенидов магния)при взаимодействии с углекислым газом и дальнейшем гидролизе получают карбоновые кислоты.
R-COO-MgBr + H2O →R-COOH + Mg(OH)Br
Физические свойства карбоновых кислот
Карбоновые кислоты с одним, двумя и тремя атомами углерода в цепи в нормальных условиях –легкоподвижные жидкости с резким запахом. Соединения с четырьмя-девятью атомами углерода в цепи – жидкости с неприятным запахом, а последующие по гомологическому ряду соединения – твердые вещества без запаха. Агрегатное состояние всех ненасыщенных карбоновых кислот в обычных условиях – жидкое, а дикарбоновых и ароматических – кристаллическое.
Первые три представителя гомологического ряда растворяются с водой в любых соотношениях. По мере увеличения углеродной цепи эта способность падает. Также по гомологическому ряду карбоновых кислот температура кипения и плавления увеличивается, а запах ослабевает. Наличие кратных связей характеризуется меньшими температурами плавления и кипения.
Высокие температуры плавления и кипения связаны с тем, что между молекулами формируются водородные связи. Такая связь более прочная, т.к. она образуется между водородом гидроксильной группы одного соединения и карбонильным кислородом другого.
Физические свойства представителей карбоновых кислот
Муравьиная кислота (НСООН) – прозрачная жидкость с характерным запахом. Температура кипения – +101˚С. Она содержится в выделениях муравьев, соке крапивы и хвое ели. На листьях крапивы находятся иголки с муравьиной кислотой, которые при соприкосновении с кожей ломаются и кислота проникает в организм. Муравьиная кислота оказывает раздражающее действие.
Молекула муравьиной кислоты
Пальмитиновая и стеариновая кислоты – твердые белые вещества. Они нерастворимы в воде, но немного растворимы в органических растворителях.
Молекулы пальмитиновой и стеариновой кислот
Бензойная кислота (С6Н5СООН) – ароматическая кислота, которая легко возгоняется, без превращения в жидкое состояние. Температура плавления – 122,4˚С. При понижении температуры ее пары преобразуются в кристаллы. Для бензойной кислоты характерна низкая растворимость в холодной воде, но высокая – в органических растворителях. Применяется для очистки веществ от примесей от загрязнений.
Молекула бензойной кислоты
Химические свойства карбоновых кислот
Для карбоновых кислот не свойственны реакции присоединения.
Кислотные свойства
Реакция замещения гидроксильной группы карбоновой кислоты
Для проведения реакции необходима минеральная кислота.
Замещение атома водорода при ближайшем к карбоксильной группе углеродном атоме
Для взаимодействия карбоновых кислот с галогенами необходим красный фосфор.
Применение карбоновых кислот
Для муравьиной кислоты характерны антибактериальные свойства, поэтому она применяется в промышленном производстве. Например, потребителям она известна как добавка Е236. Она используется в консервации кондитерских изделий, молочных продуктов, безалкогольной продукции.
Применение муравьиной кислоты
Уксусная кислота применяется при получении красителей, лекарственных препаратов, растворителей лаков. В пищевой промышленности она известна как добавка Е260. Часто она используется при консервации различной продукции.
Применение уксусной кислоты
Масляная (бутановая) кислота используется при лечении заболеваний ЖКТ. Она в кишечнике образует кислую среду, которая подавляет развитие патогенных бактерий. Соли бутановой кислоты применяются в качестве кормовых добавок для животных. Они улучшают иммунную систему, пищеварение, подавляют деятельность многих вредных кишечных микроорганизмов, уменьшают необходимость применения антибиотиков и лекарственных средств.
Молекула масляной кислоты
Щавелевая кислота – непредельная двухосновная карбоновая кислота. Она применяется в синтезе красителей, чернил, пластмасс и т.д. Обладает дезинфицирующими и отбеливающими свойствами, поэтому часто добавляется в синтетические моющие средства. Соли щавелевой кислоты можно синтезировать из листьев щавеля, кислицы, ревеня. В пищевой промышленности практически не используется, т.к. щавелевая кислоты образует в организме человека труднорастворимые соли, которые откладываются в виде камней в почках и мочевом пузыре.

Карбоновые кислоты
Ключевые слова конспекта: Карбоновые кислоты. Предельные одноосновные карбоновые кислоты. Муравьиная кислота. Уксусная кислота.
Понятие и формулы карбоновых кислот
Органические вещества, содержащие в молекуле карбоксильную группу, связанную с углеводородным радикалом, называют карбоновыми кислотами .

Органических кислот великое множество. Мы будем знакомиться с предельными одноосновными карбоновыми кислотами, в молекулах которых с предельным углеводородным радикалом связана одна карбоксильная группа. Общая формула этих кислот СnН2n+1СООН, или RCOOH.
Однако в молекуле первого представителя гомологического ряда предельных одноосновных карбоновых кислот вместо углеводородного радикала с карбоксильной группой связан атом водорода. Эту кислоту называют муравьиной кислотой, её формула НСООН.
Формулы, а также тривиальные и международные названия некоторых представителей гомологического ряда предельных одноосновных карбоновых кислот приведены в таблице.
Физические свойства и способы получения карбоновых кислот
Низшие карбоновые кислоты — жидкости с резким запахом, хорошо растворимые в воде. По мере роста углеводородного радикала растворимость кислот падает, температуры кипения и плавления увеличиваются. Пальмитиновая и стеариновая кислоты — твёрдые вещества, нерастворимые в воде.

Основным способом получения карбоновых кислот служат реакции окисления. Исходные вещества в подобных синтезах — спирты и альдегиды:
Пищевую уксусную кислоту получают биотехнологическим путём — сбраживанием сахарсодержащих растворов при действии особых микроорганизмов.
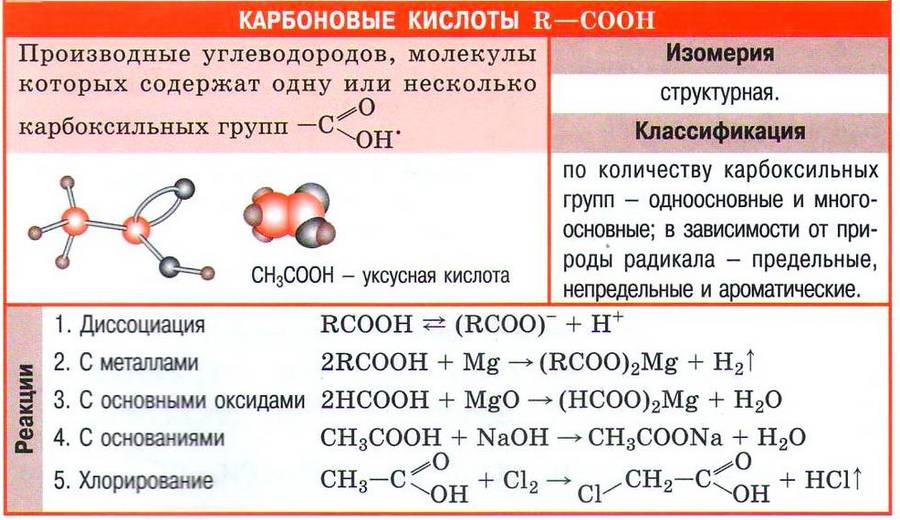
Химические свойства карбоновых кислот

Следует учесть, что химические свойства карбоновых кислот, как и кислот неорганических, обусловлены их способностью диссоциировать с образованием катиона водорода:
Почему же в уравнении электролитической диссоциации соляной кислоты ставится знак равенства, а в аналогичном уравнении для уксусной кислоты — знак обратимости? Дело в том, что в отличие от соляной кислоты уксусная является слабой, распаду на ионы в водном растворе подвергается только небольшая часть её молекул.
Благодаря наличию в растворе катионов водорода карбоновые кислоты проявляют все характерные для кислот свойства: имеют кислый вкус, изменяют окраску индикаторов, реагируют с активными металлами, основными и амфотерными оксидами, основаниями, солями. Рассмотрим свойства карбоновых кислот на примере уксусной кислоты СН3СООН.

Уксусная кислота реагирует с активными металлами с образованием солей (ацетатов) и выделением водорода:

Оксиды металлов реагируют с уксусной кислотой с образованием соли металла и воды:

При взаимодействии уксусной кислоты со щелочами или нерастворимыми в воде основаниями также образуются соль и вода:

Одно из важнейших химических свойств карбоновых кислот вам уже знакомо. В присутствии концентрированной серной кислоты в качестве катализатора кислоты реагируют со спиртами, образуя сложные эфиры. Сама реакция вам уже знакома, это реакция этерификации. Так, в результате взаимодействия уксусной кислоты и этилового спирта образуется сложный эфир — этиловый эфир уксусной кислоты:
Нахождение в природе и применение карбоновых кислот
Карбоновые кислоты широко распространены в природе. Они содержатся во фруктах и ягодах, не только придавая им кисловатый вкус, но и предохраняя их от порчи и поражения вредителями.
Муравьиная кислота выделяется железами внутренней секреции муравьёв и некоторых видов медуз. Жжение листьев крапивы также обусловлено раздражением кожи муравьиной кислотой.
Области применения карбоновых кислот в промышленности, в технике и технологии, в быту также весьма обширны. Муравьиную кислоту применяют для протравливания текстиля и бумаги, обработки кожи, получения лекарственных средств, как консервант фруктовых соков и зелёных кормов. Она входит в состав средства для местной анестезии. Её также используют при крашении тканей и бумаги.
Уксусную кислоту используют как приправу к пище, как растворитель лаков, для производства лекарственных средств, например аспирина, для получения пластмасс, ядохимикатов, красителей. В продаже встречается уксусная эссенция — 70%-ный раствор уксусной кислоты. С кислотой такой концентрации необходимо обращаться очень осторожно! Её пары могут вызвать ожоги дыхательных путей, а употребление внутрь неразбавленной уксусной эссенции смертельно опасно. Хранить эссенцию нужно в месте, недоступном для детей и домашних животных.


Карбоновые кислоты — это производные углеводородов, в молекулах которых содержится одна или несколько карбоксильных групп:

Карбоксильная группа имеет сложный состав. Она состоит из карбонильной и гидроксильной (гидроксо) групп:

Карбоновые кислоты часто встречаются в природе, придавая ягодам и фруктам, а также некоторым другим продуктам питания кислый вкус. Их делят на различные группы (классы) по некоторым признакам:
- По строению (составу) углеводородного радикала кислоты делят на:

в углеводородном радикале только простые связи;
– Непредельные (в углеводородном радикале есть кратная связь);

в углеводородном радикале есть кратная связь;

имеется бензольное кольцо.
Задание 24.1. Определите состав этих кислот.
Для того чтобы различить по составу предельные и непредельные кислоты, нужно умножить на два число атомов углерода в углеводородном радикале и сравнить полученную величину (С) с числом атомов водорода (В) в углеводородном радикале:
- у предельных кислот В > C, например для С3Н7СООН: В = 7, а С = 3 · 2 = 6;
- у непредельных кислот B Гомологический ряд, номенклатура, изомерия
Предельные одноосновные карбоновые кислоты образуют гомологический ряд с общей формулой:

Вопрос. По какому принципу составляются названия кислот?
Для того чтобы составить название кислоты, нужно:
Задание 24.3. Назовите по ИЮПАК пропионовую и масляную кислоты.
Если вы выполнили вышеизложенные правила, у вас получилось: пропановая кислота, бутановая кислота.
Начиная с n = 3, у кислот появляются изомеры. Изомерия предельных кислот связана со строением углеводородного радикала:

Задание 24.4. Составьте молекулярные формулы этих кислот и убедитесь, что это изомеры.

Строение молекул
В состав карбоксильной группы входит гидроксогруппа ОН.
Вопрос. В каких соединениях встречается функциональная группа ОН?
Такая же группа входит в состав молекул спиртов. Спирты проявляют очень слабые кислотные свойства, могут вступать в реакции только с очень активными, щелочными металлами, не изменяют окраску индикатора, не реагируют с растворами щелочей.
Если в раствор карбоновой кислоты добавить индикатор (лакмус), то раствор окрасится в красный цвет. Это означает, что кислоты проявляют более кислые свойства, чем спирты. Почему? Потому что карбонильная группа, которая расположена рядом с гидроксогруппой, влияет на неё.

Таким образом, карбонильная группа увеличивает полярность связи О–Н, делая её более полярной. Поэтому атом водорода карбоксильной группы становится очень подвижным. Он легко замещается на атом металла, способен отщепляться в растворах: кислоты диссоциируют:

Гидроксогруппа тоже влияет на карбонильную группу, делая ее неактивной, поэтому кислоты не участвуют в реакциях с разрывом π-связи карбонильной группы.
Карбоксильная группа влияет на углеводородный радикал, делая некоторые связи С–Н в нём более полярными, и кислоты могут участвовать в реакциях замещения атомов водорода радикала.

Свойства кислот
Физические свойства
Кислоты с небольшим числом атомов углерода (1–10) — жидкости с резким запахом. Вкус у них разный — уксусная кислота — кислая, а масляная — горькая. Низшие кислоты растворимы в воде, причём с увеличением длины радикала их растворимость ухудшается.
Например, уксусная кислота — бесцветная жидкость с резким запахом. Смешивается с водой в любых соотношениях. 60…90 %-ные растворы уксусной кислоты (уксусная эссенция) опасны для жизни, в то время как 6…8 %-ные растворы столового уксуса широко применяются при приготовлении пищи.
Химические свойства
Кислоты проявляют все свойства неорганических кислот.
Вопрос. Какие свойства кислот вам известны?
Кислоты реагируют с металлами, которые стоят в ряду напряжений до водорода:

При составлении таких реакций следует помнить, что
- кислотный остаток — это часть молекулы кислоты без подвижного атома водорода; в данном случае это: С3Н7СОО;
- валентность кислотного остатка равна числу замещённых атомов водорода, в данном случае замещается один атом водорода и валентность равна I;
- исходя из этого, нужно переписать после реакции кислотный остаток, взять его в скобки и за скобками поставить цифру, равную валентности металла, а затем записать символ самого металла.
В результате такой реакции образуется соль и выделяется водород.
Кислоты реагируют с основными и амфотерными оксидами:

В этом случае образуется соль и вода. Такие же продукты реакции образуются при взаимодействии кислоты и основания:

Большинство карбоновых кислот — слабые кислоты. Тем не менее они могут вытеснять более слабые кислоты из их солей:

Итак, во всех этих реакциях образуются соли. Названия солей происходят от латинских названий кислот. Запомните эти названия!
Задание 24.5. Составьте для известных Вам карбоновых кислот таблицу по схеме:

Названия солей см. выше (в уравнениях химических реакций).
Кислоты могут реагировать со спиртами, в результате получаются сложные эфиры:

Это реакция этерификации. Она происходит в присутствии концентрированной серной кислоты. (Подробнее о названиях и свойствах сложных эфиров см. урок 25.)
Кислоты могут реагировать с галогенами за счёт углеводородного радикала, при этом на атом галогена замещается атом водорода у ближайшего к карбоксильной группе атома углерода (это α-углеродный атом):


Получение и применение кислот
Кислоты можно получить при помощи окисления соответствующего альдегида:

Задание 24.6. Какой альдегид нужно взять для получения уксусной кислоты? 2-метилпропановой кислоты? Составьте уравнения реакций.
Вопрос. В каких условиях происходят процессы окисления альдегидов? Являются ли эти реакции качественными на альдегидную группу?
Кислоты применяются для получения душистых веществ, растворителей, входят в состав лекарств. Наибольшее применение получила ледяная (безводная) уксусная кислота, которая используется в технических целях (для получения лекарств, ацетатного шёлка, растворителей). В магазине можно купить и пищевую уксусную кислоту (70 %-ный раствор), и уксус (6 %-ный раствор). Концентрированная уксусная кислота — яд! Она вызывает тяжёлые ожоги внутренних органов, разрушает кровь. Её следует разбавлять водой до безопасных 5–7 % (примерно 1:10). Столовый уксус используют при приготовлении пищи. Его получают из глюкозы по схеме:

Некоторые (жирные) кислоты входят в состав жиров (см. урок 25).

Выводы
Кислоты — это производные углеводородов, содержащие карбоксильную группу. Для них характерны реакции:
- замещения атома Н карбоксильной группы (с металлами);
- обмена (с оксидами, гидроксидами, солями);
- этерификации (со спиртами);
- замещения атома Н радикала (с галогенами).
Кислоты входят в состав различных овощей, фруктов и других пищевых продуктов. Используются при приготовлении пищи, например уксус.
Сертификат и скидка на обучение каждому участнику

Тема: Карбоновые кислоты
Карбоновые кислоты – производные углеводородов, содержащие функциональную группу – СООН (карбоксил).
Карбоксильная группа представляет собой сочетание гидроксильной и карбонильной групп:
Классификация. В зависимости от числа карбоксильных групп в молекуле карбоновые кислоты подразделяют на:
одноосновные (монокарбоновые), содержащие одну rpy ппу — СООН, например:
СНз - СООН СН 3 -СН 2 -СН 2 -СООН
этановая кислота бутановая кислота
двухосновные (дикарбоновые), содержащие две групп - СООН, например:
щавелевая кислота янтарная кислота
В зависимости от природы, углеводородного радикала раз личают кислоты:
предельные — производные алканов, например:
непредельные — производные алкенов и других ненасыщенных углеводородов, например:
ароматические — производные бензола, содержащие одну или несколько карбоксильных групп, непосредственно связанных (в отличие от ароматических спиртов) с углеродными атомами бензольного ядра.
По числу углеродных атомов в углеводородном радикале различают кислоты низшие (до С 10 ) и высшие (свыше С 10 ).
Предельные одноосновные карбоновые кислоты
Предельные одноосновные карбоновые кислоты — это производные алканов, в молекулах которых один атом водорода замещен на карбоксильную группу . Общая формула веществ этого C m H 2 m О 2
Исключением является муравьиная кислота, в молекуле которой карбоксильная группа связана не с углеводородным радикалом, а с атомом водорода: Н—СООН.
Номенклатура, изомерия кислот и строение карбоксильной группы
Наиболее распространенные предельные монокарбоновые кислоты
Изомерия. Для монокарбоновых кислот возможны следующие виды структурной изомерии: — изомерия углеродной цепи. Она начинается с бутановой кислоты (С > 4), которая существует в виде двух изомеров: бутановая (масляная) кислота и 2-метилпропановая (изомасляная) кислота;
— межклассовая изомерия. Одноосновные карбоновые кислоты изомерны сложным эфирам.
Строение. Карбонильная ( С = О) и гидроксильная (- ОН) группы, входящие в состав карбоксильной группы, оказывают взаимное влияние друг на друга.
Влияние карбонильной группы. Углерод карбонильной группы несет частичный положительный заряд и притягивает к себе электроны атома кислорода гидроксильной группы. Вследствие смещения электронной плотности полярность связи О - Н увеличивается настолько, что атом водорода способен отщепляться в виде иона Н + . Поэтому карбоновые кислоты — более сильные кислоты, чем спирты.
Влияние гидроксильной группы. Смещение электронов от гидроксильной группы к карбонильной понижает частичный положительный заряд на атоме углерода. Поэтому карбонильная группа в кислотах, в отличие от альдегидов и кетонов, теряет способность к реакциям присоединения. Следовательно, для кислот не характерны реакции присоединения по двойной связи.
1. Вещество, которое относится к предельным монокарбоновым кислот это.
2. Составьте электронную формулу уксусной кислоты и поясните, как происходит перекрывание и сдвиг электронных плотностей при образовании химических связей в карбоксильной группе.
3. Связь О-Н в молекулах кислот по сравнению со спиртами:
а) менее полярная; в) по полярности не отличается;
б) более полярная; г) неполярная.
4. Напишите структурные формулы возможных изомерных кислот и сложных эфиров, соответствующие формуле С 4 Н 8 О 2 . Назовите их.
Химические свойства. Предельные одноосновные кислоты – химически активные соединения, что обусловлено наличием карбоксильной группы. Для них характерны реакции, протекающие с разрывом связей О - Н и С - О (замещение группы -ОН), а также реакции замещения атома водорода у а - углеродного атома.
I. Реакции с разрывом связи О - Н
Карбоновые кислоты, по сравнению со спиртами, обладают лее выраженными кислотными свойствами, что обусловлено повышенной подвижностью атома водорода карбоксильной группы, свойствам они сходны со слабыми минеральными кислотами.
1. Диссоциация кислот. В водном растворе монокарбоновые кислоты обратимо диссоциируют с образованием катиона водорода и аниона кислотного остатка:
Карбоновые кислоты являются слабыми электролитами. Равновесие процесса ионизации сильно смещено влево. Но тем не менее их растворы изменяют окраску индикаторов, имеют кислый вкус, проводят электрический ток, они образуют соли.
2. Образование солей. Карбоновые кислоты, подобно неорганическим кислотам, вступают в реакции:
- с металлами, стоящими в электрохимическом ряду напряжений до водорода
2НСООН + Mg ( HCOO ) 2 Mg + Н 2
- с основаниями — реакция нейтрализации
- с основными и амфотерными оксидами
2 CH 3 COOH + ZnO ( CH 3 COO ) 2 Zn + Н 2 О
- с солями, образованными более слабыми и летучими кислотами, как неорганическими
так и органическими
Карбоновые кислоты являются слабыми кислотами, поэтому их соли в водном растворе легко гидролизуются:
KCH 3 C ОО + H 2 О CH 3 COOH + КОН
Сильные неорганические кислоты вытесняют карбоновые кислоты из их солей:
П оявление запаха уксусной кислоты является качественной реакцией на ацетат-ион (СН 3 СОО - ).
Реакции с разрывом связи С – О
При замещении группы — ОН в карбоновых кислотах на другие заместители образуются функциональные производные кислот.
Сложные эфиры — продукты замещения гидроксильной группы на остаток - OR . Они образуются при нагревании органической кислоты со спиртом в присутствии концентрированной серной кислоты (известная вам реакция этерификации). Me ханизм этой реакции был установлен методом меченых атомов. С этой целью использовали спирт, меченный изотопом кислорода 18 О. После реакции изотоп кислорода был обнаружен в молекуле сложного эфира:
метилацетат (метиловый эфир укс. кис-ты)
Следовательно, в реакции этерификации кислота отдает группу ОН, а спирт — атом Н (образуется вода). Реакция этерификации обратима. Серная кислота в этой реакции одновременно оказывает каталитическое действие и способствует смещению равновесия в сторону продуктов реакции за счет связывания воды.
Получение и применение карбоновых кислот.
Карбоновые кислоты широко распространены в природе. Муравьиная кислота в крапиве и хвое ели, ее выделяют муравьи. Ожог крапивой или медузой – это результат раздражающего действия муравьиной кислоты. Несмотря на это, получение карбоновых кислот из природных источников практического значения не имеет. Основным источником получения карбоновых кислот является органический синтез.
Общие способы получения кислот.
Окисление первичных спиртов и альдегидов. В качестве окислителей используют перманганат и дихромат калия, кислород и др.
R – СН 2 – ОН +(О) R – С +(О) R - С
спирт -Н 2 О Н ОН
Поскольку альдегиды легко превращаются в кислоты, то кислоты могут быть получены непосредственно окислением спиртов:
R – СН 2 – ОН + 2(О) R – СООН + Н 2 О
Стеариновую и пальмитиновую кислоты получают продуванием воздуха в расплавленный парафин, в который добавляют оксиды марганца в качестве катализатора:
Уксусная кислота. Кроме вышеуказанных методов, уксусную кислоту получают и специфическими способами, например оксосинтезом (карбонилирование метанола). Реакцию осуществляют пропусканием оксида углерода (II) под давлением через нагретый метанол:
СН 3 ОН + СО t , p , кат. СН 3 СООН
Для пищевых целей уксусную кислоту получают ферментативным брожением (окислением) жидкостей, содержащих спирт (вино, пиво):
Уксусная кислота представляет собой бесцветную прозрачную жидкость с характерным резким запахом. Безводная уксусная кислота при температуре +16,6 °С затвердевает в кристаллическую массу, напоминающую кристаллы льда, поэтому ее называют ледяной уксусной кислотой. С водой она смешивается в любых соотношениях. Водные растворы кислоты поступают в продажу под названием столового уксуса (3—9%-ный раствор) и уксусной эссенции (70—80%-ный раствор).
Ледяная и концентрирован ная уксусная кислоты при попадании на кожу вызываем ожоги.
Из карбоновых кислот уксусная кислота находит наибольшее применение. Кислоту и ее производные (в особенности уксусный ангидрид) широко используют в химической промышленности для получения искусственного волокна, пластических масс, негорючей кинопленки, красителей, медикаментов и т. д. Солями уксусной кислоты протравливают ткани при крашении, они способствуют закреплению красителей на волокне Ацетат свинца применяют для изготовления свинцовых белил и свинцовой примочки в медицине. В пищевой промышленности уксусную кислоту применяют для консервирования продуктов и в виде уксуса. Ряд сложных эфиров уксусной кислоты используют в кондитерском производстве.
Высшие карбоновые кислоты — это кислоты, у которых в радикале свыше десяти углеродных атомов . Из высших предельных монокарбоновых кислот наибольшее значение имеют пальмитиновая (гексадекановая) С 15 Н 31 СООН и стеариновая (окта декановая) С 17 Н 35 СООН кислоты. Углеводородные радикалы в их молекулах содержат неразветвленную цепь из пятнадцати и семнадцати атомов углерода, соединенных о-связями. Они входят в состав твердых жиров. Получают эти кислоты каталитическим окислением парафина или гидролизом жиров. В настоящее время пальмитиновую и стеариновую кислоты используют главным образом для производства мыла — натриевых и калиевых солей этих кислот (стеараты и пальмитаты), для изготовления стеарина, который идет на производство стеариновых свечей.
1. Для борьбы с сорняками в сельском хозяйстве используют 2,2-дихлор-
пропановую кислоту и натриевую соль трихлоруксусной кислоты. Составьте их структурные формулы.
2. Рассчитайте, какой объем уксусной эссенции (р = 1,07 г/см 3 ) потребуется для приготовления 500 см 3 столового уксуса (р = 1,007 г/см 3 ). Массовая доля уксусной кислоты в уксусной эссенции равна 80%, в столовом уксусе — 6%.
3. Масса раствора с массовой долей уксусной кислоты 90%, полученного при окислении 5,6 л бутана (н. у.) кислородом воздуха с практическим выходом кислоты 60%, составляет . г:
а) 150; б) 200; в) 250; г) 175.
4. Окислением 7,2 г пропанола-1 получена пропионовая кислота, на нейтрализацию которой потребовалось 16,4 см 3 раствора с массовой долей гидроксида натрия 20% (р=1,22 г/см 3 ). Рассчитайте выход пропионовой кислоты.
5. Напишите уравнения реакций, при помощи которых можно получить уксусную кислоту, имея в своем распоряжении воду, воздух, уголь и известняк.
6. Вычислите, какая масса карбоната кальция с массовой допей примесей 10% необходима для получения (по вышеуказанной схеме) конечного продукта Х 5 массой 5,4 г, если массовая доля его выхода составляет 90%.
Двухосновные, непредельные и ароматические кислоты
Двухосновные, или дикарбоновые кислоты содержат в молекуле две карбоксильные группы. Общая формула этих кислот:
Простейшим представителем этого ряда кислот является щавелевая кислота НООС—СООН . Это кристаллическое, хорошо растворимое в воде вещество. Щавелевая кислота и ее соли (оксалаты) широко распространены в природе, они содержатся в щавеле, смородине, кислице, апельсинах и других растениях.
Дикарбоновые кислоты более сильные, чем соответствующие им (по числу углеродных атомов) монокарбоновые. Например, щавелевая кислота сильнее уксусной почти в 200 раз. Это объясняется взаимным влиянием карбоксильных групп.
Двухосновные кислоты вступают в те же реакции, которые характерны для одноосновных кислот. При этом они образу! два ряда производных, в зависимости от того, участвуют од или две карбоксильные группы. Так, они образуют кислые средние соли, кислые и полные эфиры:
Специфическими свойствами щавелевой кислоты являют разложение при нагревании в присутствии концентрированной серной кислоты:
На восстановительных свойств основано применение щавелевой кислоты для отбеливания древесины, тканей, удаления чернильных пятен, ржавчины, в кожевенном и красильном производстве и т. п.
Непредельные кислоты — это производные непредельных углеводородов. Наибольшее значение имеет непредельные кислоты с двойными связями. Общая формул непредельных кислот, содержащих одну двойную связь:
Для них характерны такие же типы изомерии, как и для непредельных углеводородов.
Из низших непредельных кислот наибольшее значение имеют акриловая (пропеновая) кислота:
Простейшей одноосновной ароматической кислотой является бензойная кислота С 6 Н 5 СООН. В промышленности ее получают каталитическим окислением толуола кислородом воздуха при повышенных температуре и давлении в присутствии катализатора.
Бензойная кислота — бесцветное кристаллическое вещество, плохо растворимое в холодной воде, хорошо — в горячей воде. Она является более сильной кислотой, чем одноосновные карбоновые кислоты алифатического ряда (за исключением муравьиной кислоты).
Благодаря сильному антисептическому действию и не ток сичности бензойную кислоту применяют как консервант в пи щевой промышленности (добавка 0,1% к соусам, рассолам, фруктовым сокам, мясному фаршу и др.), антисептик в медицине (главным образом в дерматологии), парфюмерии и косметике. Используют в производстве синтетических волокон, красителей, лекарственных веществ.
Читайте также:

