Как сделать из zn zncl2
Обновлено: 02.07.2024
Цель работы: качественные реакции обнаружения различных ионов с целью их последующей идентификации из смеси.
Приборы и реактивы: штатив с пробирками, стеклянная палочка с впаянной платиновой проволокой, спиртовка, соли цинка и алюминия.
О п ы т 1. Обнаружение Zn 2+ -ионов
1. Реакция с сероводородом или растворимым сульфидом. Сероводород или растворимый сульфид с ионами Zn 2+ образует белый осадок сульфида цинка ZnS:
Сульфид цинка растворяется в минеральных кислотах. Из приведенного уравнения видно, что при реакции образуется соляная кислота, поэтому сероводород не может полностью осадить цинк. Осаждение иона Zn 2+ будет практически полным, если к раствору соли цинка добавить ацетат натрия, а затем пропустить сероводород. В присутствии ацетата натрия вместо сильной кислоты НСl образуется слабая уксусная кислота.
Выполнение реакции. К исследуемому раствору объемом 1 cм 3 добавляют раствор ацетата натрия объемом 1 cм 3 и сероводородной воды объемом 1 cм 3 . Наблюдают выделение белого осадка сульфида цинка.
2. Реакция со щелочами. Едкие щелочи с катионом Zn 2+ образуют белый осадок гидроксида цинка Zn(OH)2, который обладает амфотерными свойствами и поэтому растворяется в кислотах и щелочах.
Тетрагидроксоцинкат натрия Na2[Zn(OH)4] при нагревании разлагается:
Цинкаты, в отличие от алюминатов, при действии NH4Cl осадка не образуют, так Zn(OH)2 растворяется в солях аммония.
Выполнение реакции. Поместите в пробирку 1–2 cм 3 раствора соли цинка и прилейте несколько капель 2 н раствора щелочи. При этом выпадает белый творожистый осадок. Проверить поведение осадка под действием кислот и щелочей.
3. Реакция с аммиаком. Аммиак образует с катионом Zn 2+ осадок гидроксида, который растворяется в избытке аммиака и в солях аммония с образованием комплексного соединения [Zn(NH3)6](ОН)2:
Выполнение реакции. Поместите в пробирку 1–2 cм 3 раствора соли цинка и прилейте несколько капель раствора аммиака. При этом выпадает осадок. Проверить поведение осадка под действием аммиака или солей аммония.
4. Реакция с карбонатами щелочных металлов. Карбонаты щелочных металлов и аммония образуют с катионом Zn 2+ белый осадок основной соли переменного состава:
Состав основной соли зависит от концентрации раствора и от температуры.
Выполнение реакции. Поместите в пробирку 1–2 cм 3 раствора соли цинка и прилейте несколько капель раствора карбоната натрия, калия или аммония. При этом выпадает белый осадок.
5. Реакция с желтой кровяной солью. Гексациано-II-Ферат калия K4[Fe(CN)6] образует с катионом Zn 2+ белый осадок ферроцианида цинка и калия этот осадок нерастворим в кислотах, а растворяется в щелочах с образованием цинката:
Эта реакция дает возможность отделить катионы цинка от катионов алюминия.
Выполнение реакции. Поместите в пробирку 1–2 cм 3 раствора соли цинка и прилейте несколько капель желтой кровяной соли. При этом выпадает белый осадок. Проверить поведение осадка под действием кислот и щелочей.
О п ы т 2. Обнаружение Аl 3+ -ионов
1. Реакция со щелочами. Едкие щелочи с ионами А1 3+ образуют белый осадок гидроксида алюминия, который обладает амфотерными свойствами и растворяется в избытке щелочи и кислотах:
При растворении гидроксида алюминия в щелочах образуется комплексное соединение, которое может иметь переменный состав [NaAl(OH)4] или Na3[Al(OH)6]
Комплексный ион [Al(OH)4] - ‑ это ион АlO2 - , гидратированный двумя молекулами воды.
Алюминаты как соли слабых кислот гидролизуются:
Для предупреждения реакции гидролиза, в растворе должна быть большая концентрация гидроксид-ионов, и наоборот, чтобы гидролиз довести до конца, надо связать ионы ОН - , это достигается добавлением твердой соли NH4C1. Когда к алюминату добавляют хлорид аммония, равновесие реакции гидролиза нарушается и выпадает осадок:
Реакция гидролиза алюмината характерна для обнаружения ионов алюминия.
Выполнение реакции. К исследуемому раствору объемом 0,5 мл добавляют по каплям раствор едкого натра до тех пор, пока осадок А1(ОН)3, образовавшегося не растворится. К прозрачному раствору добавляют небольшими порциями твердый хлорид аммония, смесь кипятят. В присутствии А1 3+ выпадает белый осадок гидроксида алюминия.
2. Реакция с аммиаком. Аммиак осаждает из растворов солей алюминия белый осадок Al(OH)3, который немного растворяется в избытке NH4OH.
Выполнение реакции. Поместите в пробирку 1–2 cм 3 раствора соли алюминия и прилейте несколько капель раствора аммиака. При этом выпадает осадок. Проверить поведение осадка под действием аммиака.
Ионы Fe 3+ , Cu 2+ , Вi 3+ т.д. мешают реакции А1 3+ с ализарином, они образуют окрашенные осадки.
Реакцию обнаружения А1 3+ ализарином лучше проводить в слабокислом растворе (рН = 4,2-4,6) ‑ в этих условиях ализарин имеет желтый цвет. В щелочной среде фиолетовый цвет самого ализарина маскирует красный цвет алюминиевого комплекса и влияет на результаты анализа.
Выполнение реакции. К исследуемому раствору объемом 0,5 см 3 добавляют 2 н раствор едкого натра до сильнощелочной реакции. Если выпадает осадок (присутствуют ионы Fe 3+ , Сu 2+ > Вi 3+ ), его отделяют и к прозрачному раствору каплями добавляют 0,2-процентный раствор ализарина объемом 0,5 см 3 , сначала появляется фиолетовое окрашивание, затем добавляют каплями 2 н раствор уксусной кислоты до тех пор, пока не исчезнет фиолетовая окраска. В присутствии алюминия (в зависимости от концентрации) раствор окрашивается в красный цвет или выпадает красный осадок.
Реакцию обнаружения катионов А1 3+ ализарином можно выполнить капельным методом. На полоску фильтровальной бумаги наносят каплю раствора гексациано-II-ферраты калия K4[Fe(CN)6] и в центр образованной пятна добавляют каплю исследуемого раствора. Если в исследуемом растворе присутствуют ионы Cr 3+ , Zn 2+ , Fe 3+ , Mn 2+ , Co 2+ , Ni 2+ и т.д., все они осаждаются в виде ферроцианидов и остаются в центре пятна, а ионы А1 3+ по капиллярам перемещаются дальше. Фильтровальная бумага с пятном держат над пробиркой с аммиаком и внешнюю зону пятна смачивают ализарином. Бумага высушивают, а внешнюю зону пятна смачивают 1 н раствором уксусной кислоты. В присутствии Аl 3+ появляется розовое кольцо.
Ионы Zn 2+ мешают этой реакции, так с солями кобальта при прокаливании образуют зеленое соединение.
Выполнение реакции. Полоску фильтровальной бумаги смачивают исследуемым раствором, а затем 2-3 каплями раствора нитрата кобальта. В присутствии алюминия зона бумаги, смоченной исследуемым раствором, окрашивается в синий цвет.
О п ы т 3. Обнаружение Zn 2+ - и Аl 3+ -ионов
К четвертой группе относятся катионы Zn 2+ , Al 3+ , Sn 2+ , Sn (IV), As (III), As (V), которые образуют амфотерные гидроксиды (за исключением мышьяка). Групповым реактивом на эти катионы есть избыток едкой щелочи.
Амфотерные гидроксиды, образованные катионами четвертой группы, способные диссоциировать в растворе как основания и как кислоты:
Кислоты уменьшают диссоциацию амфотерных гидроксидов как кислот, а щелочи ‑ как оснований:
Алюминаты и хромиты устойчивые только в присутствии избытка щелочи.
Большинство солей катионов четвертой группы гидролизуются:
Для всех катионов четвертой группы (за исключением мышьяка) характерна реакция с едкими щелочами, при этом образуются гидроксиды, растворимые в избытке реактива.
Выполнение реакции. В две пробирки наливают растворы хлорида алюминия и хлорида цинка объемами по 0,5 см 3 . В каждую из пробирок добавляют раствор гидроксида натрия объемами по 0,5 см 3 , перемешивают и наблюдают образование осадков, обращают внимание на цвет осадков. Затем в каждую пробирку вливают еще щелочь объемами по 1 см 3 , содержимое пробирок перемешивают и проверяют растворимость осадков в избытке реактива.
Растворимые карбонаты (Na2CO3, К2СО3) осаждают катион А1 3+ в виде гидроксида, катион Zn 2+ ‑ в виде основной соли.

Хлори́д ци́нка (хлористый цинк, дихлорид цинка, паяльная кислота) — химическое соединение цинка с хлором, имеющее формулу ZnCl2.
Содержание
Свойства
Физические свойства
Химические свойства
Концентрированные растворы имеют кислую среду.
Получение
- растворение цинка или его окиси в соляной кислоте с последующим выпариванием растворов
- нагревание жидкого цинка в токе хлора
Применение
- ситцепечатание
- изготовление зубных цементов
- антисептическая пропитка дерева (например, шпал) перед пайкой
- компонент при производстве фибры
- рафинирование расплавов цинковых сплавов
- фракционный анализ угольных проб
- в батарейках
См. также
Литература
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Hg2 2+ | Pb 2+ | Sn 2+ | Cu + | Cu 2+ | |
| OH − | P | P | P | — | P | М | Н | М | Н | Н | Н | — | Н | Н | Н | Н | Н | — | — | Н | Н | Н | Н | |
| F − | P | Н | P | P | Р | М | Н | Н | М | Р | Н | Н | Н | Р | Р | М | Р | Р | М | М | Н | Р | Н | Р |
| Cl − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | Н | М | — | Н | Р |
| Br − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | Н | М | Р | H | Р |
| I − | P | P | P | P | Р | Р | Р | Р | Р | Р | ? | Р | — | Р | Р | Р | Р | Н | Н | Н | Н | М | Н | — |
| S 2− | P | P | P | P | — | Р | М | Н | Р | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| SO3 2− | P | P | P | P | Р | М | М | М | Н | ? | ? | М | ? | Н | Н | Н | М | Н | Н | Н | Н | ? | Н | ? |
| SO4 2− | P | P | P | P | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Н | Р | Р | Р |
| NO3 − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | — | Р | Р |
| NO2 − | P | P | P | P | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? | ? | ? |
| PO4 3− | P | Н | P | P | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | ? | Н | Н | Н | Н |
| CO3 2− | М | Р | P | P | Р | Н | Н | Н | Н | — | — | Н | — | Н | Н | — | Н | Н | — | Н | — | — | ? | — |
| CH3COO − | P | Р | P | P | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | М | Р | — | Р | Р |
| CN − | P | Р | P | P | Р | Р | Р | Р | Р | ? | Н | Н | — | Н | Н | Н | Н | Н | Р | Н | Р | — | — | Н |
| SiO3 2− | H | Н | P | P | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | ? | Н | ? | ? | ? |
- Соединения цинка
- Хлориды
- Галогениды металлов
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое "Хлорид цинка" в других словарях:
хлорид цинка — хлористый цинк … Cловарь химических синонимов I
Цинка хлорид — Хлорид цинка Хлорид цинка (хлористый цинк) химическое соединение цинка с хлором, имеющее формулу ZnCl2. Белые гигроскопичные кристаллы. Содержание 1 Свойства … Википедия
Цинка галогениды — Существуют: Фторид цинка Хлорид цинка Бромид цинка Иодид цинка … Википедия
ЦИНКА СЕМЕЙСТВО — ПОДГРУППА IIB. СЕМЕЙСТВО ЦИНКА ЦИНК, КАДМИЙ, РТУТЬ Положение элементов семейства цинка как членов рядов переходных металлов, рассмотрено ранее (см. разд. Подгруппа IB и Переходные элементы). Хотя валентный электрон, отличающий их от элементов… … Энциклопедия Кольера
Хлорид вольфрама(VI) — Общие … Википедия
Хлорид вольфрама(II) — Общие Систематическое наименование Хлорид вольфрама(II) Традиционные названия Хлористый вольфрам; гексамер дихлорида вольфрама Химическая формула WCl2 Физические свойства … Википедия
Хлорид вольфрама(IV) — Общие Систематическое наименование Хлорид вольфрама(IV) Традиционные названия хлористый вольфрам Химическая формула WCl4 Физические свойства Сос … Википедия
Хлорид вольфрама(V) — Общие Систематическое наименование Хлорид вольфрама(V) Традиционные названия Хлористый вольфрам Химическая формула WCl5 Физические свойства Состо … Википедия
Хлорид ванадия(II) — Раствор хлорида ванадия(II) Общие Систематическое наименование Хлорид Ванадия(II) … Википедия
Хлорид водорода (соляная кислота) — Хлорид водорода (HCl) это бесцветный дымящийся газ с удушливым запахом, получаемым действием водорода (или воды и кокса) на хлор или действием серной кислоты на хлорид натрия. Он легко сжижается под давлением и легко растворим в воде. Хранится… … Официальная терминология
ZnCl2 — соль образованная слабым основанием и сильной кислотой, поэтому реакция гидролиза протекает по катиону.
Первая стадия (ступень) гидролиза
Молекулярное уравнение
ZnCl2 + HOH ⇄ ZnOHCl + HCl
Полное ионное уравнение
Zn 2+ + 2Cl - + HOH ⇄ ZnOH + + Cl - + H + + Cl -
Сокращенное (краткое) ионное уравнение
Zn 2+ + HOH ⇄ ZnOH + + H +
Вторая стадия (ступень) гидролиза
Молекулярное уравнение
ZnOHCl + HOH ⇄ Zn(OH)2 + HCl
Полное ионное уравнение
ZnOH + + Cl - + HOH ⇄ Zn(OH)2 + H + + Cl -
Сокращенное (краткое) ионное уравнение
ZnOH + + HOH ⇄ Zn(OH)2 + H +
Среда и pH раствора хлорида цинка
В результате гидролиза образовались ионы водорода (H + ), поэтому раствор имеет кислую среду (pH
Оксид цинка (II) ZnO – белые кристаллы, при нагревании приобретают желтую окраску, кристаллизуются в гексагональной сингонии. Плотность 5,7 г/см3, температура возгонки 1800°С.
При температуре выше 1000°С восстанавливается до металлического цинка углеродом, угарным газом и водородом:
ZnO + CO = Zn + CO2;
ZnO + H2 = Zn + H2O.
С водой не взаимодействует.
Проявляет амфотерные свойства, реагирует с растворами кислот и щелочей:
ZnO + 2HCl = ZnCl2 + H2O;
ZnO + 2NaOH + H2O = Na2[Zn(OH)4].
При сплавлении с оксидами металлов образует цинкаты:
При взаимодействии с оксидами неметаллов образует соли, где является катионом:
2ZnO + SiO2 = Zn2SiO4,
ZnO + B2O3 = Zn(BO2)2.
Получается при горении металлического цинка:
при термическом разложении солей:
Гидроксид цинка (II) Zn(OH)2 – бесцветное кристаллическое или аморфное вещество, существует в пяти полиморфных модификациях, устойчивой является только ромбическая ε-Zn(OH)2.
Плотность 3,05 г/см3, при температуре выше 125°С разлагается:
Гидроксид цинка проявляет амфотерные свойства, легко растворяется в кислотах и щелочах:
Zn(OH)2 + H2SO4 = ZnSO4 + 2H2O;
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4];
также легко растворяется в водном растворе аммиака с образованием гидроксида тетраамминцинка:
Zn(OH)2 + 4NH3 = [Zn(NH3)4](OH)2.
Получается в виде осадка белого цвета при взаимодействии солей цинка со щелочами:
ZnCl2 + 2NaOH = Zn(OH)2 + 2NaCl.
Элементы IIБ группы: цинк, кадмий, ртуть
Элементы этой подгруппы – полные электронные аналоги друг друга, каждый в своем периоде является последним элементом d-семейства, у них завершена d-электронная конфигурация, валентные электроны (n-1)d10ns2. На внешней электронной оболочке содержатся 2 электрона и 18 электронов на предыдущей оболочке. Цинк и его аналоги отличаются от d-элементов и в большей степени проявляют сходство с p-элементами больших периодов.
У атомов цинка, кадмия и ртути, как и у атомов меди, (n-1)d-подуровень целиком заполнен и вполне стабилен.
Удаление из него электронов требует очень большой затраты энергии. Поэтому рассматриваемые элементы проявляют в своих соединениях максимальную степень окисления +2. Только ртуть образует соединения, в которых ее степень окисления равна +1.
Характерной особенностью элементов является их склонность к комплексообразованию (к.ч.= 4; 6).
В отличие от элементов главных подгрупп элементы подгруппы цинка труднее окисляются, проявляют меньшую реакционную способность и обнаруживают более слабые металлические свойства.
В подгруппе сверху вниз: возрастает атомный радиус, уменьшается температура плавления и кипения, возрастает электроотрицательность и электродный потенциал.
Минимальная энергия ионизации наблюдается у кадмия (8,99 эВ), т.к. на свойствах ртути сказывается лантаноидное сжатие, в результате которого ее энергия ионизации возрастает до 10,43 эВ (у цинка 9,39 эВ).
Распространенности и основные минералы.
ZnS – цинковая обманка,
Природные соединения цинка входят в состав полиметаллических сульфидных руд, которые содержат пирит FeS2, галенит PbS, халькопирит CuFeS2, и в меньшем количестве ZnS.
Ртуть является редким элементом и встречается в самородном состоянии.
Металлический цинк, его получение, свойства и применение.
Серебристо-белый мягкий металл, на воздухе покрывается оксидной пленкой.
Полиморфных модификаций не имеет, диамагнетик. Внешняя электронная конфигурация атома Zn 3d104s2. Степень окисления в соединениях +2. Нормальный окислительно-восстановительный потенциал, равный 0,76 в, характеризует Цинк как активный металл и энергичный восстановитель.
Для выделения цинка, полученный после обогащения концентрат ZnS подвергается обжигу, а образовавшийся оксид восстанавливается углем:
2ZnS + 3O2 = 2ZnO + 2SO2↑
Другой способ заключается в том, что руду, содержащую ZnS, обжигают, а затем обрабатывают разбавленной серной кислотой:
ZnO + H2SO4 = ZnSO4 + H2O
Полученный раствор сернокислого цинка подвергают электролизу.
По химической активности подгруппа цинка уступает щелочноземельным металлам.
В подгруппе с ростом атомной массы химическая активность металлов падает, о чем свидетельствуют значения стандартных электродных потенциалов (см. выше). Цинк – химически активный металл, легко растворяется в кислотах и при нагревании – в щелочах:
Zn + 2HCl = ZnCl2 + H2↑ Zn + H2SO4(р-р) = ZnSO4 + H2↑
Эти реакции идут медленно, т.к.
образующийся атомарный водород покрывает поверхность цинка.
Zn + 2H2SO4(конц.) = ZnSO4 + SO2↑ + H2O
4Zn + 10HNO3 = 4Zn(NO3)2 + NH4NO3 + 3H2O
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2↑
Металлический цинк вытесняет менее активные металлы и восстанавливает H2CrO4, HMnO4, соли железа (III) и олова (IV):
5Zn + 2KMnO4 + 8H2SO4(р-р) = 2MnSO4 + 5ZnSO4 + K2SO4 + 8H2O
Zn + CuSO4 = ZnSO4 + Cu
Применение цинка разнообразно.
Из цинка готовят сплав с алюминием, медью, магнием, которые имеют промышленное значение. Значительная часть цинка идет на нанесение покрытий на железные и стальные изделия, которые защищают основной металл от коррозии.
Оксид и гидроксид цинка.
Оксид цинка – рыхлый белый порошок, желтеющий при нагревании, но при охлаждении снова становящийся белым, полупроводник.
Zn -> ZnO -> ZnCl2 -> Zn(OH)2 -> ZnSO4 осуществить цепочку превращений
Оксид цинка амфотерен — реагирует с кислотами с образованием солей, при взаимодействии с растворами щелочей образует комплексные три- тетра- и гексагидроксицинкаты (Na2[Zn(OH)4], Ba2[Zn(OH)6]):
ZnO + 2HCl = ZnCl2 + H2↑

ZnO + 2NaOH + 2H2O Na2[Zn(OH)4] + H2↑
Оксид цинка растворяется в водном растворе аммиака, образуя комплексный аммиакат:
ZnO + 4NH3 + Н2O — [Zn(NH3)4](OH)2
При сплавлении с щелочами и оксидами металлов оксид цинка образует цинкаты:

ZnO + 2NaOH Na2ZnO2 + H2O

ZnO + CoO CoZnO2
При сплавлении с оксидами бора и кремния оксид цинка образует стекловидные бораты и силикаты:

ZnO + B2O3 Zn(BO2)2

ZnO + SiO2 ZnSiO3
При температуре выше 1000°С восстанавливается до металлического цинка углеродом, угарным газом и водородом:
ZnO + CO = Zn + CO2
ZnO + H2 = Zn + H2O
С водой не реагирует.
При взаимодействии с оксидами неметаллов образует соли, где является катионом:
2ZnO + SiO2 = Zn2SiO4
ZnO + B2O3 = Zn(BO2)2
Получается при горении металлического цинка:
при термическом разложении солей:
ZnCO3 = ZnO + CO2
Оксид цинка применяют для изготовления белой масляной краски (цинковые белила), в медицине и косметике (для изготовления различных мазей); значительная часть оксида цинка используется в качестве наполнителя резины.
Гидроксид цинка – бесцветное кристаллическое или аморфное вещество.
При температуре выше 125°С разлагается:
Zn(OH)2 = ZnO + H2O
Гидроксид цинка проявляет амфотерные свойства, легко растворяется в кислотах и щелочах:
Zn(OH)2 + H2SO4(конц) = ZnSO4 + 2H2O
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]
также легко растворяется в водном растворе аммиака с образованием гидроксида тетраамминцинка:
Zn(OH)2 + 4NH3 = [Zn(NH3)4](OH)2
Получается в виде осадка белого цвета при взаимодействии солей цинка со щелочами:
ZnCl2 + 2NaOH = Zn(OH)2 + 2NaCl
Оксид цинка и ртути. Гидроксид цинка и его соли
Оксид цинка ZnO с водой в реакцию не вступает, однако, обладая амфотерным характером, может вступать в реакцию как [ с кислотами:
ZnO+H2SO4=ZnSO4+Н2О ZnO+2Н+=Zn2++Н2О так и со щелочами:
При сильном нагревании с углем он может быть восстановлен до свободного цинка:
Оксид цинка иногда встречается в природе.
Он широко используется как наполнитель в резиновой промышленности и как белый пигмент. Необходим он и в косметике, и в медицине (мази, пасты, присыпки при кожных заболеваниях).
Гидроксид цинка Zn(OH)2 — также вещество амфотерное, нерастворимое в воде, но хорошо растворимое как в кислотах:
Zn(OH)2+2Н+=Zn2++2Н2О так и в щелочах:
Из солей цинка важнейшими являются хлорид ZnCl2, сульфат ZnSO4 и сульфид ZnS.
Следует отметить, что соли Zn2+ бесцветны и хорошо растворимы в воде, за исключением ZnF2, ZnS и ZnCO3.
Соли цинка способны к образованию комплексных соединений:
Сульфат цинка (цинковый купорос) поступает в лабораторию в виде кристаллогидрата ZnSO4•7Н2О.
Его разбавленные растворы применяются как лекарственное средство при некоторых заболеваниях. Его используют для получения металлического цинка путем электролиза, а также как протраву при крашении тканей.
Сульфид цинка ZnS входит в состав литопона — белой краски; получают ZnS по реакции:
Эта краска дешевле свинцовых белил и не темнеет в присутствии сероводорода.
ZnS в смеси с CdS входит в состав покрытий для экранов телевизоров.
Ртуть с кислородом образует ряд соединений: Hg2O, HgO, HgO2.
Как из Zn(OH)2 получить ZnO
Из них наиболее устойчив HgO, который существует в двух формах — красной и желтой.
Красная форма образуется при осторожном нагревании нитрата до 350°С:
При добавлении щелочей к раствору соли Hg(II) выпадает желтый оксид ртути (II).
Обе формы оксида ртути (II) имеют одинаковую кристаллическую структуру. Цвет же их зависит от размеров кристалликов. При размерах кристалликов до 4 мкм цвет оксида Hg желтый, выше 8 мкм — красный.
Красный оксид ртути входит в состав краски для подводных частей морских судов — она губительно действует на морские организмы. Желтый оксид ртути применяется в качестве компонента кожных мазей.
Из солей ртути следует привести в пример сулему HgCl2 и каломель Hg2Cl2.
Каломель получают по обменной реакции:
Каломель применяют для изготовления каломельных электродов сравнения в электрохимии и как легкое слабительное.
Сулема образуется при нагревании смеси сульфата двухвалентной ртути с поваренной солью:
Сулема — очень сильный яд.
В виде растворов ее применяют для дезинфекции и для протравливания семян.
Каломель, в отличие от сулемы, не ядовита и плохо растворима в воде.
Соли ртути также способны к образованию комплексных соединений:
В результате взаимодействия оксида цинка с водой (ZnO + H2O = ?) происходит образование гидроксида цинка (соединение). Молекулярное уравнение реакции имеет вид:

Данная реакция не относится к окислительно-восстановительным, поскольку ни один химический элемент не изменяет своей степени окисления.
Оксид цинка представляет собой термически устойчивые кристаллы белого цвета (иногда с желтоватым оттенком), которые при сильном прокаливании возгоняются и разлагаются, однако плавятся только под избыточным давлением кислорода.
Не реагирует с водой, не восстанавливается водородом. Проявляет амфотерные свойства; реагирует с кислотами, щелочами, кислотными и основными оксидами.




Основной промышленный способ получения оксида цинка – из природных минералов.
Цинк — это хрупкий металл серебристо-голубого цвета, он очень ковок и пластичен.

Химические свойства цинка
Тридцатый элемент таблицы Менделеева является мощным восстановителем. При высоких температурах металл сгорает и тем самым образует атмосферный белый оксид цинка. Реакция сопровождается голубым пламенем:
При горении цинк весьма бурно реагирует с серой. Взаимодействие сопровождается красивым зеленоватым пламенем:
С галогенами цинк реагирует в присутствии влаги:
Также цинк реагирует с парами воды при 600–800 °С с образованием водорода и оксида цинка:
Zn + 2H₂O = ZnO + H₂
Если опустить кусочек цинка в разбавленную серную кислоту, пойдет выделение пузырьков водорода:
H₂SO₄ + Zn = ZnSO₄ + H₂↑
Цинк — тяжелый металл (например, по сравнению с литием), поэтому такой металл не всплывает на поверхность под действием пузырьков.
Реакция цинка и соляной кислоты
Рассмотрим взаимодействие серебристого металла с соляной кислотой. С НСl цинк реагирует также медленно, с образованием небольших пузырьков и выделением водорода. В результате реакции получается хлорид цинка ZnCl₂:
Zn + HCl → ZnCl₂ + H₂
Десятки экспериментов у вас дома
Один из самых интересных и амбициозных образовательных химических проектов
Положение в периодической системе химических элементов
Цинк расположены в побочной подгруппе II группы (или в 12 группе в современной форме ПСХЭ) и в четвертом периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение цинка и свойства
Электронная конфигурация цинка в основном состоянии :
+30Zn 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2
3s 3p 3d
Характерная степень окисления цинка в соединениях +2.
Физические свойства
Цинк при нормальных условиях — хрупкий переходный металл голубовато-белого цвета (быстро тускнеет на воздухе, покрываясь тонким слоем оксида цинка).

Температура плавления цинка 420°С, температура кипения 906°С, плотность 7,13 г/см 3 .
Нахождение в природе
Среднее содержание цинка в земной коре 8,3·10 -3 мас.%. Основной минерал цинка: сфалерит (цинковая обманка) ZnS..
Цинк играет важную роль в процессах, протекающих в живых организмах.
В природе цинк как самородный металл не встречается.
Способы получения
Цинк получают из сульфидной руды. На первом этапе руду обогащают, повышая концентрацию сульфидов металлов. Сульфид цинка обжигают в печи кипящего слоя:
2ZnS + 3O2 → 2ZnO + 2SO2
Чистый цинк из оксида получают двумя способами.
При пирометаллургическом способе , который использовался издавна, оксид цинка восстанавливают углём или коксом при 1200—1300 °C:
ZnO + С → Zn + CO
Далее цинк очищают от примесей.
В настоящее время основной способ получения цинка — электролитический (гидрометаллургический) . При этом сульфид цинка обрабатывают серной кислотой:
При это получаемый раствор сульфата цинка очищают от примесей (осаждением их цинковой пылью) и подвергают электролизу.
При электролизе чистый цинк осаждается на алюминиевых катодах, с которых его удаляют и подвергают плавлению в индукционных печах. Таким образом можно получить цинк с высокой чистотой (до 99,95 %).
Качественные реакции
Качественная реакция на ионы цинка — взаимодействие избытка солей цинка с щелочами . При этом образуется белый осадок гидроксида цинка.

Например , хлорид цинка взаимодействует с гидроксидом натрия:
ZnCl2 + 2NaOH → Zn(OH)2 + 2NaCl

При дальнейшем добавлении щелочи амфотерный гидроксид цинка растворяется с образованием комплексной соли тетрагидроксоцинката:

Обратите внимание , если мы поместим соль цинка в избыток раствора щелочи, то белый осадок гидроксида цинка не образуется, т.к. в избытке щелочи соединения цинка сразу переходят в комплекс:

Цинк находится в группе элементов из периодической таблицы, называемой переходными металлами. Эти металлы имеют переменную реакционную способность и различаются в природе в элементарной форме. Цинк встречается в природе как в элементарной форме – как блестящий серый металл, так и в виде соли. Люди и многие другие организмы зависят от определенного количества неметаллического цинка, то есть цинка в форме соли, для поддержания клеточной функции.
Соли, в которых цинк образует кислотный остаток (цинкаты) — образуются из оксида цинка при сплавлении с щелочами и основными оксидами:
Для понимания свойств цинкатов их также можно мысленно разбить на два отдельных вещества.
Например, цинкат натрия мы разделим мысленно на два вещества: оксид цинка и оксид натрия.
Na2ZnO2 разбиваем на Na2O и ZnO
Тогда нам станет очевидно, что цинкаты реагируют с кислотами с образованием солей цинка :
Нитрат цинка при нагревании разлагается на оксид цинка, оксид азота (IV) и кислород:
Сульфат цинка при сильном нагревании разлагается аналогично — на оксид цинка, сернистый газ и кислород:
Под действием избытка воды цинкаты переходят в комплексные соли:
ZnS + 2HCl → ZnCl2 + H2S
Под действием азотной кислоты сульфид цинка окисляется до сульфата:
(в продуктах также можно записать нитрат цинка и серную кислоту).
Концентрированная серная кислота также окисляет сульфид цинка:
При окислении сульфида цинка сильными окислителями в щелочной среде образуется комплексная соль:
Z nS + 4NaOH + Br2 = Na2[Zn(OH)4] + S + 2NaBr
Растворимые соли цинка и сильных кислот гидролизуются по катиону. Гидролиз протекает ступенчато и обратимо, т.е. чуть-чуть:
I ступень: Zn 2+ + H2O = ZnOH + + H +
II ступень: ZnOH + + H2O = Zn(OH )2 + H +

Для описания свойств комплексных солей цинка — гидроксоцинкатов, удобно использоваться следующий прием: мысленно разбейте тетрагидроксоцинкат на две отдельные частицы — гидроксид цинка и гидроксид щелочного металла.
Например , тетрагидроксоцинкат натрия разбиваем на гидроксид цинка и гидроксид натрия:
Na2[Zn(OH)4] разбиваем на NaOH и Zn(OH)2
Свойства всего комплекса можно определять, как свойства этих отдельных соединений.
Таким образом, гидроксокомплексы цинка реагируют с кислотными оксидами .
Например , гидроксокомплекс разрушается под действием избытка углекислого газа. При этом с СО2 реагирует NaOH с образованием кислой соли (при избытке СО2), а амфотерный гидроксид цинка не реагирует с углекислым газом, следовательно, просто выпадает в осадок:
Аналогично тетрагидроксоцинкат калия реагирует с углекислым газом:
А вот под действием избытка сильной кислоты осадок не выпадает, т.к. амфотерный гидроксид цинка реагирует с сильными кислотами.
Например , с соляной кислотой:
Правда, под действием небольшого количества ( недостатка ) сильной кислоты осадок все-таки выпадет, для растворения гидроксида цинка кислоты не будет хватать:
Аналогично с недостатком азотной кислоты выпадает гидроксид цинка:
Если выпарить воду из раствора комплексной соли и нагреть образующееся вещество, то останется обычная соль-цинкат:
1. Гидроксид цинка реагирует с растворимыми кислотами .
Например , гидроксид цинка взаимодействует с азотной кислотой с образованием нитрата цинка:
2. Гидроксид цинка взаимодействует с кислотными оксидами .
Например , гидроксид цинка взаимодействует с оксидом серы (VI) с образованием сульфата цинка:
3. Гидроксид цинка взаимодействует с растворимыми основаниями (щелочами). При этом в расплаве образуются соли—цинкаты, а в растворе – комплексные соли . При этом гидроксид цинка проявляет кислотные свойства.
Например , гидроксид цинка взаимодействует с гидроксидом калия в расплаве с образованием цинката калия и воды:
Гидроксид цинка растворяется в избытке щелочи с образованием тетрагидроксоцинката:
4. Г идроксид цинка разлагается при нагревании :
Оксид цинка можно получить различными методами :
1. Окислением цинка кислородом:
2Zn + O2 → 2ZnO
2. Разложением гидроксида цинка при нагревании:
3. Оксид цинка можно получить разложением нитрата цинка :
Оксид цинка — типичный амфотерный оксид . Взаимодействует с кислотными и основными оксидами, кислотами, щелочами.
1. При взаимодействии оксида цинка с основными оксидами образуются соли-цинкаты.
Например , оксид цинка взаимодействует с оксидом натрия:
2. Оксид цинка взаимодействует с растворимыми основаниями (щелочами). При этом в расплаве образуются соли—цинкаты, а в растворе – комплексные соли . При этом оксид цинка проявляет кислотные свойства.
Например , оксид цинка взаимодействует с гидроксидом натрия в расплаве с образованием цинката натрия и воды:
Оксид цинка растворяется в избытке раствора щелочи с образованием тетрагидроксоцинката:
3. Оксид цинка не взаимодействует с водой.
ZnO + H2O ≠
4. Оксид цинка взаимодействует с кислотными оксидами . При этом образуются соли цинка. В этих реакциях оксид цинка проявляет основные свойства.
Например , оксид цинка взаимодействует с оксидом серы (VI) с образованием сульфата цинка:
5. Оксид цинка взаимодействует с растворимыми кислотами с образованием солей.
Например , оксид цинка реагирует с соляной кислотой:
ZnO + 2HCl = ZnCl2 + H2O
6. Оксид цинка проявляет слабые окислительные свойства .
Например , оксид цинка при нагревании реагирует с водородом и угарным газом:
ZnO + С(кокс) → Zn + СО
ZnO + СО → Zn + СО2
7. Оксид цинка — твердый, нелетучий. А следовательно, он вытесняет более летучие оксиды (как правило, углекислый газ) из солей при сплавлении.
Например , из карбоната бария:
Цинк и соляная кислота
Цинк как минерал
Цинк в теле
Пока у вас HCl в желудке – он помогает в переваривании пищи – вы не производите ни H2, ни ZnCl2, когда потребляете цинк в пище. Это потому, что цинк вы взятие через продукты питания или дополнения не в металлической форме. Вместо этого оно имеет потеряли некоторые из его электронов, образуя положительно заряженные частицы, называемые ионами цинка. Тело не использует металлический цинк, а цинк в пище не реагирует с HCl.
Цинк как типичный щелочной металл
Цинк – это типичный представитель металлов, в нормальном состоянии имеет голубовато-серый цвет, легко окисляется на воздухе, приобретая на поверхности оксидную пленку (ZnO).
Как типичный амфотерный металл цинк взаимодействует с кислородом воздуха: 2Zn+O2=2ZnO – без температуры, с образованием оксидной пленки. При нагревании образуется белый порошок.
Сам оксид реагирует с кислотами с образованием соли и воды:
С растворами кислот. Если цинк обычной чистоты, то уравнение реакции HCl Zn ниже.
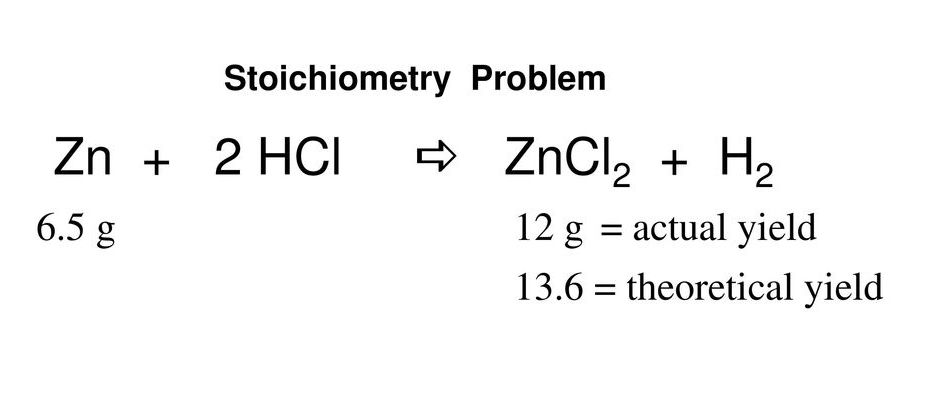
Zn+2HCl= ZnCl2+H2↑ – молекулярное уравнение реакции.
Zn (заряд 0) + 2H (заряд +) + 2Cl (заряд -) = Zn (заряд +2) + 2Cl (заряд -)+ 2H (заряд 0) – полное Zn HCl ионное уравнение реакции.
Zn + 2H(+) = Zn(2+) +H2 – С.И.У. (сокращенное ионное уравнение реакции).
Реакция цинка с соляной кислотой
Данное уравнение реакции HCl Zn относится к типу окислительно-восстановительных. Это можно доказать тем, что у Zn и H2 в ходе реакции изменился заряд, наблюдалось качественное проявление реакции, а также наблюдалось присутствие окислителя и восстановителя.
В данном случае H2 является окислителем, так как с. о. водорода до начала реакции была “+”, а после стала “0”. Он участвовал в процессе восстановления, отдавая 2 электрона.
Zn является восстановителем, он участвует в окислении, принимая 2 электрона, повышая с.о. (степень окисления).
Также это реакция замещения. В ходе нее участвовало 2 вещества, простое Zn и сложное – HCl. В результате реакции образовалось 2 новых вещества, а также одно простое – H2 и одно сложное – ZnCl2. Так как Zn расположен в ряду активности металлов до H2, он вытеснил его из вещества, которое реагировала с ним.
Читайте также:

