Как сделать из углерода оксид углерода
Добавил пользователь Morpheus Обновлено: 05.10.2024
Существует множество оксидов углерода, но наиболее известны угарный и углекислый газы. Они представляют собой химические соединения одних и тех же элементов, но, несмотря на одинаковые исходные реагенты, характеристики веществ имеют отличия. Например, первый газ известен как крайне опасный яд, образующийся при процессах горения. Второй же часто используется в качестве наполнителя для огнетушителей.

Монооксид углерода

Угарным газом называют оксид углерода с формулой CO. Кроме того, это соединение называют монооксидом и окисью углерода. Он представляет собой бесцветный безвкусный горючий газ без запаха, который легче воздуха. Вещество образуется в случаях, когда топливо сгорает не до конца. Оно плохо растворяется в воде.
У молекулы этого оксида линейное строение. Между атомами его элементов образуется тройная связь. Два неспаренных электрона обоих элементов образуют пару ковалентных связей. Третья же связь возникает, когда электронная пара кислорода размещается на свободной орбитали атома углерода.
У молекулы слабая полярность. Наличие двух неспаренных электронов говорит о том, что в этом соединении углерод проявляет валентность II.
Химические свойства
Оксид углерода (II) не образует солей и является восстановителем. Кроме того, к химическим свойствам угарного газа относятся:

- Горение синим пламенем в кислородной атмосфере.
- Окисление хлором, если присутствует катализатор или на него воздействует свет. При этом образуется ядовитое газообразное вещество — фосген. Молекулярное уравнение реакции: CO + Cl2 → COCl2.
- При повышенном давлении вещество вступает во взаимодействие с водородом. Из этой смеси, называемой синтез-газом, при различных условиях получают углеводороды, например, метан.
- При наличии давления оксид углерода (II) вступает в реакцию с щелочами. В результате появляется соль муравьиной кислоты.
- Восстановление металлов из оксидов. К примеру, взаимодействие с оксидом железа (III) даёт железо и углекислый газ.
- Реакции с сильными окислителями приводят к образованию углекислого газа или карбонатов.
Способы изготовления
Получить монооксид можно как в лабораторных условиях, так и в производственных. В первом случае для образования необходимого вещества используют концентрированную серную и муравьиную или щавелевую кислоты.

В промышленности для получения угарного газа применяют специальные газогенераторы. В них соединение вырабатывается воздухом, проходящим через раскалённый уголь. Ещё одним промышленным методом изготовления газа является паровая конверсия метана или угля. Кроме того, на производстве используют процесс неполного окисления метана.
Угарный газ присутствует и в атмосфере планеты. Он туда поступает тремя способами:
- неполное разложение органических веществ без доступа воздуха;
- сгорание биологической массы, например, лесные и степные пожары;
- выхлопные газы, которые образуются в двигателях внутреннего сгорания.
Использование соединения
Основное применение горючего вещества — изготовление генераторного или воздушного газа, для чего монооксид смешивают с азотом. Кроме того, соединяя его с водородом, получают водяной газ.
В металлургической промышленности из-за химической характеристики угарный газ используется в качестве восстановителя металлов из их руд. Также окись применяют при разложении карбонилов, что позволяет получить высокочастотные металлы.
Влияние на живые организмы
Монооксид крайне токсичен, потому что связывается с находящимся в крови гемоглобином прочнее и во много раз быстрее кислорода. Он блокирует процессы доставки жизненно необходимого вещества.
Если концентрация вещества в атмосфере превышает 0,1%, то живые организмы погибают в течение одного часа. Если же уровень оксида этого типа поднимается до 0,3%, то смерть наступает в течение нескольких минут. По этим причинам угарный газ относится к быстродействующим отравляющим веществам.

Специалистами установлено, что чаще всего люди погибают при пожарах в результате отравления указанным углеродным соединением, поскольку он является неотъемлемым продуктом горения большинства материалов. Кроме того, оксид вырабатывается двигателями автомобилей, что также приводит к гибели неосторожных граждан, например, механиков, которые пренебрегают организацией должной вентиляции в гараже.
Если отравление лёгкой степени, то пострадавшему для восстановления здоровья будет достаточно гипервентиляции лёгких кислородом. Если же отравление тяжёлое, то человеку потребуется серьёзная медицинская помощь.
Углекислый газ

Углекислый газ, двуокись или оксид углерода (IV) представляет собой газообразное бесцветное вещество, не имеющее запаха. Его химическая формула — CO2. Двуокись не горит и в минимальных концентрациях не представляет опасности для организма. Также она является необходимым элементом для нормальной жизнедеятельности растений.
У вещества линейная молекула. Из-за четырёх неспаренных электронов в своих соединениях углерод проявляет валентность, равную IV.
Атом углерода в этом соединении имеет пару двойных связей с кислородными атомами. Полярность четырёх связей делает молекулу двуокиси неполярной. Это хорошо видно в структурной формуле оксида, которая наглядно демонстрирует связь атомов внутри молекулы:
Взаимодействие с другими веществами
В химии углекислота считается солеобразующим оксидом, проявляющим слабые свойства окислителя. Она прекрасно взаимодействует с водой, причём эта реакция является практически полностью обратимой.
Вещество имеет следующие химические свойства:

- Вступление в реакцию с основными оксидами и основаниями. Соединение взаимодействует лишь с щелочами и их оксидами. При этом могут образовываться кислые и средние соли. К примеру, гидроксид калия в таком случае образует гидрокарбонат калия, который является кислой солью. Если же щелочи много, то получится карбонат калия — средняя соль.
- Взаимодействие с карбонатами с последующим образованием гидрокарбонатов.
- Реакции с некоторыми восстановителями, например, с углеродом, магнием и пероксидом натрия.
Методы получения
Углекислый газ получают и в лабораториях, и в промышленности. В лабораторных условиях для его производства применяются следующие методы:
- Воздействие сильными кислотными веществами на карбонаты и гидрокарбонаты различных металлов.
- Углекислое соединение образуется, когда растворимые карбонаты реагируют с растворимыми солями алюминия, железа (III) и хрома (III).
- Разложение растворимых гидрокарбонатов и нерастворимых карбонатов при высоких температурах.
На производстве двуокись получают из печных газов, а также из продуктов разложения известняка и доломита. Для этого смесь веществ промывают раствором карбоната калия. Реагент поглощает углекислоту и становится гидрокарбонатом. Получившееся вещество нагревают, что приводит к его разложению и высвобождению оксида углерода. Затем газ закачивают в баллоны.
Применение углекислоты
Химические и физические характеристики соединения позволяют использовать его в самых разных областях. Так, вещество активно применяется в химической промышленности, металлургии и при производстве бумаги.

А также углекислота применяется в следующих сферах деятельности:
- сварка;
- сельское хозяйство;
- медицина;
- фармацевтика;
- приборы и оборудование;
- защита окружающей среды;
- пищевая промышленность;
- пневматическое оружие.
Очень востребован этот вид оксида углерода в системах пожаротушения. Им наполняют специальные огнетушители. Их принцип действия основан на том, что углекислота не горит и весит больше воздуха. За счёт этого вещество окутывает очаг возгорания и перекрывает для огня источник кислорода, которые необходим для поддержания процесса горения. В таких условия пламя довольно быстро гаснет.
Физиологическое действие
Углекислота — нетоксичное вещество. Но если в воздухе её становится слишком много, то все живые организмы, дышащие кислородом, могут испытывать приступы удушья, способные привести к смерти. По этой причине углекислому газу присвоен четвёртый класс опасности.
Если уровень находящегося в воздухе углеродного соединения составляет от 2 до 4%, то человек чувствует сонливость и слабость. Когда концентрация двуокиси достигает 7—10%, начинают появляться симптомы удушья, похожи на признаки высотной болезни:

- головная боль;
- головокружение;
- слуховые расстройства;
- потеря сознания.
Чем выше концентрация газа в атмосфере, тем длительнее проявляются симптомы. При очень высокой концентрации оксида человек или животное быстро погибает от удушья, которое вызывается гипоксией.
Само по себе вдыхание воздуха с высоким содержанием двуокиси неопасно, а потому не влечёт за собой длительных проблем со здоровьем. После того как пострадавший переносится в атмосферу с обычным уровнем углекислоты, его самочувствие приходит в норму.
Помогите составить химическое уравнение по схеме CO2 -> CO. Расставьте стехиометрические коэффициенты. Укажите тип взаимодействия. Запишите молекулярное и ионное уравнения реакции. Охарактеризуйте соединение диоксид углерода: укажите основные физические и химические свойства, способы получения.
![]()
, то он будет разлагаться на монооксид углерода и кислород. Молекулярное уравнение реакции имеет вид:
Во-вторых, монооксид углерода является продуктом восстановления углекислого газа углем. Молекулярное уравнение реакции имеет вид:
Диоксид углерода (углекислый газ) при обычных условиях представляет собой бесцветный газ, который в 1,5 раза тяжелее воздуха, что позволяет переливать его, как жидкость, из одного сосуда в другой. Растворимость диоксида углерода в воде невелика.
Под давлением диоксид углерода при комнатной температуре превращается в жидкость. А при быстром выливании его из баллона он превращается в твердую белую снегообразную массу.
Углекислый газ проявляет кислотные свойства: реагирует со щелочами, гидратом аммиака. Восстанавливается активными металлами, водородом, углеродом.
![]()
![]()
В промышленных условиях углекислый газ получают из дымовых газов или в качестве побочного продукта многих химических реакций, например при разложении природных карбонатов – известняка и доломита.

В этом видеофрагменте собран материал по особенностям строения атома углерода, его аллотропным модификация. Подробно изучаются химические свойства углерода, его оксидов. А также в виде демонстраций приведены опыты, иллюстрирующие качественные реакции на углекислый газ и на карбонат-ион. Здесь подобран интересный материал о круговороте углерода в природе, об использовании алмазов, различных соединений углерода.
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Углерод. Оксиды углерода"
Углерод. Оксиды углерода
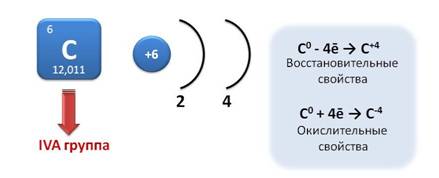
Углерод – элемент IVA группы. На внешнем энергетическом уровне у углерода четыре электрона, которые он может отдавать или присоединять до завершения внешнего слоя. Если углерод отдаёт четыре электрона, то он проявляет восстановительные свойства и приобретает степень окисления +4. Если он присоединяет четыре электрона, то он проявляет окислительные свойства и приобретает степень окисления -4 .
Углерод образует несколько аллотропных модификаций, наиболее распространённые из них – алмаз и графит.
Алмаз – прозрачное кристаллическое вещество. Одно, из самых твёрдых веществ, в природе. Высокая твёрдость алмаза обусловлена строением его кристаллической решётки. Для алмаза характерна атомная кристаллическая решётка, где каждый атом углерода окружён такими же атомами, расположенными в вершинах правильного тетраэдра.

Как правило, алмазы бесцветные, но встречаются синего, голубого, красного и чёрного цвета. Алмаз имеет сильный блеск из-за высокой светопреломляющей и светоотражающей способности.





Огранённые прозрачные алмазы называют бриллиантами. Они украшают короны царей бывшей Российской империи, орден Святого Андрея Первозванного, который представляет собой восьмилучевую звезду, которая усыпана бриллиантами и украшена тридцатью мелкими сапфирами.





Алмазы применяют не только как украшения, но и для изготовления буров, свёрл, шлифовальных инструментов, резки стекла.



Крупнейшие месторождения алмазов находятся в Южной Африке, в России алмазы добывают в Якутии.
Вторым аллотропным видоизменением углерода является графит, который представляет собой тёмно-серое, жирное на ощупь кристаллическое вещество с металлическим блеском.
Графит, по сравнению с алмазом, мягкий и непрозрачный, хорошо проводит теплоту и электрический ток. Физические свойства графита обусловлены его кристаллической решёткой. Атомы углерода в кристаллической решётке лежат в одной плоскости, образуя правильные шестиугольники. Слоистая структура графита определяет его мягкость: он легко оставляет след на бумаге. Связи между этими слоями мало прочные. Графит тугоплавок.

Из графита делают электроды, твёрдые смазки, замедлители нейтронов в ядерных реакторах, стержни для карандашей. При высоких температурах и давлении из графита получают искусственные алмазы.





Сходное с графитом строение имеют сажа и древесный уголь. Древесный уголь получают при сухой перегонке древесины. Древесный уголь обладает адсорбцией, то есть он поглощает газы и растворённые вещества своей пористой поверхностью.

Древесный уголь обрабатывают горячим водяным паром для увеличения поглотительной способности. Такой обработанный уголь называется активированным. Активированный уголь используют для изготовления бытовых фильтров, противогазов. Первый противогаз был изобретён выдающимся русским химиком Н.Д. Зелинским.

Н.Д. Зелинский

Если бросить кусочек активированного угля в колбу с бурым газом – NO2, то бурая окраска в колбе исчезнет.

Адсорбция углем
Активированный уголь используют в промышленности для очистки спирта от сивушных масел, сахарного сиропа от окрашенных веществ, для улавливания бензина из природных газов.
Химические свойства углерода
Углерод реагирует с кислородом с образованием оксида углерода четыре (CO2).
Если поместить в ложечку для сжигания веществ кусочек древесного угля и раскалить его на пламени спиртовки, а затем внести в колбу с кислородом, то уголь начинает гореть сверкающим пламенем.
В этой реакции углерод повышает свою степень окисления с 0 до +4, проявляя тем самым восстановительные свойства, а кислород понижает свою степень окисления с 0 до -2 и проявляет окислительные свойства.
C 0 + O2 0 = C +4 O2 -2 ↑
C 0 – восстановитель, O2 0 – окислитель, C +4 O2 -2 – оксид углерода( IV).
Углерод вступает во взаимодействие с металлами при нагревании, при этом образуются карбиды. Например, в реакции алюминия с углеродом образуется карбид алюминия.
4Al 0 + 3C 0 = Al4 +3 C3 -4
Al 0 – окислитель, Al4 +3 C3 -4 – карбид алюминия.
В данной реакции углерод понижает свою степень окисления с 0 до -4, поэтому здесь он проявляет окислительные свойства.
Углерод реагирует с водородом с образованием метана. В этой реакции углерод понижает свою степень окисления с 0 до +4, а водород повышает с 0 до +1, поэтому углерод окислитель, а водород – восстановитель.
t, Ni
В-ль ок-ль метан
C 0 – восстановитель, Н2 0 – окислитель, С +4 Н4 -1 – метан.
Если в пробирке прокалить смесь чёрного порошка оксида меди два (CuO) с порошком древесного угля, то смесь приобретает красный цвет из-за образовавшейся в результате реакции меди (Cu).
В этой реакции углерод повышает свою степень окисления с 0 до +4, поэтому он является восстановителем, а медь понижает свою степень окисления с +2 до 0, поэтому медь – окислитель.
C 0 + Cu +2 O = C +4 O2 -2 + Cu 0
C 0 – восстановитель, Cu +2 O – окислитель, С +4 Н4 -1 – метан.
Применение углерода
Углерод является составной частью крема для обуви, адсорбентом в противогазах, наполнителем при производстве резины, его используют в производстве синтетического бензина, в медицине, для получения карбида кальция (CaC2), для получения искусственных алмазаов, в металлургии для очистки этилового спирта, для приготовления чёрной краски.

Углерод – это основной элемент биосферы Земли. Он входит в состав клеток животных и растений.
В природе углерод встречается в свободном состоянии (алмаз, графит) и в форме соединений, в основном в виде карбонатов, наиболее распространённым из них является карбонат кальция – (CaCO3), который образует известняк, мел и мрамор.
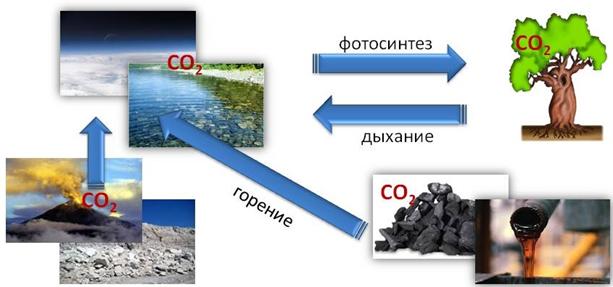
В атмосфере содержится оксид углерода (IV) – CO2 – углекислый газ. Он образуется при дыхании и сгорании топлива, при тлении и гниении органических веществ. Углекислый газ содержится также в водах морей и океанов.
Углерод является составной частью каменного угля, бурого угля, торфа.
Он входит в состав нефти, торфа и природного газа.

В природе постоянно происходит круговорот углерода. Так, из атмосферы и природных вод углекислый газ поглощается зелёными растениями в процессе фотосинтеза, а образующийся в результате дыхания, брожения и гниения углекислый газ снова поступает в атмосферу и воды морей и океанов. Уголь, нефть и другие ископаемые при сжигании выделяют углекислый газ, который поступает в окружающую среду.
При разрушении пород, содержащиеся в них металлы, при действии атмосферного углекислого газа образуют осаждающиеся карбонаты. Большое количество углекислого газа выделяется при извержении вулканов.
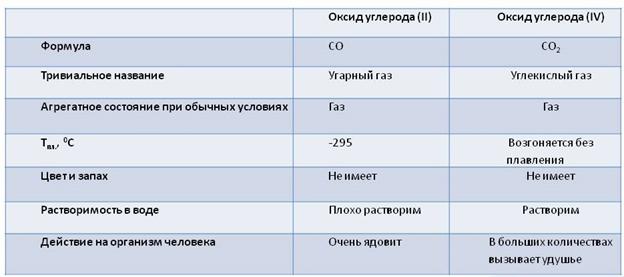
Оксиды углерода
Углерод образует два оксида: оксид углерода (II) – CO и оксид углерода (IV) – CO2. Сравним свойства этих оксидов. Оксид углерода два или угарный газ является бесцветным газом, он не имеет запаха, малорастворим в воде. Ядовит. Температура плавления -205 0 C. При дыхании он попадает в кровь и соединяясь с гемоглобином крови образует соединение – карбоксигемоглобин, которое не даёт гемоглобину переносить кислород. При вдыхании воздуха, в котором содержится одна десятая процента угарного газа, человек может потерять сознание и умереть. Угарный газ образуется при неполном сгорании топлива.

СО – несолеобразующий оксид. Он обладает восстановительными свойствами, так как углерод здесь находится в промежуточной степени окисления +2.
Оксид углерода два горит в кислороде с образованием оксида углерода (IV).
В этой реакции углерод повышает свою степень окисления с +2 до +4, а кислород понижает с 0 до -2. Поэтому углерод является восстановителем, а кислород окислителем. В этой реакции каждый атом углерода отдаёт по два электрона молекуле кислорода.
2С 0 + О2 0 (нед) = 2С +2 О -2
Кроме этого, оксид углерода (II) восстанавливает металлы из их оксидов. Например, в реакции оксида железа (III) с оксидом углерода (II), СО отнимает кислород от железа, при этом образуется железо и углекислый газ.
Fe2 +3 O3 + 3C +2 O = 2Fe 0 + 3C +4 O2↑
В этой реакции железо понижает свою степень окисления с +3 до 0, а углерод повышает с +2 до +4, при этом каждый атом углерода отдаёт по два электрона атомам железа. Углерод выступает в роли восстановителя, а железо в роли окислителя.


Оксид углерода (IV) – кислотный оксид. Он реагирует со щелочами. Например, в реакции с известковой водой (Ca(OH)2), известковая вода мутнеет, потому что образуется соль – карбонат кальция (CaCO3). Эта реакция является качественной реакцией на углекислый газ.
CO2 + Ca(OH)2 = CaCO3↓ + H2O
Оксид углерода четыре взаимодействует и с основными оксидами. Например, в реакции с оксидом магния (MgO) образуется соль – карбонат магния (MgCO3).
CO2 + MgO = MgCO3
При растворении углекислого газа в воде образуется слабая неустойчивая угольная кислота (H2CO3).
CO2 + H2O ↔ H2CO3
Углекислый газ не горит, но магний продолжает гореть в углекислом газе с образованием оксида магния и выделением углерода в виде сажи (C).
CO2 + 2Mg = 2MgO + C
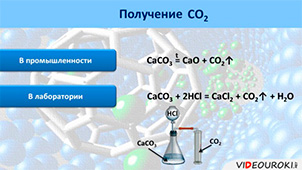
В промышленности углекислый газ получают обжигом известняка (CaCO3):
CaCO3 = CaO + CO2↑ (t)
В лаборатории углекислый газ получают действием соляной кислоты (HCl) на карбонат кальция (CaCO3):






Сравнительна таблица оксидов углерода
Таким образом, углерод элемент IV A группы, на внешнем энергетическом уровне у него четыре электрона, для углерода характерны степени окисления -4, +2, +4. В реакциях с кислородом и оксидами металлов он проявляет восстановительные свойства, а в реакциях с металлами, водородом – окислительные свойства. Наиболее известными аллотропными модификациями углерода являются алмаз и графит. В природе углерод встречается в свободном виде и в виде соединений, главным образом карбонатов. Углерод образует два оксида – оксид углерода (II) и оксид углерода (IV). Углерод и его соединения находят широкое применение во многих областях народного хозяйства.
Вам может понравиться Все решебники






Главная задача сайта: помогать школьникам и родителям в решении домашнего задания. Кроме того, весь материал совершенствуется, добавляются новые сборники решений.
Читайте также:

