Как сделать из атома ион
Обновлено: 07.07.2024
При химических реакциях атомное ядро остается без изменения. Химические свойства атомов связаны со структурой их электронных орбиталей. При этом решающую роль играют электроны, находящиеся на внешнем электронном уровне атома. Влияние на свойства атомов (и ионов) электронов второго и третьего снаружи уровней сказывается значительно слабее.
Как известно, электронная оболочка атома состоит из нескольких энергетических уровней (их обозначают буквами K, L, М, N, О, Р и Q). Максимальное число возможных электронов на энергетическом уровне определяется формулой:
где N — максимальное число электронов на данном уровне, n — номер уровня.
Так, первый, ближайший к ядру, уровень К (n=1) может содержать не более 2 электронов, второй уровень L (n=2) не более 8, третий уровень М (n=3) не более 18, четвертый уровень N (n=4 не более 32 и т. д. Больше 32 электронов ни на одном из уровней не содержится. Число электронов на внешнем уровне не может превышать 8, а на предпоследнем 18.
Все элементы периодической системы Д. И. Менделеева в зависимости от того, на каком подуровне появляется очередной электрон каждого последующего элемента, делятся на s-,p-, d- и f-элементы.
В атомах s-элементов пополняется электронами подуровень s внешнего уровня. К s-элементам относятся элементы главных подгрупп I и II групп периодической системы, а также водород и гелий.
В атомах p-элементов пополняется электронами подуровень p внешнего уровня. К ним относятся элементы главных подгрупп III—VII, а также инертные элементы, кроме гелия.
У d-элементов происходит пополнение электронами d-подуровня, соседнего с внешним уровнем. К ним относятся элементы побочных подгрупп. На внешнем уровне d-элементов находится 2 электрона или реже 1 (у палладия оба внешних электрона находятся на d-подуровне).
У f-элементов пополняются электронами f-подуровень четвертого уровня у лантаноидов и пятого у актиноидов (т. е. третьего снаружи энергетического уровня). К ним относятся лантаноиды и актиноиды. На внешнем уровне у них имеется 2 электрона, а на предпоследнем 8 или реже 9 электронов.
Так как химические свойства элементов зависят главным образом от самых внешних уровней, то изменение числа электронов на 3-м снаружи уровне проявляется очень слабо и все -элементы по химическим свойствам похожи друг на друга.
Электроны внешнего энергетического уровня (а иногда и , считая снаружи) являются валентными. Валентные электроны наиболее удалены от ядра, наименее прочно связаны с ним, легче всего подвергаются внешним воздействиям.
Состав внешнего энергетического уровня атомов элементов периодической системы с возрастанием порядкового номера изменяется периодически. В зависимости от этого и химические свойства элементов изменяются периодически. У элементов, атомы которых имеют сходные структуры и одинаковое число электронов на внешнем уровне, химические свойства оказываются сходными, хотя общее число электронов и заряд ядра у них различны.
Все элементы периодической системы по химическому поведению и физическим свойствам можно разделить на металлы, неметаллы и инертные элементы (благородные газы).
Металлы, как правило, имеют на наружном энергетическом уровне 1, 2 или 3 электрона.
В периодической таблице элементов к металлам относятся все элементы I, II, III групп, элементы IV группы - и , V группы кроме N, Р, , побочные группы VI и VII, VIII группа, а также лантаноиды и актиноиды, т. е. в периодической системе подавляющее большинство — 82 элемента — металлы. Металлы в реакциях окисления — восстановления проявляют восстановительные свойства, отдавая свои электроны, переходят в положительно заряженные ионы. Отрицательно заряженных ионов они практически не образуют.
Атомы неметаллов на внешнем энергетическом уровне имеют 7, 6, 5, и 4 электрона.
К ним относятся: элементы IV основной подгруппы — углерод и кремний, V основной подгруппы — азот, фосфор и мышьяк, VI — основной подгруппы — О, , Те, VII основной подгруппы — . К неметаллам относятся, как указано выше, Н и В.
Неметаллы в реакциях в зависимости от условий могут принимать электроны (до октета), т. е. выступать в качестве окислителей, и отдавать электроны, т. е. быть восстановителями.
Неметаллов в периодической таблице всего 16.
Инертные элементы (благородные газы) — это 6 элементов периодической системы: Не, . Для них характерна устойчивость внешних энергетических уровней (у Не на внешнем уровне 2 электрона, у остальных инертных элементов по 8), что обусловливает их химическую инертность. В обычных условиях атомы инертных элементов не принимают и не отдают электронов, т. е. не проявляют ни окислительных, ни восстановительных свойств.
В последнее время установлено, что и эти элементы образуют химические соединения. Помимо кристаллогидратов, например , получены , а также соединения и с хинолином.
В 1962 г. Бартлетт показал, что ксенон окисляется , образуя соединение .
Другим исследователям прямым взаимодействием с удалось получить .
Установлено, что с фтором реагирует и радон.
В малых периодах периодической системы с возрастанием порядкового номера число электронов на внешнем уровне непрерывно увеличивается; в связи с этим металлические свойства — способность к отдаче внешних электронов — ослабляются, а неметаллические свойства — способность к принятию внешних электронов — увеличиваются.
Каждый период периодической системы (кроме первого) начи-нается с типичного металла и заканчивается благородным газом.
В больших периодах отдача и принятие электронов в общем происходит так же, как и в малых периодах, с той лишь разницей, что металлические свойства ослабевают гораздо медленнее, так как в них происходит пополнение электронами не последнего электронного слоя, а предпоследнего, у лантаноидов и актиноидов, расположенных в 6-м и периодах, даже третьего энергетического уровня, считая от внешнего. Поэтому в 4-м периоде все элементы первой половины периода имеют на внешнем уровне 2 (реже 1) электрона и характеризуются преобладанием металлических свойств.
У элементов второй половины 4-ого периода (начиная с и кончая ) число электронов на внешнем уровне растет постепенно, как и в малых периодах, и, следовательно, металлические свойства постепенно ослабляются, неметаллические усиливаются.
В пределах главных подгрупп по мере увеличения порядкового номера элемента число электронных уровней у атомов возрастает, внешние электроны располагаются на сравнительно большем расстоянии от ядра, а потому способность их в реакциях переходить к другим атомам, как правило, усиливается; способность же присоединять к себе электроны других атомов ослабляется.
При столкновении или при сближении нейтральных атомов один атом принимает электроны, другой их отдает. Атом, отдающий электроны, может перейти в состояние положительно заряженного иона; атом, принимающий электроны, — в состояние отрицательно заряженного иона.
Положительно заряженные ионы образуют атомы всех элементов, за исключением инертных элементов и фтора.
Если на внешнем уровне атома имеется один электрон и атом относится к -элементам, то он отдает, как правило, только один электрон и переходит в состояние однозарядного положительного иона. Так, щелочные металлы образуют только однозарядные ионы: .
Если на внешнем уровне атома имеется два электрона и атом относится к -элементам, то, как правило, он отдает сразу два электрона и образует двухзарядный положительный ион. Так, атомы II группы периодической системы элементов (четный ряд) образуют ионы .
Если внешний энергетический уровень атома состоит из трех, пяти или семи электронов и атом относится к р-элементам, то он может отдавать последовательно от 1 до 7 электронов.
Атомы, внешний уровень которых состоит из трех электронов, могут отдавать один, два и три электрона. Так, алюминий образует ион , индий — ионы , таллий — ионы и .
Атомы, внешний уровень которых состоит из пяти или семи электронов, как, например, азот и хлор, образуют несколько ионов.
У атомов, внешний уровень которых состоит из четного числа (четырех, шести или восьми) электронов, электроны отрываются парами. Например, атом олова, внешний энергетический уровень которого состоит из четырех электронов, образует ионы и
У d-элементов в первую очередь отрываются электроны внешнего уровня, затем электроны соседнего с внешним уровня, пока в нем не останется восемь электронов.
У f-элементов (лантаноиды и актиноиды) в первую очередь отрываются электроны внешнего уровня, затем соседнего с внешним и, наконец, третьего, считая от внешнего уровня. Лантаноиды, как правило, образуют трехзарядные ионы. Кроме того, и в некоторых соединениях образуют четырехзарядные ионы, а , и — двухзарядкые ионы.
Актиноиды в соединениях могут проявлять следующие валентности: -3, 4; -3, 4, 5; U — 3, 4, 5, 6; -3, 4, 5, 6; -3, 4, 5, 6;
-3, 4, 5, 6;-3, 4;-3, 4; - 3;- 3; - 3; - 3.
Отрицательно заряженные ионы образуются за счет того, что атомам, внешний уровень которых состоит из пяти, шести и семи электронов (неметаллы), легче присоединить еще несколько электронов до восьми на внешнем уровне, чем отдать их. Например:
Атомы, внешний уровень которых содержит один, два и три электрона, отрицательно заряженных ионов не образуют. Чтобы пополнить свой наружный слой до восьми, они должны притянуть пять, шесть и семь электронов, что, естественно, труднее, чем потерять один, два, три электрона.
Нетрудно установить, что
а) наиболее энергично притягивают электроны, при прочих равных условиях, те атомы, внешний уровень которых состоит из семи электронов, т. е. те атомы, которым до полного заполнения внешней электронной оболочки достаточно притянуть один избыточный электрон;
б) наименее энергично притягивают электроны те нейтральные атомы, внешний уровень которых состоит из четырех электронов, т. е. атомы, которым для образования октета необходимо еще четыре электрона;
в) чем больше радиус атома, тем избыточные электроны удерживаются слабее.
Следует еще раз подчеркнуть, что положительно заряженные ионы образуют металлы; отрицательно заряженные ионы образуют неметаллы; атомы инертных газов в обычных условиях ни положительно, ни отрицательно заряженных ионов не образуют (табл. 9, 10).
Таблица 9. Изменение числа электронов на внешнем уровне атомов в процессе реакций окисления — восстановления
Массы трех фундаментальных частиц, выраженные в а.е.м., имеют следующие значения:
масса протона – 1.007277 а.е.м., масса нейтрона – 1.008665 а.е.м., масса электрона – 0.000548 а.е.м.
Указывать массу электрона 0- принципиальная ошибка,вводит учеников в дальнейшие заблуждения.
Где "ровно ноль"? В тексте сказано "ПОЧТИ ноль" и уточнено - в 1836 раз меньше массы протона.
Многие и "почти ноль" не желают знать и помнить.
Цитаты:
Свойства электрона: масса 0 и заряд –1.
Протон Электрон Нейтрон
Масса 1 0 1
Так и пишите"почти 0" или ставьте знак приближенного равенства.
Портал Проза.ру предоставляет авторам возможность свободной публикации своих литературных произведений в сети Интернет на основании пользовательского договора. Все авторские права на произведения принадлежат авторам и охраняются законом. Перепечатка произведений возможна только с согласия его автора, к которому вы можете обратиться на его авторской странице. Ответственность за тексты произведений авторы несут самостоятельно на основании правил публикации и законодательства Российской Федерации. Данные пользователей обрабатываются на основании Политики обработки персональных данных. Вы также можете посмотреть более подробную информацию о портале и связаться с администрацией.
© Все права принадлежат авторам, 2000-2022. Портал работает под эгидой Российского союза писателей. 18+
Впервые термин "ион" был введен в 1834 году, в чем заслуга Майкла Фарадея. После изучения действия электрического тока на растворы солей, щелочей и кислот он пришел к выводу, что в них содержатся частицы, имеющие некий заряд. Катионами Фарадей назвал ионы, которые в электрическом поле двигались к катоду, имеющему отрицательный заряд. Анионы - отрицательно заряженные неэлементарные ионные частицы, которые в электрическом поле движутся к плюсу - аноду.
Данная терминология применяется и сейчас, а частицы изучаются далее, что позволяет рассматривать химическую реакцию как результат электростатического взаимодействия. Многие реакции протекают по этому принципу, что позволило понять их ход и подобрать катализаторы и ингибиторы для ускорения их протекания и для угнетения синтеза. Также стало известно, что многие вещества, особенно в растворах, всегда находятся в виде ионов.
Номенклатура и классификация ионов
Ионы - это заряженные атомы или группа атомов, которая в ходе химической реакции потеряла или приобрела электроны. Они составляют внешние слои атома и могут теряться из-за низкой силы притяжения ядра. Тогда результатом отсоединения электрона является положительный ион. Также если атом имеет сильный ядерный заряд и узкую электронную оболочку, ядро является акцептором дополнительных электронов. В результате этого образуется отрицательная ионная частица.
Сами ионы - это не только атомы с избыточной или недостаточной электронной оболочкой. Это может быть и группа атомов. В природе чаще всего существуют именно групповые ионы, которые присутствуют в растворах, биологических жидкостях тел организмов и в морской воде. Имеется огромное количество видов ионов, названия которых вполне традиционны. Катионы - это ионные частицы, заряженные положительно, а заряженные отрицательно ионы - это анионы. В зависимости от состава их называют по-разному. Например, катион натрия, катион цезия и другие. Анионы называются по-другому, так как чаще всего состоят из многих атомов: сульфат-анион, ортофосфат-анион и другие.
Механизм образования ионов
Химические элементы в составе соединений редко являются электрически нейтральными. То есть они почти никогда не находятся в состоянии атомов. В образовании ковалентной связи, которая считается самой распространенной, атомы также имеют некий заряд, а электронная плотность смещается вдоль связей внутри молекулы. Однако заряд иона здесь не формируется, потому как энергия ковалентной связи меньше, нежели энергия ионизации. Потому, несмотря на различную электроотрицательность, одни атомы не могут полностью притянуть электроны внешнего слоя других.
В ионных реакциях, где разница электроотрицательности между атомами достаточно большая, один атом может забирать электроны внешнего слоя у другого атома. Тогда созданная связь сильно поляризуется и разрывается. Затраченная на это энергия, которая создает заряд иона, называется энергией ионизации. Для каждого атома она различная и указывается в стандартных таблицах.
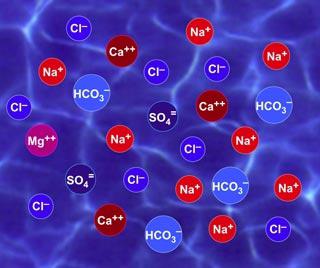
Ионизация возможна только в том случае, когда атом или группа атомов способен либо отдавать электроны, либо акцептировать их. Чаще всего это наблюдается в растворе и кристаллах солей. В кристаллической решетке также присутствуют почти неподвижные заряженные частицы, лишенные кинетической энергии. А поскольку в кристалле нет возможности для передвижения, то реакция ионов протекают чаще всего в растворах.
Ионы в физике и химии
Физики и химики активно изучают ионы по нескольким причинам. Во-первых, эти частицы присутствуют во всех известных агрегатных состояниях вещества. Во-вторых, энергию отрыва электронов от атома можно измерить, чтобы использовать это в практической деятельности. В-третьих, в кристаллах и растворах ионы ведут себя по-разному. И, в-четвертых, ионы позволяют проводить электрический ток, а физико-химические свойства растворов меняются в зависимости от концентраций ионов.
Ионные реакции в растворе
Сами растворы и кристаллы следует рассмотреть детальнее. В кристаллах солей существуют отдельно расположенные положительные ионы, к примеру, катионы натрия и отрицательные, анионы хлора. Структура кристалла удивительна: за счет сил электростатического притяжения и отталкивания ионы ориентируются особым образом. В случае с хлоридом натрия они образуют так называемую алмазную кристаллическую решетку. Здесь каждый натриевый катион окружен 6 хлоридными анионами. В свою очередь, каждый хлоридный анион окружает 6 анионов хлора. Из-за этого простая поваренная соль и в холодной и горячей воде растворяется почти с одинаковой скоростью.

В растворе тоже не существует цельной молекулы хлорида натрия. Каждый из ионов здесь окружается диполями воды и хаотично передвигается в ее толще. Наличие зарядов и электростатических взаимодействий приводит к тому, что солевые растворы воды замерзают при температуре чуть меньше нуля, а кипят при температуре выше 100 градусов. Более того, если в растворе присутствуют другие вещества, способные вступить в химическую связь, то реакция протекает не с участием молекул, а ионов. Это создало учение о стадийности химической реакции.
Те продукты, которые получаются в конце, не образуются сразу в ходе взаимодействия, а постепенно синтезируются из промежуточных продуктов. Изучение ионов позволило понять, что реакция протекает как раз по принципам электростатических взаимодействий. Их результатом является синтез ионов, которые электростатически взаимодействуют с другими ионами, создавая конечный равновесный продукт реакции.
Резюме
Такая частица, как ион, это электрически заряженный атом или группа атомов, которая получается в ходе потери или приобретения электронов. Самым простым ионом является водородный: если он теряет один электрон, то представляет собой лишь ядро с зарядом +1. Он обуславливает кислую среду растворов и сред, что важно для функционирования биологических систем и организмов.
Ионы могут иметь как положительные, так и отрицательные заряды. За счет этого в растворах каждая частица вступает в электростатическое взаимодействие с диполями воды, что также создает условия для жизни и передачи сигналов клетками. Более того, в ионные технологии развиваются дальше. К примеру, созданы ионные двигатели, которыми оснащалось уже 7 космических миссий NASA.
РАЗДЕЛ И. ОБЩАЯ ХИМИЯ
2. Строение атома
2.4. Электрон. Электронные слои
2.4.3. Устойчивость электронных слоев. Превращение атомов в ионы
Наиболее устойчивой электронной конфигурацией атома является такая, при которой во внешнем электронном слое размещается 2 (как г атома Гелия) или 8 е - (как в атомах других инертных газов). Восьмиелектронний внешний слой атома называют электронным октетом. Во время химических реакций атомы стремятся получить именно такую самую устойчивую электронную конфигурацию. Это достигается в результате присоединения или отдачи электронов внешнего электронного слоя. Атомы металлических элементов, которые имеют во внешнем электронном слое 1-3 e - , теряя их, получают положительный заряд и превращаются в ; Положительно заряженные ионы - катионы :

Электронная формула атома Калия - 40К 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 1 . На последнем энергетическом уровне в атоме размещается один электрон, а на предпоследнем - восемь (октет). Во время химический реакций атом Калия втра: чает именно один электрон (4 s 1 ), превращаясь в положительно заряженный ион - катион Калия К + :

Атомы неметаллических элементов, которые имеют во внешнем электронном слое 4-7 электронов, во время химических реакций присоединяют один или несколько электронов, получают отрицательный заряд и превращаются в отрицательно заряженные ионы - анионы, Например, атом Кислорода имеет следующую электронную формулу: 8В 1 s 2 2 s 2 2 p 4 . До завершения электронного слоя ему не хватает двух электронов. Во время химических реакций атом Кислорода присоединяет эти два электрона:
превращаясь в отрицательно заряженный ион - амнион Кислорода О 2 - :

Радиусы катионов меньше радиусов соответствующих атомов (поскольку уменьшается число электронных слоев). Радиусы анионов и соответствующих атомов почти одинаковые.
Остальные элементы стремятся принять конфигурацию благородного газа, превращаясь при этом в ионы.
Рассмотрим данный процесс на примере некоторых элементов.
Конфигурация благородного газа. Образование ионной связи.

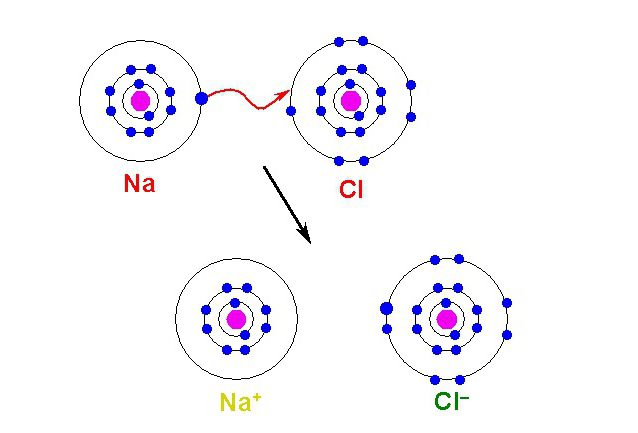
Строение атома натрия
Атому натрия, для завершения внешнего энергетического уровня не хватает семь электронов, притянуть такое количество, имея большой радиус и небольшое количество протонов оказывается невозможным. Поэтому натрию легче отдать электрон внешнего уровня, тогда второй уровень станет внешним, на нём как раз расположено восемь электронов.
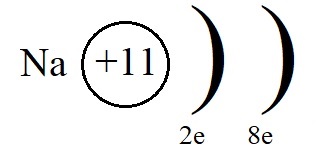
Однако, при этом количество протонов в ядре остаётся равным одиннадцати, а электронов теперь всего десять. Элементарные вычисления (+11-10 = +1) дают нам понять, что теперь это не атом, а положительно заряженная частица – ион:
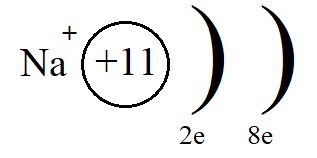
Ионы, несущие положительный заряд, называются катионами.
Если же мы рассмотрим строение внешнего энергетического уровня фтора, то обнаружим, что этому элементу до завершенного внешнего уровня не хватает всего одного электрона:
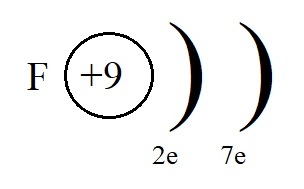
Этот электрон фтор может получить от натрия, превратившись при этом в отрицательно заряженную частицу – анион:
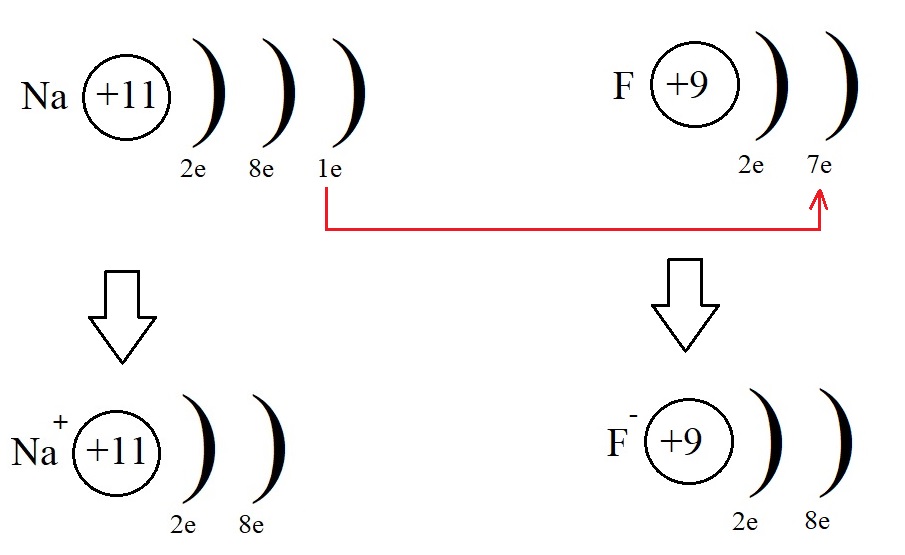
Оба атома при таком взаимодействии приняли конфигурацию благородного газа (8 электронов на внешнем уровне), превратились в ионы, после чего притянулись друг к другу из-за противоположных знаков и образовали фторид натрия NaF. Так образуется ионная связь.
Элементы, которые с наибольшей вероятностью отдают электроны, называют металлами, у них хорошо выражены восстановительные свойства (способность отдавать свои электроны, восстанавливая электронную оболочку другого атома до восьмиэлектронной).
Элементы, отдающие электроны (восстановители) повышают свою степень окисления, тогда как элементы, принимающие электроны (окислители) – понижают степень окисления за счет того, что принятые электроны несут отрицательный заряд.
Читайте также:

