Твердотельный электролит своими руками
Добавил пользователь Morpheus Обновлено: 04.10.2024
Еще в конце прошлого века, в период всеобщего бума, знаменовавшего начало электрической эры, известный немецкий физик В, Нернст создал довольно необычную лампу накаливания. В ней вместо угольной или металлической нити, помещенной в вакуум или инертную атмосферу, находился открытый стерженек, изготовленный из смеси оксидов циркония и иттрия.
Это была первая, хотя и неудачная попытка применить на практике так называемые твердые электролиты — довольно необычную группу кристаллических ионных соединений, проводящих ток в результате движения ионов, а не электронов. Неудача Нернста объяснялась тем, что такую лампу приходилось зажигать … спичкой, поскольку керамический стерженек начинал проводить ток лишь при 800°С.
Тем не менее сегодня подобные нагревательные элементы (только в них вместо оксида иттрия обычно содержится оксид кальция) широко используются в технике для создания высоких температур, так как в отличие от металлических нагревателей они не только не окисляются на воздухе, но работают тем лучше, чем окислительнее среда.
И вообще, в последнее время исследованием твердых электролитов стали заниматься многие ведущие лаборатории мира, поскольку есть надежда, что с помощью ионных проводников удастся решить многие проблемы современной техники, в том числе и современной энергетики.
Но прежде разберемся в том, ПОЧЕМУ ОНИ ПРОВОДЯТ ток.
У большинства ионных кристаллов ионы каждого сорта занимают вполне определенные позиции, причем число этих позиций в точности соответствует числу имеющихся ионов. Например, в кристалле NaCl каждый ион Nа + находится в центре октаэдра, вершины которого заняты ионами Cl — , и наоборот, каждый ион Сl — располагается в симметричном окружении шести ионов Na + (рис. 1).
Этот жесткий порядок начинает в какой-то мере нарушаться лишь при высоких температурах, когда амплитуда колебаний ионов возрастает настолько, что некоторые частицы оказываются способными покинуть свои насиженные места в узлах кристаллической решетки и перейти в междоузлия или на поверхность кристалла (рис. 2).
Появление свободных узлов или, как говорят, ионных вакансий делает возможной ионную проводимость, которая хотя и растет с температурой, но остается достаточно малой даже близ температуры плавления — в этом смысле кристалл NaCl можно считать своеобразным ионным полупроводником. И лишь после плавления кристалла (или его растворения в подходящем растворителе) ионы обретают полную свободу.
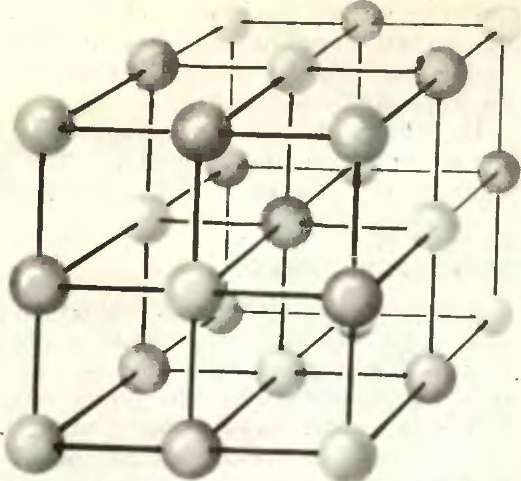
Строение ионного кристалла (например, NaCl) строго упорядочено А вот в оксиде циркония, содержащем примесь оксида кальция, дело обстоит несколько иначе. Когда в кристаллическую решетку ZrO2 вводится СаО, ионы Са 2+ встраиваются вместо ионов Zr 4+ , а ионы О 2- достраивают кислородную подрешетку. Однако полностью ее достроить им не удается, так как с каждым новым ионом Са 2+ в кристалл вводится только один ион O 2- , в то время как с каждым ионом Zr 4+ должно связываться по два иона.
Иначе говоря, в кристалле возникает дефицит кислорода, появляются беспорядочно рассредоточенные по решетке кислородные вакансии, А коли так, то ионы O 2- обретают повышенную подвижность, способность мигрировать по кристаллу, придавая ему тем самым способность проводить электрический ток.
Тут надо заметить интересную особенность твердых электролитов: их сходство с жидкостями. Наличие большого числа вакансий, беспорядочно расположенных в кристаллической решетке, по сути дела означает нарушение строгого дальнего порядка, характерного для настоящих твердых кристаллических тел; такое отсутствие дальнего порядка присуще, однако, жидкостям. Чем меньше порядка в той или иной подрешетке кристалла и чем подвижнее составляющие ее ионы, тем больше сходство кристалла с жидкостью, вернее не всего кристалла, а лишь одного из его компонентов.
ПРИ КОМНАТНОЙ ТЕМПЕРАТУРЕ?
Чем жестче и упорядоченнее кристаллическая решетка, образованная ионами одного сорта, и чем беспорядочнее и подвижнее ионы другого сорта, тем ниже температура, при которой может работать твердый электролит. При этом ионная жидкость, обеспечивающая электропроводность, может состоять не только из ионов кислорода, она может быть образована даже ионами металлов.
Были открыты и другие ионные сверхпроводники — такие, например, как Ag6I5WO4, Ag19I15Р2O7. Все они содержат серебро, что, конечно, значительно ограничивает возможность их широкого применения: во-первых, серебро дорого, а во-вторых, химическое сродство Ag к I невысоко, в результате чего удельная энергоемкость Ag—I-батареи почти в десять раз меньше удельной энергоемкости батареи, основанной на взаимодействии иода, скажем, с литием.
Впрочем, литий-иодная батарея существует. В ней в качестве твердого электролита используется сам LiI, способный проводить ток в результате перемещения ионов лития. Такая батарея имеет э.д.с. до 2,8 Вольта (э.д.с. Ag—I-батареи не превышает 0,7 вольта) и была бы прекрасным источником тока, если бы не слишком низкая проводимость LiI. Это вынуждает применять его в виде очень тонких пленок, что технологически крайне сложно.
Значит, нужны другие ионные сверхпроводники, пропускающие ток в результате движения ионов Li + или, на худой конец, ионов Mg 2+ , Ca 2+ , Zn 2+ … Эта задача, однако, не так проста: тут мало надежды на случайный успех. Но в теории ионной проводимости еще очень много неясного, и поэтому все надежды исследователеи связаны с дальнейшим развитием теоретических представлений, способных сделать поиск целенаправленным.
Но пока ионная сверхпроводимость остается еще дразнящей приманкой, быть может, стоит изучать
НЕ ТОЛЬКО СВЕРХПРОВОДНИКИ
Свыше сорока лет назад технологи заметили, что при плавлении соды в печах, футерованных β-глиноземом, на поверхности огнеупора образуется необычная кристаллическая фаза, которую сочли за новую модификацию Al2O3 и потому назвали β-глиноземом. Позже выяснилось, что в действительности β-глинозем представляет собой соединение Na2O * nAl2O3 переменного состава (5,5 + легко замещаются ионами других щелочных металлов, что, очевидно, связано с их аномально высокой подвижностью.
Однако прошло еще более 25 лет, пока необычные свойства β-глинозема не нашли практического применения: в 1968 году в США был выдан патент на высокоэффективную натрий-серную батарею с рекордной энергоемкостью — до 300 ватт-часов на один килограмм веса.
При нагревании ионного кристалла идеальный порядок начинает нарушаться, ионы переходят в междоузлия (слева)
или выводят на поверхность кристалла (справа). В результате в твердом электролите идеального порядка нет и при температурах, далеких от температуры плавления
Принципиальная схема натрий-серной батареи, в которой твердым электролитом служит Na + проводящий β-глинозем В сравнении с обычными электрохимическими системами эта батарея устроена, так сказать, шиворот-навыворот в ней электродами служат не твердые вещества, а расплавы натрия и серы, в то время как вместо жидкого электролита используется твердый β-глинозем, обладающий ионной проводимостью (рис. 3). Ионы натрия переносятся через мембрану из твердого электролита, давая в результате взаимодействия с серой сульфиды, а электроны движутся по внешней цепи.
Изобретение такой батареи сделало реальностью электромобиль, не загрязняющий внешнюю среду ядовитыми выхлопами и вместе с тем способный преодолеть расстояние в 500-600 км со средней скоростью 70 км/час.
К сожалению, у Na—S-батарей есть один крупный недостаток: поскольку в результате реакции образуются сравнительно высокоплавкие сульфиды натрия, батарея работает лишь при 300°С, и ее надо либо постоянно поддерживать в сильно нагретом состоянии, либо тратить на стартовый разогрев много времени. Увы, несмотря на отдельные успехи, идеальная батарея не создана до сих пор, и виной тому — сравнительно ограниченный выбор твердых электролитов, обладающих достаточной проводимостью нужного типа при не слишком высоких температурах.
Поэтому, естественно, во всех технически развитых странах идет поиск новых электрохимических систем, не обладающих недостатками натрий-серной батареи, но имеющих не меньшую энергоемкость. Работы по созданию новых твердых электролитов — в том числе и на основе β-глинозема — ведутся, в частности, на химическом факультете Московского государственного университета при участии автора статьи. С помощью разработанного здесь метода криосинтеза * удалось создать модификации β-глинозема, в которых проводимость обусловлена ионами Li + , К + , Rb + , Cs + , Тl + , Аg + , Ga + , NO + , NH4 + , Cu + — целое семейство разнообразных ионных проводников. Когда же твердые электролиты окончательно перестанут быть экзотикой, это откроет перед техникой буквально
Не так давно у β-глинозема было обнаружено еще одно необычное свойство: оказалось, что его проводимость существенно зависит от давления водорода в окружающей среде. Хотя природа этого явления еще не выяснена, на его основе были немедленно созданы чувствительные детекторы водорода, крайне необходимые, например, в химической промышленности. Говоря о водороде, нельзя не упомянуть о научно-технической проблеме, которая сейчас оживленно обсуждается, — о переводе энергетики с электричества на водород. Суть ее заключается в том, что энергию, полученную тем или иным способом, можно использовать для разложения воды на кислород и водород; последний можно практически без потерь транспортировать по трубам на далекие расстояния.
Существующие топливные элементы, дающие электрический ток в результате взаимодействия водорода с кислородом, основаны на применении жидких электролитов, что существенно снижает возможность их широкого использования — несравненно больший эффект сулит применение твердых кислородпроводящих электролитов.
Но еще заманчивее создать твердые электролиты, проводящие электрический ток в результате движения ионов водорода — протонов. Не говоря уже о том, что такие электролиты можно было бы использовать в тех же топливных элементах, их можно было бы использовать вместо труб, для транспортировки водорода в виле ионов, Подумайте только: тогда бы водородное топливо можно было передавать подобно обычной электроэнергии — по проводам, изготовленным из такого протон-проводящего твердого электролита!
Но возможности применения твердых электролитов не ограничиваются только энергетикой.
Известно, что граница раздела между разнородными материалами обладает особыми свойствами. Это в полной мере относится и к границе раздела между твердым электролитом и электронным проводником.
Например, если на поверхность кристалла Ag4RbI5 нанести платиновые или графитные контакты и наложить внешнее электрическое поле, то через раздел фаз ток идти не будет, поскольку графит или платина блокируют движение ионов Ag + , а кристаллы Ag4RbI5 — движение электронов. В результате на границе раздела будет накапливаться электрический заряд, образованный ионами Ag + с одной стороны и электронами — с другой.
Иначе говоря, такая система способна служить электрическим конденсатором. Причем, поскольку расстояние между обкладками такого конденсатора может быть доведено до расстояния между атомами, он способен иметь феноменальную емкость.
Способность ионных проводников пропускать только ионы можно использовать и иначе. Если на кристалл Ag4RbI5 нанести два серебряных электрода, то при пропускании тока масса одного электрода станет убывать, а другого — увеличиваться в точном соответствии с количеством прошедшего электричества. И поэтому подобная система может быть использована для очень точных электрических измерений, а также для создания интегральных элементов памяти.
А если на тот же кристалл нанести электроды, один из которых серебряный, а другой — платиновый, то в результате пропускания тока в одном из направлений серебро будет переноситься через твердый электролит и откладываться на платине в количестве, пропорциональном количеству прошедшего электричества. Если же внешний источник тока отключить и замкнуть цепь, то в системе возникнет ток противоположного направления, и этот ток будет идти до тех пор, пока с платины не удалится все осажденное серебро. Так можно создавать автоматические переключающие устройства с периодами переключения тока от нескольких секунд до нескольких месяцев.
Многие свойства твердых электролитов до сих пор остаются тайной, и трудно сказать, как скоро они будут познаны до конца. Но игра, как говорится, стоит свеч: ионным проводникам предстоит рано или поздно совершить переворот во многих наших представлениях о возможностях химических источников тока.
Эти и подобные исследования, в итоге, вылились в соpдание датчика кислорода , которые начали использоваться в системах управления двигателями для контроля содержания кислорода отработавших газах с целью формирования стехиометрической смеси и снижения нагрузки на катализаторы.
Но все равно в процессе эксплуатации катализаторы выходят из строя и требуют замены или удаления. Для обеспечения корректной работы блоков управления, при удалении или отказе катализатора требуется установка эмулятора катализатора.

Разработан новый твердый электролит для натрий-ионных аккумуляторов на основе бороводородов. С его помощью швейцарские ученые создали полностью твердый и стабильный аккумулятор с напряжением три вольта, сообщается в исследовании швейцарских ученых, опубликованном в журнале Energy & Environmental Science.
Большинство современных устройств, таких как смартфоны, ноутбуки и даже электромобили, используют в качестве источника энергии литий-ионные аккумуляторы. Их популярность обусловлена в первую очередь высокой емкостью. Но ученые рассматривают и другие материалы для создания аккумуляторов. Одним из перспективных материалов считается гораздо более дешевый натрий.
Натрий-ионные аккумуляторы устроены таким же образом, как и литий-ионные. Они состоят из анода и катода, разделенного электролитом, через который перемещаются ионы металла (лития или натрия). Во время разрядки ионы металла перемещаются к катоду, а электроны к аноду. Во время зарядки процессы идут в обратном направлении. Проблема таких аккумуляторов заключается в том, что металл может осаждаться на электрод неравномерно и образовывать дендриты — кристаллические отростки древовидной формы. Эти дендриты могут разрушать сепаратор, который отделяет анод от катода, из-за чего может произойти короткое замыкание, которое, в свою очередь, может вызвать возгорание или даже взрыв аккумулятора.
Ученые разрабатывают разные пути решения этой проблемы, в том числе аккумуляторы с твердым электролитом, который препятствует образованию дендритов. Исследователи под руководством Арндта Ремхофа (Arndt Remhof) из Швейцарского федерального исследовательского института материаловедения и технологий (Empa) решили совместить низкую стоимость сырья для натрий-ионных аккумуляторов и безопасность твердотельных электролитов. Для этого они разработали новый электролит с высокой проводимостью натриевых ионов, состоящий из клозобората Na2(B12H12)0.5(B10H10)0.5.

Léo Duchêne et al., / Energy & Environmental Science, 2017
На его основе они собрали аккумулятор с натриевым анодом и катодом из NaCrO2. Для этого они спрессовали порошок электролита и порошок для катода, в который предварительно также добавили небольшую долю Na2(B12H12)0.5(B10H10)0.5. К полученному материалу они добавили натриевую фольгу и собрали аккумуляторную ячейку. Исследователи протестировали ее электрохимические свойства, и выяснили, что ее напряжение составляет три вольта, емкость около 85 миллиампер-часов на грамм. При этом аккумулятор сохраняет около 80 процентов емкости после 250 циклов зарядки-разрядки в режиме пятичасового разряда (C/5).
В 2015 году американские физики создали более стабильный катод для натрий-ионных аккумуляторов на основе эльдфеллита, а недавно другая группа американских ученых разработала другой катод для аккумуляторов такого типа, который позволит достичь емкости, сравнимой с литий-ионными аккумуляторами при гораздо меньшей стоимости производства. Также недавно исследователи предложили новый метод борьбы с образованием дендритов в литий-ионных аккумуляторах — добавлять в их электролит наноалмазы, которые значительно увеличивают количество точек роста на поверхности электрода, и тем самым обеспечивают равномерное осаждение металла.
В обычной конструкции аккумуляторов чаще всего используются два твердых металлических электрода с жидкой литиевой солью, действующей в качестве электролита. Ионные частицы движутся от одного электрода (катода) к другому (аноду), когда заряжается аккумулятор, и наоборот, когда он разряжается. Жидкий электролит литиевой соли – это среда, которая обеспечивает это движение. Если вы когда-либо видели пробитую батарею смартфона, то видели как из неё сочится жидкость, которая представляет собой жидкий электролит.

Хотя идея твердотельных батарей существует уже много десятилетий, успехи в их развитии только появились, благодаря стимуляции через инвестиции от компаний, производящих электронику, электромобили и промышленную продукцию.
Преимущества твердотельных аккумуляторов
Твердотельные батареи сжимают анод, катод и электролит на три плоских слоя, вместо суспендирования электродов в жидком электролите. Это означает, что вы можете сделать их меньше или, по крайней мере, более плоскими, при этом удерживая столько же энергии, сколько более крупная батарея на основе жидкости.
Если вы замените литий-ионный или литиево-полимерный аккумулятор на своем телефоне или ноутбуке на твердотельную батарею такого же размера, она сможет удерживать намного больший заряд.
Твердотельные батареи также более безопасны, поскольку нет токсичных, легковоспламеняющихся жидкостей, и они не выделяют столько тепла, сколько обычные аккумуляторные батареи.
Согласно последним исследованиям, твердотельная батарея может превосходить обычные перезаряжаемые батареи на 500% и больше с точки зрения мощности и заряжаться в десятки раз быстрее.
Каковы недостатки твердотельных аккумуляторов
Поскольку твердотельные батареи представляют собой новую технологию, они невероятно дороги в производстве. Так дорого, что пока они не установлены ни на одном крупном потребительском устройстве.
В 2012 году аналитики подсчитали, что типичная твердотельная батарея размером со смартфон будет стоить около 15000 долларов США. Один достаточно большой для питания электромобиля элемент обойдется в 100000 долларов.
Отчасти это связано с тем, что отсутствует производственная экономия – сотни миллионов жидких перезаряжаемых батарей производятся каждый год прямо сейчас, поэтому стоимость производства материалов и оборудования распределяется по огромным линиям. Вместе с тем, существует лишь несколько компаний и университетов, изучающих твердотельные батареи, поэтому стоимость производства пока астрономическая.
Когда появятся твердотельной аккумуляторы
Как и для всех новых технологий, попытка понять, когда мы получим её на руки, – это, в лучшем случае, догадки.
Отрадно, что огромные корпорации инвестируют в исследования, необходимые для вывода на рынок твердотельных аккумуляторов, но в ближайшем будущем они не смогут совершить крупный прорыв, трудно сказать, будет ли большой шаг вперед.
По крайней мере, одна автомобильная компания заявляет, что к 2023 году она будет готова поставить на рынок транспортное средство с твердотельным источником питания, но можно только догадываться, сколько будет стоить этот автомобиль. Пять лет кажутся слишком оптимистичными; вероятнее всего, десять лет. А, может, двадцать лет или более до того, прежде чем будут урегулированы все проблемы с материалами и будут разработаны производственные процессы.
Но, как мы уже говорили в начале статьи, обычная технология аккумуляторов достигла потолка. И нет иного выхода, как стимулировать исследования и разработки. Возможно, что в скором времени вы всё-таки сможете использовать гаджет или автомобиль на базе твердотельной батареи.
Готовность к массовому коммерческому производству оценивается к 2025-му году [Bloomberg, 28 октября 2021].
Узнайте, чем технология отличается от других, и почему во всём мире не видят без твердотельной батареи никакого будущего.

Что это значит — твердотельный аккумулятор?
Твердотельный электролит — это полимерные и композитные материалы на основе неорганических оксидов и сульфидов. Каждый разработчик, исследователь и стартап изучает собственные уникальные формулы химического состава, часто они патентуются.
Например, у Toyota было 203 патента в области твердотельных аккумуляторов за 2010-2018, у Samsung и Fuji Film по 35, у Murata 33, у Panasonic 30 [Statista, 19 октября 2021].
Погоня исследований объясняется просто. В случае успеха и выхода на коммерческое производство, разработчик получит несравнимые преимущества за счёт владения более совершенной технологией, чем литий-ионная. Ставки высоки.

Преимущества (плюсы) твердотельного аккумулятора
- • Переход от графита на аноде (как у Li-ion) к чистому литию увеличивает удельную энергию (меньше размеры и вес, дольше держит заряд);
- • трёхмерная структура поверхностей позволяет сделать слои тоньше (увеличивается ёмкость, дольше работает от одной зарядки);
- • отказ от жидкого электролита в пользу твёрдого полимера или керамического сепаратора решает проблему дендритов (увеличен срок службы);
- • совокупное применение новых материалов позволяет ячейке принимать заряд за короткое время (самая быстрая зарядка из доступных).
Исследователи не сдаются, хотя им предстоит ещё решить огромное количество инженерных проблем, с которыми все они столкнулись при разработке твердотельных аккумуляторов.

Недостатки (минусы) твердотельного аккумулятора
- • Литиевый анод подвержен расширению при заряде и сжатию при разряде (проблема безопасности, для которой фактически найдено решение);
- • пока удаётся уменьшить размеры, но не вес ячеек (например, в электромобилях важнее уменьшить массу транспортного средства);
- • безопасность сильно зависит от конкретных материалов и их сочетания (одни твердотельные аккумуляторы безопаснее других);
- • плохая проводимость материалов при низких температурах (хуже приспособлены к зимней эксплуатации, чем литий-ионные);
- • доказательств срока службы больше, чем у литий-ионных не предоставлено до сих пор (проблема скрыта в сложной диагностике ячеек из-за конструкции);
- • фактор, который говорит скорее о невысоком сроке службы — относительно высокое внутреннее сопротивление таких ячеек.
Поэтому технология твердотельных аккумуляторов всё ещё исследуется. Сейчас вы не найдёте в массовой продаже ячейки такого типа за редким исключением (опытные поставки).
Если вам понравилась статья, рекомендуем поинтересоваться про литий-керамическую технологию.
В настоящее время выбор аккумуляторных батарей огромен — в продаже можно найти уже готовые к использованию источники питания, а также сухозаряженные батареи, которые требуют осуществить приготовление электролита и его заливку до начала эксплуатации. Дальнейшее обслуживание аккумуляторов многие часто осуществляют в сервисах. По разным причинам может возникнуть необходимость самостоятельно приготовить раствор. Чтобы это мероприятие увенчалось успехом, следует знать, как сделать электролит в домашних условиях.
Что такое электролит?

Электролит — электропроводящий раствор, содержащий в своём составе дистиллированную воду и серную кислоту, едкий калий или натрий в зависимости от типа источника питания.
Концентрация серной кислоты в АКБ
Этот показатель кислотности напрямую зависит от необходимой плотности электролита. Изначально средняя концентрация этого раствора в автомобильном аккумуляторе — около 40% в зависимости от температуры и климата, в которых используется источник питания. Во время эксплуатации концентрация кислоты падает до 10–20%, что сказывается на работоспособности АКБ.
Вместе с тем стоит понимать, что аккумуляторная серная составляющая — наичистейшая жидкость, которая на 93% состоит непосредственно из кислоты остальные 7% — примеси. На территории России производство этого химиката строго регламентировано — продукция должна соответствовать требованиям ГОСТ.
Отличия электролитов для разных типов аккумуляторов
Несмотря на то что принцип работы раствора одинаков для разных источников питания, следует знать о некоторых различиях составов. В зависимости от состава принято выделять щелочной и кислотный электролиты.
Щелочные АКБ

Этот вид источников питания характеризуется наличием гидроокиси никеля, окиси бария и графита. Электролит в этом виде аккумуляторов представляет собой 20% раствор едкого калия. Традиционно используется добавка моногидрата лития, которая позволяет продлить срок эксплуатации АКБ.
Щелочные источники питания отличаются отсутствием взаимодействия калийного раствора с веществами, образуемыми во время работы аккумулятора, что способствует аксимальному уменьшению расхода.
Кислотные АКБ

Этот вид источников питания является одним из самых традиционных, поэтому и раствор в них знаком многим — смесь дистиллированной воды и серного раствора. Концентрат электролита для свинцово-кислотных аккумуляторов дешёво стоит и характеризуется способностью проводить ток большой величины. Плотность жидкости должна соответствовать климатическим показателям.
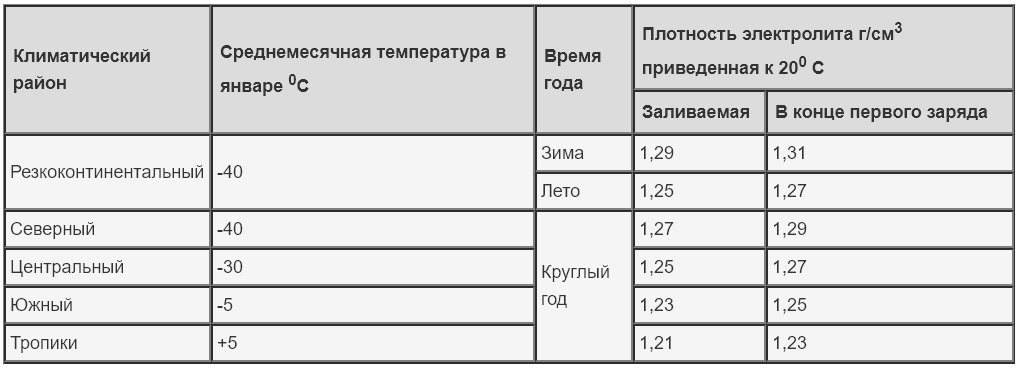
Таблица 1. Рекомендуемая плотность электролита
Другие виды АКБ: можно ли приготовить электролит для них самостоятельно?

Отдельно хотелось бы обратить внимание на современные свинцово-кислотные источники питания — гелевые и AGM. Они также могут быть заправлены собственноручно приготовленным раствором, который в них находится в специфической форме — в виде геля или внутри сепараторов. Для заправки гелевых аккумуляторов понадобится ещё один химический компонент — силикагель, который загустит кислотный раствор.
Кадмиевоникелевые и железоникелевые аккумуляторы
В отличие от свинцовых источников питания, кадмиево- и железоникелевые заливаются щелочным растовром, который является смесью дистиллированной воды и едкого калия или натрия. Гидроксид лития, входящий в состав этого раствора для определённых температурных режимов, позволяет увеличить срок службы АКБ.

Таблица 2. Состав и плотность электролита для кадмиево- и железоникелевых и аккумуляторов.
Железоникелевые источники питания рекомендуется эксплуатировать в тех же условиях, что и кадмиево-никелевые. Однако стоит отметить, что они более восприимчивы к низким температурам. Поэтому их следует использовать до минус 20 градусов.
Как правильно приготовить электролит в домашних условиях: техника безопасности
Приготовление раствора — работа с кислотами и щелочами, поэтому соблюдение мер предосторожности необходимо для самых опытных людей. Перед началом действия подготовьте средства защиты:
- резиновые перчатки
- одежду и фартук, устойчивый химическим веществам;
- защитные очки;
- нашатырный спирт, кальцинированную соду или борный раствор, чтобы нейтрализовать кислоту и щёлочь.
Оборудование
Для приготовления аккумуляторного электролита помимо самого источника питания потребуются следующие предметы:
- ёмкость и палочка, устойчивые к воздействию кислот и щелочей;
- дистиллированная вода;
- инструменты для измерения уровня, плотности и температуры раствора;
- аккумуляторная серная жидкость — для кислотной АКБ, твёрдые или жидкие щелочи, литий — для соответствующих видов АКБ, силикагель — для гелевых аккумуляторов.
Последовательность процесса: делаем электролит для кислотно-свинцового источника питания
Перед началом работ ознакомьтесь с информацией, приведённой в таблице 3. Она позволит выбрать необходимый объем жидкостей. В аккумуляторах залито от 2,6 до 3,7 литра кислотного раствора. Мы рекомендуем разводить примерно 4л электролита.
Таблица 3. Пропорции воды и серной кислоты.
- В ёмкость, устойчивую к едким веществам, налейте нужный объем воды.
- Разбавлять воду кислотой следует постепенно.
- По окончании процесса вливания замеряйте плотность получившегося электролита с помощью ареометра.
- Дайте составу отстояться около 12 часов.
Таблица 4. Плотность электролита для разных климатов.
Концентрация кислотного раствора должна соотноситься с минимальной температурой, при которой эксплуатируется аккумулятор. Если жидкость получилась слишком концентрированной, её необходимо разбавить дистиллированной водой.
Смотрите видео, как измерить плотность электролита.
Внимание! Вливать воду в кислоту нельзя! В результате этой химической реакции может возникнуть закипание состава, что приведёт к его расплескиванию и возможности получить кислотные ожоги!
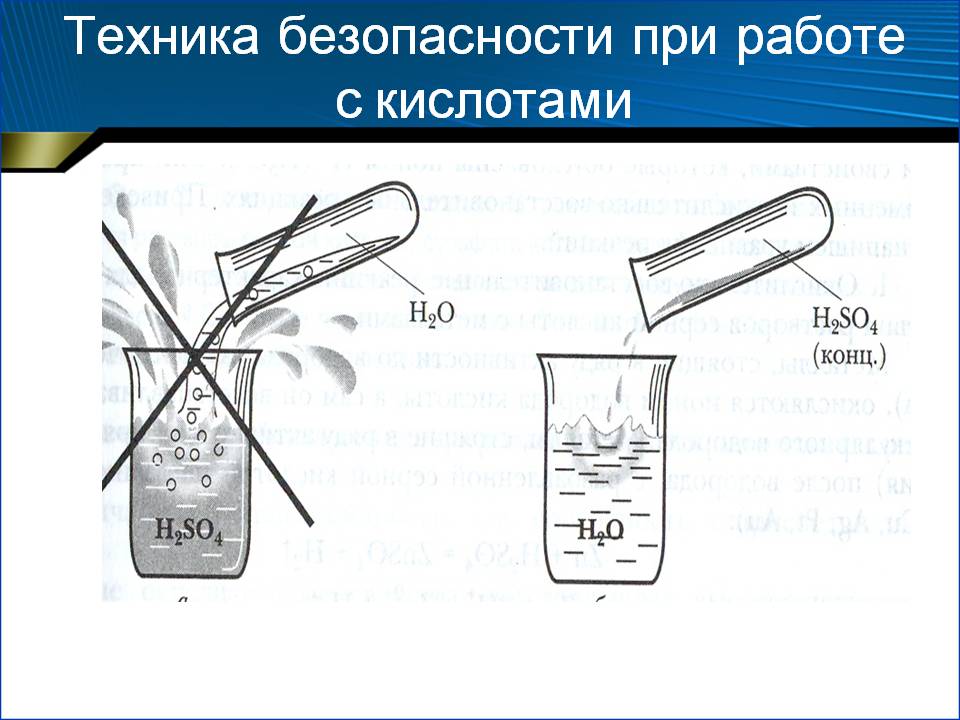
Обращаем ваше внимание, что во время смешивания компонентов выделяется тепло. В подготовленный аккумулятор следует заливать остывший раствор.
Способ развести электролит для щелочного источника питания
Плотность и количество электролита в таких аккумуляторах указана в инструкции по эксплуатации источника питания или на сайте компании-производителя.
Необходимая плотность раствора
Количество твёрдой щелочи равняется количеству электролита, разделенному на
- Влейте в посуду дистиллированную воду.
- Добавьте щелочь.
- Смешайте раствор, герметично его закройте и дайте настояться в течение 6 часов.
- По истечении времени слейте образовавшийся светлый раствор — электролит готов.
При появлении осадка следует его перемешивать. Если к концу отстаивания он остаётся, слейте электролит так, чтобы осадок не попал в аккумулятор — это приведёт к уменьшению срока его эксплуатации.
Внимание! Во время работ температура щелочного раствора не должна превышать 25 градусов по Цельсию. Если жидкость чрезмерно нагревается, охладите её.
После приведения раствора к комнатной температуре и его заливке в аккумулятор, источник питания необходимо полностью зарядить током, составляющим 10% от ёмкости АКБ (60Ач — 6А).
Как видите, приготовление раствора электролита не такое сложное дело. Главное, следует чётко определиться с необходимым количеством ингредиентов и помнить о безопасности. Вы пробовали развести электролит своими руками? Поделитесь опытом с нашими читателями в комментариях.
Читайте также:

