Сульфид натрия своими руками
Обновлено: 08.07.2024
Оглавление диссертации кандидат технических наук Гайсин, Ленар Гайнуллович
Глава 1. ЛИТЕРАТУРНЫЙ ОБЗОР ПРОИЗВОДСТВА СУЛЬФИДОВ НАТРИЯ И БАРИЯ И ОБОСНОВАНИЕ
ВЫБОРА НАПРАВЛЕНИЙ ИССЛЕДОВАНИЯ
1.1. Области применения сульфидов натрия и бария, общие сведения о качестве, производстве и потреблении сульфидов натрия и бария в РФ и за рубежом
1.2. Производство сульфида натрия в Российской Федерации
1.3.Производство сульфида натрия за рубежом
1.4.Производство сульфида бария , 36 1.5.0боснование выбора направлений и задачи исследования
Глава 2. ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ
КОНВЕРСИОННОГО СПОСОБА ПОЛУЧЕНИЯ СУЛЬФИДА НАТРИЯ
2.1.Исследование процесса конверсии 45 2.2.0собенности восстановительного обжига оборотного сульфата бария
2.3.Результаты цикловых опытов
Глава 3. ФИЗИКО-ХИМИЧЕСКИЕ ОСНОВЫ КОНВЕРСИИ СУЛЬФИДА БАРИЯ В СУЛЬФИД НАТРИЯ
Глава 4.РЕЗУЛЬТАТЫ ПРОВЕРКИ КОНВЕРСИОННОГО
СПОСОБА НА ОПЫТНО-ПРОМЫШЛЕННОЙ УСТАНОВКЕ
4.1.Задачи испытаний и описание принципиальной и аппаратурно-технологической схемы установки | ;
4.2.Результзты наработки ретурного сульфата бария
4.3.Испытания способа е цикловом режиме
Глава 5. ПРОМЫШЛЕННЫЙ ПРОЦЕСС ПРОИЗВОДСТВА
СУЛЬФИДА НАТРИЯ КОНВЕРСИОННЫМ СПОСОБОМ
5.1.Описание технологического процесса
Научное обоснование и разработка технологических решений применительно к переработке минерального и вторичного сырья на основе процессов восстановления тяжелых цветных металлов собственной сульфидной серой 2012 год, доктор технических наук Олейникова, Наталья Васильевна
Кондиционирование цианидных оборотных растворов с повышенным содержанием меди 2010 год, кандидат технических наук Файберг, Анна Александровна
Научные и практические основы экологических технологий комплексной переработки производственных отходов в крупном промышленном регионе 2002 год, доктор технических наук Адеева, Людмила Никифоровна
Методы и средства повышения экологической безопасности производства и природопользования в цветной металлургии 2004 год, доктор технических наук Боровков, Георгий Александрович
Процесс получения элементарной серы восстановлением сульфата кальция природным газом 1983 год, кандидат технических наук Влох, Вера Михайловна
Во многих производствах образуются в значительных количествах отходы, содержащие сульфат натрия. Потребность в нем на 50% удовлетворялась в бывшем СССР и США, (а в ряде стран полностью) за счет переработки промышленных отходов [1]. Попутным продуктом сульфат натрия является в производствах синтетических жирных кислот, искусственных волокон (главным образом, вискозы), бихрома-та натрия, силикагелей и др. В производстве глинозема - это содосульфатная смесь, а при переработке нефти - сульфатсодержащие сточные воды. Как правило, такой сульфат натрия является низкосортным и вследствие этого имеет ограниченный сбыт, что в условиях рыночной экономики имеет немаловажное значение.
Между тем, в производстве бихромата натрия получаемый отход традиционно перерабатывается в сульфид натрия вследствие невозможности его другого использования из-за содержащегося в нем высокотоксичного шестивалентного хрома. Этот пример показывает, что возможна и целесообразна переработка сульфатсо-держащих отходов в ценный, более дорогой и пользующийся опросом продукт.
Сульфид натрия широко применяется в цветной металлургии при обогащении медных, свинцово-цинковых, молибденовых и др. руд, в кожевенной промышленности для удаления волосяного покрова со шкур, в текстильной - при крашении тканей, в химической - для производства сернистых красителей и как восстановитель в ряде процессов. Применяемый сегодня способ производства сульфида натрия путем восстановления брикетированного сульфата натрия металлургическим коксом в шахтных печах исключает возможность переработки сульфатсодержащих растворов, образующихся во многих производствах. Этот способ, реализованный в промышленном масштабе в середине 60-х годов и являясь в то время прогрессивным, в настоящее время .морально устарел, не обеспечивает соблюдение повышенных требований к охране окружающей среды и является неконкурентоспособным с зарубежными как по технико-экономическим показателям, так и по качеству получаемого продукта. Все это, а также общий кризис российской экономики, привели к тому, что часть потребителей стали приобретать более дешевый зарубежный продукт, поставив под угрозу само существование отечественного производства сульфида натрия. Выход из этой ситуации возможен путем перевода производства на новый способ, обеспечивающий, с- одной стороны, безотходное производство, с другой - повышение его технико-экономических показателей и качества продукта до конкурентоспособного уровня. Вследствие этого исследование и разработка такого способа являются актуальными и насущно необходимыми для возрождения отечественного производства сульфида натрия. С точки зрения использования промышленных сульфатсодержащих отходов немаловажным является осуществление возможности подачи их в производство в виде растворов, что невозможно при существующем способе производства.
Цель и задачи исследования. Целью исследования являлась разработка и научное обоснование способа получения сульфида натрия, позволяющего расширить круг перерабатываемых сульфатсодержащих отходов, отвечающего современным требованиям к охране окружающей среды и конкурентоспособного в сравнении с зарубежными.
Критический анализ литературных данных обосновал необходимость разработки способа получения сульфида натрия путем конверсии сульфида бария при взаимодействии с сульфатсодержащими отходами с последующим восстановлением образующегося при этом сульфата бария до сульфида, существенно, что в этом случае бариевое сырье теоретически не расходуется и отсутствуют твердые отходы. Скудные и весьма противоречивые литературные сведения о конверсии сульфида бария в сульфид натрия определили задачи исследования:
- детальное изучение процесса конверсии,
- теоретическое обоснование способа путем изучения растворимости в системе Ва$-№2$-Н20,
- лабораторные и опытно-промышленные испытания разрабатываемого способа и его технико-экономическая оценка.
Стремление к разработке такого способа было поддержано всеми заводами, имеющими в своем составе производство сульфида натрия, а также Менделеевским химзаводом им. Л.Я. Карпова, принявшим самое активное и непосредственное участие в исследованиях, проведенных совместно с Уральским научно-исследовательским химическим институтом (УНИХИМ). Целью такой работы кроме возрождения отечественного производства сульфида натрия являлось предоставить возможность и инструмент многим предприятиям для ликвидации имеющихся у них сульфатсодержащих растворов с получением полезного и дорогостоящего продукта. С этих позиций разраббтка способа, позволяющего снизить вредное влияние сульфатсодержащих сточных вод на окружающую среду и тем самым уменьшить техногенную нагрузку на нее' многих предприятий, приобретает народнохозяйственное звучание и значение.
Научная новизна. Впервые; исследован процесс конверсии сульфида бария в сульфид натрия на сульфате натрия различного происхождения с применением математического планирования эксперимента. Установлены оптимальные условия процесса и дано его математическое описание. Теоретически обоснованы режимы ряда стадий технологического процесса путем исследования растворимости в системе ВаБ-N825-420, сведения о которой отсутствуют в литературе. Разработана безотходная технология сульфида натрия, защищенная патентом РФ.
Практическая ценность. Результаты исследований использованы при разработке: исходных данных для проектирования реконструкции цеха сульфида натрия Актюбин-ского завода хромовых соединений (1994 г.), технико-экономического обоснования (ТЭО) реконструкции цеха, сульфида натрия АО "Кучуксульфат" (1996 г.), ТЭО переработки сульфатсодержащих стоков на АО "Уфанефтехим" (1995 г.). Принято решение об использовании способа при реконструкции производства бариевых солей на АО "Химзавод им. Л.Я. Карпова" (г. Менделеевск, Татарстан).
На защиту выносятся:
- результаты детального изучения процесса конверсии сульфида бария в сульфид натрия и его математическое описание;
-экспериментально полученные сведения о растворимости в системе ВаЗ-МагЗ-НгО, являющиеся физико-химической основой конверсионного способа получения сульфида натрия; 7 результаты испытаний способа на опытно-промышленной установке; безотходный технологический процесс получения сульфида натрия конверсион ным способом.
При получении сульфгидрата путем утилизации коксового газа в продукте содержатся также з начительные количества алюминия (0,20-0,15 г/л), :цианов (2- 3 з/л), тиоцианатов (10-12 г/л).
А. Очистка сульфгидрата натрия.
Приготовляют осадительную смесь, для чего в эмалированном реа кторе перемешивают 0,012 1Вбс. ч. цинка .марки М-1, 0,010 вес. ч. воды, добавляют 0,008 вес. ч. уксусной кислоты. Реакционную смесь подогревают до 90°С и перемешивают- до однородной консистенции.
Осаждение примесей. В peaiKTOp, изготовленный из -стали марки Х18Н9Т, снабженный механической мешалкой и циркуляционным насосом для перемешивания, загружают 1,5 вес. ч. сульфгидрата натрия, и осадительную смесь перемешивают,- до равномерного расн 5еделеиия компонентов. Затем загружают 0,01 вес. ч. насыщенного раствора нолиакриламида, 0,005 вес. ч. древесного угля активированного марки БОУ, перемешивают 10 мин, фильтруют. В результате очистки содержание примесей железа и хрома резко умеиьшается.
Очистка едкого натра. В эмалированный реактор, снабженный механнческой мешалкой, загружают 1,0 вес. ч. насыш,енного раствора едкого натра марки «Д-химическнй, жидкий, добавляют 0,005 вес.ч. древесного угля активированного, перемешивают до равномерного распределения компонентов и загружают 0,02 вес. ч. осадительной смеси.
Осадительную с.месь готовят путем гашения 1 вес. ч. окиси кальция в 2 вес. ч. насыш.енного раствора полиакриламида с добавлением 0,5 вес. ч. перекиси водорода (в пересчете на 30%-ный раствор).
Лосле загрузки осадительной смеси раствор едкого натра интенсивно -перемешивают JiO мин - (Происходит фиксация примесей железа, хрома, алюминия, кремния. Реакционную смесь выдерживают до полного разделения фаз.
Твердая фаза всплывает на поверхность едкого натра. Она состоит преимуш,ественно из щелочей. Твердую фазу отделяют путем фильтрации. Ее можно испоа ьзовать в производстве сульфида аммония для отгонки аммиака.
|Получение сульфида натрия. В реакторкристаллизатор, снабженный рубашкой для охлаждения, загружают 2 вес. ч. очищенного раствора сульфгидрата натрия и 1 вес. ч. очищенного раствора едкого натра. Реакционную смесь перемешивают 10-15
мин, производят корректировку реакционной смеси путем догрузки едкого натра, либо сульфгидрата. Корректировку считают законченной, когда содержание овободной щелочи в реакционной смеси достигает .60;-70 г/л. Реакционную смесь охлаждают .до температуры окружающей среды (но не более 25° С). Осаждаются сульфиды в виде основного конгломерата.
Твердую фазу отделяют от маточного р-аствора на друкфильтрах и центрифугах. Промывают насыщенным раствором сульфида натрия и водой с целью разложения сульфидно-щелочного конгломерата и
получения- сульфида. натрия. Промытый продукт фасуют.
Маточный раствор, прсзмывные воды и щламсодержащие сульфиды, карбонаты, тиосульфаты, полисульфиды могут быть
использованы в ироизводстве сульфида аммония.--Пример 2. В peaiKTop, изготовленный из стали марки Х18Н10Т,снабженный циркуляционным насосом дл-я перемешивания
и змеевиком для обогрева, загружают 0,8 вес. ч. сульфгидрата натрия и 0,6 вес. ч. плавленного технического сернистого натрия, отвочаюпюго техническим требованиям ГОСТа 596-70.
Технический сульфид растворяют в сульфгидрате натрия при 80-85° С. При более н.изкой температуре скорость растворения и растворимость сернистого натрия уменьшаются. При более высокой
температуре резко усиливается коррозия апларатуры, в связи с этим реакционная смесь загрязняется примесями железа, хрома и ннкеля.
Про-цесс растворения сульфида натр.ия
считается законченным, когда содержание сульфидов в растворе .достигает 360-370 г/л (в пересчете на NaHS).
Полученный раствор сульфгидрата натрия .перекачивают центрО|бежным насосом в осадитель и очищают от примесей хрома и железа. В реакционную смесь добавляют 0,01 вес. ч. уксусной кислоты и перемешивают 5-10 мин пр,и 80-85° С. Раствор сульфгидрата натрия из осадителя
фильтруют на фильтр-прессе и нейтрализуют в реакторе-нейтрализаторе. В отфильтрованном растворе осаждают сульфиды насыщенным раствором предварительно очищенного едкого натра, загружаемого
из мерника (конц. 600 г/л).
Процесс осаждения , сульф идов считается законченным, 1когда содержание свободной п.1елочи в реакционной с.меси состащляет около 60 г1л (в нересчете на NaOH). ЗнаЧительный избыток едюой щелочи необходим для достижения полноты осаждения сульфидов и для уменьшения соосаждения цримесей железа и хрома с сульфидом натрия, для уменьшения загрязнения сульфида натрия примесями железа и хрома.
Реакционную смесь в алпарате охлаждают до температуры окружающей среды. Твердую фазу, состоящую преимущественно из сульф|Ида натрия, отделяют от маточного раствора на центрифуге, лромывают насыщенным раствором сульфида натрия,, фильтруют.
Сульфиды (Na2S 9 Тиосульфаты (SOj Вещества, нерасл
Сульфаты (Na2SO4 Полисульфиды Карбонаты ()
Ф О р м у Л а II а о б р е т е и и я
1. Способ получения сульфида натрия nyTe.vi взаимодействия бисульфида натрия с едким натром в годном растворе с последующим выделением целевого продукта, отличающийся тем, что, с целью обеспечения возможности использования .неочищенного от загрязнений бисульфида натрия, например, отхода, получаемого при содовой очистке серусодержащих газов, с концентрацией по бисульфиду натрия около. 200 и получения продукта с высокой степенью чистоты, едкий натр берут в количестве, превышающем стехиометричеокое на 60-70 г1л, и выделение целевого продукта осуществляют .путем кристаллизаМаточный раствор и промывание воды, содерл ащие около 70 г1л сзльф,идов и 60 г/л едкой щелочи, могут быть использованы в производстве сульфида аммония.
Целевой продукт -сульфид натрия может иметь следующий состав- см. таблиЦ .
ции твердого вещества с последующей нромывкоп его водой.
, отличаю щ и и с я тем, что едкий натр
предварительно очигащеной в растворе щают окисью Кальция полиакриламида..
1 II 2, о т л и ч а ющ и и с я тс.м, что бисульфпд натрия предварительно очищают окисью цинка, подкисленной УКСУСНОЙ кислотой.
сульфид натрия (Na2S) представляет собой кристаллическое твердое вещество от желтого до кирпично-красного. В природе встречается с разной степенью гидратации, являясь наиболее распространенным нонагидратом сульфида натрия (Na2S · 9H2O)..
Это водорастворимые соли, которые дают сильно щелочные растворы. При воздействии влажного воздуха они поглощают влагу из воздуха, которая может самопроизвольно нагреваться и вызывать воспламенение близлежащих горючих материалов. Кроме того, при контакте с влажным воздухом они выделяют сероводород, который пахнет тухлыми яйцами.

Они являются сильными восстановителями. Эти вещества могут быть опасны для окружающей среды, особенно для водных организмов..
Моносульфид натрия коммерчески доступен в форме хлопьев, содержащих 60-62% Na2С .
2D структура
3D структура
Характеристика сульфида натрия
Физико-химические свойства

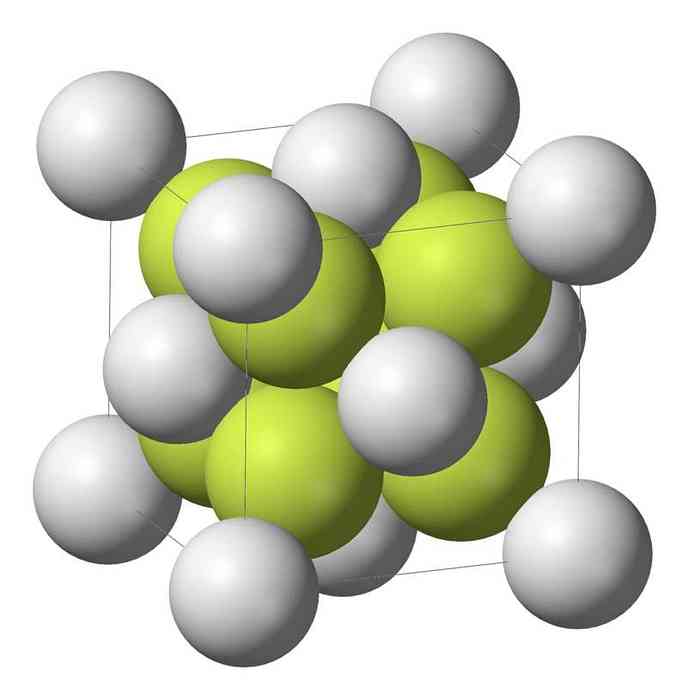
Моносульфид натрия (Na2S) кристаллизуется с антифторитовой структурой, в которой каждый атом S окружен кубом из 8 атомов Na, а каждый атом Na - тетраэдром из 4 атомов S..
воспламеняемость
Единственным легко воспламеняющимся веществом в группе неорганических сульфидов является сероводород. Однако некоторые другие неорганические сульфиды, такие как сульфид натрия, могут самопроизвольно нагреваться и даже воспламеняться при воздействии влаги..
При воздействии огня сульфид натрия выделяет газы или пары диоксида серы, которые являются раздражающими или токсичными.
реактивность
- Неорганические сульфиды обычно являются основными (некоторые являются сильно основными и поэтому несовместимы с кислотами).
- Многие из этих соединений являются восстановителями (они энергично реагируют с окислителями).
- Простые соли сульфидов (такие как сульфид натрия, калия и аммония) активно реагируют с кислотами с выделением высокотоксичного и легковоспламеняющегося газообразного сероводорода.
- Сульфид натрия легко воспламеняется. Может взорваться при быстром нагревании или ударе.
- При нагревании до разложения выделяет токсичные пары оксида натрия и оксидов серы..
- Реагирует бурно с углеродом, углем, солями диазония, N, N-дихлорметиламином, сильными окислителями и водой.
токсичность
Многие представители группы неорганических сульфидов ведут себя как сильные основания и могут вызвать сильные ожоги при контакте с кожей..
Это свойство зависит от его растворимости. Наиболее нерастворимые неорганические сульфиды (например, сульфид ртути (II) и сульфид кадмия) не являются едкими.
Сульфид натрия имеет средний коэффициент распределения октанол / вода (Pow) (-3,5). Эта величина используется как мера растворимости (и биоконцентрации) вещества в жировых тканях животных (особенно водных животных)..
Сульфид натрия считается опасным для окружающей среды, особенно для водных организмов..
приложений
В домашних условиях сульфида натрия используют для разглаживания труб, бытовых чистящих средств (для печи, ванной комнаты), выпрямителей для волос, мыла для посуды и автомобильных подушек безопасности..
В промышленности его используют в очистителях, в цементе и в качестве прекурсора при производстве других химических продуктов..
Клинические эффекты
Воздействие сульфида натрия распространено в развитых и слаборазвитых странах, как в промышленности, так и дома. Эти едкие вещества присутствуют в нескольких бытовых продуктах в низких концентрациях.
В развитых странах серьезные последствия редки. Это происходит главным образом из-за преднамеренного приема химического вещества у взрослых. Однако в развивающихся странах серьезные последствия встречаются чаще..
Щелочные коррозийные вещества вызывают некроз из-за разжижения. Омылять жиры в клеточной мембране, разрушая клетки и обеспечивая глубокое проникновение в ткани слизистых оболочек.
Устное воздействие
Первичное воспаление происходит в желудочно-кишечной ткани, затем следует некроз ткани (с возможной перфорацией), затем грануляция и, наконец, формирование стеноза..
У пациентов с легким проглатыванием развиваются раздражение или ожоги I степени (поверхностная гиперемия и отек) ротоглотки, пищевода или желудка.
У пациентов с умеренной интоксикацией могут развиться ожоги II степени (поверхностные волдыри, эрозии и изъязвления) с возможным дальнейшим формированием стеноза (особенно пищевода).
У некоторых пациентов (особенно маленьких детей) может развиться отек в верхних дыхательных путях.
У пациентов с тяжелой интоксикацией при проглатывании могут развиться глубокие ожоги и некроз слизистой оболочки желудочно-кишечного тракта с такими осложнениями, как перфорация (пищевод, желудок, редко двенадцатиперстная кишка), образование свищей (трахеопищевод, аортоэзофаге) и желудочно-кишечное кровоизлияние.
Они могут развиться: гипотензия, тахикардия, тахипноэ, образование стриктур (в основном пищевода), рак пищевода и отек верхних дыхательных путей (что является распространенным и часто опасным для жизни).
Сильное отравление, как правило, ограничивается преднамеренным потреблением у взрослых.
Воздействие при вдыхании
Легкое воздействие может вызвать кашель и бронхоспазм.
Тяжелое вдыхание может вызвать отек верхних дыхательных путей, ожоги, стридор и, редко, острое повреждение легких.
Воздействие на глаза
Это может привести к сильному раздражению конъюнктивы и хемозу, дефектам эпителия роговицы, лимбической ишемии, постоянной потере зрения и в тяжелых случаях перфорации..
Кожное воздействие
Мягкое воздействие вызывает раздражение и частичные ожоги. Метаболический ацидоз может развиться у пациентов с тяжелыми ожогами или шоком.
Длительное воздействие или продукты с высокой концентрацией могут вызвать ожоги общей толщины.
Безопасность и риски
Заявления об опасности Глобально согласованной системы классификации и маркировки химических веществ (SGA)
Согласованная на глобальном уровне система классификации и маркировки химических веществ (SGA) представляет собой согласованную на международном уровне систему, созданную Организацией Объединенных Наций и предназначенную для замены различных стандартов классификации и маркировки, используемых в разных странах, с использованием согласованных критериев во всем мире..
Классы опасности (и соответствующая им глава СГС), стандарты классификации и маркировки, а также рекомендации для сульфида натрия следующие (Европейское химическое агентство, 2017, Организация Объединенных Наций, 2015, PubChem, 2017):
Наш проект живет и развивается для тех, кто ищет ответы на свои вопросы и стремится не потеряться в бушующем море зачастую бесполезной информации. На этой странице мы рассказали (а точнее - показали :) вам Как сделать сульфит натрия в домашних условиях . Кроме этого, мы нашли и добавили для вас тысячи других видеороликов, способных ответить, кажется, на любой ваш вопрос. Однако, если на сайте все же не оказалось интересующей информации - напишите нам, мы подготовим ее для вас и добавим на наш сайт!
Если вам не сложно - оставьте, пожалуйста, свой отзыв, насколько полной и полезной была размещенная на нашем сайте информация о том, Как сделать сульфит натрия в домашних условиях .

Сульфид натрия, устар. сернистый натрий, — сложное неорганическое вещество с химической формулой Na2S.
Содержание
Описание
Сульфид натрия — бескислородная соль. В обычном состоянии — порошок белого цвета, очень гигроскопичный. Плавится без разложения, термически устойчивый. Технический сульфид натрия желтоватый или коричневатый (красноватый) содержит в себе до 60 % сульфида натрия. Хорошо растворим в воде, гидролизуется по аниону, создает в растворе сильнощелочную среду. При стоянии на воздухе раствор мутнеет (коллоидная сера) и желтеет (окраска полисульфида). Типичный восстановитель. Присоединяет серу. Вступает в реакции ионного обмена.
Получение
В промышленности — прокаливание минерала мирабилит Na2SO4 · 10H2O.
Химические свойства
Взаимодействует с разбавленной соляной кислотой:
Взаимодействует с концентрированной серной кислотой:
Реагирует с водным раствором перманганата калия:
В реакции с йодом оседает чистая сера:

Применение
Сульфид натрия применяется в производстве сернистых красителей и целлюлозы, для удаления волосяного покрова шкур при дублении кож, как реагент в аналитической химии, а так же на хим.водоочистке.
Безопасность
Сульфид натрия ядовит.
- Натрий (Na)
- Азид натрия (NaN3) Натрий тринитрид
- Альгинат натрия ((C6H7O6Na)n) Натрий альгиновокислый
- Алюминат натрия (NaAlO2) Натрий метаалюминат
- Алюмонатриевые квасцы (NaAl(SO4)2) Алюминий-натрий сернокислый
- Амид натрия (NaNH2) Амид натрия
- Антимонат натрия (NaSbO3) Натрий метасурьмянокислый
- Антимонит натрия (NaSbO2) Натрий сурьмянистокислый
- Арсенат натрия (Na3AsO4) Натрий мышьяковокислый
- Арсенид тринатрия (Na3As) Натрий мышьяковистый
- Аскорбат натрия (C6H7O6Na) Натрий аскорбиновокислый
- Аурат натрия (Na[AuO2])
- Ацетат натрия (CH3COONa) Натрий уксуснокислый
- Ацетиленид натрия (NaHC2) Этинилнатрий
- Бензоат натрия (C6H5COONa) Натрий бензойнокислый
- Борогидрид натрия (NaBH4) Натрий тетрагидридоборат
- Бромат натрия (NaBrO3) Натрий бромноватокислый
- Бромид натрия (NaBr) Натрий бромистый
- Вольфрамат натрия (Na2WO4) Натрий вольфрамовокислый
- Гексагидроксохромат III натрия (Na3[Сr(OH)6]) Гексагидроксохромит III натрия
- Гексатиоцианатоферрат III натрия (Na3[Fe(SCN)6])
- Гексафосфат натрия (Na6P6O18) Натрий гексаметафосфат
- Гексафторосиликат натрия (Na2[SiF6]) Натрий кремнефтористый
- Гексацианоферрат II натрия (Na4[Fe(CN)6]) Натрий гексацианоферроат
- Гексацианоферрат III натрия (Na3[Fe(CN)6]) Натрий гексацианоферриат
- Гептагидроксоферрат III натрия (Na4[Fe(OH)7])
- Гидрид натрия (NaH) Натрий водородистый
- Гидроарсенат натрия (Na2HAsO4) Натрий мышьяковокислый кислый
- Гидроарсенит натрия (Na2HAsO3) Натрий мышьяковистокислый кислый
- Гидрокарбонат натрия (NaHCO3) Натрий двууглекислый (сода пищевая)
- Гидроксид натрия (NaOH) Натрий гидроокись
- Гидросульфид натрия (NaHS) Натрий сернистый кислый
- Гипофосфат натрия (Na4P2O6) Натрий фосфорноватокислый
- Гипофосфит натрия (Na(PH2O2)) Натрий фосфорноватистокислый (Натрий фосфинат)
- Гипохлорит натрия (NaOCl) Натрий хлорноватистокислый, Жавелевая вода (Лабарракова вода)
- Гликолят натрия (NaC2H3O3) Натрий оксиацетат
- Глутамат натрия (C5H8NO4Na * H2O) Натрий глютамат (Глютамат натрия)
- Глюконат натрия (NaC6H11O7) Натрий глюконат
- Дигидрофосфат натрия (NaH2PO4) Натрий дигидроортофосфат
- Диселенид натрия (Na2Se2) Натрий диселенистый
- Диселенит натрия (Na2Se2O5) Натрий селенистокислый
- Дисульфид натрия (Na2S2) Динатрийдисульфан
- Дитионат натрия (Na2S2O6) Натрий дитионовокислый
- Дитиохромат III натрия (NaCrS2) Натрий дитиохромит
- Дихромат натрия (Na2Cr2O7) Натрий двухромовокислый (Бихромат натрия)
- Инозинат натрия (C10H11N4Na2O8P) Натрий инозинат
- Йодат натрия (NaIO3) Натрий йодноватокислый
- Йодид натрия (NaI) Натрий йодистый
- Карбонат натрия (Na2CO3) Натрий углекислый
- Кокоат натрия
- Лактат натрия (NaC3H5O3) Натрий молочнокислый
- Лауретсульфат натрия (C12+2nH25+4nNaO4+nS) Лаурет
- Лаурилсульфат натрия (C12H25SO4Na) Натрий додецилсульфат
- Манганат натрия (Na2MnO4) Натрий марганцовистокислый
- Метаборат натрия (NaBO2) Натрий метаборат
- Метаванадат натрия (NaVO3) Натрий ванадиевокислый
- Метависмутат натрия (NaBiO3) Натрий висмутовокислый
- Метасиликат натрия (Na2SiO3) Натрий кремнекислый
- Метафосфат натрия (NaPO3) Натрий фосфорнокислый
- Молибдат натрия (Na2MoO4) Натрий молибденовокислый
- Нитрат натрия (NaNO3) Натрий азотнокислый (натриевая селитра)
- Нитрид натрия (Na3N) Натрий азотистый
- Нитрит натрия (NaNO2) Натрий азотистокислый
- Оксалат натрия (Na2C2O4) Натрий щавелевокислый
- Оксид натрия (Na2O) Натрий окись (окись натрия)
- Олеат натрия (NaC18H33O2) Натрий олеиновокислый
- Ортованадат натрия (Na3VO4) Натрий ортованадат
- Пальмитат натрия (NaC16H31O2) Натрий пальмитиновокислый
- Пентаборат натрия (NaB5O8) Натрий борнокислый
- Пентасульфид натрия (Na2S5) Динатрийпентасульфан
- Перборат натрия (NaBO3) Натрий надборнокислый
- Перкарбонат натрия (Na2CO3·1,5H2O2) Гидропероксосольват карбоната натрия
- Перманганат натрия (NaMnO4) Натрий марганцовокислый
- Пероксодисульфат натрия (Na2S2O8) Натрий надсернокислый
- Перренат натрия (NaReO4) Натрий рениевокислый
- Перхлорат натрия (NaClO4) Натрий хлорнокислый
- Перхромат натрия (Na3CrO8) Натрий надхромовокислый
- Пиросульфат натрия (Na2S2O7) Дисульфат натрия
- Пиросульфит натрия (Na2(SO2SO3)) Натрий метабисульфит
- Пирофосфат натрия (Na4P2O7) Натрий пирофосфат
- Полиакрилат натрия ([-CH2-CH(COONa)-]n) Натрий полиакрилат
- Полисульфиды натрия
- Пропионат натрия (CH3CH2COONa) Натрий пропионовокислый
- Родизонат натрия (Na2C6O6) Натрий родизонат
- Салицилат натрия (C7H5NaO3) Натрий салицилат
- Саркозинат натрия (CH3NHCH2COONa) Натрий метиламиноацетат
- Селенат натрия (Na2SeO4) Натрий селеновокислый
- Селенид натрия (Na2Se) Натрий селенистый
- Селенит натрия (Na2SeO3) Натрий селенистокислый
- Силицид натрия (NaSi) Натрий кремнистый
- Сорбат натрия (C6H7NaO2) Натрий сорбат
- Стеарат натрия (NaC18H35O2) Натрий стеариновокислый
- Сукцинат натрия (Na2C4H4O4) Натрий янтарнокислый
- Сульфат натрия (Na2SO4) Натрий сернокислый
- Сульфид натрия (Na2S) Натрий сернистый
- Сульфит натрия (Na2SO3) Натрий сернистокислый
- Тартрат натрия (Na2C4H4O6) Натрий виннокислый
- Тетраборат натрия (Na2B4O7) Натрий тетраборнокислый (Бура)
- Тетрасульфид натрия (Na2S4) Натрий тетрасульфид
- Тиосульфат натрия (Na2S2O3) Натрий гипосульфит
- Тиоцианат натрия (NaSCN) Натрий роданистый
- Титанат натрия (Na2TiO3) Натрий титановокислый
- Трифосфат натрия (Na5P3O10)
- Формиат натрия (HCO2Na) Натрий муравьинокислый
- Фосфаты натрия
- Фосфид натрия (Na3P) Натрий фосфористый
- Фосфит натрия (Na2(PHO3)) Натрий фосфористокислый
- Фторид натрия (NaF) Натрий фтористый
- Хлорат натрия (NaClO3) Натрий хлорноватокислый
- Хлорацетат натрия (NaC2H2ClO2) Натрий хлоруксуснокислый
- Хлорид магния-натрия (NaMgCl3) Магний-натрий хлористые
- Хлорид натрия (NaCl) Натрий хлористый
- Хлорит натрия (NaClO2) Натрий хлористокислый
- Хромат натрия (Na2CrO4) Натрий хромовокислый
- Цианат натрия (NaOCN) Натрий циановокислый
- Цианид натрия (NaCN) Натрий цианистый
- Цинкат натрия (Na2ZnO2) Натрий цинкат
- Цирконат натрия (Na2ZrO3) Натрий циркониевокислый
- Цитрат натрия (Na3C6H5O7) Натрий лимоннокислый
- Этилат натрия (NaC2H5O) Натрий этоксид
© 2000-2020 Все права защищены.
Любое копирование, в т.ч. отдельных частей текстов или изображений, публикация и републикация, перепечатка или любое другое распространение информации, в какой бы форме и каким бы техническим способом оно не осуществлялось, строго запрещается без предварительного письменного согласия со стороны редакции. Во время цитирования информации подписчиками ссылки обязательны. Допускается цитирование материалов сайта без получения предварительного согласия, но в объеме не более одного абзаца и с обязательной прямой, открытой для поисковых систем гиперссылкой на сайт.
Читайте также:

