Оксид алюминия своими руками
Обновлено: 04.07.2024
Что такое алюминий — это элемент третьего периода. Заряд ядра атома +13. Электроны располагаются на трех энергетических уровнях: 2, 8, 3. Электронная конфигурация атома алюминия (1s22s22p63s23р1):
Алюминий принадлежит к семейству р-элементов.
Валентные электроны алюминия располагаются на s-оболочке и р-оболочке внешнего электронного слоя. Этих электронов три, поэтому алюминий может образовывать три валентных связи, что для него наиболее типично.
Единственная степень окисления алюминия, которую он может проявлять, не считая нейтрального состояния, равна +3. Таким образом, в окислительно-восстановительных процессах алюминий ведет себя как восстановитель.
■ 73. Почему алюминий относится к р-элементам? (См. Ответ) 74. Какие степени окисления возможны для алюминия? 75. Начертите схему строения Аl+3. 76. Каково поведение алюминия в окислительно-восстановительных реакциях?(См. Ответ)
Алюминий Al — это серебристо-белый металл. Его атомный вес 26,98. Плотность алюминия 2,7, температура плавления 660°, температура кипения 2060°. Алюминий принадлежит к группе легких металлов. Алюминий обладает высокой электропроводностью, равной 0,6 электропроводности меди, поэтому при большем сечении алюминиевых проводов электропроводность их равна медным, а вес гораздо меньше.
Впервые алюминий был получен в 1827 г. Велером и стоил весьма дорого, так как методы его получения еще не были разработаны и уровень развития электротехники был еще слишком низок для массового получения этого металла. В настоящее время это один из самых дешевых и широко распространенных металлов.
Свойства
Бесцветные нерастворимые в воде кристаллы. Амфотерный оксид. Практически не растворим в кислотах. Растворяется в горячих растворах и расплавах щелочей. Является диэлектриком, но некоторые исследователи считают его полупроводником n-типа. Диэлектрическая проницаемость 9,5—10. Электрическая прочность 10 кВ/мм.
Плотность
| Модификация | Плотность, г/см3 |
| α-Al2O3 | 3,99 |
| θ-Al2O3 | 3,61 |
| γ-Al2O3 | 3,68 |
| κ-Al2O3 | 3,77 |
Основные модификации оксида алюминия
В природе можно встретить только тригональную α-модификацию оксида алюминия в виде минерала корунда и его редких драгоценных разновидностей (рубин, сапфир и т. д.). Она является единственной термодинамически стабильной формой Al2O3. При термообработке гидроксидов алюминия около 400 °С получают кубическую γ-форму. При 1100—1200 °С с γ-модификацией происходит необратимое превращение в α-Al2O3, однако скорость этого процесса невелика, и для завершения фазового перехода необходимо либо наличие минерализаторов, либо повышение температуры обработки до 1400—1450 °С.
Известны также следующие кристаллические модификации оксида алюминия: кубическая η-фаза, моноклинная θ-фаза, гексагональная χ-фаза, орторомбическая κ-фаза. Спорным остаётся существование δ-фазы, которая может быть тетрагональной или орторомбической.
Вещество, иногда описываемое как β-Al2O3, на самом деле представляет собой не чистый оксид алюминия, а ряд алюминатов щелочных и щёлочноземельных металлов со следующими общими формулами: MeO·6Al2O3 и Me2O·11Al2O3, где MeO — это оксиды кальция, бария, стронция и т. д., а ME2O — оксиды натрия, калия, лития и других щелочных металлов. При 1600—1700 °С β-модификация разлагается на α-Al2O3 и оксид соответствующего металла, который выделяется в виде пара.

Соединения алюминия
Al2O3 (глинозем)
Оксид алюминия Al2O3 является белым, очень тугоплавким и твердым веществом (в природе тверже только алмаз, карборунд и боразон).
Свойства глинозема:
- не растворяется в воде и вступает с ней в реакцию;
- является амфотерным веществом, реагируя с кислотами и щелочами: Al2O3 + 6HCl = 2AlCl3 + 3H2O; Al2O3 + 6NaOH + 3H2O = 2Na3[Al(OH)6];
- как амфотерный оксид реагирует при сплавлении с оксидами металлов и солями, образуя алюминаты: Al2O3 + K2O = 2KAlO2.
В промышленности глинозем получают из бокситов. В лабораторных условиях глинозем можно получить сжигая алюминий в кислороде: 4Al + 3O2 = 2Al2O3.
Применение глинозема:
- для получения алюминия и электротехнической керамики;
- в качестве абразивного и огнеупорного материала;
- в качестве катализатора в реакциях органического синтеза.
Al(OH)3
Гидроксид алюминия Al(OH)3 является белым твердым кристаллическим веществом, которое получается в результате обменной реакции из раствора гидроксида алюминия — выпадает в виде белого студенистого осадка, кристаллизующегося со временем. Это амфотерное соединение почти не растворимое в воде: Al(OH)3 + 3NaOH = Na3[Al(OH)6]; Al(OH)3 + 3HCl = AlCl3 + 3H2O.
- взаимодействие Al(OH)3 с кислотами: Al(OH)3+3H+Cl = Al3+Cl3+3H2O
- взаимодействие Al(OH)3 со щелочами: Al(OH)3+NaOH- = NaAlO2-+2H2O
Гидроксид алюминия получают путем действия щелочей на растворы солей алюминия: AlCl3 + 3NaOH = Al(OH)3 + 3NaCl.
Получение
Получают из бокситов, нефелинов, каолина, алунитов алюминатным или хлоридным методом. Сырьё в производстве алюминия, катализатор, адсорбент, огнеупорный и абразивный материал.
3Cu2O + 2Al →1000∘C 6Cu + Al2O3 2Al(OH)3 →t Al2O3 + 3H2O
Плёнки оксида алюминия на поверхности алюминия получают электрохимическими или химическими методами. Так, например, получают диэлектрический слой в алюминиевых электролитических конденсаторах. В микроэлектронике также применяется эпитаксия оксида алюминия, которая многими учёными считается перспективной, например, в изоляции затворов полевых транзисторов.
Химические свойства
По химическим свойствам алюминий принадлежит к числу весьма активных металлов, обладающих амфотерными свойствами. В ряду активности он занимает место за щелочноземельными металлами. Но в чистом виде как на воздухе, так и в воде он может храниться очень долго, так как его поверхность со временем покрывается тонким и очень прочным слоем окиси, которая предохраняет его от окисления.
Для того чтобы наблюдать окисление алюминия на воздухе, необходимо сначала освободиться от защитной пленки.
Для этого алюминий сначала протирают наждачной шкуркой, а затем кипятят в щелочи. Окись алюминия, как и сам металл, проявляет амфотерные свойства, а потому растворяется в щелочи. После этого алюминий опускают в раствор какой-либо соли ртути, например нитрата ртути Hg(NO3)2. Алюминий как более активный металл вытесняет ртуть из ее соли:
2Аl + 3Hg(NO3)2 = 2Al(NO3)3 + 3Hg
4Аl + 3O2 = 2Аl2O3
Но поскольку амальгама покрывает алюминий неравномерно, окисление идет местами и окись алюминия заметна на поверхности металла в виде пушистой щетки (рис. 3).
Интересно взаимодействие алюминия с галогенами — с бромом и йодом. Для реакции используются порошкообразный алюминий и жидкий бром, а для реакции с йодом— смесь порошка йода с алюминием.
Во всех случаях алюминий ведет себя как восстановитель.
Рис. 3. Образование окиси алюминия на амальгированной поверхности металл.
При высокой температуре алюминий вытесняет некоторые металлы из их окислов. Это свойство нашло применение. Если смешать окись железа с алюминиевым порошком и поджечь с помощью магниевой вспышки, произойдет реакция:
Fe2О3 + 2Аl = Аl2O3 + 2Fe
которая сопровождается выделением большого количества тепла. За счет этого тепла образующееся свободное железо плавится и может быть выпущено из тигля, в котором происходит реакция, через находящееся внизу отверстие. Такая выплавка металлов называется алюминотермией; в технике она применяется очень широко. Некоторые металлы можно получить только алюминотермическим путем. Этот процесс был впервые осуществлен Н. Н. Бекетовым.
Алюминий является амфотерным металлом. В различных условиях он ведет себя по-разному. В растворе щелочи алюминий вытесняет из воды водород, образуя соль алюминиевой кислоты — алюминат натрия (или калия), в котором он играет роль кислотообразующего элемента:
2Аl + 2NaOH + 2Н2O = 2NaAlO2 + 3H2↑
Из кислоты алюминий вытесняет водород:
2Аl + 6НСl = 2АlСl3 + 3H2↑
В этом случае он проявляет металлические свойства. Концентрированные азотная и серная кислоты на алюминий не действуют, так как на его поверхности образуется защитная пленка, предохраняющая металл от дальнейшего окисления. В разбавленном виде азотная кислота на алюминий также не действует, а серная действует в слабой степени.
Использование солей

Комплексные соли алюминия часто используют в фармацевтике, производстве витаминов и биологически активных веществ. Препараты, созданные на основе этих веществ, помогают в борьбе с похмельем, улучшают состояние желудка и общее самочувствие организма человека. Очень полезные соединения, как можно заметить.
При работе с химическими элементами нужно соблюдать правила безопасности: обязательно наличие перчаток, защитного стекла, специализированной посуды и приборов.
Промышленный способ

Большинство производств для добычи элемента используют руды, которые называют бокситами. Сначала из них выделяют оксид, потом растворяют его в расплаве криолита, а затем получают чистый алюминий путем электрохимической реакции.
Это обходится дешевле всего и не требует дополнительных операций.
Кроме того, можно получить хлорид алюминия из оксида алюминия. Как это сделать?
Как из оксида алюминия получить алюминий
К этому методу мы можем отнести и наш вопрос, как из оксида алюминия получить алюминий.
Чтобы образовать металл из его оксида, нужно добавить восстановитель — водород. Пойдет реакция замещения с образованием воды и металла: МеО + Н2 = Ме + Н2О (где Ме — металл, а Н2 — водород).
Пример с алюминием: Al2О3 + 3Н2 = 2Al + 3Н2О
На практике такой прием позволяет получать чистые активные металлы, которые не восстанавливаются оксидом углерода. Метод подходит для очистки небольшого количества алюминия и довольно-таки дорого стоит.
Электролиз глинозема
Электролиз проводят в электролизере, имеющим ванну из углеродистого материала (рисунок 45). Кожух ванны изготавливают из листового железа. Подину и стены ванны выкладывают из углеродистых блоков. В подину вмонтированы медные шины, соединенные с отрицательным полюсом источника тока. В ванне находится расплавленный алюминий, служащий катодом, и жидкий криолит.
Анодное устройство состоит из угольного анода, погруженного в электролит, состоящего из криолита, глинозема, фтористых алюминия и натрия, добавляемых для понижения температуры плавления электролита.
Перед началом электролиза на подину ванны насыпают тонкий слой молотого кокса. Затем к нему подводят угольные электроды и пропускают ток. Когда угольная футеровка ванны нагреется до определенной температуры, в неё загружают криолит и расплавляют его. После получения в ванне достаточного слоя расплавленного криолита в неё загружают глинозем.
Под действием постоянного тока в расплавленном криолите происходит диссоциация криолита и глинозема
Na3ALF6 = 3Na+ + AlF63-
Al2O3 = Al3+ + AlO33-
Образующиеся положительно заряженные ионы алюминия разряжаются на катоде в первую очередь, как имеющие более высокий потенциал выделения по сравнению с другими положительно заряженными ионами, и образуется алюминий
Из отрицательно заряженных ионов на аноде разряжаются в первую очередь ионы AlO33-, как более отрицательные ионы
2Al33- — 6e → Al2O3 + 1,5O2
Выделяющийся кислород взаимодействует с углеродом анода с образованием смеси газов CO и CO2, удаляющейся из ванны через вентиляционную систему.
Алюминий собирается на дне ванны под слоем электролита. Его периодически извлекают, используя специальное устройство. Для нормальной работы ванны на её дне оставляют немного алюминия.
Подробнее: Получение алюминия электролизом
Эпилог
Химия – несомненно, сложная для понимания наука, но иногда полезно в ней разобраться. Проще всего это сделать через интересные статьи, простой слог и понятные примеры. Не лишним будет прочитать пару книг по теме и освежить в памяти курс школьной программы по химии.
Здесь было разобрано большинство тем химии, связанных с преобразованиями алюминия и его оксидов, в том числе, как из оксида алюминия получить тетрагидроксоалюминат, и еще множество интересных фактов. Оказалось, что у алюминия есть много самых необычных сфер применения в производстве и в быту, да и история получения металла весьма незаурядна. Химические формулы соединений алюминия тоже заслуживают внимания и подробного разбора, что и было освящено в этой статье.
Соли: комплексные и не очень
Бывают средние (нормальные), кислые, основные и комплексные.
Средние соли состоят из самого металла и кислотного остатка и имеют вид AlCl3 (хлорид алюминия), Na2SO4 (сульфат натрия), Al(NO3)3 (нитрат алюминия) или MgPO4.
Кислые соли — это соли из металла, водорода и кислотного остатка. Их примеры: NaHSO4, CaHPO4.
Основные соли так же, как и кислые, состоят из кислотного остатка и металла, но вместо Н там ОН. Примеры: (FeOH)2SO4, Ca(OH)Cl.
И, наконец, комплексные соли — это вещества из ионов разных металлов и кислотного остатка многоосновной кислоты (соли, содержащие сложный ион): Na3[Co(NO2)6], Zn[(UO2)3(CH3COO)8].
Речь пойдет о том, как из оксида алюминия получить комплексную соль.
Условием превращения оксида в это вещество является его амфотерность. Глинозем отлично подходит для метода. Чтобы получить комплексную соль из оксида алюминия, нужно смешать этот оксид с раствором щелочи:
2NaOH + Al2O3 + H2O → Na2[Al(ОН)4]
Этот род веществ также образуется при воздействии растворов щелочей на амфотерные гидроксиды.
Раствор гидроксида калия взаимодействует с основанием цинка с получением тетрагидроксоцинката калия:
2KOH + Zn(OH)2 → K2[Zn(OH)4]
Раствор щелочи натрия реагирует, например, с гидроксидом берилия с образованием тетрагидроксобериллата натрия:
Использование: при получении гранулированного активного оксида алюминия, применяемого в качестве сорбента, носителя, катализатора. Сущность изобретения: технический гидроксид алюминия подвергают пластификации, формовке, сушке и термообработке сформованных гранул. Пластификацию проводят в две стадии: на первой стадии к техническому гидроксиду алюминия добавляют азотную кислоту и воду до кислотному модуля 0,1 - 0,9 и перемешивают не более 1 ч. На второй стадии вводят связующее в количестве 10 - 40 мас.% и перемешивают не более 1 ч. 7 з.п. ф-лы, 1 табл.
Изобретение относится к химической технологии и может быть использовано для получения гранулированного активного оксида алюминия, применяемого в качестве сорбента, носителя, катализатора.
Известен способ получения гранулированного активного оксида алюминия [1] при котором гиббсит подвергают механохимической активации, а затем проводят его пластификацию в присутствии минеральной кислоты и добавки гидроксида алюминия в количестве 0,5 7,0 мас. в пересчете на оксид алюминия от массы смеси. В качестве добавки гидроксида алюминия используют продукт после пластификации. Способ позволяет повысить удельную поверхность оксида алюминия до 260-300 м 2 /г.
Известен также способ получения активного оксида алюминия [2] когда перед пластификацией к гигроскопическому гидроксиду алюминия в форме псевдобемита или его смеси с бемитом и/или аморфной составляющей добавляют негигроскопический гидроксид алюминия в форме тригидрата при соотношении (70 - 95): (5 30) для повышения адсорбционной емкости по парам воды.
Недостатком данного способа являются высокие энергические затраты и трудоемкость.
Известен способ получения гранулированного активного оксида алюминия из технического гидроксида алюминия с использованием в качестве неорганического связующего смеси 40 60% азотной кислоты и бентонитовой глины [3] при котором азотную кислоту берут в количестве 10% а бентонитовую глину в количестве 2 3% от веса гидроксида алюминия. Компоненты смешивают, формуют в гранулы, сушат и прокаливают при 400 450 o C.
Недостаток способа заключается в том, что носитель обладает недостаточно высокой прочностью.
Наиболее близким к изобретению по технической сущности и достигаемому эффекту является способ получения активного оксида алюминия, включающий измельчение технического гидроксида алюминия, смешение его с неорганическим связующим, перемешивание полученной массы, формование в гранулы, сушку и прокаливание, а в качестве неорганического связующего используют гидроксид кальция в количестве 10 25% от гидроксида алюминия и на стадии перемешивания добавляют воду. Образцы, получаемые по предложенной технологии, также имеют высокий насыпной вес (0,835 0,839 г/см 2 ) и довольно низкую механическую прочность (2,6 3,1)[4] Задачей изобретения является получение различных модификаций оксида алюминия, повышение качества и прочности.
Поставленная задача решается следующим образом.
Активный оксид алюминия получают из технического гидроксида алюминия с использованием связующего, который представляет собой активный гидроксид алюминия. Пластификацию проводят в две стадии: на первой стадии к техническому гидроксиду алюминия добавляют азотную кислоту и воду до кислотного модуля 0,1 0,9 и перемешивают не более 1 ч, на второй стадии вводят связующее в количестве 10 40 мас. и перемешивают не более 1 ч. В качестве активного гидроксида алюминия используют переосажденный гидроксид алюминия, продукт термомеханохимической активации (ТМХА) или химически активированный гидроксид алюминия (ХА).
Технический гидроксид алюминия предварительно подвергают размолу до 5 - 10 мкм.
Для получения различных модификаций носителя термообработку сформованных гранул ведут при 450 1300 o C.
Предложенная совокупность признаков приводит к достижению поставленной цели.
Существенными отличительными признаками предлагаемого способа являются: в качестве связующего используют активный гидроксид алюминия; пластификацию проводят в две стадии; на первой стадии к техническому гидроксиду алюминия добавляют азотную кислоту и воду до кислотного модуля 0,1-0,9; перемешивают не более 1 ч; на второй стадии вводят связующее 10-40 мас% перемешивают не более 1ч.
Отличием является то, что в качестве связующего используют переосажденный гидроксид алюминия; продукт термомеханохимической активации (ТМХА); химически активированный гидроксид алюминия (ХА); технический гидроксид алюминия предварительно подвергают размолу до частиц размера 5-10 мкм; для получения активного оксида алюминия различных модификаций сформованные гранулы гидроксида алюминия подвергают термообработке при температуре 450 - 1300 o C.
Способ осуществляется следующим образом. Для приготовления активного оксида алюминия на первой стадии к техническому гидроксиду алюминия добавляют азотную кислоту и воду до кислотного модуля 0,1 0,9, перемешивают не более 1 ч, далее на второй стадии вводят связующее 10 40 мас. представляющее собой активный гидроксид алюминия, полученный различными известными способами. В качестве активного гидроксида алюминия предпочтительно используют переосажденный гидроксид алюминия, ХА, ТМХА. Перемешивают полученную смесь не более 1 ч, формуют, сушат, проводят термообработку при различных температурах в зависимости от требуемой модификации.
Полученный активный оксид алюминия может служить в дальнейшем как носитель для катализаторов различных марок, а также как катализатор, осушитель.
Свойства полученного активного оксида алюминия определяют следующими способами: распределение пор по радиусам проводилось методом ртутной порометрии на поромере 2000 фирмы "Carbo Erba"; прочность на раздавливание на торец определяли на приборе МП-9С; удельная поверхность определялась сорбционным методом.
Пример 1 (по прототипу). 1168 г виброизмельченного порошка технического гидроксида алюминия со средним размером частиц 1 7 мкм смешивают с 238 г связующего порошка гидроксида кальция. Смесь перемешивают и добавляют 420 см 3 воды. Приготовленную массу формуют в шнеке-грануляторе с диаметром фильеры 3 мм. Гранул термообрабатывают при 100 120 o C в течение 4 ч и при 400 450 o C в течение 4 ч. Содержание компонентов составляет: активный оксид алюминия 80 мас. связующее гидроксид кальция 20 мас.
Пример 2. Технический гидроксид алюминия перед загрузкой в аппарат просеивают через сетку с размером ячеек 5 х 5 мм. Процесс пластификации осуществляют в мешателе типа "Verner", аппарата из нержавеющей стали емкостью 200 л с двумя зигзагообразными мешалками, делающими по 40 об/мин.
В аппарат сначала заливают воду-конденсат 10,5 л, затем при перемешивании загружают 2,87 кг в пересчете на 100% азотную кислоту и 70 кг технического гидроксида алюминия в пересчете на сухой продукт. Массу перемешивают в течение 1 ч, после чего в смеситель загружают активный гидроксид алюминия в количестве 7,74 кг в пересчете на сухой продукт и массу перемешивают в течение 1 ч. После перемешивания массу формуют, сушат и подвергают термообработке.
Пример 3. Аналогичен примеру 2, только кислотный модуль равен 0,1, время перемешивания 0,9 ч.
Пример 4. Аналогичен примеру 2, только кислотный модуль равен 0,9 и время перемешивания 0,8 ч.
Пример 5. Аналогичен примеру 2, только технический гидроксид алюминия предварительно размалывают до частиц размером 5 7 мкм и соотношение технического гидроксида алюминия к химически активному гидроксиду алюминия составляет 90:10 мас. кислотный модуль равен 0,3, время перемешивания 0,5 ч.
Пример 6. Аналогичен примеру 2, только соотношение технического гидроксида алюминия к активному составляет 60:40 мас. температура термообработки 850 o C и кислотный модуль равен 0,6.
Пример 7. Аналогичен примеру 2, только соотношение технического гидроксида алюминия к активному составляет 70:30 мас. и температура термообработки 1300 o C.
Пример 8. Аналогичен примеру 2, только перемешивание на первой стадии пластификации составляет 1,5 ч.
Пример 9. Аналогичен примеру 2, только перемешивание на второй стадии пластификации составляет 1,5 ч.
Пример 10. Аналогичен примеру 2, только кислотный модуль равен 0,45, время перемешивания на первой стадии 0,9 ч. на второй стадии 0,8 ч.
Пример 11. Аналогичен примеру 2, только пластификацию проводят в одну стадию. В аппарат загружают технический гидроксид алюминия, добавляют связующее, затем заливают азотную кислоту с водой и далее смесь перемешивают в течение 1 ч.
Пример 12. Аналогичен примеру 2, только температура термообработки составляет 1100 o C.
Пример 13. Аналогичен примеру 2, только содержание связующего составляет 5 мас.
Примеры выполнения способа сведены в таблицу.
Как видно из приведенных примеров, предлагаемый способ дает возможность получать различные модификации оксида алюминия по упрощенной технологии. К техническому гидроксиду алюминия добавляют связующее в количестве 10 40% Добавка связующего в количестве менее 10% приводит к получению носителя с низкой прочностью (пример 13), а использование связующего в количестве более 40% приводит к удорожанию стоимости получаемого носителя. Связующее представляет собой переосажденный гидроксид алюминия (пример 2) или ТМХА (пример 3) или ХА (примеры 5 и 8). Пластификацию проводят в две стадии к техническому гидроксиду алюминия сначала приливают азотную кислоту и воду, перемешивают и затем добавляют связующее. Проведение пластификации в дну стадию приводит к получению носителя с низкой механической прочностью (пример 11). Проведение пластификации в течение 1,5 ч приводит к разжижению пасты и плохой формуемости (примеры 8 и 9). Пластификацию проводят с кислотным модулем 0,1-0,9. При снижении кислотного модуля (пример 3) снижается прочность катализатора.
Изменение температуры термообработки от 450 до 1300 o C дает возможность получать активный оксид алюминия с различной удельной поверхностью, пористостью и прочностью. Предварительный размол технического гидроксида энергоемок и требует дополнительных трудозатрат, но в последующем при пластификации требуется меньшее количество азотной кислоты и уменьшается время пластификации (пример 5).
Таким образом, предлагаемый способ позволяет получать различные модификации активного оксида алюминия в рамках единой технологической схемы и значительно улучшать качество получаемых продуктов.
1. Способ получения активного оксида алюминия из технического гидроксида алюминия, включающий его пластификацию со связующим, формование, сушку и термообработку сформованных гранул, отличающийся тем, что в качестве связующего используют активный гидроксид алюминия, пластификацию проводят в две стадии: на первой стадии к техническому гидроксиду алюминия добавляют азотную кислоту и воду до кислотного модуля 0,1 0,9 и перемешивают не более 1 ч, на второй стадии вводят связующее в количестве 10 40 мас. и перемешивают не более 1 ч.
2. Способ по п.1, отличающийся тем, что в качестве активного гидроксида алюминия используют переосажденный гидрооксид алюминия.
3. Способ по п.1, отличающийся тем, что в качестве активного гидроксида алюминия используют гидроксид алюминия, являющийся продуктом термомеханохимической активации.
4. Способ по п.1, отличающийся тем, что в качестве активного гидроксида алюминия используют химически активированный гидроксид алюминия.
5. Способ по п.1, отличающийся тем, что перед пластификацией технический гидроксид алюминия подвергают размолу до частиц размером 5 10 мкм.
6. Способ по п.1, отличающийся тем, что при получении активного оксида алюминия с бидисперсной пористой структурой, используемого в качестве носителя, сформованные гранулы подвергают термообработке при 450 650 o С.
7. Способ по п.1, отличающийся тем, что при получении крупнопористого активного оксида алюминия, используемого в качестве носителя, термообработку ведут при 850 1100 o С.
8. Способ по п.1, отличающийся тем, что при получении активного оксида алюминия, используемого в качестве высокотемпературного носителя, термообработку ведут при 1100 1300 o С.
Алюминий является самым распространенным металлом в земной коре. Свойства алюминия позволяют активно применять в составе металлоконструкций: он легкий, мягкий, поддается штамповке, обладает высокой антикоррозийной устойчивостью.
Для алюминия характерна высокая химическая активность, отличается также высокой электро- и теплопроводностью.

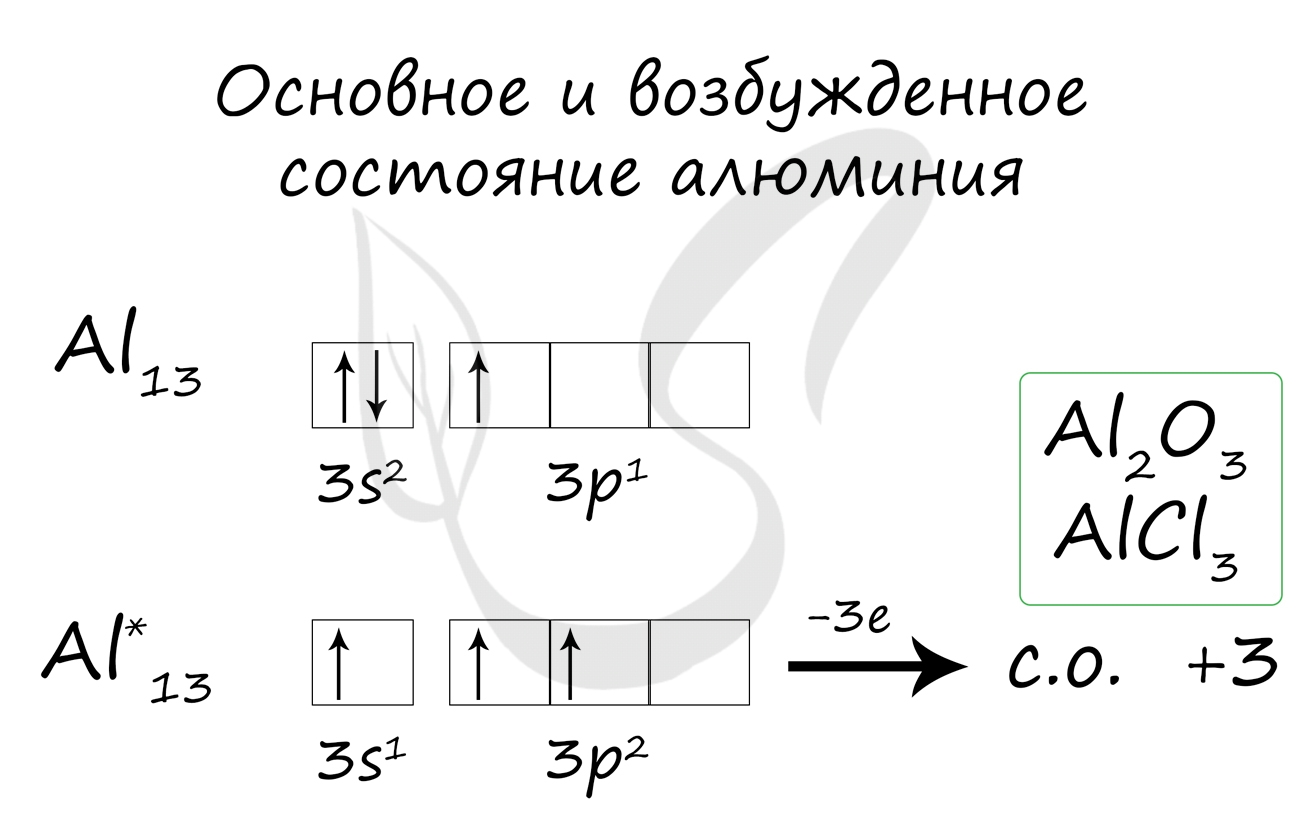
Основное и возбужденное состояние
При переходе атома алюминия в возбужденное состояние 2 электрона s-подуровня распариваются, и один электрон переходит на p-подуровень.
Природные соединения
- Al2O3 - корунд
- 3BeO*Al2O3*6SiO2 - берилл (аквамарин - примесь Fe и изумруд - примесь Cr2O3)
- Al2O3*Cr2O3 - красный рубин
- Al2O3 с примесью Fe +2 /Fe +3 /Ti
- Al2O3*H2O - боксит

Получение
Алюминий получают путем электролиза расплава Al2O3 в криолите (Na3[AlF6]). Галлий, индий и таллий получают схожим образом - методом электролиза их оксидов и солей.
Химические свойства
При комнатной температуре реагирует с галогенами (кроме фтора) и кислородом, покрываясь при этом оксидной пленкой.
Al + Br2 → AlBr3 (бромид алюминия)
При нагревании алюминий вступает в реакции с фтором, серой, азотом и углеродом.
Al + F2 → (t) AlF3 (фторид алюминия)
Al + S → (t) Al2S3 (сульфид алюминия)
Al + N2 → (t) AlN (нитрид алюминия)
Al + C → (t) Al4C3 (карбид алюминия)

Алюминий проявляет амфотерные свойства (греч. ἀμφότεροι - двойственный), вступает в реакции как с кислотами, так и с основаниями.
Al + NaOH + H2O → Na[Al(OH)4] + H2↑ (тетрагидроксоалюминат натрия; поскольку алюминий дан в чистом виде - выделяется водород)
При прокаливании комплексные соли не образуются, так вода испаряется - вместо них образуются (в рамках ЕГЭ) средние соли - алюминаты (академически - сложные окиселы):
При комнатной температуре не идет из-за образования оксидной пленки - Al2O3 - на воздухе. Если разрушить оксидную пленку нагреванием раствора щелочи или амальгамированием (покрытием металла слоем ртути) - реакция идет.

Алюминотермия (лат. Aluminium + греч. therme - тепло) - способ получения металлов и неметаллов, заключающийся в восстановлении их оксидов алюминием. Температуры при этом процессе могут достигать 2400°C.
С помощью алюминотермии получают Fe, Cr, Mn, Ca, Ti, V, W.

Оксид алюминия
Оксид алюминия получают в ходе взаимодействия с кислородом - на воздухе алюминий покрывается оксидной пленкой. При нагревании гидроксид алюминия, как нерастворимое основание, легко разлагается на оксид и воду.
Проявляет амфотерные свойства: реагирует и с кислотами, и с основаниями.
Al2O3 + NaOH + H2O → Na[Al(OH)4] (тетрагидроксоалюминат натрия)

Гидроксид алюминия
Гидроксид алюминия получают в ходе реакций обмена между растворимыми солями алюминия и щелочами. В результате гидролиза солей алюминия часто выпадает белый осадок - гидроксид алюминия.
Проявляет амфотерные свойства. Реагирует и с кислотами, и с основаниями. Вследствие нерастворимости гидроксид алюминия не реагирует с солями.
Al(OH)3 + LiOH → Li[Al(OH)4] (при избытке щелочи будет верным написание - Li3[Al(OH)6] - гексагидроксоалюминат лития)

Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.

Во многих современных технологических процессах просто невозможно обойтись без химических реагентов. Они являются неотъемлемой составляющей в работе нефтеперерабатывающих и фармакологических производств, пищевой и текстильной промышленности. Одним из таких химических реагентов является оксид алюминия. Благодаря своим уникальным свойствам он может использоваться, как осушитель или катализатор, а также в виде составляющей полимеров.
Как получают алюминия оксид?
Для получения этого вещества используют бокситовые и каолиновые руды, а также алуниты и нефелины. Главное достоинство оксида алюминия по сравнению с прочими веществами, обладающими сходными физико-химическими свойствами, - это довольно большая распространённость и доступность. Нужный объём материала можно извлекать из естественной среды методом хлорирования или алюминатным способом.
Физико-химические свойства
Вещество устойчиво к воздействию большинства кислот, является природным атмосферным оксидом. Специалисты выделяют две основных модификации данного материала:
- корунд - естественная, природная альфа-модификация;
- искусственная форма, получаемая в ходе термообработки содержащих алюминий соединений.
В промышленности вещество производится в виде маленьких шариков или гранулированного материала, характеризующихся большой устойчивостью к внешним факторам. Поверхность материала микропористая. Вещество обладает повышенными адсорбционными свойствами, характеризуется полным отсутствием запаха и абсолютной химической стабильностью при комнатной температуре воздуха. К прочим физико-химическим особенностям оксида алюминия относят следующие:
- стойкость к механическому воздействию;
- отсутствие реакции на капельную влагу;
- химически устойчивую форму;
- минимальный уровень токсичности.
Всё это делает вещество сырьём, востребованным в различных областях промышленности, а также максимально удобным при транспортировке.
Читайте также:

