Очистка воды электролизом своими руками
Добавил пользователь Алексей Ф. Обновлено: 19.09.2024
При прохождении воды через электролизер в результате действия электрического тока происходит образование особых соединений. С их помощью воду можно обеззараживать во время ее течения. Данная технология обеззараживания воды без применения реагентов является сегодня самым перспективным направлением.
Научные предпосылки.
Очистка воды прямым электролизом при прохождении электрического тока вызывает электрохимические реакции. Таким образом, в воде образуются новые вещества. Также происходит изменение структуры межмолекулярных взаимодействий.
Экологические предпосылки.
Окислители во время электролиза образуются непосредственно из воды, что не требует их дополнительного внесения.
Экономические предпосылки.
Природную воду методом прямого электролиза можно обрабатывать при помощи блока электропитания и электролизёра. Дозирующие насосы, реагенты в данном случае не нужны. При прямом электролизе природной воды затраты электроэнергии составляют около 0,2 кВт/м³.
Нормативные предпосылки.
Обеззараживание воды прямым электролизом рекомендуется СНиП 2.04.02-84 в том случае, если в воде содержится не менее 20 мг/л хлоридов. При этом ее жесткость выражается в показателе не больше 7 мг-экв/л. Такую обработку могут производить станции, производительность которых составляет 5 000 м³ в сутки.
Очистка и обеззараживание воды прямым электролизом
Прямой электролиз идеально подходит для очистки природных вод. Во время этого процесса образуются несколько окислителей, например, озон и кислород. Любая природная вода содержит хлориды в разной степени, поэтому в процессе прямого электролиза образуется свободный хлор.
Электролизные установки базируются на модульности. Производительность электролизного оборудования можно увеличить за счет увеличения количества модулей. Модули с мощностью 5 или 12 кг активного хлора в сутки имеют сейчас повышенный спрос. Модули с производительностью от 20 до 50 кг активного хлора в сутки применяются на объектах с большей мощностью.

Электролиз воды сопровождается серией электрохимических реакций, в результате которых в воде происходит синтез окислителей. Основными реакциями электролиза воды является образование кислорода O2 и водорода H2, а также гидроксид иона OH¯:
на аноде 2H2O → O2↑ + 4H + + 4e − (1)
на катоде 2H2O + 2e → H2↑ + 2OH¯ (2)
При электролизе воды также образуются озон O3 и перекись водорода H2O2:
на аноде 3H2O → O3↑ + 6e − + 6H + (3)
В присутствии хлоридов при электролизе воды образуется растворённый хлор:
на аноде 2Cl – → Cl2+2e – (5)
Растворённый хлор Cl2, реагируя с водой и гидроксид ионом, образует хлорноватистую кислоту HClO:
Cl2 + OH¯ → HClO + Cl¯ (7)
Разложение хлорноватистой кислоты HClO в воде приводит к образованию гипохлорит иона:
Из приведённых выше реакций следует, что при электролизе воды образуется ряд окислителей:
гипохлорит ион OCl¯.
Появление при электролизе воды OH-радикалов, H2O2 и O3 приводит к образованию других сильных окислителей, таких как O3¯, O2¯, O¯, HO2, HO3, HO4 и др.
г. Краснодар данное оборудование изготавливает по следующим принципам:
Электролизер
Электролиз – химико-физическое явление по разложению веществ на элементы при помощи электротока, которое повсюду используется в производственных целях. На основе данной реакции делаются агрегаты для получения, к примеру, хлора или цветных металлов.
Электролизная установка, которая состоит из пластин
Постоянный рост расценок на энергетические ресурсы сделал востребованными ионные установки домашнего применения. Что собой представляют подобные конструкции, и как их сделать дома?
Домашний электролиз своими руками
Когда я был маленький, я всё время хотел что-либо делать сам, своими рукам. Вот только родители (и другие родственники) обычно этого не разрешали. А я не видел тогда (и до сих пор не вижу) ничего плохого, когда маленькие дети хотят учиться
Самодельный прибор для получения живой и мертвой воды

В статье дается краткое описание свойств и способов применения активированной воды. Приведено описание устройства двух приборов для ее приготовления.
Легенды и сказки о живой воде
Целебные свойства живой и мертвой воды известны очень давно. Еще в русских народных сказках погибшего героя-богатыря воскрешали при помощи мертвой и живой воды. О живой воде упоминается во многих литературных источниках.
Еще в рукописях Древней Руси XIV в. упоминается, что Александр Македонский во время своего исторического похода на край света вдоль Траверса (горная цепь Кавказ, Памир, Тянь - Шань) обнаружил источник с живой водой. Царь приказал налить кувшин этой воды и заставил своего воина ее охранять: он надеялся, что в случае гибели эта вода его оживит. Но дочь Александра, Панорея, соблазнила юношу-охранника, заколола его ножом, выпила немного воды из кувшина, а остальную вылила на себя. После этого она стала бессмертной и невидимой.
Сохранились исторические сведения, что эликсир бессмертия пытались найти многие китайские императоры, Римские Папы и другие правители и сильные мира сего. Для поиска эликсира бессмертия организовывались целые экспедиции.
Экспедицию по поиску живой воды, о которой узнали от местных жителей – индейских народов, в XVI в. организовали испанские завоеватели. Искали они ее на островах Атлантического океана и Карибского моря, но им удалось найти лишь несколько целебных источников и открыть острова Антильского архипелага.
Уже при Петре I в России поиском живой воды – эликсира бессмертия занимался один из сподвижников царя генерал – фельдмаршал Яков Велимович Брюс (1670-1735). После смерти Брюса, согласно завещанию, его тело должны были окропить живой водой. Но получилось так, что при открытии волшебного пузырька, слуга всю воду просто вылил на пол. Лишь малая толика попала на руку Брюса. Могила Брюса была вскрыта для перезахоронения в двадцатых годах XX в. – одна его рука осталась нетленной.
Все эти легенды и сказки говорят о том, что нашим предкам было известно о существовании живой и мертвой воды. Самая обычная вода до сих пор не изучена до конца, современная наука до сих пор многого о ней не знает.

Физико–химические свойства воды весьма многочисленны, поэтому она может оказывать самые разнообразные воздействия на растительный и физический мир: в одних случаях она приносит жизненную энергию растениям и организмам, а в других отбирает. В определенных условиях вода может обладать целительными свойствами, не замерзать при очень низких температурах, и даже светиться в темноте.
В средней Азии, например, отмечено, что урожай хлопчатника, поливаемого водой из подземного источника, выше на 30%, чем при поливе водой из арыка. Такое происходит оттого, что на открытом воздухе вода интенсивно отдает жизненную энергию просто в окружающее пространство. Причиной тому ветер, солнце и многое другое. Поэтому вода с гор доставлялась на поля через подземные тоннели – кяризы. Таким образом, в одних источниках содержится вода живая, а в других мертвая.
Живая вода содержится в горных реках, водопадах, это дождевая вода, особенно во время грозы, разумеется, если дождь не кислотный. Также живой водой является вода от таяния ледников. Все эти воды ведут человека к долголетию и полезны для здоровья.
Живая и мертвая вода для лечения
Чтобы получить живую и мертвую воду вовсе не обязательно искать ее природные источники – горные реки или болота. Такая вода сейчас с успехом может быть получена с помощью электролиза обычной воды даже в домашних условиях. Часто такую воду называют активированной водой.
Исследованиями свойств живой и мертвой воды еще в 80-е годы прошлого века занимались ведущие медицинские учреждения СССР. Но исследования в этой области проводились, как и многие другие, в обстановке секретности и большая часть результатов на афишировалась и для широких кругов публики была недоступна. Но, как гласит народная мудрость, шила в мешке не утаишь, поэтому тайна достигла заинтересованных людей, - о ней узнали врачи и народные целители.
Наверно, в этом плане больше помогли работы зарубежных исследователей, ведь там у них подобные разработки велись открыто, и даже в условиях железного занавеса их результаты были доступны в СССР. Эти разработки попросту опубликовывались в прессе.
Современной наукой доказано, что живая вода, также называемая католитом, в процессе электролиза получает отрицательный потенциал. От такого превращения она обладает весьма высокими регенерирующими и иммуностимулирующими свойствами, которые дают ей возможность успешно применяться при лечении многих заболеваний. Даже Фармакологический Комитет СССР подтвердил уникальные свойства живой и мертвой воды, ее абсолютную безвредность, как при наружном, так и внутреннем применении и возможность применения при лечении множества болезней.
Мертвую воду, полученную в процессе электролиза также называют анолитом, ведь она скапливается около положительного электрода – анода. Свойства мертвой воды известны достаточно давно, - именно благодаря ее антибактериальным свойствам сотням людей удалось спастись от пролежней и гниющих ран.
Получение живой и мертвой воды
Активированная вода получается с помощью электролиза обычной водопроводной воды. С точки зрения химии живая вода обладает щелочными свойствами, которые оказывают заживляющее действие, а мертвая вода имеет свойства кислотные, поэтому у нее налицо дезинфицирующие свойства. Проходя через обычную воду, электрический ток меняет ее внутреннюю структуру и способствует стиранию вредной экологической информации.
После обработки электричеством вода разделяется на две фракции, которые обладают целебными свойствами. При лечении болезни живую и мертвую воду принимают в различных сочетаниях. Для разных болезней эти сочетания различны, достаточно хорошо изучены, в Интернете имеется множество статей и таблиц о лечении активированной водой.
Первые опыты применения активированной воды

Автором прибора для приготовления живой и мертвой воды у нас в отечестве считается Н.М. Кратов. История создания прибора такова. В 1981 году Н.М. Кратов находился на излечении в больнице по поводу аденомы предстательной железы и воспаления почек. После более чем месяца лечения врачи предложили операцию аденомы. От такого предложения он отказался, поэтому был просто выписан.
Как раз в это время на руке у сына была рана, не заживающая более полугода. Испытания свойств активированной воды были проведены на ней и превзошли все ожидания: рана зажила уже на второй день.
Окрыленный успехом автор начал сам принимать живую воду по полстакана в день три раза перед едой, и вскоре почувствовал бодрость. Вместе с аденомой через неделю прошли опухоль ног и радикулит.
Чтобы убедиться в эффективности своего лечения Н.М. Кратов обратился в поликлинику, и проведенные анализы показали, что болезни его полностью оставили. Вдобавок ко всему пришло в норму кровяное давление.
Со временем к Н.М. Кратову стали обращаться за помощью люди. При лечении живой и мертвой водой всего за два дня прошел ожог третьей степени на руке у соседки, полученный кипятком.
В течение целых шести месяцев гноилась десна у соседского мальчика, образовался нарыв в горле, а желаемого результата традиционные медикаментозные средства не давали. По совету автора прибора горло и десну полоскали 6 раз в день мертвой водой (дезинфицировали), после чего принимали внутрь по стакану живой воды. В результате всего лишь за 3 дня пришло полное выздоровление.
Методы лечения активированной водой
Кроме Кратова исследованиями свойств активированной воды занимался Г.Д. Лысенко и еще многие авторы. Благодаря их стараниям стало известно, что с помощью живой и мертвой воды возможно излечение почти от 50-ти заболеваний, начиная от ангины и заканчивая язвой двенадцати - перстной кишки и желудка. В этот список входят также такие распространенные болезни, как грипп, простуда, насморк, ожоги, радикулит, повышенное кровяное давление и многие другие. Все это достаточно легко найти в Интернете, там же указаны и способы лечения.
Аппарат живой и мертвой воды своими руками
Аппараты для производства живой и мертвой воды сейчас нетрудно найти в продаже, во всяком случае, в Интернете такой рекламы полно. Но, если такой прибор купить и посмотреть на его устройство, то можно заметить, что цена, отданная за столь простой прибор, достаточно велика. Проще было бы изготовить его своими руками, тем более, что для этого понадобится совсем немного материалов, времени, а умения нашим мастерам – самодельщикам не занимать. Схема прибора для получения активизированной воды показана на рисунке 1.

Рисунок 1. Схема прибора для получения живой и мертвой воды.
На этой схеме видно, что весь прибор состоит из двух металлических электродов, помещенных о обычную стеклянную банку. Электроды с помощью винтов и гаек крепятся на крышке банки. Один из электродов подключен напрямую, это будет катод, а другой подключен через диод.
При указанной на рисунке полярности подключения левый электрод является анодом.
На положительном электроде будет выделяться мертвая вода – анолит, поэтому для ее сбора на аноде укреплен мешочек из плотной ткани. Ткань должна быть достаточно плотной, но тонкой, очень подходит для этих целей брезент от противогазных сумок или бязь. Критерием для выбора ткани можно считать прохождение через нее воздуха. Для этой цели достаточно ткань приложить ко рту и попробовать продуть сквозь нее воздух: сопротивление ткани должно быть достаточно заметно.
Главными деталями устройства являются электроды, размеры которых показаны на рисунке 2.
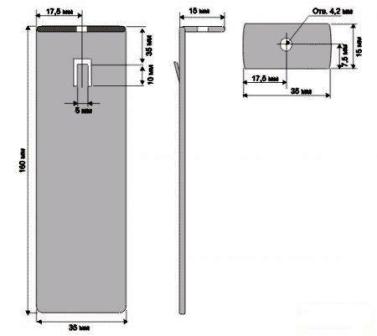
Рисунок 2. Электроды.
Длина электродов на рисунке указана 100 мм. Это справедливо, если будет применяться поллитровая банка. В принципе объем банки можно увеличить до трех литров, тогда просто потребуется удлинить электроды, но так, чтобы они не касались дна банки не менее чем на 5 - 10 мм.
На рисунке видно, что на электроде имеется П-образный пропил. Такой пропил необходим лишь на положительном электроде – аноде для того, чтобы на нем можно было повесить матерчатый мешочек для сбора мертвой воды. На другом электроде такой пропил делать не потребуется.
Электроды крепятся к банке при помощи обычной капроновой крышки как показано на рисунке 1. Известно, что такие крышки механической прочностью не отличаются, поэтому чтобы поведение электродов не было непредсказуемым, следует их укрепить на крышке через уплотняющую изолирующую прокладку. Ее можно выполнить из стеклотекстолита конечно же, без фольги, текстолита или любой другой пластмассы. Конструкция прокладки показана на рисунке 3.
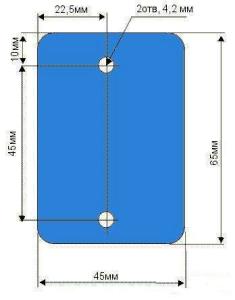
Рисунок 3. Изолирующая прокладка.
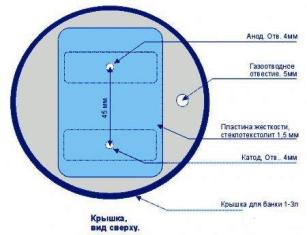
На рисунке 4 показано, как эта прокладка устанавливается на капроновую крышку банки. Показаны отверстия для крепления электродов и отверстие для выхода газов.
На рисунке 5 показано крепление электродов и прокладки к крышке.
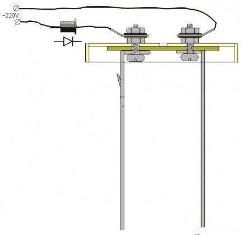
Рисунок 5. Крепление электродов.
Если использовать диод с резьбовым креплением, то его резьба будет крепить положительный электрод. Принципиально ничего не мешает вместо одного диода использовать выпрямительный мостик. В этом случае просто возрастет в 4 раза мощность устройства и соответственно ускорится процесс приготовления, что при систематическом использовании устройства немаловажно.
Приготовление активированной воды
Приготовление живой воды достаточно просто. Просто надо в матерчатый мешочек залить воды, укрепить его на положительном электроде, и после этого вставить в банку залитую водой. Вода в банке не должна доходить до краев и быть чуть ниже верхнего края матерчатого мешочка. Более точно уровень заливки воды в банку устанавливается опытным путем.
Приготовление живой воды занимает не более 5 - 10 минут. После этого надо вынуть электроды из банки и очень аккуратно, чтобы не смешать полученные фракции, вылить в отдельную посуду мертвую воду из матерчатого мешочка.
Кроме уже описанной конструкции можно рекомендовать для изготовления конструкцию прибора без матерчатого мешка. В этом случае потребуется две отдельных емкости, только без горлышка, как у банок, а с прямыми отвесными краями. Конструкция электродов остается без изменений, только устанавливать их придется отдельно на каждую емкость.
Для того, чтобы обеспечить электрический контакт между этими банками их следует соединить ватным жгутом, замотанным в марлю. При этом жгут следует предварительно смочить водой. Такой жгут соединит банки электрически и обеспечит путь для прохождения ионов между банками. Таким образом в одной банке будет скапливаться живая вода, а в другой мертвая. Поэтому после окончания процесса достаточно просто выключить установку из сети и получить католит и анолит просто из разных банок, причем одинаковой емкости.
Всю конструкцию, как эту, так и предыдущую можно включить в сеть не напрямую, а через лампочку мощностью около 15 Вт. Такие применяются в холодильниках и швейных машинах. В случае короткого замыкания электродов она выполнит роль предохранителя, а в случае нормальной работы – индикатора: в начале процесса лампа будет светить ярко, ближе к окончанию яркость значительно упадет, после чего лампа совсем погаснет. Это является сигналом о готовности активированной воды.
В процессе приготовления воды на электродах и на самой банке будет образовываться накипь, удалить которую будет можно раствором лимонной или соляной кислоты. После этого банку следует тщательно промыть.
Не следует заливать в прибор воду сразу из-под крана. Лучше, если дать воде отстояться не менее 5 - 6 часов, чтобы из нее вышел хлор, иначе может получиться соляная кислота. Совсем хорошо, если водопроводную воду профильтровать через любой бытовой фильтр и вскипятить.
Движение электрического тока через электролит есть результат перемещения полярных частиц к электродам, имеющим противоположные знаки: к положительно заряженному аноду перемещаются отрицательно заряженные частицы, к отрицательно заряженному катоду – частицы с положительным зарядом. Основная роль в этом процессе принадлежит ионам (табл. 5.3).
Между электродом и элекролитом возникает разность потенциалов, что делает принципиально возможными окислительно-восстановительные реакции (см. табл. 6.4). Продукты этих электродных реакций, а так же другие водные примеси, могут вступать между собой в химические взаимодействия. Химические реакции, происходящие в меж-электродном пространстве, называются объемными. Таким образом, электрохимическая очистка осуществляется в результате электродных и объемных процессов, причем первые полностью или частично инициируют вторые.
7.2. Разрушение молекул воды при электролизе
В результате электродных реакций происходит разрушение некоторого количества молекул воды с образованием продуктов, активно участвующих в объемных процессах. Непосредственно у электродов вода находится в неустойчивом состоянии. У анода мощность редокс–системы по кислороду r02 равна нулю, у катода нулевое значение имеет мощность по водороду rН2 (рис. 6.14).В зависимости от РН и потенциала Е происходят анодные реакции, сопровождающиеся выделением молекулярного кислорода, озона, пероксида водорода, т.е. сильных окислителей:
при E 0 =+1,23 В 2 Н 2 О ↔ О 2 + 4 Н + + 4 е ,
при E 0 =+2,07 В O 2 + Н 2 О ↔ О 3 + 2 Н + + 2 е ,
при E 0 =+1,77 В 2 Н 2 О ↔ Н 2 О 2 + 2 Н + + 2 е .
В [22] высказывается мнение, что в при-анодном пространстве может образовываться анион Н 3 О 2 – , после окисления, которого следует ожидать появления атомарного кислорода. Анион Н 3 О 2 – возникает в результате разрыва связи между кислородом и водородом в молекуле воды, что требует создания больших напряжений.
У катода происходит восстановление молекулярного водорода:
при E 0 =+1,77 В 2 Н + +2 ОН – ↔ 2 Н 2 О + 2 е .
Катодное восстановление катионов Н + до молекулярного водорода идет по схеме
Н ↔ Н + + е ; Н + Н = Н 2 .
В кислой среде восстанавливается гидроксон
2 Н 3 O + + 2 e ↔ Н 2 + Н 2 O .
7.3. Электролиз хлоридов
Электролиз хлоридов позволяет получить все формы активного хлора: молекулярный, хлорноватистую кислоту и гипохлорит-ион. Эти окислители участвуют в соответствующих объемных процессах. При растворении поваренной соли, она диссоциируется, разделяясь на катионы натрия и анионы хлора. Последние окисляются у анода до молекулярного хлора:
при E 0 = -0,87 В 2 Cl – ↔ Cl 2 + 2 е .
В ходе дальнейших объемных процессов, в зависимости от pН, образуются другие формы активного хлора:
2 Cl 2 + 4 OH – ↔ 2 ClO – + 2 H 2 O ,
Cl 2 + OH – ↔ HOC l + Cl – ,
Cl 2 + H 2 O ↔ HCl + HOCl .
Гипохлорит-ион также образуется в результате ряда реакций с участием катионов натрия:
Na + + OH – ↔ NaOH ,
NaOH + HCl = H 2 O + NaClO (гипохлорит натрия),
NaClO ↔ Na + + ClO – ( при РН >> 5).
Если гипохлорит-ион используется в объемных реакциях недостаточно интенсивно и накапливается в меж-электродном пространстве, происходит его анодное окисление с образованием малоактивного аниона ClO 3 – . Этот процесс будет превалировать, т.к. электродный потенциал конкурирующей реакции окисления Cl – до Cl 2 меньше. Перевод хлора в малоактивное состояние, естественно нежелателен.
7.4. Электрохимическая деструкция водных загрязнений
Механизм очистки от хорошо диссоциирующихся кислот, щелочей, солей включает следующие этапы: диссоциацию, перемещение ионов к электродам, электродное окисление или восстановление. Деполяризованные ионы теряют водную оболочку и сорбируются, либо образуют новые молекулярные соединения.
Одновременно происходят различные объемные реакции.
Следует заметить, что при близких значениях потенциалов Е может возникнуть конкуренция между компонентами, участвующими в электродных реакциях.
Например, анодное разрушение молекул воды с образованием О2 происходит при Е 0 = + 1,23 [В], а окисление Cl – до Cl 2 – при +1,36 [В]. Поэтому, между этими процессами в области значений Е = +1,36–1,40 [В] происходит конкуренция и лишь при заметном увеличении Е окисление Cl – идет достаточно энергично.
На значение перенапряжения влияют многие факторы и, в первую очередь, материал электрода, активность его молекул (наибольшее перенапряжение требуется для электродов из свинца). Кроме того, перенапряжение зависит от плотности тока, т.е. его силы, отнесенного к единице площади поверхности электрода.
Значение перенапряжения находят по зависимости:
E = a + b lg iel ,
где а и b – постоянные, зависящие от материалов электродов; iel – плотность тока.
Таким образом, выбор напряжений при электрической очистке предусматривает учет требуемых для данных реакций нормальных напряжений, перенапряжений и условий конкуренции между примесями.
Рассмотрим электрохимическую очистку воды от некоторых видов загрязнений.
7.4.1. Очистка от соединений циана
При электролизе щелочных сточных вод, содержащих комплексные и простые цианиды, последние окисляются на анодах с образованием цианатов:
CN – + 2 OH – " CNO – + H 2 O + 2 ē .
По мере накопления в растворе цианаты дополнительно окисляются и, взаимодействуя с параллельно деполяризующимися гидроксид-ионами, разрушаются до карбонат-аниона и газообразного азота:
2 CNO – + 6 OH – → 2 HCO 3 + N 2 ↑ + 2 H 2 O + 6 ē .
При разрушении комплексных цианидов в воду поступают катионы металлов: кадмия, железа, меди и др. Перемещаясь к катоду и попадая в область восстановления они деполяризуются и осаждаются на катоде, либо взаимодействуя с анионами ОН – образуют гидроксиды, которые при соответствующих значениях рН в дальнейшем выпадают в осадок.
При генерации в электролизере активного хлора, он окисляет цианиды в ходе объемных реакций (см. главу 6).
7.4.2. Очистка от шестивалентного хрома и ионов тяжелых металлов
Восстановление шестивалентного хрома до трехвалентного осуществляется в электрокоагуляторах, электролизерах с растворимыми стальными анодами. Растворение анодов происходит в соответствии с реакцией: Fe · → Fe 2+ + 2 ē . Катионы двухвалентного железа частично окисляются до трехвалентного: Fe 2+ → Fe 3+ + ē и, Fe 2+ + 2 OH – → Fe ( OH )2.
В основном же, окисление двухвалентного железа в трехвалентное происходит в результате объемных процессов и сопровождается восстановлением шестивалентного хрома до трехвалентного согласно реакциям:
Cr 2 O 7 2– + 6 Fe 2+ + 14 H + → 6 Fe 3+ + 2 Cr 3+ + 7 H 2 O .
В приведенных реакциях участвуют продукты электрохимического разрушения воды: Н + и ОН – .
Восстановление шестивалентного хрома происходит у катода:
CrO 4 2– + 4 H 2 O + 3 e → Cr ( OH )3 + 5 OH – ,
Cr 2 O 7 2– + 7 H 2 O + 6 e → 2 Cr ( OH )3 + 7 OH – .
Для осаждения продуктов восстановления Fe ( OH )3, Cr ( OH )3, Fe ( CrO 4 )2 необходима корректировка рН, исключающая растворение этих веществ.
Если в воде помимо хрома содержатся катионы других тяжелых металлов, то в ходе объемных процессов они восстанавливаются двухвалентным железом и осаждаются вместе с гидроксидами хрома и железа; часть этих металлов взаимодействуя с анионами ОН – переходят в малорастворимые соединения гидроксидов или, деполяризуясь на катоде, теряют гидратную оболочку и сорбируются на его поверхности.
Рекомендуемые значения рН, обеспечивающие удаление тяжелых металлов осаждением, приводятся в табл. 7.2.
Рекомендуемые значения рН при удалении ионов тяжелых металлов
Содержание Сr 6+ , мг/л
Медь, цинк, кадмий
Шестивалентные хром, медь, цинк
Шестивалентные хром, кадмий, никель
7.4.3. Электрохимическая деструкция органики
Процессы электрохимической деструкции органических веществ, обладающих ковалентными химическими связями, недостаточно изучены. Проф. И.Г. Краснобородько отмечал, что механизмы этих процессов должны выясняться применительно к конкретном органическом соединениям.
Часто при анодном окислении происходит частичное или полное расчленение органических молекул на отдельные фрагменты.
Так происходит окисление аниона муравьиной кислоты НСООН :
НСОО – ↔ Н + СО 2 + е .
В зависимости от условий (рН, материал анода, перенапряжение, участие в анодных процессах деполяризованных, частиц и других) окисление идет разными путями с получением разных конечных продуктов. Например, уксусная кислота в щелочной среде окисляется на платиновом аноде по нескольким возможным схемам:
СН 3 СОО – + 3 ОН – → СН 3 ОН + СО 3 2– + Н 2 О + 2 е ,
2 СН 3 СОО – + 4 ОН – → С 2 Н 6 + 2 СО 3 2– + 2 Н 2 О + 2 е ,
СН 3 СОО – + 5 ОН – → СН 2 О + СО 3 2– + 3 Н 2 О + 4 е ,
СН 3 СОО – + 11 ОН – → 2 СО 3 2– + 7 Н 2 О + 8 е .
Анодное окисление спиртов сопровождается потерей водорода, т.е. дегидрированием.
В [18] отмечается, что катодное восстановление органики происходит под влиянием разных механизмов выделения водорода. В процессе могут участвовать как катионы, так и атомы водорода (после деполяризации Н + ). Кроме того, в катодных реакциях участвует вещество самой органики, с образованием радикалов Rc в виде органических анионов Rc + e → Rc – , и дальнейшей гидратацией: Rc – + H + → Rc . Наконец, возможны при-катодные реакции по схеме: Rc + H + e → RcH . При высоких потенциалах у катодов образуются свободные радикалы, участвующие в тех или иных объемных процессах. Катодные процессы нередко вызывают замещение электроотрицательных функциональных групп органики водородом, т. е. образование новых соединений, менее устойчивых или не являющихся загрязнениями. В ряде случаев деструкция загрязнений начинается с катодного восстановления. Так ароматические соединения восстанавливаются у катодов до аминов, а затем подвергаются анодному окислению до образования воды, углекислого газа и молекулярного азота.
Особенностью электрохимической деструкции многих органических соединений с устойчивыми химическими связями является то, что электродные процессы только ослабляют связи и вызывают частичную деструкцию, а достаточно глубокое разрушение достигается в результате объемных окислительных процессов с участием соединений хлора.
Для деструкции некоторых устойчивых загрязнений необходим избыток активного хлора, накопление которого приводит к бесполезным потерям, т.к. на аноде он окисляется до малоактивного хлорат-иона ClO3 – . В этих условиях целесообразно использование катализаторов, обеспечивающих разложение активного хлора с образованием атомарного кислорода, и свободных радикалов (см. п. 6.3.2.1).
И.Г. Краснобородько разработал основанный на этом метод электрокаталитической деструкции, обеспечивающий глубокое разрушении химически устойчивых веществ. Катализаторами могут служить соединения хрома, кобальта, никеля, марганца (см. п. 6.3.2.1).
Качество разных видов катализаторов оценивается по скорости каталитического разложения активного хлора. Наибольшая скорость разложения происходит при использовании оксида кобальта Со3О4, но это приводит к такому бурному выделению атомарного кислорода, что только часть его успевает использоваться по прямому назначению для окисления органики, а остальное количество после рекомбинации образует менее активный молекулярный кислород.
На рис. 7.2 приводится график, описывающий кинетику окисления анионогенного СПАВ при электрокаталитической очистке с применением разных катализаторов. Начальное содержание СПАВ составляло 22,3 мг/л.
Установки могут быть проточными, либо периодического действия с рециркуляцией воды.
На рис. 7.4. приведена принципиальная схема электрокаталитической очистки сточных вод красильно–отделочного производства. Сильнозагрязненный сток частично очищается в электролизере, содержит значительное количество активного хлора и направляется для доочистки в каталитический реактор после предварительного смешения со слабозагрязненным стоком. Таким образом, глубокая очистка достигается хлорированием в присутствии катализатора.
Рис. 7.4. Принципиальная технологическая схема электрокаталитической очистки сточных вод красильно-отделочного производства: 1 – усреднитель; 2 – смеситель; 3 – электролизер; 4 – каталитический реактор; 5 – сильно загрязненный сток; 6 – слабо загрязненный сток; 7 – раствор NaCl
Электролизер – это генератор продуктов для окисления и восстановления. Согласно закону М. Фарадея, теоретическое количество вещества, прореагировавшего на электродах при пропускании электрического тока, определяется по формуле:
G = AIcurt , (7.1)
где G – количество вещества, г; Icur – сила тока, А; t – продолжительность процесса, ч; А – электрохимический эквивалент вещества, г/Ач.
Электрохимический эквивалент равен:
А = М / 26,8 z. (7.2)
где М – атомная масса элемента или молекулярная масса соединения, z – его валентность.
Пример 7.1. Определить удельный расход электричества, необходимый для восстановления шестивалентного хрома. М = 52,01, z = 6.
1. Электрохимический эквивалент шестивалентного хрома:
А = 52,01 / (26,8∙6) = 0,323 г/Ач.
2. Удельный расход электричества, т.е. отнесенный к G =1г, равен:
qуд = 1/ А = 1/0,323 = 3,09 Ач/г.
На кинетику электродных окисления и восстановления влияют плотность тока и продолжительность электролиза.
Плотность тока – его сила, отнесенная к единице площади электрода, анода или катода. В соответствие с этим, плотности тока могут быть анодными и катодными. Обычно, в расчетах используют анодную плотность, равную:
где Icur – сила тока, А; Fan – площадь анода (суммарная), м 2 .
Скорость прохождения электродных процессов, определяющая их кинетику, прямо пропорциональна плотности тока.
С увеличением ian возрастает и степень деструкции. Вместе с тем, плотность тока ограничивается по условиям турбулизации потока воды в межэлектродном пространстве. С увеличением плотности тока возрастает газовыделение, происходит энергичное перемешивание воды, размывается прианодный слой, где накапливается наиболее активное соединение хлора. Таким образом, хотя плотность тока непосредственно влияет только на электродные процессы, но косвенно сказывается на ходе объемных реакций. С увеличением продолжительности электролиза эффект очистки монотонно повышается и имеет тенденцию к стабилизации. Чем выше плотность тока, тем быстрее достигается максимальный эффект очистки.
В некотором интервале значений плотности тока, от минимального, при котором происходит устойчивая очистка, и приблизительно до 80–100 А/м 2 затраты электроэнергии на единицу объема воды зависят только от достигаемого эффекта очистки.
При проектировании электролизеров расчетными характеристиками аппаратов являются полезная вместимость и площадь электродов.
Полезная вместимость определяется по зависимости: Wп = qwt , где qw – производительность (расчетный расход воды), t – продолжительность электролиза по экспериментальным данным.
Величину силы тока определяем из формулы 7.1: Icur = G / At .
Площадь анодов: Fan = Icur / ian , где iап – плотность тока по экспериментальным данным.
В тех случаях, когда продолжительность электролиза велика, предусматривается схема с многократной рециркуляцией очищаемой воды, либо электролизер конструируется с лабиринтным движением воды. Аппарат работает следующим образом. Вода через штуцер 8 поступает в первую ячейку и движется справа налево, затем через отверстия 1 в электроде попадает во вторую ячейку и т.д. Методика расчета таких аппаратов приведена в [18, 23].

Удорожание энергоносителей стимулирует поиск более эффективных и дешевых видов топлива, в том числе на бытовом уровне. Более всего умельцев–энтузиастов привлекает водород, чья теплотворная способность втрое превышает показатели метана (38.8 кВт против 13.8 с 1 кг вещества). Способ добычи в домашних условиях, казалось бы, известен – расщепление воды путем электролиза. В действительности проблема гораздо сложнее. Наша статья преследует 2 цели:
- разобрать вопрос, как сделать водородный генератор с минимальными затратами;
- рассмотреть возможность применения генератора водорода для отопления частного дома, заправки авто и в качестве сварочного аппарата.
Краткая теоретическая часть
Водород, он же hydrogen, – первый элемент таблицы Менделеева – представляет собой легчайшее газообразное вещество, обладающее высокой химической активностью. При окислении (то бишь, горении) выделяет огромное количество теплоты, образуя обычную воду. Охарактеризуем свойства элемента, оформив их в виде тезисов:

- Горение водорода – процесс экологически чистый, никаких вредных веществ не выделяется.
- Благодаря химической активности газ в свободном виде на Земле не встречается. Зато в составе воды его запасы неиссякаемы.
- Элемент добывается в промышленном производстве химическим способом, например, в процессе газификации (пиролиза) каменного угля. Зачастую является побочным продуктом.
- Другой способ получения газообразного водорода – электролиз воды в присутствии катализаторов – платины и прочих дорогих сплавов.
- Простая смесь газов hydrogen + oxygen (кислород) взрывается от малейшей искры, моментально высвобождая большое количество энергии.
Для справки. Ученые, впервые разделившие молекулу воды на hydrogen и oxygen, назвали смесь гремучим газом из-за склонности к взрыву. Впоследствии она получила название газа Брауна (по фамилии изобретателя) и стала обозначаться гипотетической формулой ННО.

Раньше водородом наполняли баллоны дирижаблей, которые нередко взрывались
Из вышесказанного напрашивается следующий вывод: 2 атома водорода легко соединяются с 1 атомом кислорода, а вот расстаются весьма неохотно. Химическая реакция окисления протекает с прямым выделением тепловой энергии в соответствии с формулой:
Здесь кроется важный момент, который пригодится нам в дальнейшем разборе полетов: hydrogen вступает в реакцию самопроизвольно от возгорания, а теплота выделяется напрямую. Чтобы разделить молекулу воды, энергию придется затратить:
Это формула электролитической реакции, характеризующая процесс расщепления воды путем подведения электричества. Как это реализовать на практике и сделать генератор водорода своими руками, рассмотрим далее.
Создание опытного образца
Чтобы вы поняли, с чем имеете дело, для начала предлагаем собрать простейший генератор по производству водорода с минимальными затратами. Конструкция самодельной установки изображена на схеме.
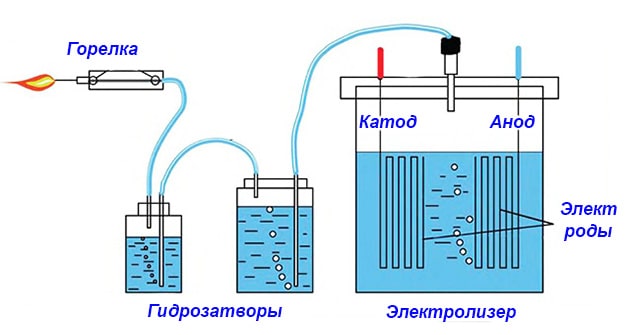
Из чего состоит примитивный электролизер:
- реактор – стеклянная либо пластиковая емкость с толстыми стенками;
- металлические электроды, погружаемые в реактор с водой и подключенные к источнику электропитания;
- второй резервуар играет роль водяного затвора;
- трубки для отвода газа HHO.
Важный момент. Электролитическая водородная установка работает только от постоянного тока. Поэтому в качестве источника питания применяйте сетевой адаптер, автомобильное зарядное устройство или аккумулятор. Электрогенератор переменного тока не подойдет.
Принцип работы электролизера следующий:
Чтобы своими руками сделать показанную на схеме конструкцию генератора, потребуется 2 стеклянных бутылки с широкими горлышками и крышками, медицинская капельница и 2 десятка саморезов. Полный набор материалов продемонстрирован на фото.

Из специальных инструментов потребуется клеевой пистолет для герметизации пластиковых крышек. Порядок изготовления простой:
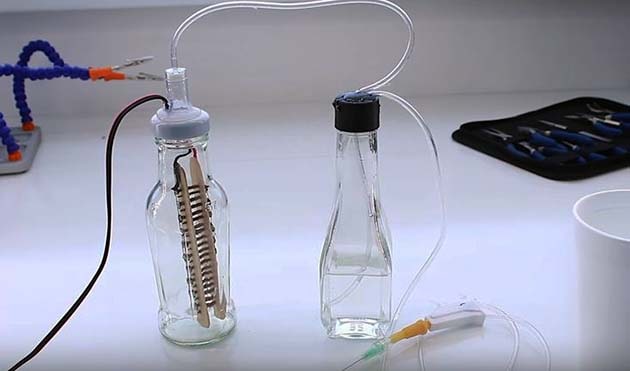
- Плоские деревянные палочки скрутите саморезами, располагая их концами в разные стороны. Спаяйте головки шурупов между собой и подсоедините провода – получите будущие электроды.
- Проделайте отверстие в крышке, просуньте туда разрезанный корпус капельницы и провода, затем герметизируйте с 2 сторон клеевым пистолетом.
- Поместите электроды в бутылку и завинтите крышку.
- Во второй крышке просверлите 2 отверстия, вставьте трубки капельниц и накрутите на бутылку, заполненную обычной водой.
Для запуска генератора водорода налейте в реактор подсоленную воду и включите источник питания. Начало реакции ознаменуется появлением пузырьков газа в обеих емкостях. Отрегулируйте напряжение до оптимального значения и подожгите газ Брауна, выходящий из иглы капельницы.
Второй важный момент. Слишком высокое напряжение подавать нельзя — электролит, нагревшийся до 65 °С и более, начнет интенсивно испаряться. Из-за большого количества водяного пара разжечь горелку не удастся. Подробности сборки и запуска импровизированного водородного генератора смотрите на видео:
О водородной ячейке Мейера
Если вы сделали и испытали вышеописанную конструкцию, то по горению пламени на конце иглы наверняка заметили, что производительность установки чрезвычайно низкая. Чтобы получить больше гремучего газа, нужно изготовить более серьезное устройство, называемое ячейкой Стэнли Мейера в честь изобретателя.
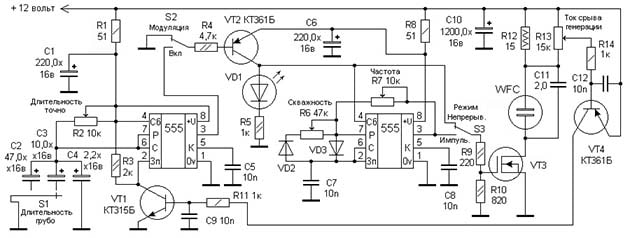
Принцип действия ячейки тоже основан на электролизе, только анод и катод выполнены в виде трубок, вставляющихся одна в другую. Напряжение подается от генератора импульсов через две резонансные катушки, что позволяет снизить потребляемый ток и увеличить производительность водородного генератора. Электронная схема устройства представлена на рисунке:
Для изготовления ячейки Мейера потребуется:
- цилиндрический корпус из пластмассы или оргстекла, умельцы нередко используют водопроводный фильтр с крышкой и патрубками;
- трубки из нержавеющей стали диаметром 15 и 20 мм длиной 97 мм;
- провода, изоляторы.

Нержавеющие трубки крепятся к основанию из диэлектрика, к ним припаиваются провода, подключаемые к генератору. Ячейка состоит из 9 или 11 трубок, помещенных в пластиковый либо плексигласовый корпус, как показано на фото.

Под ячейку Мейера можно приспособить готовый пластиковый корпус от обычного водопроводного фильтра
Соединение элементов производится по всем известной в интернете схеме, куда входит электронный блок, ячейка Мейера и гидрозатвор (техническое название – бабблер). В целях безопасности система снабжена датчиками критического давления и уровня воды. По отзывам домашних умельцев, подобная водородная установка потребляет ток порядка 1 ампера при напряжении 12 В и обладает достаточной производительностью, хотя точные цифры отсутствуют.
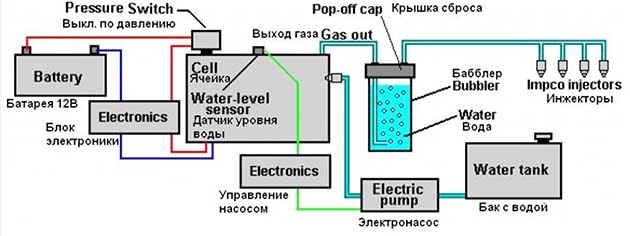
Принципиальная схема включения электролизера
Реактор из пластин
Высокопроизводительный генератор водорода, способный обеспечить работу газовой горелки, выполняется из нержавеющих пластин размером 15 х 10 см, количество – от 30 до 70 шт. В них просверливаются отверстия под стягивающие шпильки, а в углу выпиливается клемма для присоединения провода.

Кроме листовой нержавейки марки 316 понадобится купить:
- резина толщиной 4 мм, стойкая к воздействию щелочи;
- концевые пластины из оргстекла либо текстолита;
- шпильки стяжные М10—14;
- обратный клапан для газосварочного аппарата;
- фильтр водяной под гидрозатвор;
- трубы соединительные из гофрированной нержавейки;
- гидроокись калия в виде порошка.
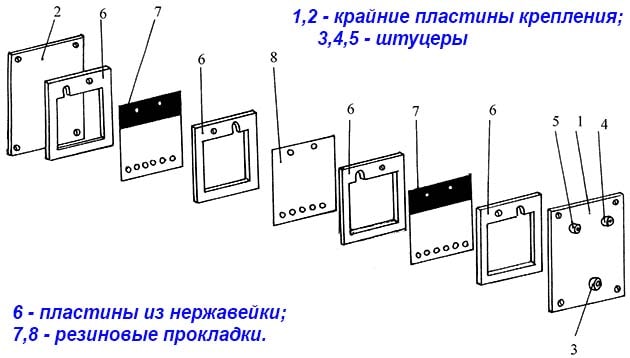
Пластины нужно собрать в единый блок, изолировав друг от друга резиновыми прокладками с вырезанной серединой, как показано на чертеже. Получившийся реактор плотно стянуть шпильками и подключить к патрубкам с электролитом. Последний поступает из отдельной емкости, снабженной крышкой и запорной арматурой.
Примечание. Мы рассказываем, как сделать электролизер проточного (сухого) типа. Реактор с погружными пластинами изготовить проще – резиновые прокладки ставить не нужно, а собранный блок опускается в герметичную емкость с электролитом.
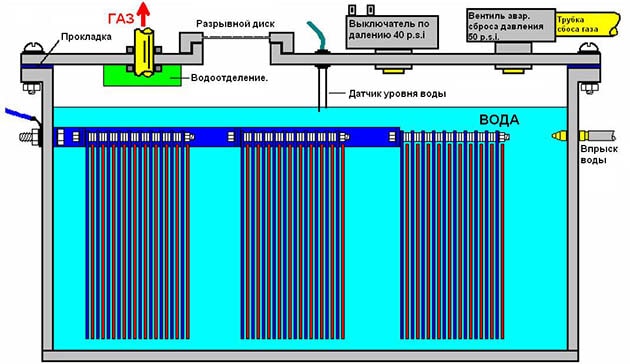
Схема водородной установки мокрого типа
Последующая сборка генератора, производящего водород, выполняется по той же схеме, но с отличиями:
Для питания реактора проще всего задействовать сварочный инвертор, электронные схемы собирать не нужно. Как устроен самодельный генератор газа Брауна, расскажет домашний мастер в своем видео:
Выгодно ли получать водород в домашних условиях
Ответ на данный вопрос зависит от сферы применения кислородно-водородной смеси. Все чертежи и схемы, публикуемые различными интернет-ресурсами, рассчитаны на выделение газа HHO для следующих целей:
- использовать hydrogen в качестве топлива для автомобилей;
- бездымно сжигать водород в отопительных котлах и печах;
- применять для газосварочных работ.
Главная проблема, перечеркивающая все преимущества водородного топлива: затраты электричества на выделение чистого вещества превышают количество энергии, получаемое от его сжигания. Что бы ни утверждали приверженцы утопичных теорий, максимальный КПД электролизера достигает 50%. Это значит, что на 1 кВт полученной теплоты затрачивается 2 кВт электроэнергии. Выгода – нулевая, даже отрицательная.

Вспомним, что мы писали в первом разделе. Hydrogen – весьма активный элемент и реагирует с кислородом самостоятельно, выделяя уйму тепла. Пытаясь разделить устойчивую молекулу воды, мы не можем подвести энергию непосредственно к атомам. Расщепление производится за счет электричества, половина которого рассеивается на подогрев электродов, воды, обмоток трансформаторов и так далее.
Важная справочная информация. Удельная теплота сгорания водорода втрое выше, чем у метана, но – по массе. Если сравнивать их по объему, то при сжигании 1 м³ гидрогена выделится всего 3.6 кВт тепловой энергии против 11 кВт у метана. Ведь водород – легчайший химический элемент.
Теперь рассмотрим гремучий газ, полученный электролизом в самодельном водородном генераторе, как топливо для вышеперечисленных нужд:
Для справки. Чтобы сжигать гидроген в отопительном котле, придется основательно переработать конструкцию, поскольку водородная горелка способна расплавить любую сталь.
Заключение
Гидроген в составе газа ННО, полученный из самодельного водородного генератора, пригодится для двух целей: экспериментов и газосварки. Даже если отбросить низкий КПД электролизера и затраты на его сборку вместе с потребляемым электричеством, на обогрев здания попросту не хватит производительности. Это касается и бензинового двигателя легковой машины.
53 Replies to “Как сделать генератор водорода в домашних условиях”
Спасибо за Ваше замечание по количеству трубок.
В статье не стоит задача что-то доказывать. Излагается ситуация на данный момент и общее руководство по изготовлению генератора — ежели кто захочет.
Получать горючий газ HHO можно по методу (реакция) Марсоля, разлагая воду на цинке и сурьме, всё.
Боюсь, этот метод ничем не лучше других. Если изучить скудную информацию по данной теме, то в глаза сходу бросается 3 нестыковки:
1. Вода в молекулярном двигателе Марсоля разлагается на кислород и водород, минуя паровую фазу. Нонсенс.
2. Насос и сопротивление затрачивает электричество, поршень совершает механическую работу. Каково соотношение затраченной и полученной энергии, неизвестно.
3. Потери теплоты в насосе и молекулярном двигателе неизбежны.
Сдается мне, разложение электролизом куда перспективнее.
Все очень даже работает, я езжу на 3-литровом моторе с расходом в 7-8 литров самого дешманского бензина. И что радует помимо экономии, что в конях прибавка около 15%,так что жизнь налаживается, да и ресурс мотора до 40% увеличивается, вот как-то так!
Да статья интересная,а еще интереснее как работают автомобильные газогенераторы. Ведь как уже слышно налаживается серийный выпуск автомобилей на водородном топливе заправляемые обычной водой,то есть там стоит газогенератор и как слышал и КПД намного выше.
Есть ещё один важный момент, который не рассмотрен в статье: это увеличение эффективности природных источников энергии с помощью электролиза. Как известно, для получения солнечной энергии можно использовать солнечные панели, либо коллекторы. Но эти решения трудно использовать для отопления, так как солнце наиболее интенсивно светит днём и летом, а топить нужно зимой и ночью. Потому напрямую греть ТЭН от солнечной панели не получится.
Чтобы запасать энергию, используются аккумуляторы, но у них низкий КПД и короткий срок службы в циклическом режиме.
И тут интересно рассмотреть возможность использования электролиза для запасания солнечной (или ветровой) энергии. Например летом на солнце использовать электричество солнечной панели, чтобы получить запас водорода, а ночью зимой этот водород сжигать в водородном котле. То что у системы низкий КПД — в этом случае не важно, солнца ведь и так много. Гораздо важнее насколько безопасно получится запасать водород в больших объёмах, чтобы потом использовать по мере необходимости.
Ваша идея запасать водород на ночь, используя солнечную энергию днем, действительно интересна. В статье мы не рассматривали эту возможность, потому что никто не применял подобную схему на практике. Во всяком случае, нам неизвестны такие факты. Ну и конечно, надо считать выгоду – во сколько обойдется производство водорода днем (плюс стоимость оборудования) и обычное отопление по ночному тарифу.
Мной давно рассмотрена идея синтеза водорода при помощи гибрида ветряка и солнечными элементами, последующим электролизом и связыванием водорода в гидрид алюминия.
То что водородная установка работает это 100% правда , я сам ими занимался 25 лет назад. Вопрос только в том кто вам даст этим заниматься ? Нефтеные магнаты тоже хотят кушать и они вас съедят за эти установки. 2 вопрос , куда вы денете миллионы безработных которых уволят с нефтеперерабатывающих заводов?
Установка РАБОТАЕТ.
То, что установка работает известно давно. Ещё в СССР хотели запустить автобусы на водороде. Не дали, по причине причинения вреда экономике.
Для повышения КПД, наверно, надо генератор с частотой резонансной колебательной частоте молекулы воды.
И мне если можно . Разрабатываю газообразный водород в сухой для овощных зерновых культур
Поделитесь чертежами пожалуйста,мне для отопления дома.Можете?
А если водород собирать из системы водяного отопления, которая работает на электричестве. У которой в котле вместо электроТЭНов будет стоять реактор из пластин?
Не думаю, что это хорошая идея. Львиная доля энергии будет расходоваться на нагрев теплоносителя, который постоянно идет из системы отопления. Водорода выделится мизер, и как его улавливать? На выходе воздухоотводчика?? Да и смысл этим заниматься, если все равно греем воду электрокотлом.
Для чего надо лезть в мировую экономику, просто создать для себя комфортные условия проживания, а на остальных плевать нет народа в стране у всех хата скраю, Сибирь горит и лес миллионами кубометров вывозят, а народишку наплевать, так и тут, сделал для себя и плюй в потолок:)
Очистка воды электролизом представляет собой физико-химический процесс. Он заключается в выделении на электродах различных составных частей веществ, растворенных в воде. Процедура очистки воды электролизом возникает при пропускании через раствор или расплав электролита электрического разряда. Анодом в химии называется положительный электрод, катодом — отрицательный. Положительные ионы — (катионы) — начинают движение к катоду, отрицательные ионы — (анионы) — стремятся к аноду. Суть процесса в следующем: в электрическом поле, созданном соединенными с источником электрической энергии электродами, возникает упорядоченное движение ионов. Для возникновения процесса необходимо лишь поместить устройство в проводящую жидкость – воду. Электролиз воды - это сложный электролитический процесс доочистки водопроводной воды, при котором с помощью электрического тока вода распадается на составляющие - кислород и водород, иногда для этого процесса используется шестивольтная батарея. Ячейка электролиза состоит из двух электродов. Их присоединяют к противоположным полюсам источника электрической энергии. Первые примеры применения электролиза описаны в истории и датированы примерно 300 столетием до н.э.
Широкое применение процесса электролиза очистки воды обусловлено его эффективностью. Результатом такой водоподготовки является разрушение органических веществ в воде и извлечение металлов, кислот, неорганических веществ и примесей. Электролитическая очистка осуществляется с помощью специальных устройств - электролизеров. Стоит отметить, что обычный гидравлический насос – простой приборчик элементарного электролиза воды из крана.
Поскольку очистка воды электролизом основана на способности веществ распадаться под действием электрического тока, то использование этого метода имеет ряд преимуществ, главное из которых — высокая степень очистки, позволяющая передавать очищенную воду на коммунальные сооружения, также следует отметить, что вещества (СО2, Н2, О2), образующиеся при распаде воды, оказывают гораздо меньшее воздействие на окружающую среду, чем содержащиеся в исходной воде. К недостаткам этого метода можно отнести повышенный расход электроэнергии. Сегодня представляет интерес использование этого метода для локальной очистки водоемов, содержащих роданид, тиосульфат и сульфат натрия с высокой концентрацией загрязняющих примесей. В настоящее время установки для очистки воды электролизом разрабатываются повсеместно, ведутся исследования этого перспективного метода, который в дальнейшем позволит устранить ряд важных проблем, связанных со здоровьем человека и защитой окружающей среды.
Полупроницаемая мембрана позволяет молекулам воды попасть внутрь клетки из слабоконцентрированного раствора, при этом в самой клетке раствор становится более насыщенным, а уровень жидкости, соответственно, повышается. Даже, если оба раствора находятся под одинаковым давлением извне, переход молекул воды через мембрану все равно происходит – это и называется осмотическим давлением. Ученые провели эксперимент: к концентрированному раствору (морская вода) приложили давление, которое больше естественного осмотического давление. Результат оказался ошеломляющим: Молекулы воды стали переходить из более концентрированного раствора в менее концентрированный, тем самым, на выходе ученые получили насыщенную кислородом чистую воду, а в сосуде, остались солевые отложения. Это явление получило название обратного осмоса, и именно оно лежит в основе большинства способов очистки растворов от примесей и солей. Процесс обратного осмоса может обеспечить наивысшую очистку воды от загрязнений и солевых включений в сравнении с другими способами очистки.
Обычная система очистки воды методом обратного осмоса включает в себя четыре степени очистки:
- Предварительная очистка воды от механических загрязнений (грязи, взвешенных частиц с размером до 4-5 мкм)
- Заменяемые угольные картриджи (удаление хлорных примесей, бактериальных частиц)
- Непосредственно сама обратноосмотическая мембрана
- Еще один угольный специальный фильтр, который обеспечивает воде приятный вкус, удаляет неприятные запахи.
По сути, в процессе обратного осмоса происходит разделение воды и растворенных в ней веществ на молекулярном уровне, поэтому никакие другие способы очистки воды не могут быть сравнимы с данной системой по качеству выпускаемой воды. Никакие традиционные методы фильтрации не дадут такого качества, поскольку они основаны только на отделении механических частиц и адсорбции некоторых растворенных в воде веществ с помощью активированного угля. При использовании обратного осмоса с одной стороны мембраны мы получаем чистую воду, а с другой – все примеси, включая примеси органического характера.
Кроме того, на чистоту воды после обратного осмоса будут влиять ряд других факторов и это влияние надо учитывать при производстве чистой воды:
Читайте также:

