Модель атома резерфорда как сделать
Добавил пользователь Алексей Ф. Обновлено: 18.09.2024
Химические свойства атома определяются электронной оболочкой, точнее, её наружными электронами. Такие электроны сравнительно слабо связаны с атомом и поэтому наиболее подвержены электрическим воздействиям со стороны наружных электронов соседних атомов. То же относится к силам притяжения или отталкивания между нейтральными атомами и молекулами (к молекулярным силам). Напротив, протоны и нейтроны прочно связаны внутри ядра. Чтобы воздействовать на ядро, нужны силы, в миллионы раз превосходящие те силы, которые достаточны для отрыва наружных электронов атома. Однако строение и свойства электронной оболочки определяются в конце концов электрическим полем ядра атома.
Если изложенная модель атома соответствует действительности, то атом должен быть в высокой степени прозрачным для пронизывающих его частиц. Для пучка электронов это было установлено еще Ленардом. Однако окончательное экспериментальное доказательство этой модели атома было дано Резерфордом (1871—1937) в 1911 г. Поэтому она по справедливости называется моделью Резерфорда. По предложению и под руководством Резерфорда его ученики Гейгер и Марсден (1889— 1970) исследовали количественно рассеяние α-частиц, испускаемых радиоактивными веществами. В их опытах параллельный пучок α-частиц направлялся в вакууме на тонкую металлическую фольгу и рассеивался ею. Применялся визуальный метод регистрации рассеянных α-частиц. При ударе о флуоресцирующий экран из сернистого цинка α-частица оставляла на нем вспышку (сциптилляцию). Отдельные сцинтилляции можно было наблюдать в темноте через лупу или микроскоп. И экспериментаторы производили подсчет таких сцинтилляций.
Оказалось, что подавляющее число α-частиц рассеивалось на небольшие углы порядка 1—3°. Угловое распределение таких частиц хорошо описывалось кривой случайных ошибок Гаусса (1777—1855). Однако наблюдались также отдельные α-частицы, отклоняющиеся на большие углы, доходившие до 150°. Относительное число таких частиц было ничтожно. Например, при прохождении через платиновую фольгу пучка α-частиц от RaC из 8000 падающих частиц в среднем только одна частица отклонялась на угол, превышавший 90°. Но и этого было бы слишком много, если бы большие отклонения возникали в результате накопления множества случайных отклонений.
Резерфорд сделал вывод, что каждое большое отклонение появляется в результате единичного акта взаимодействия какого-то практически точечного силового центра с близко пролетающей α-частицей. Таким силовым центром и является положительно заряженное ядро атома. Сама α-частица есть также атомное ядро, именно ядро атома гелия. Это подтверждается тем, что α-частица может быть получена в результате двукратной ионизации атома гелия, как это было уже ранее установлено тем же Резерфордом. Электростатическое взаимодействие между этими двумя ядрами и вызывает рассеяние α-частиц на большие углы.
Резерфорд разработал и количественную теорию рассеяния α-частиц. В этой теории к взаимодействию α-частицы с ядром применяется закон Кулона. Это, конечно, гипотеза, так как α-частица может подходить к ядру на расстояния порядка 10~12 см, а на таких расстояниях закон Кулона не был проверен экспериментально. Разумеется, движение α-частицы в поле ядра Резерфордом рассматривалось классически. Наконец, масса ядра предполагается большой по сравнению с массой α-частицы, так что ядро может считаться неподвижным. От последнего предположения легко освободиться, заменив массу α-частицы приведенной массой.
В опытах Резерфорда применялись очень тонкие металлические фольги с толщиной порядка 10“5— 10"4 см. В таких случаях при рассеянии на большие углы можно было не учитывать многократные столкновения α-частицы с атомными ядрами. Вероятность двукратных, а тем более многократных столкновений с большими отклонениями ничтожна. Ничтожна вероятность рассеяния на большие углы и на электронах ввиду малости их масс. Многократные столкновения с ядрами и с электронами атомных оболочек играют роль только при очень малых углах рассеяния. Такие углы мы исключим из рассмотрения. Тогда, учитывая взаимодействие α-частицы только с одним ядром, к которому α-частица подходит наиболее близко, мы придем к задаче двух тел. От всех остальных ядер α-частица проходит много дальше, и поэтому взаимодействием с ними пренебрегается. Таким образом, теория Резерфорда применима для больших отклонений, когда отклонение вызывается только электрическим полем одного ядра, так что по сравнению с этим отклонением все прочие отклонения, вместе взятые, пренебрежимо малы. Соответствующее рассеяние называется резерфордовским. Оно является упругим в том смысле, что кинетическая энергия а-частицы в результате рассеяния не изменяется, т.е. не растрачивается на возбуждение атомов, а тем более атомных ядер.
Сформулированная задача формально аналогична задаче Кеплера (1571 —1630) о движении планеты вокруг Солнца. И тут и там сила взаимодействия тел — центральная и меняется обратно пропорционально квадрату расстояния между ними. В случае планеты это сила притяжения, в случае α-частицы — сила отталкивания. Это проявляется в том, что планета (в зависимости от ее полной энергии) может двигаться и по эллипсу, и по гиперболе, а α-частица— только по гиперболе. Но в математических вычислениях это не имеет значения. Угол рассеяния α-частицы û равен углу между асимптотами ее гиперболической траектории.
Для него была получена формула:
Экспериментальной проверке в области атомных явлений, разумеется, доступна не сама формула, а статистические следствия из неё. Введем так называемое дифференциальное эффективное сечение рассеяния. Обозначим через I интенсивность плоскопараллельного пучка α-частиц, налетающих на ядро, т.е. число α-частиц пучка, проходящих в единицу времени через единичную площадку, перпендикулярную к потоку. Из этого числа через элементарную площадку do, также перпендикулярную к потоку, проходит dN1 =I do α-частиц. После рассеяния эти частицы попадают в элементарный телесный угол dΩ. Конечно, величина телесного угла dΩ и направление его оси определяются величиной и положением площадки do. Поэтому dN1 имеет также смысл числа α-частиц, рассеиваемых ядром в единицу времени в телесный угол dΩ. Отношение dN 1 к I равно do и имеет размерность площади. Оно и называется дифференциальным эффективным сечением ядра для рассеяния α-частиц в телесный угол dΩ. Это понятие применяется к рассеянию не только α-частиц, но и любых частиц, а также к другим процессам, происходящим с частицами. Таким образом, по определению т.е. дифференциальное эффективное сечение рассеяния есть отношение числа частиц, рассеянных атомом в единицу времени в телесный угол dΩ, к интенсивности I падающих частиц. Таким образом по определению т.е. дифференциальное эффективное сечение рассеяния есть отношение числа частиц, рассеянных атомов в единицу времени в телесный угол dΩ, к интенсивности I падающих частиц.
Определим теперь дифференциальное сечение для рассеяния α-частиц на отдельном ядре атома. Задача сводится к определению величины площадки do, пройдя через которую α-частица после рассеяния попадает внутрь заданного телесного угла dΩ. Возьмем за ось X прямолинейную траекторию той α-частицы, которой соответствует прицельное расстояние Ь= О (такая частица испытала бы с ядром лобовое столкновение). Используя цилиндрическую симметрию, для упрощения заменим do на кольцевую площадку do = 2πbdb, перпендикулярную к потоку. Внутренний радиус такой площадки равен Ь, наружный b + db, а центр расположен на оси X. Интервалу b, b + db соответствует интервал углов рассеяния û, û+ dû, причем по формуле
Введя телесный угол в который рассеиваются α-частицы, прошедшие через кольцевую площадку, нетрудно получить
В таком виде формула справедлива для любой элементарной площадки do, а не только для кольцевой. Она и называется формулой Резерфорда.
Введем понятие полного сечения рассеяния или какого-либо другого процесса. Оно определяется как отношение полного числа частиц, претерпевших рассматриваемый процесс в единицу времени, к интенсивности падающего пучка частиц. Полное сечение ð может быть получено из дифференциального сечения do путем интегрирования его по всем возможным значениям dΩ. В случае рассеяния α-частиц в формуле следует сначала положить dΩ = 2πsinðdð, а затем выполнить интегрирование в пределах от ð =0 до ð = п. Это дает ð = ∞. Результат этот понятен. Чем дальше площадка do удалена от оси X, тем меньше угол рассеяния ð. Частицы, проходящие через удаленные площадки, практически не отклоняются, т. е. проходят в окрестности угла рассеяния ð = 0. Суммарная площадь таких площадок, а с ней и полное число рассеянных частиц бесконечно велики. Бесконечно велико и полное поперечное сечение рассеяния. Впрочем, этот вывод имеет формальный характер, так как при малых углах рассеяния формула Резерфорда неприменима.
Приведем теперь формулу к виду, доступному для экспериментальной проверки. Акты рассеяния α-частиц различными атомами независимы. Отсюда следует, что если n — число ядер (атомов) в единице объема, то число α-частиц, рассеиваемых объемом V в единицу времени в телесный угол dΩ, определяется выражением
В таком виде формула Резерфорда и была подтверждена на опыте. В частности, на опыте было показано, что при постоянстве dΩ величина dN sin4 (ð/2) постоянна, т. е. не зависит от угла рассеяния ð, как это и должно быть согласно формуле.
Подтверждение формулы Резерфорда на опыте может рассматриваться как косвенное доказательство закона Кулона на таких малых расстояниях, на какие могут сближаться центры а-частицы и взаимодействующего с ней ядра. Другим доказательством могут служить опыты Блэкетта (1897—1974) по рассеянию α-частиц в газах. Фотографировалось большое количество треков α-частиц в камере Вильсона, измерялись угловые отклонения их и подсчитывалось, как часто встречаются определенные углы рассеяния. Эти опыты также подтвердили формулу Резерфорда. Но главной целью их была проверка закона Кулона. Оказалось, что при расстояниях между центрами α-частицы и взаимодействующего ядра в случае воздуха от до до см и меньше. На таких расстояниях проявляют свое действие ядерные силы притяжения, перекрывающие кулоновские силы отталкивания ядер.
Формулу Для подсчета сцинтилляций от α-частиц, рассеянных фольгой, отверстие кольца AА' закрывалось экраном, непрозрачным для α-частиц. Наоборот, для измерения I производился подсчет сцинтилляций, когда отверстие было свободно, а кольцо АА' закрыто. Так как в этом случае число сцинтилляций было очень велико, то для его уменьшения перед экраном S устанавливался вращающийся диск с узким вырезом. Зная ширину выреза и сосчитав число сцинтилляций, можно вычислить I. Чэдвик нашел для платины Z = 77,4, серебра Z = 46,3, меди Z = 29,3. Атомные или порядковые номера этих элементов в периодической системе Менделеева равны соответственно 78, 47, 29. Тем самым был подтвержден уже известный результат, впервые установленный Мозли (1887—1915), что заряд ядра Z совпадает с атомным номером элемента.
Вернемся к модели атома, обоснованной опытами Резерфорда. Могут ли атомное ядро и окружающая его электронная оболочка образовать устойчивую систему, какой, несомненно, является атом? Если бы это было возможно, то эти частицы не могли бы находиться в покое. В противном случае получилась бы электростатическая система (практически) точечных зарядов, между которыми действуют кулоновы силы, а такая система, согласно теореме Ирншоу, неустойчива. Кулоновы силы меняются обратно пропорционально квадрату расстояния между взаимодействующими частицами. Но так же меняются гравитационные силы между телами планетной системы. Устойчивость планетной системы обеспечивается вращением планет вокруг Солнца. Поэтому Резерфорд естественно пришел к планетарной модели атома, в которой электроны вращаются вокруг ядра.
Однако, согласно классической электродинамике, при движении заряда меняется и электромагнитное поле, источником которого является заряд. В частности, электрический заряд, движущийся ускоренно, излучает электромагнитные волны. Вращающийся электрон имеет ускорение, а потому должен непрерывно излучать. Теряя энергию на излучение, электрон непрерывно приближался бы к ядру и в конце концов упал бы на него. Таким образом, и при наличии движения получается неустойчивая модель атома. Можно было бы предположить, что закон Кулона и прочие законы, определяющие электромагнитное поле в электродинамике, нарушаются в случае элементарных частиц и малых расстояний. Можно было бы учесть ядерные силы и ввести неизвестные нам гипотетические силы, обеспечивающие устойчивость атома. Но и это не спасает положения. Каковы бы ни были силы, согласно общим принципам классической механики спектр излучения атома должен состоять из нескольких основных частот и соответствующих им обертонов. Опыт приводит к совсем иной закономерности, выражаемой комбинационным принципом Ритца (1878—1909). Приходится констатировать, что классическая механика и электродинамика оказались не в состоянии объяснить существование атомов как устойчивых систем атомных ядер и электронов. Решение этой проблемы было получено только в рамках квантовой механики.
Одним из самых важных открытий в области современной физики стало открытие сложного строения атома. В процессе изучения этого строения были открыты новые законы, которые применимы только для описания движения микрочастиц. Такие законы называют законами квантовой механики.
Строение атома по Томсону
Правильное представление о строении атома сложилось не сразу. Первую модель строения частицы вещества предложил английский физик Дж. Дж. Томсона, которому принадлежит открытие электронов. Сравнить эту модель можно с кексом. Положительный заряд атома, играющий роль теста, занимает весь атомарный объем. Причем его плотность одинакова во всех точках. Электроны, словно изюминки в тесте, равномерно распределяются в объеме, занятом положительным зарядом.

Так, согласно представлениям Томсона, атом водорода представляет собой небольшой положительно заряженный шарик радиусом в 10 –10 м. И внутри него расположен один электрон. У более сложных атомов электронов больше.
Опыты Резерфорда
Модель Томсона подверглась критике уже тогда, поскольку она абсолютно противоречила уже открытым к тому времени свойствам атома. Одно из главных свойств — устойчивость.
Известно, что масса электронов в несколько тысяч раз меньше массы атомов. Но в целом атом является нейтральным. Значит, основная масса приходится на его положительно заряженную часть. Для экспериментального исследования распределения положительного заряда, а значит, и массы внутри атома Эрнест Резерфорд предложил в 1906 г. применить зондирование атома с помощью α-частиц. Такие частицы образуются при распаде радия и некоторых других химических элементов. Их масса примерно в 8000 раз больше массы электрона, а положительный заряд равен по модулю удвоенному заряду электрона. По сути, α-частицы — это лишенные электронов атомы гелия. Двигаются они со скоростью, равной 1/15 скорости света.
Такими частицами Резерфорд в своих экспериментах бомбардировал атомы тяжелых элементов. Известно, что электроны неспособны изменить траекторию движения α-частиц, потому что они слишком мало весят. Ведь небольшой камешек, врезавшийся в автомобиль, не может существенно повлиять на его скорость.
Изменить направление движения α-частиц может только положительный заряд атома. Так, если бомбардировать этими частицами атом, то по их рассеянию можно узнать, каким образом распределяется положительный заряд внутри него. Схема опыта резерфорда выглядит так:

Резерфорд поместил в цилиндр радиоактивное вещество. Вдоль цилиндра ученый высверлил узкий канал, из начал исходить пучок α-частиц. Этот поток попадал на тонкую золотую фольгу. Пройдя ее, частицы попадали на полупрозрачный экран, покрытый сульфидом цинка. За экраном стоял микроскоп , с помощью которого можно было наблюдать столкновение полностью ионизированных атомов гелия с экраном. Ведь при каждом столкновении на экране можно было наблюдать вспышку — сцинтилляцию. Вся установка находилась внутри сосуда, из которого был выкачан воздух — это гарантировало отсутствие других факторов, которые могли бы повлиять на исход опыта.
Если провести опыт без фольги, то глядя в микроскоп, можно было наблюдать следующую картину: на экране формировался кружок, образованный сцинтилляциями от удара α-частиц об экран.

Но если на пути потока этих частиц поставить тонкую фольгу из золота, то картина меняется. Кружок, состоящий из сцинтилляций, становится больше.

Такой результат эксперимента нельзя было предсказать, если считать, что атом действительно имеет такое строение, какое предположил Томсон. Ведь при распределении по всем объему атома положительный заряд не может создать сильное электрическое поле. Поэтому он не смог бы отклонить траекторию движения α-частиц кардинально. Максимальная сила отталкивания в этом случае может быть рассчитана путем применения закона Кулона:
F m a x = k q a q R 2 . .
q a — заряд α-частицы, q — положительный заряд атома, R — радиус атома, а k — коэффициент пропорциональности. Напряженность электрического поля равномерно заряженного шара максимальна на поверхности шара и убывает до нуля по мере приближения к центру. Поэтому чем меньше радиус R, тем больше сила, отталкивающая α-частицы.
Определение размеров атомного ядра
Резерфорд сделал вывод о том, что α-частица могла быть отброшена назад только случае, если положительный заряд атома и его масса сконцентрированы в небольшом пространстве. Так ученый пришел к мысли о существовании атомного ядра . По его представлению, это было тело малых размеров, в котором сконцентрирована почти вся масса и весь положительный заряд атома.

На рисунке выше изображены траектории α-частиц, пролетающих на различных расстояниях от ядра. Подсчитывая количество α-частиц, рассеянных на различные углы, Резерфорд дал оценку размерам ядра. Выяснилось, что его диаметр равен примерно 10 –12 –10 –13 см. Такой разброс связан с тем, что размеры ядер атомов разных веществ различны. Размер же самого атома равен 10 –8 см. Это в 10–100 тыс. раз больше размера атомного ядра.
Планетарная модель атома
Основываясь на результатах опыта, Резерфорд создал планетарную модель атома. Согласно ей, в центре атома расположено положительно заряженное ядро . В нем сосредоточена почти вся масса атома. Но в целом атом является нейтральной частицей. Это связано с тем, что положительный заряд ядра уравновешивается отрицательным зарядом электронов, которые вращаются вокруг этого ядра подобно тому, как вращаются планеты вокруг Солнца. Но если планеты вращаются под действием гравитационных сил, то электроны вращаются под действием сил кулоновских (со стороны ядра).

Так, в атоме водорода вокруг ядра вращается только лишь один электрон. Его ядро имеет положительный заряд, равный по модулю заряду электрона. Причем его масса примерно в 1836,1 раза больше массы электрона. Это ядро было названо протоном и стало рассматриваться как элементарная частица. Размер атома водорода определяется радиусом орбиты его электрона.
Простая и наглядная планетарная модель атома имеет прямое экспериментальное обоснование. Она кажется совершенно необходимой для объяснения опытов по рассеиванию α-частиц. Но даже это модель не объяснить факт существования атома, его устойчивость. Ведь движение электронов по орбитам происходит с ускорением, и оно очень велико. Ускоренно движущийся заряд по законам электродинамики Максвелла должен излучать электромагнитные волны с частотой, равной частоте его обращения вокруг ядра. Излучение сопровождается энергетическими потерями. Теряя энергию, электроны должны приближаться к ядру так, как спутник приближается к Земле при торможении о верхние слои атмосферы. По расчетам, электрон должен упасть на ядро за 10 –8 с. Но этого не происходит. Атомы устойчивы и в невозбужденном состоянии могут существовать бесконечно. При этом они не излучают электромагнитные волны.
Опыты Э. Резерфорда по рассеянию α-частиц показали, что
А. почти вся масса атома сосредоточена в ядре.
Б. ядро имеет положительный заряд.
Какое(-ие) из утверждений правильно(-ы)?
- только А
- только Б
- и А, и Б
- ни А, ни Б
Алгоритм решения
- Кратко описать суть и результаты опыта, проведенного Резерфордом.
- Установить, какие выводы позволил сделать этот опыт.
Решение
Резерфорд направил пучок радиоактивного излучения на золотую фольгу. Альфа-частицы, проходя сквозь нее, попадали на экран и оставляли след. Если без фольги след представлял собой более менее четко ограниченный круг, то в случае с фольгой, четких границ круга не было. Когда Резерфорд окружил установку фольгой, он обнаружил, что часть альфа-частиц изменила траекторию движения после столкновения с фольгой в обратном направлении. Но это было бы невозможно, если бы заряд был распределен в атомах равномерно по всему объему. Наблюдать такую картинку возможно только при условии, что заряд атома концентрируется в небольшом пространстве — ядре. Причем этот заряд положительный, поскольку он не притягивает, а отталкивает альфа-частицы. Поэтому оба утверждения являются верными.
pазбирался: Алиса Никитина | обсудить разбор | оценить
На рисунке изображены схемы четырёх атомов, соответствующие модели атома Резерфорда. Чёрными точками обозначены электроны. Атому 63 Li соответствует схема:

Алгоритм решения
- Описать планетарную модель атома.
- Установить, какой рисунок подходит для данного химического элемента.
Решение
pазбирался: Алиса Никитина | обсудить разбор | оценить
Ядро атома содержит 3 нейтрона и 4 протона, вокруг ядра обращаются 2 электрона. Эта система частиц является
а) нейтральным атомом углерода 9 6C б) ионом бериллия 7 4Be в) ионом лития 9 3Li г) нейтральным атомом бериллия 7 4B
Алгоритм решения
- Установить, будет ли атом нейтральным.
- Выбрать подходящий ответ.
Решение
Согласно условию, содержится 4 протона и всего 2 электрона. Это значит, что речь будет идти о положительно заряженном ионе. Массовое число будет равно 7 (4 протона + 3 нейтрона), а зарядовое число — 4 (4 протона). Этому соответствует ион бериллия.
Планетарную модель атома предложил Э. Резерфорд в 1910 году. Первые исследования структуры атома были сделаны им при помощи альфа-частиц. На основе результатов, полученных в экспериментах по их рассеянию, Резерфорд предположил, что весь положительный заряд атома сосредоточен в крошечном ядре в его центре. С другой стороны, отрицательно заряженные электроны распределены внутри всего остального его объема.
Немного предыстории
Первую гениальную догадку о существовании атомов сделал древнегреческий ученый Демокрит. С тех пор идея о существовании атомов, комбинации которых дают все окружающие нас вещества, не покидала воображения людей науки. Периодически к ней обращались различные ее представители, но до начала XIX века их построения были всего лишь гипотезами, не подкрепленными опытными данными.
Наконец, в 1804 году, более чем за сто лет до того как появилась планетарная модель атома, английский ученый Джон Дальтон представил доказательства его существования и ввел понятие атомного веса, явившееся его первой количественной характеристикой. Как и его предшественники, он представлял атомы мельчайшими частями материи, похожими на твердые шарики, которые не могут быть разделены на еще более мелкие частицы.
Открытие электрона и первая модель атома

Эта модель удовлетворительно объясняла то обстоятельство, что при нагревании вещества оно начинает излучать свет. Хотя это была первая попытка понимания того, что же такое атом, она не смогла удовлетворить результатам экспериментов, выполненных позже Резерфордом и другими. Томсон в 1911 году согласился, что его модель просто не может ответить, как и почему происходит наблюдаемое в опытах рассеяние α-лучей. Поэтому она была оставлена, а на смену ей пришла более совершенная планетарная модель атома.
Как же все таки устроен атом?
Эрнест Резерфорд дал объяснение явления радиоактивности, которое принесло ему Нобелевскую премию, однако его наиболее значительный вклад в науку был сделан позднее, когда он установил, что атом состоит из плотного ядра, окруженного орбитами электронов, подобно тому, как Солнце окружено орбитами планет.
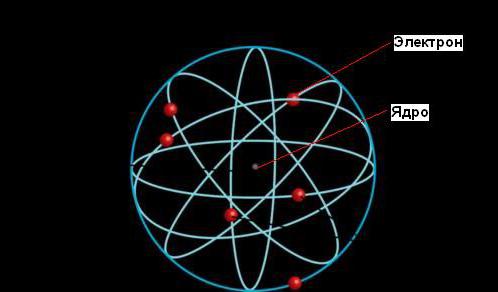
Согласно планетарной модели атома, большая часть его массы сконцентрирована в крошечном (по сравнению с размерами всего атома) ядре. Электроны двигаются вокруг ядра, путешествуя с невероятной скоростью, но большая часть объема атомов является при этом пустым пространством.
Размер ядра настолько мал, что его диаметр в 100 000 раз меньше, чем у атома. Диаметр ядра была оценен Резерфордом как 10 -13 см, в отличие от размера атома - 10-8 см. За пределами ядра электроны вращаются вокруг него с высокими скоростями, в результате чего возникают центробежные силы, уравновешивающие электростатические силы притяжения между протонами и электронами.
Опыты Резерфорда
Планетарная модель атома возникла в 1911, после знаменитого эксперимента с золотой фольгой, позволившего получить некоторые фундаментальные сведения о его строении. Путь Резерфорда к открытию атомного ядра является хорошим примером роли творчества в науке. Его поиски начались еще в 1899 году, когда он обнаружил, что некоторые элементы испускают положительно заряженные частицы, которые могут проникать через что угодно. Он назвал эти частицы альфа (α) частицами (теперь мы знаем, что они были ядрами гелия). Как и все хорошие ученые, Резерфорд был любопытен. Он задавался вопросом, можно ли использовать альфа-частицы, чтобы узнать структуру атома. Резерфорд решил нацелить луч альфа-частиц на лист очень тонкой золотой фольги. Он выбрал золото, потому что из него можно получать листы толщиной всего 0,00004 см. За листом золотой фольги он поставил экран, который светился, когда альфа-частицы ударяли в него. Его использовали для обнаружения альфа-частиц после их прохождения через фольгу. Небольшая прорезь в экране позволяла лучу альфа-частиц достичь фольги после выхода из источника. Часть из них должна пройти сквозь фольгу и продолжать двигаться в том же направлении, другая их часть должна отскакивать от фольги и отражаться под острыми углами. Вы можете увидеть схему эксперимента на рисунке ниже.
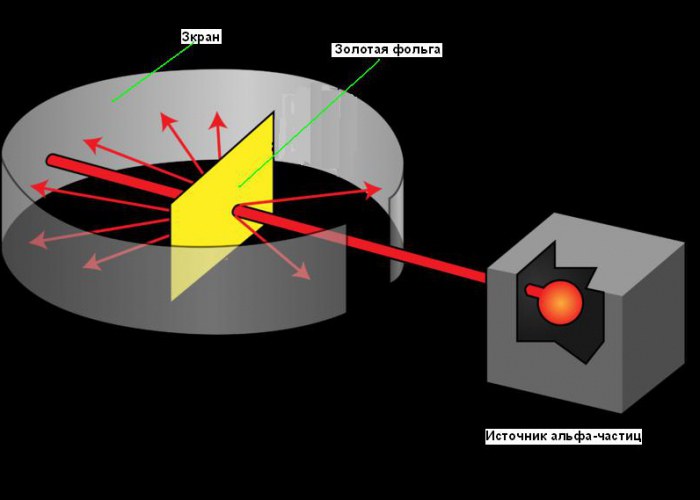
Что же получилось в опыте Резерфорда?
Исходя из модели атома Дж. Дж. Томсона, Резерфорд предполагал, что сплошные области положительного заряда, заполняющие весь объем золотых атомов, будут отклонять или сгибать траектории всех альфа-частиц, когда они проходят через фольгу.
Однако подавляющее большинство альфа-частиц прошло прямо через золотую фольгу, как будто ее и не было. Казалось, они проходят через пустое пространство. Лишь немногие из них отклоняются от прямого пути, как и предполагалось вначале. Ниже приведен график зависимости количества частиц, рассеянных в соответствующем направлении, от угла рассеяния.
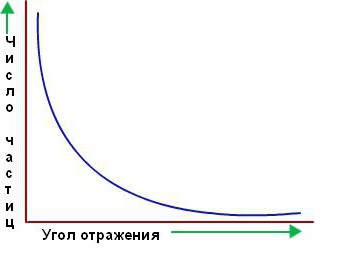
Удивительно, но крошечный процент частиц возвращался от фольги, как баскетбольный мяч отскакивает от щита. Резерфорд понял, что эти отклонения были результатом прямого столкновения между альфа-частицами и положительно заряженными компонентами атома.
Ядро занимает центральное место
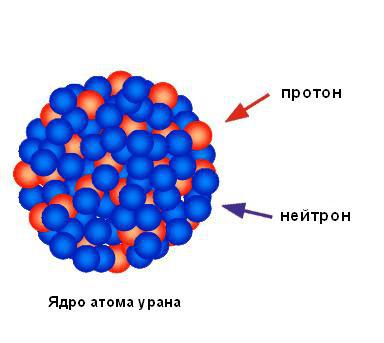
Исходя из ничтожного процента отразившихся от фольги альфа-частиц, можно сделать вывод, что весь положительный заряд и практически вся масса атома сосредоточены в одной маленькой области, а в остальной части атома в основном находится пустое пространство. Резерфорд назвал площадь концентрированного положительного заряда ядром. Он предсказал и вскоре обнаружил, что оно содержит положительно заряженные частицы, которые он назвал протонами. Резерфорд предсказал существование нейтральных атомных частиц, называемых нейтронами, но он не смог обнаружить их. Тем не менее его ученик Джеймс Чедвик открыл их через несколько лет. На рисунке ниже показана структура ядра атома урана.
Атомы состоят из положительно заряженных тяжелых ядер, окруженных вращающимися вокруг них отрицательно заряженными чрезвычайно легкими частицами-электронами, причем на таких скоростях, что механические центробежные силы просто балансируют их электростатическое притяжение к ядру, и в этой связи якобы обеспечивается стабильность атома.
Недостатки этой модели
Основная идея Резерфорда относилась к идее малоразмерного атомного ядра. Предположение об орбитах электронов было чистой гипотезой. Он не знал точно, где и как электроны вращаются вокруг ядра. Поэтому планетарная модель Резерфорда не объясняет распределение электронов на орбитах.
Основная идея Резерфорда относилась к идее малоразмерного атомного ядра. Предположение об орбитах электронов было чистой гипотезой. Он не знал точно, где и как электроны вращаются вокруг ядра. Поэтому планетарная модель Резерфорда не объясняет распределение электронов на орбитах.
Кроме того, стабильность атома Резерфорда была возможна только при непрерывном движении электронов по орбитам без потерь кинетической энергии. Но электродинамические расчеты показали, что движение электронов по любым криволинейным траекториям, сопровождающееся изменением направления вектора скорости и появлением соответствующего ускорения, неизбежно сопровождается излучением электромагнитной энергии. При этом, согласно закону сохранения энергии, кинетическая энергия электрона должна очень быстро израсходоваться на излучение, и он должен упасть на ядро, как схематически показано на рисунке ниже.
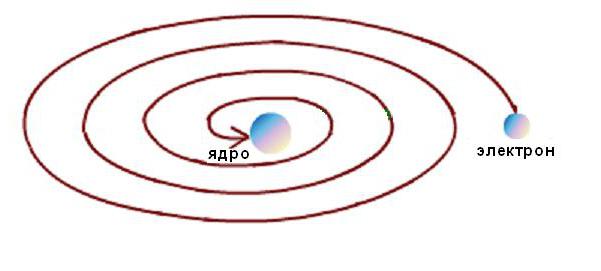
Но этого не происходит, так как атомы являются стабильными образованиями. Возникло типовое для науки противоречие между моделью явления и опытными данными.
От Резерфорда к Нильсу Бору
Следующий крупный шаг вперед в атомной истории произошел в 1913 году, когда датский ученый Нильс Бор опубликовал описание более детальной модели атома. Она определяла более четко места, где могут находиться электроны. Хотя позже ученые будут развивать и более изысканные атомные конструкции, но планетарная модель атома Бора была в основном правильной, и многое из нее принимается до сих пор. Она имела множество полезных приложений, например с ее помощью объясняют свойства различных химических элементов, характер спектра их излучений и строение атома. Планетарная модель и модель Бора явились важнейшими вехами, обозначившими появление нового направления в физике – физики микромира. Бор получил Нобелевскую премию 1922 по физике за его вклад в наше понимание структуры атома.
Что же нового привнес Бор в модель атома?
1. Электроны могут двигаться вокруг ядра только на фиксированных расстояниях от него, определяемых тем количеством энергии, которое у них есть. Он назвал эти фиксированные уровни энергетическими уровнями или электронными оболочками. Бор представлял их в виде концентрических сфер, с ядром в центре каждой из них. При этом электроны с меньшей энергией будут найдены на более низких уровнях, ближе к ядру. Те же из них, у кого больше энергии, будут найдены на более высоких уровнях, дальше от ядра.
2. Если электрон поглощает некоторое (вполне определенное для данного уровня) количество энергии, то он будет прыгать на следующий, более высокий энергетический уровень. И наоборот, если он потеряет такое же количество энергии, то вернется назад к исходному уровню. Однако электрон не может существовать на двух энергетических уровнях.
Эта идея иллюстрируются рисунком.
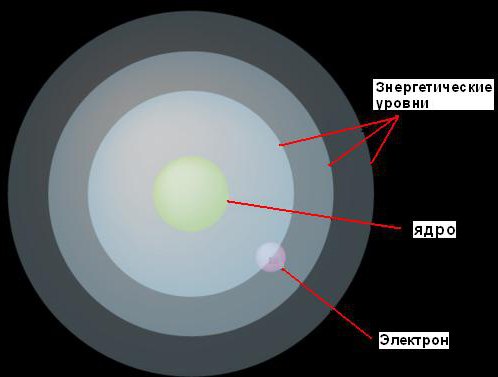
Энергетические порции для электронов
Модель атома Бора на самом деле является сочетанием двух различных идей: атомной модели Резерфорда с электронами, вращающимися вокруг ядра (по сути это планетарная модель атома Бора-Резерфорда), и идеи немецкого ученого Макса Планка о квантовании энергии вещества, опубликованной в 1901 году. A квант (во множественном числе - кванты) является минимальным количеством энергии, которая может быть поглощена или излучена веществом. Он является своего рода шагом дискретизации количества энергии.
Если энергию сравнить с водой и вы хотите добавить ее к материи в виде стакана, вы не можете просто залить воду непрерывной струей. Вместо этого вы можете добавить ее в небольших количествах, например, по чайной ложке. Бор считал, что если электроны могут поглощать или терять только фиксированные количества энергии, то они должны варьировать свою энергию только этими фиксированными количествами. Таким образом, они могут занимать только фиксированные энергетические уровни вокруг ядра, которые соответствуют квантованным приращениям их энергии.
Так из модели Бора вырастает квантовый подход к объяснению, что же из себя представляет строение атома. Планетарная модель и модель Бора явились своеобразными ступенями от классической физики к квантовой, являющейся основным инструментом в физике микромира, включая и атомную физику.

Посмотрев данный видеоурок, учащиеся познакомятся с моделью атома Джозефа Томсона. Рассмотрят схему опытов Эрнеста Резерфорда, позволивших создать планетарную модель атома. А также мы покажем, почему к явлениям, происходящим внутри атома, не применимы законы классической физики.

В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Строение атома. Опыты Резерфорда"
Исследования спектров излучения разрежённых газов (то есть спектров излучения отдельных атомов) показали, что каждому газу присущ вполне определенный линейчатый спектр, состоящий из отдельных спектральных линий или групп близко расположенных линий. Наиболее изученным является спектр самого простого атома — атома водорода. Впервые Иоганн Якоб Бальмер в 1885 году, изучая спектры атома водорода, обнаружил, что расположение четырёх цветных линий в видимой части спектра подчиняются определённой закономерности, которую можно описать с помощью математической формулы:

В этой формуле m — целое число, больше двух, а R — постоянная величина, называемая постоянной Ри́дберга.

Эти четыре линии в спектре атома водорода составляют так называемую серию линий Бальмера. Позже серии линий были установлены и в других частях спектра. В частности, Теодором Лайманом была обнаружена серия линий в ультрафиолетовой области спектра — серия Лаймана:

А в инфракрасной области было обнаружено сразу три серии:


И серия Пфу́нда:

Как видим, формулы, описывающие разные серии, очень похожи. Поэтому Йоханес Риберг свёл их в одну, которую называют обобщённой формулой Бальмера или формулой Бальмера — Ридберга:

В ней n имеет в каждой данной серии постоянное целочисленное значение от единицы до бесконечности, a k принимает целочисленные значения начиная с (n + 1).
Таким образом, излучаемый разрежёнными газами свет концентрируется в узких спектральных интервалах вблизи определённых частот, характерных для атомов данного вещества, в результате чего мы и наблюдаем линейчатые спектры испускания или поглощения. Поэтому линейчатые спектры атомарных газов являются своеобразным ключом к пониманию внутреннего строения атома, так как излучение и поглощение света атомами есть результат внутриатомных процессов, то есть процессов, в которых могут принимать участие только частицы, входящие в состав атома. Но вот что такое атом?
Мы знаем, что атомы представляют собой очень прочные системы, несоизмеримо более устойчивые, чем составленные из них молекулы. А такие внешние воздействия, как нагрев, изменение давления, мощные электрические разряды приводят лишь к незначительным изменениям атомов: они могут ионизоваться. Поэтому до конца XIX века атомы считали простейшими неделимыми частицами вещества. Однако в последнее десятилетие XIX века произошло ряд крупнейших открытий в физике. В частности, французским физиком Антуаном Анри Беккерелем было открыто явление естественной радиоактивности некоторых веществ. А в 1896 году английским физиком Джозефом Джоном Томсоном был открыт электрон.
Также Эрнестом Резерфордом было установлено, что радиоактивное излучение содержит в себе положительно и отрицательно заряженные частицы. Поэтому естественно было предположить, что эти частицы входят в состав атомов.
После открытия электрона Томсон построил модель атома для объяснения установленных в то время экспериментальных фактов:
атомы электрически нейтральны и любые атомы независимо от их природы содержат электроны;
электроны являются лёгкими относительно масс атомов отрицательно заряженными корпускулами с малым и равным зарядом;
при возбуждении атомов они излучают только на определённых частотах, порождая линейчатые оптические спектры.
В статье, опубликованной в марте 1904 года, Томсон рассмотрел три правдоподобные варианта возможного строения атома, объясняющие его электрическую нейтральность и другие свойства.


В модели Томсона электроны могли свободно вращаться по кольцевым орбитам, которые стабилизировались взаимодействиями между электронами, а линейчатые спектры объясняли разницей энергий при движении по разным кольцевым орбитам.
Суть опыта была достаточно проста. Резерфорд с помощниками брал свинцовый сосуд, внутри которого находился радиоактивный элемент, испускающий через узкое отверстие в сосуде альфа-частицы (ионизированные атомы гелия, масса которых примерно в 8000 раз больше массы электрона).
Скорость вылетающей альфа-частицы была очень велика — порядка 1/15 скорости света. Для регистрации этих самых частиц учёный использовал сцинтилляционный экран с микроскопом. Чтобы устранить рассеяние альфа-частиц на молекулах воздуха, Резерфорд поместил всю установку в сосуд, из которого был откачан воздух. Если на пути частиц нет никаких препятствий, то они попадают на экран узким пучком, а возникающие вспышки сливаются в одно небольшое световое пятно.

Однако если на пути альфа-частиц поместить тонкую золотую фольгу, то при взаимодействии с ней, площадь пятна увеличивалась. Это свидетельствовало о рассеянии альфа-частиц на атомах золота.
Но самое удивительное произошло, когда экран был поставлен с обратной стороны (говорят в результате ошибки лаборанта). Но и тогда на экране наблюдались вспышки, то есть альфа-частицы рассеивались на углы больше 90 о . Такой результат предвидеть было очень сложно, поскольку расчёты говорили о том, что электрическое поле положительного заряда, распределённого по всему атому, не может быть достаточно сильным, чтобы отбросить альфа-частицу назад. А поскольку масса электрона почти в восемь тысяч раз меньше массы альфа-частицы, то и они не могли существенно поменять траекторию альфа-частиц. При этом резкие отклонения наблюдались весьма редко (примерно одна из 20 000 альфа-частиц испытывала отклонение на угол больше 90°; одна из 40 000 — на угол больше 120°, а одна из 70 000 — на угол больше 150°).
Размер ядра мал, но в нём сосредоточена практически вся масса атома — около 99,96 %. При сближении альфа-частицы и ядра в соответствии с законом Кулона между ними возникают большие силы отталкивания, которые существенно изменяли траекторию альфа-частиц.
В модели атома Томсона электрическое поле соответствует электрическому полю равномерно заряженного по объёму шара, и при приближении к центру атома модуль его напряжённости стремится к нулю. В этом случае не было бы альфа-частиц, рассеянных на большие углы.
На основании своих опытов Резерфорд смог оценить размеры атома и его ядра. Выяснилось, что диаметр ядра составляет порядка 10 –14 — 10 –15 м, в то время как диаметр атома составляет порядка 10 –10 м. В 1911 году все эти данные привели Резерфорда к созданию ядерной модели атома.
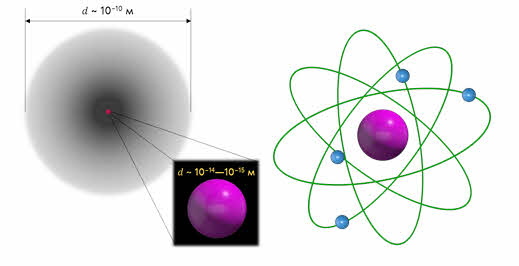
Итак, согласно этой модели в центре атома расположено положительно заряженное ядро, диаметром около 10 –15 м, в котором сосредоточена основная масса атома. Заряд ядра равен произведению порядкового номера элемента в таблице Менделеева и модулю заряда электрона: 𝑞 = +𝑍𝑒.
Ядро атома окружают электроны, образуя электронную оболочку атома, причём число электронов равно порядковому номеру элемента в таблице Менделеева, а их суммарный заряд равен заряду ядра, поэтому атом в целом электрически нейтрален: 𝑞 = 𝑍(−𝑒).
Внутри атома электроны не могут покоиться, так как под действием сил Кулона они упали бы на ядро, и атом прекратил бы своё существование. Поэтому они вращаются вокруг ядра по определенным орбитам.
Такую модель атома называют также планетарной, поскольку она напоминает нашу Солнечную систему, где планеты вращаются вокруг массивного центра — Солнца, масса которого составляет около 99,87 % массы всей Солнечной системы.
При всей своей убедительности планетарная модель атома оказалась внутренне противоречивой. По законам электродинамики движущийся ускоренно заряд излучает электромагнитные волны. Следовательно, атом должен непрерывно излучать электромагнитные волны. Излучение же связано с уменьшением энергии электрона в поле ядра. Следствием этого должно явиться уменьшение скорости движения и частоты вращения электронов вокруг ядра. Если частота непрерывно изменяется, то спектр излучения атома должен быть сплошным. Уменьшение скорости электрона должно привести к тому, что электрон будет двигаться по спирали к ядру и в течение короткого времени упадёт на него. То есть в этой модели атом должен быть неустойчивым.
Это находится в полном противоречии с экспериментальными фактами, которые свидетельствуют о том, что:
· атом является достаточно устойчивой системой;
· атом излучает электромагнитные волны лишь при определенных условиях, а не непрерывно;
· а спектры излучения атомов являются линейчатыми.
Эти противоречия возникли потому, что к электронам в атомах применяли законы классической физики, а, как мы уже с вами знаем, в микромире действуют свои законы, отличные от законов макромира.
Первым признал невозможность применения законов классической физики к атомам датский учёный Нильс Бор. Он ввёл элементы квантовой теории в модель атома Резерфорда и в 1913 году создал неклассическую теорию атома. В основе этой теории лежала идея связать в единое целое три результата, полученные в физике к тому времени.
Читайте также:

